黄眶离缘姬蜂卵巢和毒液器官的形态学及其超微结构
毛沙江洋,吴 琼,时 敏,陈学新
黄眶离缘姬蜂卵巢和毒液器官的形态学及其超微结构
毛沙江洋,吴 琼,时 敏,陈学新*
(浙江大学昆虫科学研究所,水稻生物学国家重点实验室,农业部作物病虫分子生物学重点实验室,杭州 310058)
本文观察了内寄生蜂黄眶离缘姬蜂Trathalaflavo-orbitalisCameron卵巢和毒液器官的形态及超微结构,为了解黄眶离缘姬蜂与其寄主之间的协同进化关系奠定基础。在光学显微镜下解剖雌性生殖系统,并结合透射电镜进行形态学及超微结构观察,结果表明黄眶离缘姬蜂毒液器官主要由一个薄壁的毒囊、两条接于毒囊顶端的毒腺、通向产卵器的毒液导管组成。毒腺由分泌细胞层和环腔的内膜构成,分泌细胞层中存在大量的端器,主要功能是分泌毒液。毒囊由肌肉鞘层、扁平细胞层以及内膜层组成,肌肉鞘内肌纤丝规则排列,扁平细胞层内的细胞器极其稀少,内膜呈波浪状均匀加厚。黄眶离缘姬蜂的一对卵巢分别由8条卵巢小管组成,开口于两条侧输卵管,在卵巢与侧输卵管相接处略微膨大形成卵巢萼区,萼区内存在大量类似姬蜂病毒的颗粒。黄眶离缘姬蜂的毒液器官属于II型毒液器官,是较高等的进化模式,其毒液器官的形态结构与雌蜂的产卵行为相关。在萼区内发现的类似姬蜂病毒的颗粒,对研究寄生蜂调控寄主的免疫和发育生理具有重要意义。
黄眶离缘姬蜂;卵巢;毒液器官;透射电镜;超微结构
寄生蜂是膜翅目中重要的类群,种类繁多,在害虫生物防治和害虫种群控制上起着十分重要的作用。有关寄生蜂如何调控寄主的生理变化和抑制寄主的免疫系统的研究已成为了近年来国际上的热点(陈学新,2010)。通常情况下,内寄生蜂在产卵时会向寄主体内注入毒液和卵巢萼液。大量研究表明,寄生蜂的毒液器官内不仅携带毒液,还存在类病毒颗粒等寄生因子,具有破坏寄主免疫反应、调节寄主生长发育、调控寄主血淋巴营养成分以及扰乱寄主生殖和内分泌系统等特殊的生理功能(Moreau and Guillot, 2005; Asgari and Rivers, 2011; Gattietal., 2012)。此外,在寄生蜂卵巢萼区还存在一类特殊的多DNA病毒(polydnavirus, PDV),成为在数量庞大的寄生蜂的生活史中不可或缺的共生病毒。PDV 随着寄生蜂的卵一起被注入到寄主的体内,调控寄主的免疫和发育生理,从而确保幼蜂在寄主体内生存发育(Strand, 2012; 叶熹骞等,2014)。正因如此,对寄生蜂毒液器官和卵巢形态结构的研究,不仅能为各类寄生因子和基因的组织定位研究奠定基础,而且对寄生蜂生理防御机制的研究有重要价值。
黄眶离缘姬蜂Trathalaflavo-orbitalisCameron,其分布范围较广,是我国重要粮食害虫玉米螟Ostrinianubilalis幼虫的主要寄生性天敌。除主要寄生于玉米螟外,还发现寄生于桃蛀野螟Dichocrosispunctiferalis、梨云翅斑螟Nephopteryxpirivorella、二化螟Chilosuppressalis、三化螟Scirpophagaincertulas、稻纵卷叶螟Cnaphalocrocismedinalis、棉红铃虫Pectinophoragossypiella等(何俊华等,2004)。它们单寄生于幼虫体内,蜂幼虫老熟后钻出寄主幼虫,并在尸体附近结茧化蛹。为进一步了解和认识黄眶离缘姬蜂与其寄主之间的协同进化关系,本文对黄眶离缘姬蜂卵巢和毒液器官的形态学以及超微结构做了初步的研究。
1 材料与方法
1.1 实验昆虫
黄眶离缘姬蜂采自浙江大学紫金港校区西区的实验田,将采回的雌蜂收集在放有20%蜂蜜水棉球的透明塑料盒中饲养,供解剖。
1.3 卵巢和毒液器官的摘取
将受试蜂在冰块上进行麻痹后,迅速转移到置于冰板上的凹玻片上,并滴入少许pH 7.4磷酸缓冲液,在Leica 125体视显微镜下尖嘴镊解剖出完整的雌性生殖系统,并将卵巢和毒液器官分离,然后用KEYENCE VHX-2000C照相系统进行拍照。
1.3 样品制备及观察
将解剖出的毒腺、毒囊和卵巢分别在2.5%戊二醛溶液中4℃固定过夜。
透射电镜按下列步骤处理样品:①倒掉固定液,用0.1 mol/L,pH7.0磷酸缓冲液漂洗样品3次(每次15 min);②用1%锇酸溶液固定样品1.5 h;③再次用0.1 mol/L,pH7.0磷酸缓冲液漂洗样品三次(每次15min);④通过30%-100%乙醇梯度脱水(每种浓度处理15 min,100%乙醇处理20 min);⑤纯丙酮置换处理20 min;⑥用包埋剂与丙酮的混合液1(V/V=1/1)处理样品1 h,用包埋剂与丙酮的混合液2(V/V=3/1)处理样品3 h;纯包埋剂处理样品70℃加热过夜;⑦得到的样品在LEICA EM UC7型超薄切片机中切片,获得70-90 nm切片;⑧切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5-10 min后,在Hitachi H-7650型透射电镜中观察并拍照。
2 结果与分析
2.1 黄眶离缘姬蜂雌性生殖系统的形态
黄眶离缘姬蜂的雌性生殖系统主要由中输卵管、侧输卵管、卵巢、毒液器官等组成(图1A)。两条侧输卵管会合形成一条总输卵管与产卵棒相接,一对卵巢分别开口于两条侧输卵管,位于腹腔中,左右对称,在卵巢与侧输卵管相接处略微膨大形成卵巢萼区。每个卵巢分别由8条卵巢小管组成,每根小管内,卵细胞成单列排列,卵巢小管前端伸出的细长端丝,集结成束(图1B)。卵巢在消化道两侧向前背方延伸,占据了腹腔内绝大部分的空间。毒液器官通过毒液导管与总输卵管连接。
2.2 黄眶离缘姬蜂毒液器官的形态
黄眶离缘姬蜂毒液器官主要由两条毒腺分泌小管、一个薄壁的毒囊、通向产卵器的毒液导管组成。毒囊在光学显微镜下呈椭圆形,表面有稀疏环状刻纹,内含丰富的毒液。两条毒腺分泌小管呈乳白色,细条状分叉,呈Y型,末端封闭游离,另一端在基部会合形成一条毒腺分泌总管与毒囊端部连接(图1C)。
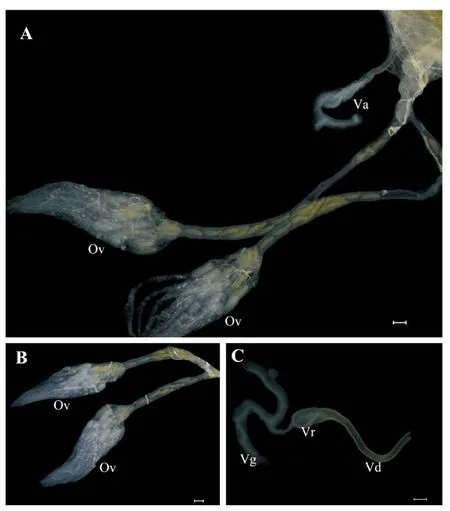
图1 黄眶离缘姬蜂卵巢和毒液器官的显微结构Fig.1 Micrograph of ovary and venom apparatus of Trathala flavo-orbitalis Cameron注:A, 黄眶离缘姬蜂的卵巢和毒液器官;B, 黄眶离缘姬蜂的卵巢;C, 黄眶离缘姬蜂的毒液器官。Va, 毒液器官;Ov, 卵巢;Vg, 毒腺;Vr, 毒囊;Vd, 毒液导管。比例尺:A-B=100.0 μm;C=200.0 μm。Note: A, Ovary and venom apparatus of Trathala flavo-orbitalis Cameron; B, Ovary of T.flavo-orbitalis Cameron; C, Venom apparatus of T.flavo-orbitalis Cameron.Va, Venom apparatus; Ov, Ovary; Vg, Venom gland; Vr, Venom reservoir; Vd, Venom duct.Scale bar: A-B =100.0 μm; C=200.0 μm.
2.3 黄眶离缘姬蜂卵巢的超微结构
黄眶离缘姬蜂卵巢由许多卵巢小管聚集而成,卵巢小管外壁薄,仅由一层扁平的上皮细胞构成(图2E)。根据卵巢小管内卵细胞的发育阶段,可以将卵巢小管分为3个区域,分别为末端纤丝,原卵区与生长区。
卵巢小管端部为末端纤丝,胞质内含有丰富的线粒体和粗面内质网;细胞内含有很多营养泡,内容物主要是一些蛋白质,碳水化合物和脂类(图2A)。在卵巢的原卵区,许多未分化的卵原细胞排列紧密。卵原细胞呈圆形,细胞核圆而大,几乎占据了整个细胞,染色质丰富。在细胞核的周围,有许多线粒体和游离核糖体(图2B-C)。卵巢小管的基部为生长区,包含不同发育时期的卵母细胞。卵母细胞发育过程中,体积不断增大,脂滴和卵黄蛋白不断积累(图2F),卵母细胞和滤泡细胞之间有大量的微绒毛(图2D)。滤泡细胞内部有大量的粗面内质网,线粒体(图2E)。卵黄蛋白积累基本完成时,开始形成卵黄膜和卵壳。在卵壳的形成过程中,其表面有大量的淀粉粒存在(图2G)。卵巢发育至后期,成熟的卵子被排入卵巢萼区。
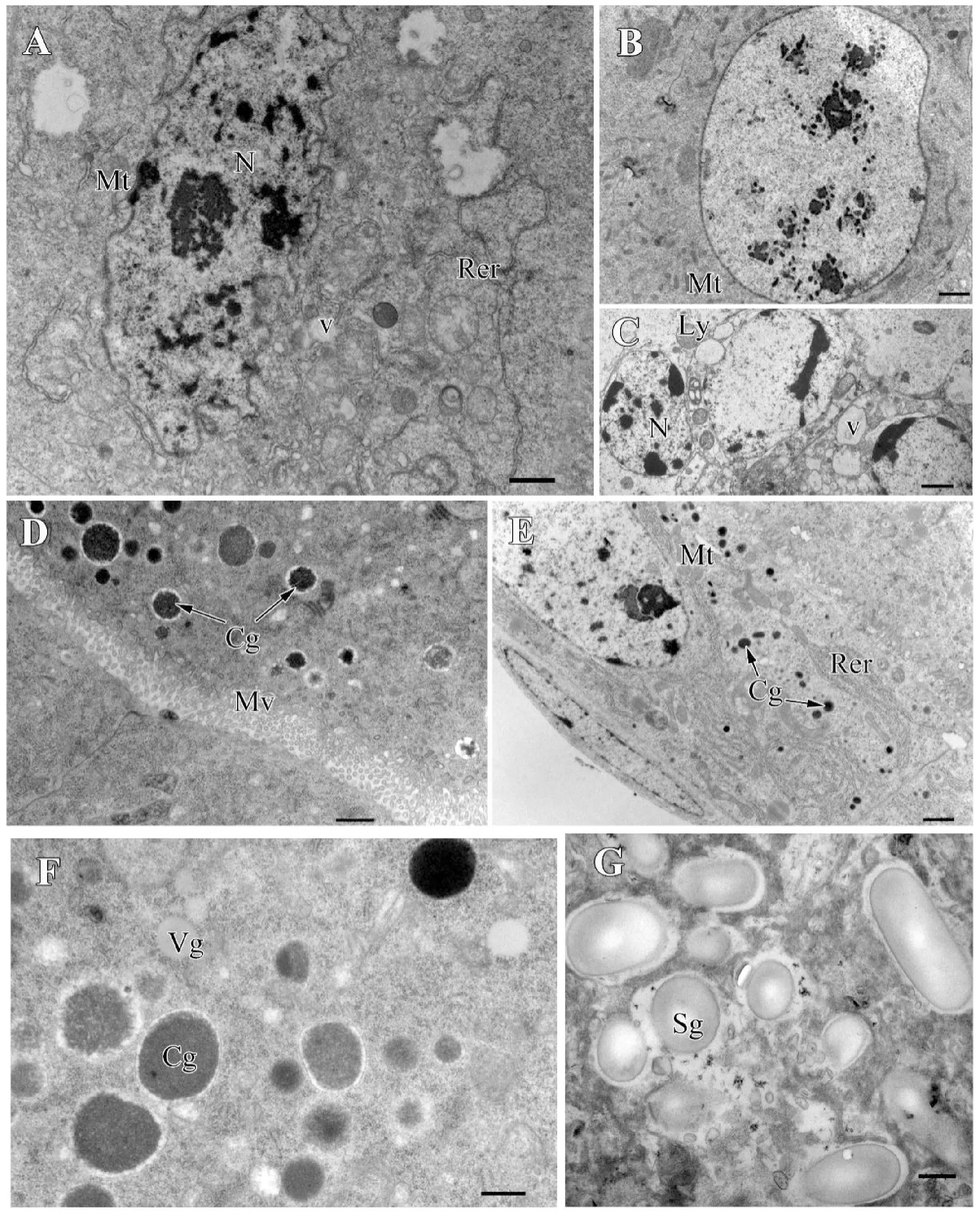
图2 黄眶离缘姬蜂卵巢的超微结构Fig.2 Ultrastructure of the ovary of Trathala flavo-orbitalis Cameron注:A, 末端纤丝胞质内含丰富的线粒体和粗面内质网;B, 原卵区细胞核圆而大;C, 原卵区细胞排列紧密;D,卵母细胞和滤泡细胞存在大量的微绒毛;E, 滤泡细胞内含大量的粗面内质网,线粒体及皮质颗粒;F, 卵母细胞中皮质颗粒和卵黄蛋白原;G, 卵壳表面淀粉粒。Mt, 线粒体;Re, 粗面内质网;N, 细胞核;V, 囊泡;Ly, 溶酶体;Mv, 微绒毛;Cg, 皮质颗粒;Vg, 卵黄蛋白;Sg, 淀粉粒。比例尺:A-F=1.0 μm;G=0.5 μm。Note:A, Cytoplasm in the region of terminal filament contain mitochondria and rough endoplasmic reticulum; B, Nucleus of germarium; C, Cells in the germarium are ranged tightly; D, There are dense microvilli between the oocyte and follicle cell; E, Follicle cell contain numerous rough endoplasmic reticulum, mitochondria and cortical granule; F, Cortical granule and vitellogenin in the oocyte; G, Many starch grains lie on the surface of the egg shell.Mt, Mitochondria; Rer, rough endoplasmic reticulum; N, Nucleus; V, Vesicles; Ly, Lysosome; Mv, Microvilli; Cg, Cortical granule; Vg, vitellogenin; Sg, Starch grains.Scale bar: A-E=1.0 μm; F-G=0.5 μm.
2.4 黄眶离缘姬蜂毒液器官的超微结构
毒腺一般由三层结构环绕而成,即环腺腔的表皮层,由表皮分泌的外胚层细胞层以及分泌细胞层(Edsonetal., 1982)。黄眶离缘姬蜂的毒腺由外向内依次为分泌细胞层、导管细胞层,表皮层细胞和外胚层细胞明显退化而形成绕腺腔的内膜,中央为腔体。
分泌细胞层细胞排列紧密。细胞核位于细胞中央,体积较大,核内有许多染色质块,且核膜清晰可见(图3A);细胞核周围有少量髓样体结构(图3B)。细胞质内存在大量的粗面内质网、分泌颗粒、液泡、高尔基体、线粒体、端器等细胞器:粗面内质网特别发达,内质网之间的囊池相互连接,使其得以延伸(图3C);细胞质内分泌囊泡数量众多,大小不一(图3D),而分泌颗粒数量相对较少,大小不均一(图3E);端器的周围有密集的微绒毛呈辐射状分布,端器的一端穿过导管细胞层和腔体连通,分泌颗粒和液泡经其直接进入腔体(图4C-D)。导管细胞层的细胞体积较小,细胞核大而明显(图4A),细胞质内除若干导管外,基本没有其他细胞器(图4B)。毒腺中央腔体中含有电子密度较深的毒液,腔体被一层不规则均质内膜包裹(图4A)。
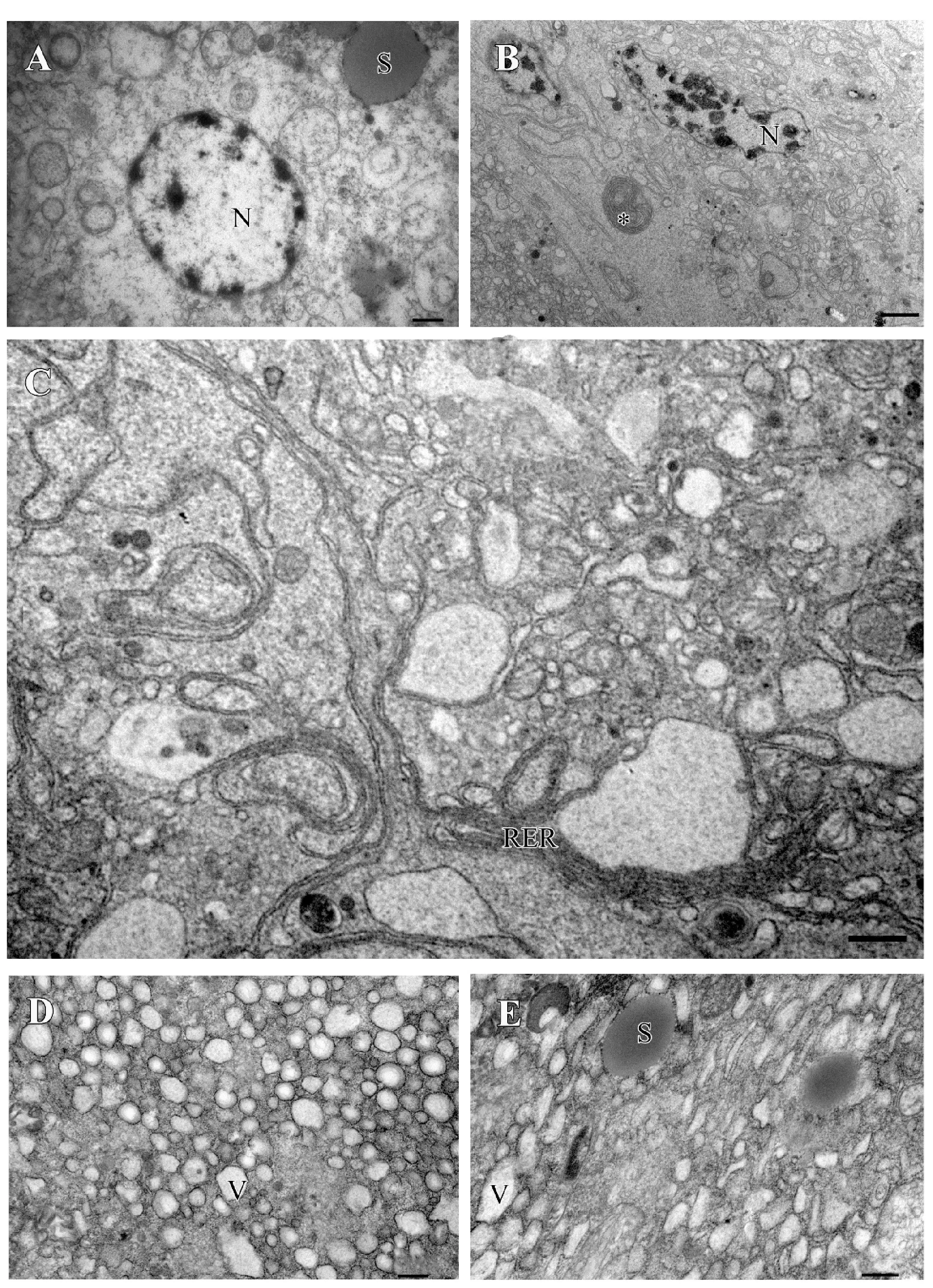
图3 黄眶离缘姬蜂毒腺分泌细胞层超微结构Fig.3 Ultrastructure of the secretory cell in venom gland of Trathala flavo-orbitalis Cameron注:A, 分泌细胞内的细胞核、分泌颗粒;B, 细胞核周围的髓样结构(*);C, 细胞质中发达的粗面内质网;D, 大量的分泌囊泡;E, 细胞质中的分泌颗粒。N, 细胞核;S, 分泌颗粒;Rer, 粗面内质网;V, 囊泡。比例尺:A、D-E=0.5 μm;B=2.0 μm;C=1.0 μm。Note: A, Nucleus and secretory granule in the secretory cell; B, Myelin body (*) beside the nucleus; C, Developed rough endoplasmic reticulum; D, Detail of the vesicle in the secretory cell; E, Secretory granules in the cytoplasm of secretory cell.N, Nucleus; S, Secretory granule; Rer, rough endoplasmic reticulum; V, Vesicle.Scale bar: A, D-E=0.5 μm; B=2.0 μm; C=1.0 μm.
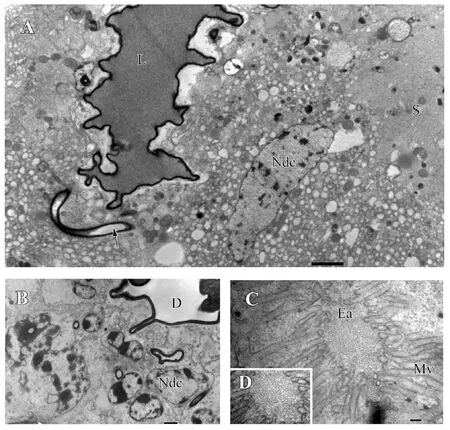
图4 黄眶离缘姬蜂毒腺的超微结构Fig.4 Ultrastructure of the venom gland of Trathala flavo-orbitalis Cameron注:A, 毒腺横截面;B, 导管细胞核大而明显;C, 端器周围有密集的微绒毛;D, 端器内充满分泌颗粒。L, 腺囊腔;Ndc, 导管细胞核;D, 导管;Ea, 端器;Mv, 微绒毛。比例尺:A=2.0 μm;B=1.0 μm;C=0.2 μm;D=100.0 nm。Note: A, Cross section of the venom gland; B, Nucleus of the duct cell; C, Characteristic appearance of the end apparatus surrounded by microvilli; D, Secretory granules filled in the end apparatus.L, Lumen of the collecting canal within the centre of the venom gland; Ndc, Nucleus of duct cell; D, Duct; Ea, End apparatus; Mv, Microvilli.Scale bar: A=2.0 μm;B=1.0 μm;C=0.2 μm;D=100.0 nm.
毒囊也由三层细胞组成,由外向内依次是:肌肉鞘层、上皮细胞层以及内膜层(图5A)。毒囊具有发达的肌肉层,肌肉层呈连续波浪状,肌纤丝不交错,规则排列,肌肉层中分布有较多线粒体。上皮细胞沿内膜不连续分布,细胞质内的细胞器极其稀少,细胞核长型,大而明显,核内有许多染色质块 (图5A)。毒囊的内膜向囊腔呈波浪状小的内突,囊腔被内膜包裹(图5B),其内充满暗灰毒液,并有纤维状物散布(图5C)。
2.5 卵巢萼区中的类似姬蜂病毒的颗粒
卵巢萼区表层拥有发达的肌肉层(图6A),萼区细胞排列紧密,细胞核呈长条型,内含有大量的DNA(图6B)。萼细胞核内含有大量类似姬蜂病毒颗粒(ichnovirus-like particles)的发生基质(图6C-D),在早期萼区细胞内,可见空的病毒衣壳和装配好的病毒粒子前体(图E),卵萼内的病毒粒子在萼细胞内获得第一层外膜,此时的病毒粒子呈圆柱状,横截面直径为50 nm-75 nm,而长度在200nm-400 nm,中间为高度浓缩的核质(图6F-G)。
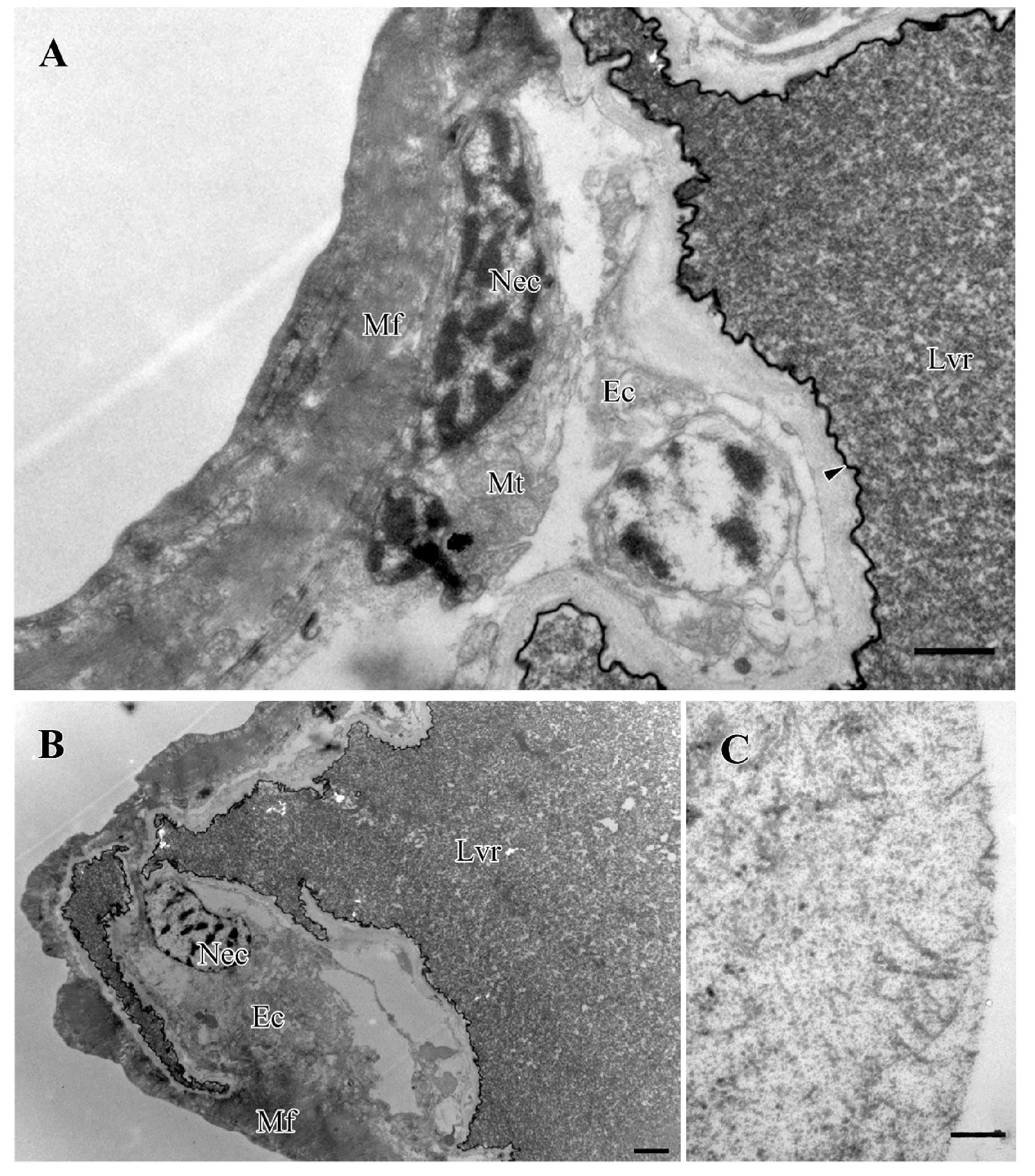
图5 黄眶离缘姬蜂毒囊的超微结构Fig.5 Ultrastructure of the venom reservoir of Trathala flavo-orbitalis Cameron注:A, 毒囊肌肉鞘层、上皮细胞层以及内膜层;B, 上皮细胞层沿内膜呈不连续分布,内膜包裹囊腔;C, 囊腔内纤维状物。Mf, 肌肉鞘;Nec, 上皮细胞的细胞核;M, 线粒体;Ec, 上皮细胞层;Lvr, 毒囊囊腔。比例尺:A=1.0 μm;B=2.0 μm;C=0.5 μm。Note: A, Part of the venom reservoir showing muscle fibers, epithelial cell and intima (arrowhead); B, The lumen of the reservoir is bounded by a thin and uniform intima, which followed by discontinuous epithelial cell; C, Fiber material in the venom reservoir.Mf, Muscle fibers; Nec, Nucleus of the epithelial cell; Mt, Mitochondria; Ec, epithelial cell; Lvr, Lumen of the venom reservoir.Scale bar: A=1.0 μm;B=2.0 μm;C=0.5 μm.
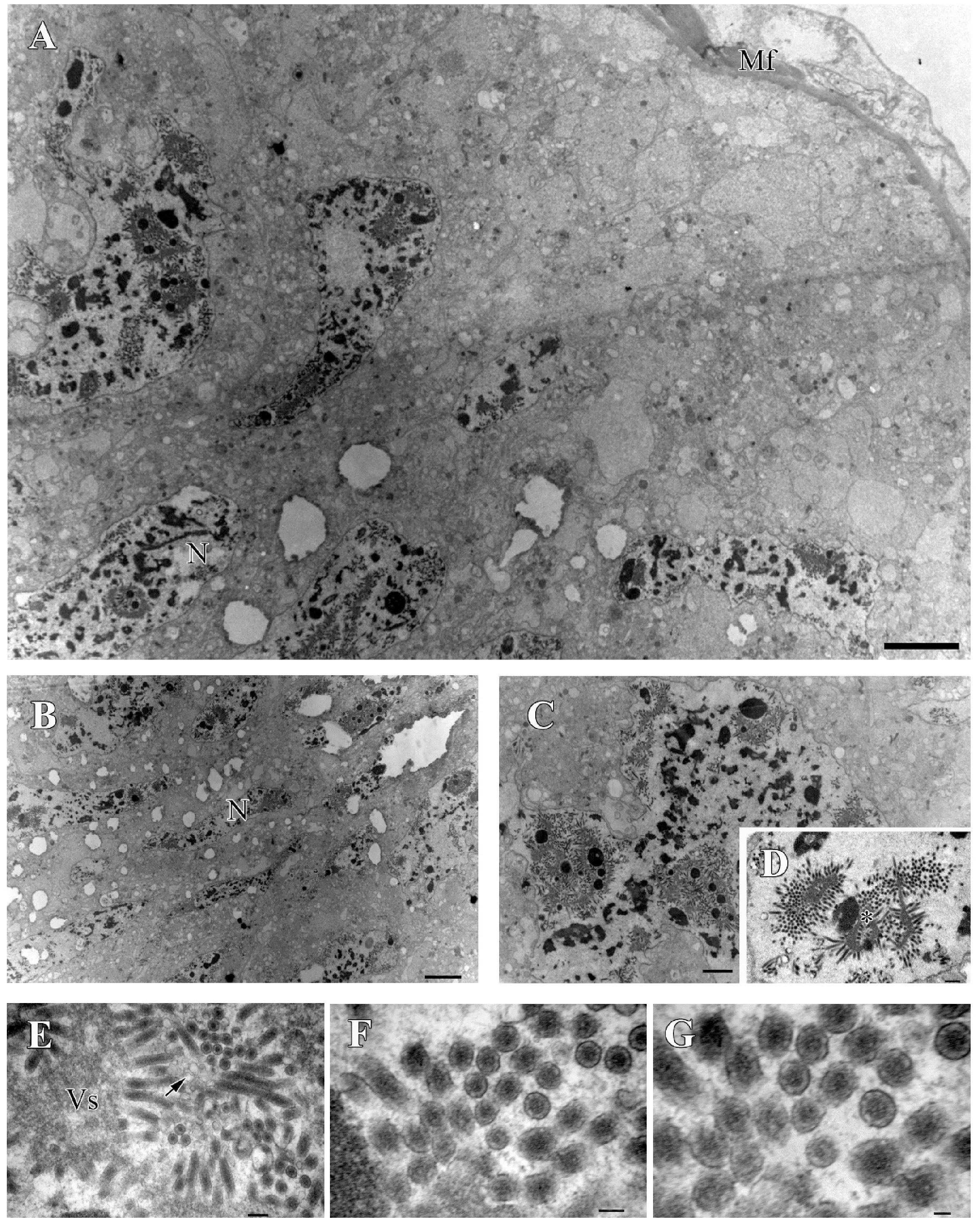
图6 黄眶离缘姬蜂卵巢萼区的超微结构Fig.6 Ultrastructure of the ovary calyx of Trathala flavo-orbitalis Cameron注:A, 萼细胞和萼区上皮细胞;B, 萼细胞核内DNA含量很高;C, 萼细胞核内存在大量类似姬蜂病毒颗粒;D, 病毒发生基质;E, 病毒发生基质和空的外壳(箭头);F-G, 已获得内膜的病毒颗粒。Mf, 肌肉层;N, 萼细胞核;Vs, 病毒发生基质。比例尺:A-B=5.0 μm;C=2.0 μm;D=0.5 μm;E=0.2 μm;F=100.0 nm;G=50.0 nm。Note: A, Calyx cells together with the epithelial layer.B, Nucleus of calyx cell have a very high DNA content; C, A cluster of ichnovirus-like particles filled in the nucleus of calyx cell; D, Patches of virogenic stroma (*); E, Virogenic stroma (Vs) and viral envelopes (arrowhead); F-G, Virus particles with an inner membrane.Mf, Muscle fibers; N, Nucleus of calyx cell; Vs, virogenic stroma.Scale bar: A-B=5.0 μm; C=2.0 μm; D=0.5 μm; E=0.2 μm; F=100.0 nm; G=50.0 nm.
3 结论与讨论
寄生蜂毒液器官的形态多种多样,研究其形态结构对膜翅目的分类和进化有重要意义。Edson等(1982)根据毒囊的超微结构在肌肉鞘和内膜上的差异,曾将毒液器官划分为两种类型:类型Ι毒囊被许多纵肌所环绕,形成非常发达的肌肉鞘,毒囊内膜不均匀,波浪状的几丁质加厚形成内壁,是较低等的进化模式;类型II毒囊被相对较少的肌肉环绕,内膜质地薄而均一,具有较进化的衍征,属于较高等的进化模式。虽然这两种类型的毒囊有着很大的差异,但是它们的毒腺的超微结构却是相似的。依据该划分标准,黄眶离缘姬蜂的毒液器官应属于类型II,属于较高等的进化模式。实验观察到,在黄眶离缘姬蜂毒囊的肌肉层中,肌纤丝规则排列,并无网状交错,且从横截面看,毒囊仅由肌肉层和少量扁平细胞层组成,这更进一步表明黄眶离缘姬蜂的毒囊只有储存毒液而无分泌毒液的功能,其毒液应是靠毒囊肌肉的收缩主动排出的。同时,在肌肉层中分散有线粒体,可以为肌肉收缩提供大量的能量。此外,毒囊内膜呈波浪状均匀加厚,向囊腔内突,这不仅在于增加内膜的表面积,而且对排毒时的收缩有直接影响(Lietal., 2006; Wanetal., 2006; Petrocellietal., 2014; Quicke, 2015)。
根据Noirot & Quennedey(1974)提出的昆虫细胞区分标准,黄眶离缘姬蜂毒腺的分泌细胞属于第III型腺体细胞,这一类型的腺体具有表皮包围的导管,并通过一个导管细胞将分泌细胞内的端器和腺体中央的收集管相连。实验观察到,黄眶离缘姬蜂毒腺的分泌细胞层中存在大量的端器,长而密的微绒毛绕中心导管向四周辐射,大大增加了毒液分泌的表面积,且细胞质中包含有许多的细胞器:粗面内质网、线粒体、液泡等,进一步表明分泌细胞层是非常活跃的(Paolietal., 2014)。而当蜂龄较大时,围绕细胞核周围会出现呈指纹状或同心圆状的髓样体,这是细胞衰老的一种表现形式,可能是已被自噬的老化线粒体、内质网、溶酶体等细胞器的残痕(潘健和陈学新, 2003)。
从黄眶离缘姬蜂的生物学习性来看,其毒液器官的形态结构是与雌蜂的产卵行为相关的。黄眶离缘姬蜂为单头内寄生蜂,蜂幼虫老熟后钻出寄主幼虫在尸体附近结茧化蛹,这些特征与其毒液器官的进化模式相同,较为高等。因此,比较寄生蜂毒液器官的形态结构在昆虫分类和进化以及寄生蜂的生理防御的研究上都有重要的价值。
黄眶离缘姬蜂卵巢管没有卵原细胞分化出来的特殊滋养细胞,属于无滋式卵巢。每个卵巢小管均由原卵区和生长区组成,其中原卵区内含正在分裂的卵原细胞,生长区内包含不同发育时期的卵母细胞,且每一个卵母细胞被包围在一个具有显著滤泡细胞的卵室内。随着卵母细胞的生长发育,包围卵母细胞的滤泡细胞经历了一系列的变化:在卵黄蛋白积累之前,滤泡细胞呈柱状,细胞排列紧密;随着脂滴和卵黄蛋白不断累积,卵母细胞胞核开始膨胀,滤泡细胞相互分离,细胞与细胞之间形成较大的间隙,方便营养物质向卵母细胞输送;卵黄蛋白积累基本完成时,滤泡细胞又恢复到紧密排列的状态,卵母细胞与滤泡细胞互相脱离,以便前者排出进入萼区(Huangetal., 2009; Poddubnayaetal., 2010)。据报道,滤泡细胞可能参与卵黄膜和卵壳的形成,在卵壳的形成过程中,滤泡细胞起初活跃,然后逐渐退化呈扁平状,直至消失(Deng and Ruohola-Baker, 2000; 陈洁等, 2015)。
寄生蜂作为膜翅目中的一个特殊群体,其卵萼处的多DNA病毒(PDV)能随着寄生蜂的卵一起被注入到寄主的体内,调控寄主的免疫和发育生理,以确保幼蜂在寄主体内生存发育(Strand, 2012; 叶熹骞等, 2014)。PDV是一组无包涵体的病毒,根据形态学特征和寄主范围的明显差异,这些病毒可分为两大类,即茧蜂病毒属Bracovirus和姬蜂病毒属Ichnovirus。茧蜂病毒仅存在于茧蜂科的某些类群中,其核衣壳呈圆柱形,仅由一层囊膜包裹,且有一个“尾巴”;姬蜂病毒则仅存在姬蜂科的某些种类中,其核衣壳呈纺锤形或圆形,由两层囊膜包裹。PDV只在寄生蜂卵巢萼区萼细胞核中复制,成熟后,病毒粒子则进入到生殖管道中,故在寄生蜂输卵管萼液中常可发现大量的病毒粒子(Stoltz and Krell, 2012)。实验观察到,黄眶离缘姬蜂萼细胞中含有大量类似姬蜂病毒的颗粒在细胞核中复制。在早期萼区细胞内,存在大量空的病毒衣壳以及装配好的病毒粒子前体,卵萼内的病毒粒子在萼细胞内获得第一层外膜,推测其会以出芽的方式进入萼区内腔时获得第二层外膜。至于在卵萼细胞内发现的这种病毒粒子是否为真正的姬蜂病毒,仍需实验进一步验证。
References)
Asgari S, Rivers DB.Venom proteins from endoparasitoid wasps and their role in host-parasite interactions [J].AnnualReviewofEntomology, 2011, 56: 13-35.
Chen XX.Recent progress, existing problems and prospects in biological control of insect pests in China [J].ChineseBulletinofEntomology, 2010, 47(4): 615-625.[陈学新.21世纪我国害虫生物防治研究的进展、问题与展望[J].昆虫知识, 2010, 47(4): 615-625]
Chen J., Wu CJ, Zhang QW,etal.Ovarian development and oogenesis ofHarmoniaaxyridisPallas [J].JournalofPlantProtection, 2015, 42(2): 237-243.[陈洁, 吴春娟, 张青文, 等.异色瓢虫卵巢及卵子发生过程观察[J].植物保护学报, 2015, 42(2): 237-243]
Deng WM, Ruohola-Baker H.Laminin A is required for follicle cell-oocyte signaling that leads to establishment of the anterior-posterior axis inDrosophila[J].CurrentBiology, 2000, 10(11): 683-686.
Edson KM, Barlin MR, Vinson SB.Venom apparatus of braconid wasps: Comparative ultrastructure of reservoirs and gland filaments [J].Toxicon, 1982, 20: 553-562.
Gatti J, Schmitz A, Colinet D,etal.Diversity of virus-like particles in parasitoids’ venom: Viral or cellular origin? In: Beckage NB, Drezen JM,eds.Parasitoid Viruses: Symbionts and Pathogens [M].New York: Academic Press, 2012, 181-216.
He JH, Chen XX, Fan JJ,etal.Hymenopteran Insect Fauna of Zhejiang [M].Beijing: Science Press, 2004, 438.[何俊华, 陈学新, 樊晋江, 等.浙江蜂类志[M].北京: 科学出版社, 2004, 438]
Huang F, Shi M, Chen XX,etal.External morphology and development of immature stages ofDiadegmasemiclausum(Hymenoptera: Ichneumonidae), an important endoparasitoid ofPlutellaxylostella(Lepidoptera: Plutellidae) [J].AnnalsoftheEntomologicalSocietyofAmerica, 2009, 102: 532-538.
Li WD, Yu RX, Chen XX,etal.Venom gland of the ichneumonidDiadromuscollaris: Morphology, ultrastructure and age-related changes [J].InsectScience, 2006, 13: 137-143.
Moreau SJM, Guillot S.Advances and prospects on biosynthesis, structures and functions of venom proteins from parasitic wasps [J].InsectBiochemistryMolecularBiology, 2005, 35(11): 1209-1223.
Noirot C, Quennedey A.Fine structure of insect epidermal glands [J].AnnualReviewofEntomology, 1974, 19: 61-80.
Pan J, Chen XX.A comparative ultrastructure of the venom apparatus from two species of parasitic wasps (Hymenoptera) ofPlutellaxylostella(Lepidoptera) [J].JournalofChineseElectronMicroscopySociety, 2003, 22(4): 298-303.[潘健, 陈学新.两种小菜蛾寄生蜂毒液器官超微结构的比较[J].电子显微学报, 2003, 22(4): 298-303]
Paoli F, Gottardo M, Marchini D,etal.Ultrastructure of the female reproductive apparatus of the egg parasitoidGryonpennsylvanicum(Ashmead) (Hymenoptera, Platygastridae) [J].Micron, 2014, 61: 28-39.
Petrocelli I, Turillazzi S, Delfino GD.The venom apparatus in stenogastrine wasps: Subcellular features of the convoluted gland [J].ArthropodStructure&Development, 2014, 43(5): 1-12.
Poddubnaya LG, Kuchta R, Scholz T,etal.Ultrastructure of the ovarian follicles, oviducts and oocytes ofGyrocotyleurna(Neodermata: Gyrocotylidea) [J].FoliaParasitologica, 2010, 57(3): 173-184.
Quicke DLJ.The Braconid and Ichneumonid Parasitoid Wasps: Biology, Systematics, Evolution and Ecology [M].New Jersey: Wiley Blackwell, 2015: 35-56.
Stoltz D, Krell P.The origins and early history of Polydnavirus research.In: Beckage NB, Drezen JM,eds.Parasitoid Viruses: Symbionts and Pathogens [M].New York: Academic Press, 2012, 5-13.
Strand MR.Polydnavirus gene expression profiling: what we know now.In: Beckage NB, Drezen JM,eds.Parasitoid Viruses: Symbionts and Pathogens [M].New York: Academic Press, 2012, 139-147.
Wan ZW, Yu RX, Chen XX.Venom apparatus of the endoparasitoid waspOpiuscaricivoraeFischer (Hymenoptera: Braconidae): morphology and ultrastructure [J].MicroscopyResearchandTechnique, 2006, 69: 820-825.
Ye XQ, Shi M, Chen XX.Origin and characteristics of polydnaviruses carried by parasitoid wasps [J].ScienceinChina, 2014, 44(4): 342-350.[叶熹骞, 时敏, 陈学新.寄生蜂携带的多DNA病毒的起源及其特性 [J].中国科学, 2014, 44(4): 342-350]
Morphology and ultrastructure of the ovary and venom apparatus of endoparasitoidTrathalaflavo-orbitalisCameron
MAO Sha-Jiang-Yang, WU Qiong, SHI Min, CHEN Xue-Xin*
(State Key Lab of Rice Biology and Ministry of Agriculture Key Lab of Molecular Biology of Crop Pathogens and Insects, Institute of Insect Sciences, Zhejiang University, Hangzhou 310029, China)
To better understand the coevolution relationship betweenTrathalaflavo-orbitalisCameron and its host, we observed the morphology and ultrastructure of the ovary and venom apparatus of the endoparasitoidTrathalaflavo-orbitalisCameron (Hymenoptera: Ichneumonidae) by dissecting the female reproductive system and then examined using optical microscope and transmission electron microscope.The venom apparatus ofT.flavo-orbitalisincludes one venom reservoir, one venom duct which leads to the ovipositor and two gland filaments which join together on the top of the venom reservoir.An outer single layer of secretory cells and an inner intima lined the lumen were observed in the gland filaments.Secretory cells contain some end apparatus, which secreted venom.The reservoir consists of a muscular sheath, epithelial cell, and intima layer.The muscular fibers are finely organized.No distinct organelles are observed in epithelial cell.The intima is thickened uniformly.A pair of ovaries is found inT.flavo-orbitalisand approximately eight ovarioles are observed in each ovary which connects with a lateral oviduct via a small calyx region.In addition, a lot of ichnovirus-like particles are found in the calyx region.The venom apparatus ofT.flavo-orbitalisbelongs to Type II.Some ichnovirus-like particles are discovered in the calyx cell, which would be significant to study how wasps regulate the immune system and developmental physiology of the host.
Trathalaflavo-orbitalisCameron; venom apparatus; ovary; ultrastructure
毛沙江洋,吴琼,时敏,等.黄眶离缘姬蜂卵巢和毒液器官的形态学及其超微结构[J].环境昆虫学报,2017,39(3):650-659.
国家自然科学基金重点项目(31230068)
毛沙江洋,女,1991年生,湖南长沙人,硕士研究生,研究方向为农业昆虫与害虫防治,E-mail: 286355711@qq.com
*通讯作者Author for correspondence, E-mail address:xxchen@zju.edu.cn
Received: 2016-03-30;接受日期Accepted: 2017-02-16
Q964;S476
A
1674-0858(2017)03-0650-10

