斜纹夜蛾Cyp10基因的克隆及表达载体构建
田航宇,俞 丹,邢文溪,李 明
斜纹夜蛾Cyp10基因的克隆及表达载体构建
田航宇,俞 丹,邢文溪,李 明*
(云南大学生命科学学院,云南省高校动物遗传多样性和进化重点实验室,昆明 650091)
亲环蛋白10(Cyclophilin 10, Cyp10)是亲环蛋白家族成员之一,这是一类广泛存在于真核及原核生物内的蛋白家族,其共性是都具有肽基脯氨酰顺反异构酶(Peptidyl-prolyl cis-trans isomerases, PPIase)活性。有研究表明,Cyp10可能参与了肿瘤细胞凋亡蛋白胞质分布的调控,但在昆虫先天免疫中的作用没有见到报道。本研究以斜纹夜蛾Spodopteralitura为研究对象,以寄生后斜纹夜蛾血细胞转录组数据中发现的特异cyp10序列为基础,通过RT-PCR克隆出了cyp10基因,通过生物信息学方法对此序列进行开放阅读框分析(Open Reading Frame, ORF)和序列同源性比对,发现cyp10基因ORF全长486 bp,编码161个氨基酸,具有肽基脯氨酰顺反异构酶家族标签序列:YNGSLFHRNIKGFIVQTG,因此确定为亲环蛋白基因家族成员。构建了包括ORF全长编码区的原核表达载体pET32a-Cyp10及真核表达载体pIZT/V5-His-Cyp10,经Western blot证明,pET32a-Cyp10和pIZT/V5-His-Cyp10可分别在大肠杆菌和鳞翅目昆虫细胞系(Hi5, Sf9和Spli221)中表达,蛋白分子量分别是26 kDa和22 kDa。之后以细胞免疫荧光定位法探索Cyp10在家蚕细胞BmN内的分布, 发现Cyp10主要分布于细胞质内。这些结果为进一步探索Cyp10在昆虫先天免疫中的作用奠定了一定基础。
斜纹夜蛾;Cyp10;克隆;表达;免疫荧光
亲环蛋白(Cyclophilin, Cyp)于1984年在牛胸腺中被发现,又称为环孢素A结合蛋白(Handschumacheretal., 1984)。目前已被发现和克隆的亲免素有130多种异构体(Galatetal., 1999)。最早被发现和提纯的亲环蛋白是亲环蛋白A(Cyclophilin, CypA),其也是迄今为止研究最为广泛的亲环蛋白家族成员。亲环蛋白作为免疫抑制剂环孢素A(CsA)的受体,除具有肽基脯氨酰顺反异构酶(PPLase)活性和作为分子伴侣外,在辅助蛋白质折叠(Iveryetal., 2000)、参与细胞凋亡(Leeetal., 1999)和细胞信号传导(Jinetal., 2000)等方面起着重要作用。亲环蛋白在进化上高度保守,广泛存在于真核生物和原核生物中(Kolerskyetal., 1986)。
亲环蛋白10(Cyclophilin10, Cyp10)作为亲环蛋白家族成员之一,又被称为PPIL3 (peptidylproly isomerase-like 3)、CypJ等(Zhouetal., 2001),与CypA相比具有40%的同源性(Huetal., 2005)。有研究表明,Cyp10参与肿瘤细胞中凋亡蛋白Apoptin的调控,它可以通过调节凋亡蛋白的构象和核质分布,来参与肿瘤细胞凋亡的调节(De-Huaetal., 2008)。为了探讨Cyp10是否在昆虫的先天免疫中也参与了昆虫血细胞的凋亡,本研究以鳞翅目昆虫斜纹夜蛾Spodopteralitura为研究对象,以斜纹夜蛾被双斑侧沟茧蜂Microplitisbicoloratus寄生后的血细胞转录组数据为基础,通过设计特异引物和RT-PCR法从寄生后斜纹夜蛾血细胞中克隆获得了cyp10基因,测序后通过BLAST及同源比对,确认为斜纹夜蛾cyps基因家族成员,并且与同为鳞翅目的大红斑蝶Danausplexippus的Cyp10高度同源,因 此被命名为Cyp10。随后便构建了原核表达载体pET32a-Cyp10和真核表达载体pIZT/V5-His-Cyp10,分别转入大肠杆菌和昆虫细胞系中,通过Western blot检测,结果表明分别获得了表达蛋白,并通过免疫细胞定位发现了Cyp10在细胞的分布情况,这些都为进一步探究Cyp10在昆虫先天免疫中的作用奠定了一定基础。
1 材料与方法
1.1 材料
1.1.1 实验昆虫及细胞
本实验室所用实验昆虫为斜纹夜蛾,虫蛹及饲料配方均来自于中山大学有害生物控制与资源利用国家重点实验室。High Five、Spli221细胞系由中山大学有害生物控制与资源利用国家重点实验室细胞培养室赠送;Sf9细胞系由云南省出入境检验检疫局动检处惠赠,以上细胞系均由本实验室进行培养,传代和冻存。培养所需的培养基为含10%胎牛血清的Hyclone TNM-FH昆虫培养基。在不含二氧化碳的27℃细胞培养箱中进行培养。12孔板中细胞密度约90%时进行转染,48 h后在荧光显微镜下通过观察荧光鉴别转染是否成功。72 h后提取总蛋白进行Western blot检测。
1.1.2 菌株、载体和试剂
大肠杆菌DH5α和BL21均购于北京全式金生物技术有限公司;昆虫原核表达载体pET-32a及真核表达载体pIZT/V5-His均为实验室保存;pMD19-T载体,Taq DNA polymerase及限制性内切酶均购自于Takara公司;RNA提取试剂盒(RNAisoTM Plus)、PCR产物回收试剂盒(Agarose Gel DNA Purification Kit)购于大连宝生物有限公司;质粒提取试剂盒(E.Z.N.A Plasmid Mini Kit I与Endo-free Plasmid Mini Kit II)均购于OMEGA生物公司;GADPH抗体,蛋白Marker、HRP偶联的山羊抗鼠二抗购于碧云天公司;超敏化学发光试剂盒(protein biology)购于Thermo公司;His抗体购于abcam公司;V5抗体购于Invitrogen公司。其它试剂均为分析纯(A.R)。转染试剂X-tremegene HP DNA Transfection Reagent(06366236001)购于Roche公司;荧光染料Propidium iodide (PI)购于Roche公司。
1.2 方法
1.2.1 引物设计和合成
本研究所用的引物是根据转录组测序所得到的斜纹夜蛾cyp10的序列,由本实验研究人员通过Primer Primer 5设计带酶切位点的引物送昆明晨绿公司合成。具体序列及说明见表1,用于后续原核,真核表达载体的构建。
1.2.2 总RNA的提取及cDNA的转录合成
提取一定量的4龄的斜纹夜蛾血淋巴,通过Trizol法提取总RNA。取1 ug RNA通过逆转录试剂盒合成cDNA。
1.2.3cyp10基因的PCR扩增
根据实验室的PCR反应步骤,设置反应体系为15 μL,取1 μg cDNA为模板,30个循环,Tm值为55℃,进行cyp10的扩增及凝胶电泳检测,结果扩增目的片段大小与转录组测序结果一致,通过胶回收试剂盒回收DNA,后与pMD19-T载体连接,转化大肠杆菌DH5α,蓝白斑筛选,挑选白色菌落进行菌落PCR鉴定正确后送昆明擎科公司测序分析。
1.2.4 生物信息学分析
利用在线工具ExPASy ProtParam tool分析蛋白理化性质,在线BLAST工具对预测的蛋白质氨基酸序列进行同源性比对;用BioEdit对测序结果进行比对分析,用TMHMM Sever 2.0进行在线跨膜结构域的预测,SMART分析结构域,MEGA 6.06进行遗传距离分析,并用NJ法构建系统进化树。
1.2.5 斜纹夜蛾Cyp10的原核表达载体构建
取经测序成功的E-pMD-19-Cyp10菌夜,加A+抗性过夜培养,用试剂盒提取质粒,根据设计的相应酶切位点对T载体质粒进行双酶切(Cyp10:BamHI/XhoI),用同样的酶对原核表达载体pET32a进行双酶切。之后将T载体上的目的基因片段和原核表达载体片段进行回收,T4连接酶16℃过夜连接。转化大肠杆菌克隆菌株DH5α,挑选白色菌落双酶切鉴定。鉴定成功后扩大培养,提质粒转化大肠杆菌表达菌株BL21,用于原核表达。
1.2.6 斜纹夜蛾Cyp10的真核表达载体构建
取经测序成功的E-pMD-19-Cyp10菌夜,加A+抗性过夜培养,用试剂盒提取质粒,根据设计的相应酶切位点对T载体质粒进行双酶切(cyp10:EcoRI/NotI),用同样的酶对真核表达载体pIZT/V5-His进行双酶切。之后将T载体上的目的基因片段和真核表达载体片段进行回收,T4连接酶16℃过夜连接。转化大肠杆菌克隆菌株DH5α,挑选白色菌落双酶切鉴定。鉴定成功后过夜培养鉴定连接正确的菌夜,通过无内毒素质粒提取试剂盒提取质粒,用于真核细胞系的转染和表达。
1.2.7 重组蛋白的表达及检测
原核表达中,将重组质粒pET32a-cyp10转化大肠杆菌BL21(DE3)感受态细胞,在含有100 mg/mL氨苄青霉素的LB培养基中37℃震荡培养至OD600=0.5。加入IPTG诱导至终浓度为0.5 mmol/L,摇床培养5 h,诱导蛋白表达。8000 rpm离心5 min收集菌体,加入PBS冰上超声破碎,至溶液呈清亮为止,加入5×SDS样品缓冲液,100℃煮沸10 min。SDS-PAGE电泳检测。
真核表达中,瞬时转染昆虫细胞72 h后,荧光显微镜检测GFP,确定pIZT/V5-His-CyP10转染成功,之后提取细胞总蛋白,用BCA法定量蛋白浓度。
取50 μg蛋白上样电泳,300 mA转膜100 min 5%脱脂牛奶温室封闭1 h后,一抗原核表达用His标签抗体(1∶1000);真核表达用V5标签抗体(1∶2000);二抗都用山羊抗鼠(1∶1000)进行孵育,最后用Tanon 5200曝光显影。
1.2.8 免疫细胞荧光定位
将家蚕BmN细胞接种于12孔板,72 h后,用PBS洗细胞,3.7 %甲醛室温固定15 min,0.2% TritonX-100处理细胞10 min。4%牛奶封闭1 h后,加入一抗V5标签抗体(1∶1000)孵育1 h。PBST(PBS+0.05%Tween-20)洗两次(10 min×2),再加入二抗Alexa Fluor® 568 Goat Anti-Rabbit lgG(H+L)(1∶2000)孵育1 h。1×PBS洗两次(5 min×2),加入鬼笔环肽稀释40倍(1×PBS配制),37℃孵育30-60 min。1×PBS洗一次(5 min)。加入DAPI(终浓度为300 nmol/L)室温孵育5 min。荧光显微镜观察。
2 结果与分析
2.1 斜纹夜蛾cyp10基因的克隆
通过对寄生后斜纹夜蛾血细胞转录组测序结果的分析,获得了cyp10基因cDNA的预测序列。以此为模板,设计特异性引物(表1),以提取斜纹夜蛾血细胞mRNA反转录获得的cDNA为模板,PCR扩增获得了一条490 bp的特异性片段(图1)。通过NCBI在线ORF查找工具,找到了特异的cyp10基因序列,根据ORF设计了带有酶切位点的引物(表1),为后面表达载体的构建做准备。
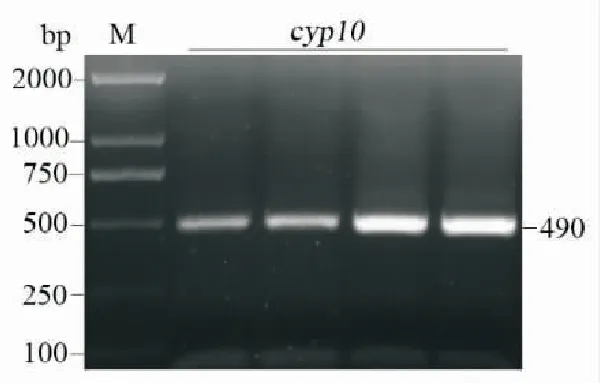
图1 斜纹夜蛾中cyp10基因的PCR扩增产物Fig.1 PCR product of cyp10 in Spodoptera litura
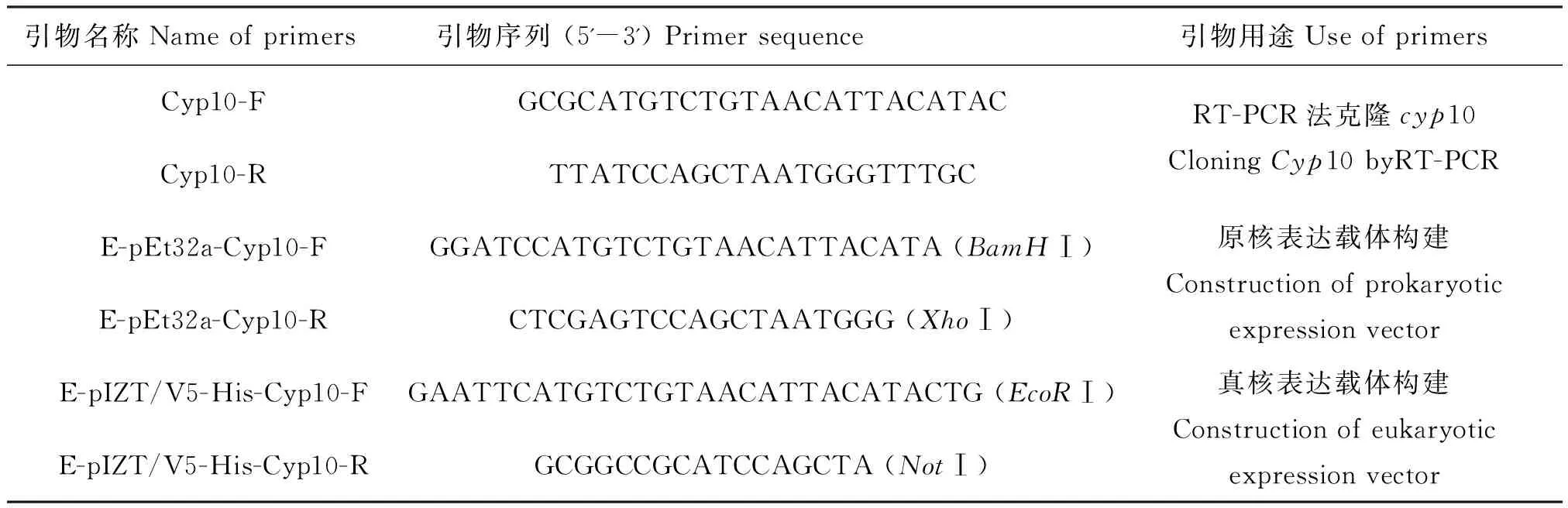
表1 本研究所用到的引物Table 1 Primers used in this study
2.2 斜纹夜蛾cyp10基因的亚克隆及测序鉴定
将上述获得的斜纹夜蛾cyp10克隆片段用试剂盒回收,与pMD19-T克隆载体连接,转化EscherichiacoliDH5α,通过蓝白斑筛选阳性克隆,挑选阳性克隆扩大培养,菌液PCR鉴定,与PCR扩增产物的大小一致。把连接好可能正确的pMD19-T-Cyp10菌液送去公司进行测序,之后用BioEdit软件对得到测序全长结果与原序列进行对比,完全正确。斜纹夜蛾cyp10基因序列ORF长为486 bp,编码161个氨基酸。 氨基酸序列 (如图2)。
2.3 斜纹夜蛾Cyp10的生物信息学分析
通过ExPASy ProtParam tool预测分子量大小为18 kDa,分子式是C795H1220N212O243S8。经过在线软件TMHMM 2.0预测,它没有跨膜结构域,初步断定其不属于膜蛋白。通过TargetP 1.1进行亚细胞定位预测,发现Cyp10定位不在线粒体。使用PROSITE数据库(http://www.expasy.org/prosite)对Cyp10蛋白结构功能域进行分析发现, Cyp10蛋白第6-154氨基酸之间是高度保守的结构功能域-PPIase cyclophilin-type,即亲环蛋白家族成员共有的典型结构域,该结构功能域具有肽基脯氨酰顺反异构酶活性(PPIase)。再通过PROSITE motif搜索预测Cyp10保守功能位点,发现Cyp10蛋白保守功能位点是37-54位的氨基酸序列:YNGSLFHRNIKGFIVQTG(图2红色箭头处),即,亲环蛋白家族标签序列。用DISPHOS 1.3预测Cyp10蛋白磷酸修饰位点,发现有五个苏氨酸修饰位点可能存在(图2蓝色箭头处),代表该蛋白质在翻译后可能会进行修饰。
用DNAman软件对斜纹夜蛾Cyp10氨基酸序列与其它已经报道的物种的Cyp10氨基酸序列进行同源性比对,结果表明斜纹夜蛾Cyp10与无脊椎动物中的大红斑蝶Cyp10(GenBank登录号:EHJ72048.1),家蚕BombyxmoriPPIL3(GenBank登录号:XP_004928560.1),脊椎动物中的人类HomosapiensPPIL3b(GenBank登录号:NP_570981.1),斑马鱼PoissonzèbrePPIL3(GenBank登录号: NP_001002146.1)高度同源,并且它们都有亲环蛋白家族共同的标签序列YNGSLFHRNIKGFIVQTG。因此,确定我们克隆的基因为斜纹夜蛾亲环蛋白家族成员。
2.3 斜纹夜蛾Cyp10系统进化树的构建与分析
从NCBI网站下载其它已经报道的部分物种的亲环蛋白基因序列,运用MEGA 6.0软件Test Neighbor joining Tree方法进行系统进化树的分析(图3),结果表明斜纹夜蛾Cyp10(绿色版块带星号)与同为鳞翅目的家蚕的PPIL3最为接近,之后与大红斑蝶,小菜蛾聚到一起,最后与达氏按蚊,豌豆长管蚜及人体虱同属一大支;而与斑马鱼及人类亲缘性较远。预示斜纹夜蛾Cyp10可能与家蚕PPIL3的功能相近。
2.4 斜纹夜蛾Cyp10基因的原核表达
将扩增出来的目的片段回收纯化后,分别用BamHI和XhoΙ酶切Cyp10;连接到相同酶切回收后的原核表达载体pET-32a上,热激转化E.coliDH5α,获得pET-32a-Cyp10。对重组质粒进行双酶切鉴定,切出目的条带(图4 A)与预期大小一致,将阳性克隆测序,序列比对结果正确,表明pET-32a-Cyp10原核表达载体构建成功(图4 B)。将构建好的pET-32a-Cyp10质粒转入大肠杆菌表达菌株BL21(DE 3)中,37℃过夜培养。经过验证,加入IPTG诱导,终浓度为0.5 mmol/L ,诱导培养5 h, Western blot检测融合蛋白6 His标签,在25-35 kDa出现目的条带,与预期结果相符(图4 C),GADPH为内参。由此证明斜纹夜蛾Cyp10能在原核表达系统中表达,原核表达载体构建成功。
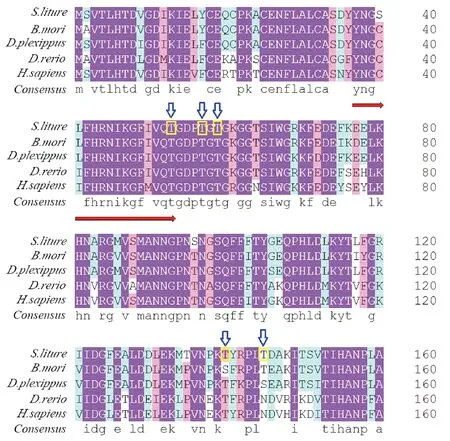
图2 斜纹夜蛾Cyp10与其它物种的同源比对Fig.2 Multiple sequence alignment of Cyp10 from Spodoptera litura with those from other species注:实心箭头指示的是亲环蛋白家族标签序列;空心箭头指示的是磷酸化位点。大红斑蝶,EHJ72048.1;家蚕,XP_004928560.1;人类,NP_570981.1;斑马鱼,NP_001002146.1。Note: The solid arrow indicates the tag sequence of Cyclophilin protein family; the hollow arrow indicates the phosphorylation sites.Danaus plexippus, EHJ72048.1; Bombyx mori, XP_004928560.1; Homo sapiens, NP_570981.1); Danio rerio, NP_001002146.1.
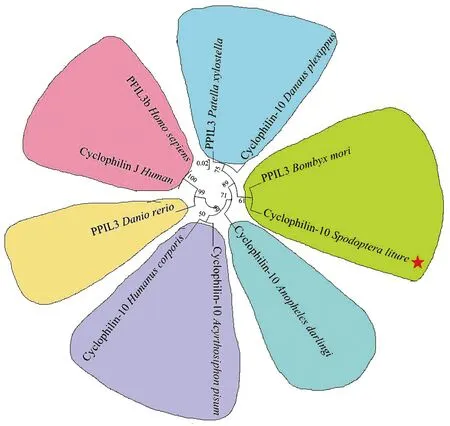
图3 斜纹夜蛾Cyp10与其他物种Cyps的系统进化树Fig.3 Phylogenetic analysis based on amino acid sequences of SpliCyp10 protein and other insect cyclophilin proteins
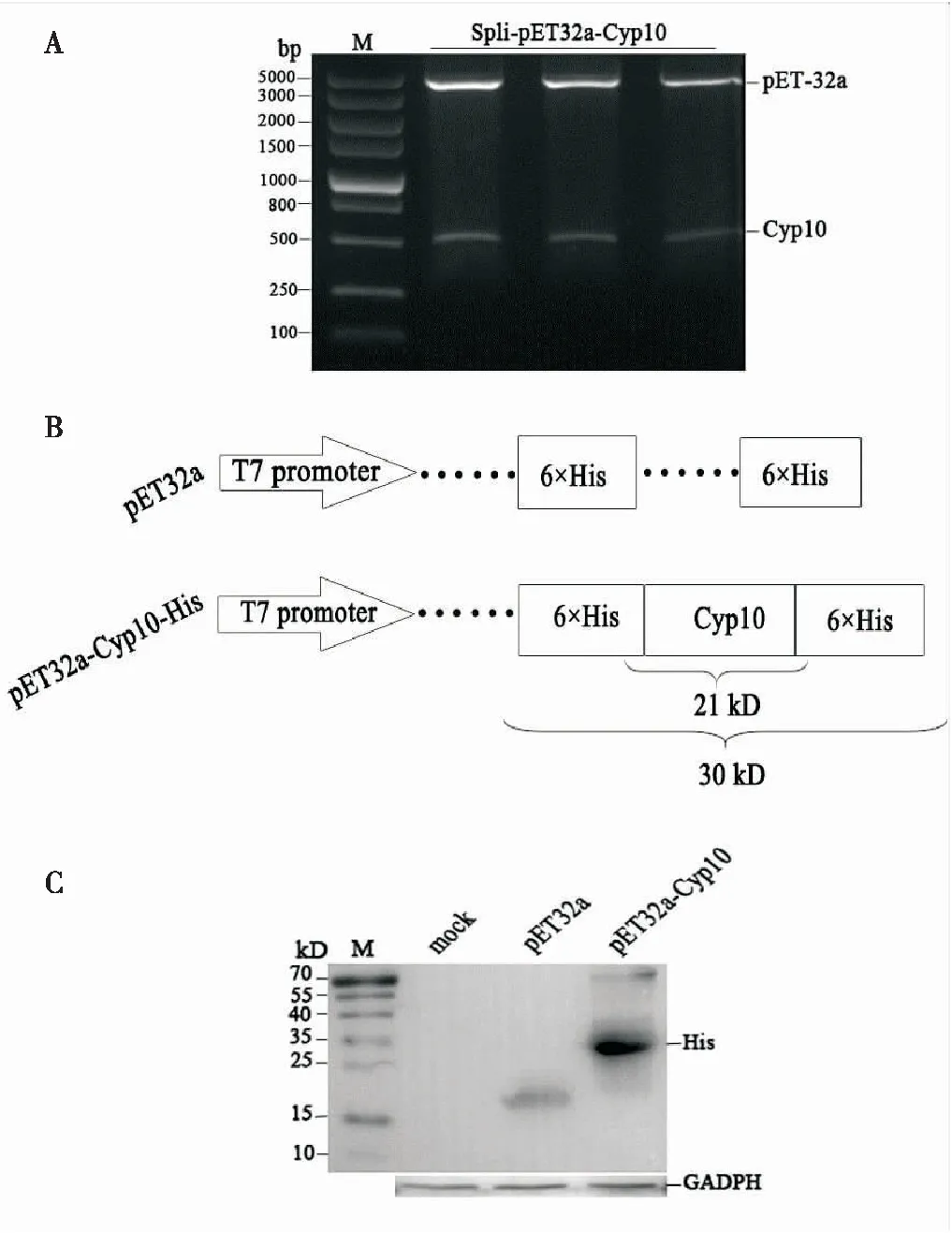
图4 重组质粒pET-32a-CyP10在大肠杆菌BL21(DE3)中的原核表达Fig.4 Prokaryotic expression of pET-32a-CyP10 in BL21 (DE3)注:A,重组质粒pET-32a-Cyp10的双酶切鉴定;B,Cyp10原核表达结构及组成融合蛋白的表达量;C,Western blot检测Cyp10融合蛋白的表达;M,低分子标准蛋白;GADPH,内参蛋白。Note: A, The identification of pET-32a-Cyp10 by double enzyme digestion; B, The prokaryotic expression structure and fusion protein molecular weight of Cyp10; C, Expression of fusion protein His-Cyp10-His determined by Western blot; M, protein mark; GADPH, inter control protein.
2.5 斜纹夜蛾Cyp10基因的真核表达

图5 重组质粒pIZT-Cyp10在High Five, Sf9 and Spli221细胞中的真核表达Fig.5 Eukaryotic expression of pIZT-Cyp10 in High Five, Sf9 and Spli221 cells注:A,重组质粒pIZT-Cyp10的双酶切鉴定;B,SpliCyp10真核表达结构以及融合蛋白表达量;C,Cyp10转染High Five,Sf9 and Spli221细胞系48 h后荧光观察GFP表达;D,Western blot检测Cyp10-V5-His在High Five, Sf9 and Spli221中融合蛋白表达。GADPH,内参蛋白;Bar=20 μm。Note:A, The identification of pIZT-Cyp10 by double enzyme digestion; B, The eukaryotic expression structure and fusion protein molecular weight of Cyp10; C, Cyp10 tranfected in High Five, Sf9, Spli221 cells 48 h, showed the expression of GFP; D, Expression of fusion Protein Cyp10-V5-His determined by Western blot in High Five, Sf9 and Spli221 cells.GADPH, inter control protein; Bar=20 μm.
为进一步研究Cyp10的功能,本研究构建了pIZT/V5-His-Cyp10的真核表达载体。将扩增出来的目的片段回收纯化后,均用EcoRI和NotI酶切Cyp10,连接到相同酶切回收后的真核表达载体pIZT/V5-His上,热激转化E.coliDH5α,获得pIZT/V5-His-Cyp10。对重组质粒进行双酶切鉴定,切出的条带(图5 A)与预期大小一致,将阳性克隆测序,序列比对结果正确,表明pIZT/V5-His-Cyp10真核表达载体构建成功。将验证正确的质粒转入斜纹夜蛾Spli221细胞,粉纹夜蛾High Five细胞及草地贪夜蛾Sf9细胞系中表达。72 h后,在荧光显微镜下可看到明显的荧光(图5 C)。GFP蛋白为真核质粒pIZT/V5-His上的自带蛋白,有荧光说明转染成功。然后用识别载体本身表达的V5序列标签抗体进行western blot实验,发现Cyp10均在15 kDa-25 kDa有特异性条带(图5 D),与预期的22 kD基本一致,且转染空质粒的没有条带。
2.6 亚细胞定位
Cyp10在家蚕BmN细胞内的定位如图6红色荧光所示,由图可知Cyp10主要分布于细胞质且靠近细胞核。经鬼笔环肽处理后细胞骨架发蓝色荧光,DAPI处理后细胞核发蓝色荧光,Merge为叠加图片。
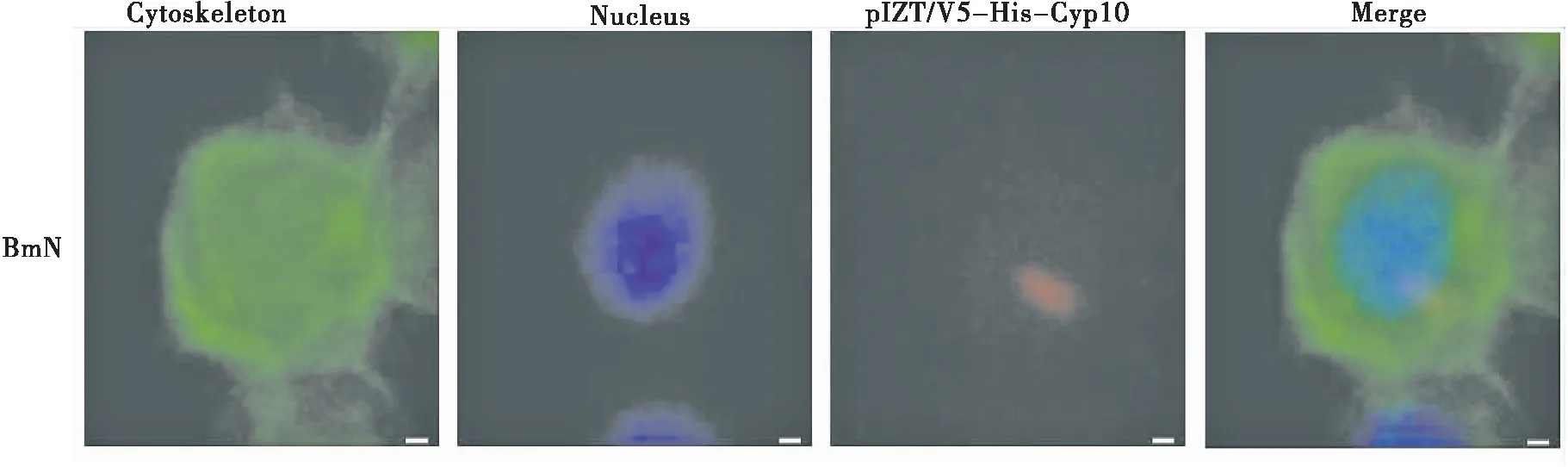
图6 Cyp10免疫细胞荧光定位Fig.6 The localization of Cyp10 in BmN cells注:绿色荧光为细胞骨架,蓝色荧光为细胞核,红色荧光为pIZT/V5-His-Cyp10。Note: Green fluorescence is cytoskeleton, blue fluorescence is nucleus, red fluorescence is pIZT/V5-His-Cyp10.
3 结论与讨论
目前,对亲环蛋白的研究主要集中在脊椎动物,特别是人类的相关疾病,例如:动脉粥样硬化(Satohetal., 2008),HIV-1病毒的复制(Towers, 2007)和炎性疾病的发生等,且以亲环蛋白A的功能研究较多。而在无脊椎动物中,亲环蛋白的研究较少。对于Cyp10的研究,目前主要在其分子克隆上,如人胚胎脑PPIL3的分子克隆(Zhouetal., 2001)等。而其生物学功能的研究,目前很少有见报道,De-Hua等(2008)发现PPIL3可能与凋亡蛋白Apoptin的折叠和细胞内分布相关,这提示其可能参与了细胞凋亡。
细胞凋亡是核酸内切酶催化下染色质DNA降解的过程,而这一过程与一系列基因的激活、表达以及调控有关(Domingos and Steller, 2007),有研究表明亲环蛋白具有核酸酶活性(Montagueetal., 1994),且参与了T细胞的自然凋亡,但具体调控机制尚不清楚。而在上述转染实验过程中,转染了pIZT/V5-His-Cyp10的几种昆虫细胞均出现了不同程度的凋亡现象,对照组没有这种现象,预示Cyp10可能参与了细胞的凋亡过程。
本研究以斜纹夜蛾为研究对象,研究其被双斑侧沟茧蜂寄生后的免疫反应,已有研究报道双斑侧沟茧蜂携带的PDV病毒会使宿主细胞凋亡(Luo and Pang, 2006),因此我们推测此过程是否与亲环蛋白的表达有关。我们以斜纹夜蛾血细胞转录组数据中发现的特异cyp10序列为基础,从斜纹夜蛾血细胞中克隆达到了cyp10基因,确定了其编码区大小为486 bp,并且通过生物信息学分析了Cyp10的理化性质及预测了结构功能域。同源比对确定从斜纹夜蛾血细胞中克隆的cyp10为斜纹夜蛾亲环蛋白家族成员,具有肽基脯氨酰顺反异构酶活性,并且与鳞翅目昆虫大红斑蝶的cyp10高度同源,因此命名为Cyp10。系统进化树的分析发现, Cyp10与家蚕PPIL3亲缘性最为接近,而与脊椎动物人或斑马鱼的亲缘性较远,预示Cyp10可能与家蚕PPIL3功能相近,由于相关文献报道较少,所以Cyp10的具体功能还需深入探究,为此我们构建了原核表达载体和真核表达载体。
本文成功构建的原核表达载体pET32a-Cyp10主要用于后期Cyp10特异性抗体的制备,方便以后Cyp10的功能研究。而成功构建的真核表达载体pIZT/V5-His-Cyp10及在昆虫细胞系中的成功表达,为进一步探索Cyp10在昆虫先天免疫中的作用奠定了一定基础。在将Cyp10转染进入到真核细胞的过程中需要合适的载体。本实验所选择的真核细胞表达载体pIZT/V5-His是一种带有GFP的载体,筛选标记简单,是一种进行基因转染、表达的理想载体。质粒转染细胞后在特定的波长下发绿色荧光,为确定Cyp10是否转染成功提供了直观的标记靶位。图5C中的绿色荧光说明成功转染了pIZT/V5-His空载和pIZT/V5-His-Cyp10。
原核生物蛋白表达没有翻译后的修饰过程,表达量即为自身。而真核生物表达的蛋白的翻译表达常伴随着磷酸化,去磷酸化等多种修饰途径,故表达的蛋白大小可能与预测的有差异。由于前面对斜纹夜蛾Cyp10蛋白磷酸修饰位点的预测,发现有五个可能存在的苏氨酸修饰位点(图2),代表该蛋白质在翻译后可能会进行修饰。通过Western blot发现pIZT/V5-His-Cyp10在High Five和Spli221细胞中的分子量稍微低于预测的大小22 kDa,特别是在Spli221细胞中,但在Sf9细胞中蛋白分子量接近22 kD。因此推测Cyp10在High Five和Spli221细胞中可能发生了修饰。
真核表达载体构建成功后,为进一步探究Cyp10的生物学功能,我们应用细胞免疫荧光定位法对Cyp10进行了亚细胞定位。结果显示其主要分布细胞质中,这与De-Hua等(2008)探究的Cyp10与凋亡蛋白Apoptin在肿瘤细胞细胞质中相互作用相符,这将为更深入探讨Cyp10的生物学功能提供帮助。而对于Cyp10深入的研究将有利于揭示昆虫先天免疫的分子机制。
References)
Huo DH, Yi LN, Yang J,etal.Interaction with Ppil3 leads to the cytoplasmic localization of Apoptin in tumor cells[J].BiochemicalandBiophysicalResearchCommunications, 2008, 372(1): 14-18.
Domingos PM, Steller H.Pathways regulating apoptosis during patterning and development[J].CurrentOpinioninGenetics&Development, 2007, 17(4): 294-299.
Galat A.Variations of sequences and amino acid compositions of proteins that sustain their biological functions: An analysis of the cyclophilin family of proteins[J].ArchivesofBiochemistryandBiophysics, 1999, 371(2):149-162.
Handschumacher RE, Harding MW, Rice J,etal.Cyclophilin: A specific cytosolic binding protein for cyclosporin A[J].Science, 1984, 226(4674): 544-547.
Hu R, Ouyang Q, Dai A,etal.Heat shock protein 27 and cyclophilin A associate with the pathogenesis of COPD[J].Respirology, 2011, 16(6): 983-993.
Hu H, Huang CQ, Liu HL,etal.Crystallization and preliminary X-ray crystallographic studies of human cyclophilin J[J].ActaCrystallographica, 2005, 61(2): 216-218.
Ivery MT.Immunophilins: Switched on protein binding domains?[J].MedicinalResearchReviews, 2000, 20(6): 452-484.
Jin ZG, Lungu AO, Xie L,etal.Cyclophilin A is a proinflammatory cytokine that activates endothelial cells[J].Arteriosclerosis,Thrombosis,andVascularBiology, 2004, 24(7): 1186-1191.
Jin ZG, Melaragno MG, Liao DF,etal.Cyclophilin A is a secreted growth factor induced by oxidative stress[J].CirculationResearch, 2000, 87(9): 789-796.
Kolersky AJ, Harding MW, Hardschumacher RE,etal.Cyclophilin: Distribution and variant properties in normal and neoplastic tissues[J].JournalofImmunology, 1986, 137(3): 1054-1059.
Luo KJ, Pang Y.Spodopteralituramulticapsid nucleopolyhedrovirus inhibitsMicroplitisbicoloratuspolydnavirus-induced host granulocytes apoptosis[J].JournalofInsectPhysiology, 2006, 52(8): 795-806.
Lee JP, Palfrey HC, Bindokas VP,etal.The role of immunophilins in mutant superoxide dismutase-1 linked familial amyotrophic lateral sclerosis[J].ProceedingsoftheNationalAcademyofSciences, 1999, 96(6): 3251-3256.
Montague JW, Gaido ML, Frye C,etal.A calcium-dependent nuclease from apoptotic rat thymocytes is homologous with cyclophilin.Recombinant cyclophilins A, B, and C have nuclease activity[J].JournalofBiologicalChemistry, 1994, 269(29): 18877-18880.
Satoh K, Matoba T, Suzuki J,etal.Cyclophilin A mediates vascular remodeling by promoting inflammation and vascular smooth muscle cell proliferation[J].Circulation, 2008, 117(24): 3088-3098.
Towers GJ.The control of viral infection by tripartite motif proteins and cyclophilin A[J].Retrovirology, 2007, 4(1): 1-10.
Zhou Z, Ying K, Dai J,etal.Molecular cloning and characterization of a novel peptidylprolyl isomerase (cyclophilin)-like gene (Ppil3) from human fetal brain[J].Cytogenetics&CellGenetics, 2001, 92(3): 231-236.
Molecular cloning and construction of expression vector of Cyp10 fromSpodopteralitura
TIAN Hang-Yu, YU Dang, XING Wen-Xi, LI Ming*
(Yunnan Province Key Laboratory for University Zoological Gentic Diversity and Evolution, School of Biosciences, Yunnan University, Kunming 650091,China)
Cyclophilin 10 is one of the members of Cyclophilin protein family with cis-trans isomerases Peptidyl-prolyl activity, which is widely distributed in eukaryotes and prokaryotes.Recent studies indicate that Cyp10 may be involved in cytoplasmic distribution of apoptin in tumor cells.However, little is known about the function of this protein in insect innate immunity.Here, we clonedcyp10 Open Reading Frame (ORF), which contained 486 bp, conded 161 AA, from theSpodopteraliturahemocytes by RT-PCR.Then, using the bioinformatics methods, the peptidyl prolyl cis-trans isomerase family tag sequence was found YNGSLFHRNIKGFIVQTG, which belongs to the conversedcypgene family.Furthermore, pET32a-Cyp10 were constructed and expressed 26 kDa by usingE.coli.Likewisely, pIZT/V5-His-Cyp10 were constructed to express 22 kDa in insect cell lines (High Five, Sf9 and Spli221).Finally, we foud that Cyp10 distributed in the cytoplasm of BmN cells by immunofluorescence.This study provides a possibility for functional research of Cyp10 in insect innate immunity.
Spodopteralitura;Cyp10;cloning;expression;immunofluorescence
田航宇,俞丹,邢文溪,等.斜纹夜蛾Cyp10基因的克隆及表达载体构建[J].环境昆虫学报,2017,39(3):588-595.
国家自然基金项目(31360454, 31260448, 31560528);云南省应用基础研究计划项目(2012FB120)
田航宇,男,1990年生,硕士,云南曲靖人,主要从事昆虫的先天免疫研究,E-mail:tianhangyu@163.com
*通讯作者Author for correspondence,E-mail:leeming@ynu.edu.cn
Received:2016-03-30;接受日期Accepted:2016-05-26
Q963;S433.4
A
1674-0858(2017)03-0588-08

