补肾活血方对AGEs条件下体外纯化培养大鼠视网膜Müller细胞HIF-1α介导缺氧信号通路的影响
秦伟,谢学军,李志英,宋明霞,曹新伟,马殿伟,荣素然,陈一兵,王雪菁
·论著:实验研究·
补肾活血方对AGEs条件下体外纯化培养大鼠视网膜Müller细胞HIF-1α介导缺氧信号通路的影响
秦伟1,谢学军2,李志英3,宋明霞2,曹新伟2,马殿伟2,荣素然2,陈一兵1,王雪菁1
目的观察在晚期糖基化终末产物(AGEs)条件下,补肾活血方含药血清对大鼠视网膜Müller细胞的缺氧诱导因子-1α(HIF-1α)缺氧信号通路的影响。方法采用SD大鼠制备补肾活血中药含药血清和空白血清,以终浓度50mg/L的AGEs作为低AGEs条件,终浓度100mg/L的AGEs作为高AGEs条件,将体外纯化培养的P2代视网膜Müller细胞分为6组,分别置于加入空白血清、中药含药血清、空白血清+低AGEs、空白血清+高AGEs、中药含药血清+低AGEs、中药含药血清+高AGEs的DMEM培养基中,培养48 h后酶联免疫吸附法(ELISA)检测各组细胞外液中HIF-1α、血管内皮生长因子(VEGF)含量,逆转录-聚合酶链法(RT-PCR)测定各组Müller细胞HIF-1αmRNA、VEGFmRNA表达量,比较差异。结果1.低AGEs组较正常对照组HIF-1α值有升高趋势,但差异无统计学意义(P>0.05),HIF-1αmRNA值明显升高,其差异有统计学意义(P<0.05),高AGEs组较正常对照组HIF-1α、HIF-1αmRNA值明显升高,其差异有统计学意义(P<0.05);低、高AGEs组较正常对照组VEGF、VEGFmRNA值明显升高,其差异有统计学意义(P<0.05)。2.正常中药干预组HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA值接近正常对照组,差异无统计学意义(P>0.05)。3.低、高AGEs中药干预组HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA值均较对应的低、高AGEs组明显降低,其差异有统计学意义(P<0.05)。结论补肾活血方含药血清可抑制视网膜Müller细胞在AGEs条件下HIF-1α介导缺氧信号通路的高表达,这可能是补肾活血方防治DR的机制之一。
补肾活血;Müller细胞;低氧诱导因子;晚期糖基化终末产物;血管内皮生长因子
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的慢性微血管并发症,成人主要致盲疾病之一。DR发病机制包括晚期糖基化终末产物(advanced glycation end products,AGEs)形成堆积、细胞生长因子异常、多元醇肌醇代谢异常等。其中AGEs的形成和堆积,可导致氧化应激作用增强、血管舒缩调节功能异常、细胞外基质结构和功能异常、白细胞黏滞性增加,并影响视网膜血管内皮细胞、周细胞、视网膜色素上皮(retinal pigmentepithelium, RPE)细胞的生理功能,使视网膜屏障受到破坏[1],可作为DR微血管病变的独立危险因素。AGEs在视网膜中不断聚集,视网膜屏障破坏,视网膜缺血缺氧不断加重,继而诱发机体产生相应的一系列适应反应,从而维持机体氧稳态。在此过程中缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)起到关键作用,它是迄今为止发现的唯一能在特异性缺氧状态下发挥活性的转录因子,是调节细胞内氧代谢的关键物质,能诱导下游基因血管内皮生长因子(vascularendothelialgrowth factor,VEGF)的表达。现已有研究表明[2],AGEs可通过细胞外调节激酶通路活化HIF-1α,从而刺激VEGF的增加,导致DR的形成发展。视网膜Müller细胞是视网膜缺氧代谢的重要环节,Müller细胞中HIF-1α介导缺氧信号通路,而VEGF是HIF-1α重要的下游靶基因。因此我们推测:了解视网膜Müller细胞在各种病理条件下是如何调控HIF-1α及VEGF的表达,将有助于诠释视网膜Müller细胞在DR发生发展及治疗过程中的作用,有利于寻求在缺血缺氧性眼病中如何利用Müller细胞较神经元耐缺血缺氧的特点,调控其缺氧应答反应过程与程度,以更好地保护视功能。我们的前期研究表明补肾活血方[3-8]是治疗DR的一种有效方法,故本实验旨在研究补肾活血方对AGEs条件下HIF-1α介导缺氧信号通路的影响,从发病机理方面进一步探究补肾活血方对DR患者视网膜Müller细胞的保护作用,为临床应用补肾活血方治疗DR奠定一定的实验基础。
1 材料与方法
1.1 实验动物及试剂
视网膜Müller细胞纯化培养:清洁级Sprague-Dawley(SD)大鼠,新生7 d,9只,雌雄不限[成都中医药大学实验动物中心提供(川实动管质第99-11号)]。
补肾活血中药复方含药血清:清洁级SD大鼠50只,体质量150~180 g,8~12周龄,雌雄各半[成都中医药大学实验动物中心提供(川实动管质第99-11号)]。
实验试剂:AGEs(北京博奥森生物技术有限公司);谷氨酰胺合成酶(glutamine synthetase,GS)鉴定I抗兔多克隆抗体(SANTA CRUZ,美国),II抗生物素化羊克兔抗体(SANTA CRUZ,美国);HIF-1α检测试剂(Bio-Rad,美国);VEGF检测试剂(Bio-Rad,美国);IQSYBRGreen Supermix(Bio-Rad,美国)。
1.2 中药含药血清制备
补肾活血中药复方(由人参须、丹参、地黄、葛根等组方,成都中医药大学提供)。SD大鼠50只,体质量120~150 g,随机分为补肾活血中药复方血清组(中药含药血清组)、空白对照组(空白血清组)两组,每组25只,制备对应的动物血清,具体方法同前期研究[8]。
1.3 视网膜Müller细胞原代及传代培养及鉴定
SD大鼠9只,新生7 d,酶消化法体外纯化传代培养视网膜Müller细胞,透射电镜观察视网膜Müller细胞超微结构,GS免疫组化染色鉴定,实验细胞取用P2代细胞;具体方法同前期研究[8]。
1.4 实验分组
实验1组:正常对照组,DMEM培养基,含20%空白血清。
实验2组:正常中药干预组,DMEM培养基,含20%中药含药血清。
实验3组:低剂量AGEs组,含20%空白血清的DMEM培养基+终浓度为50mg/L的AGEs。
实验4组:低剂量AGEs中药干预组,含20%中药含药血清的DMEM培养基+终浓度为50mg/L的AGEs。
实验5组:高剂量AGEs组,含20%空白血清的DMEM培养基+终浓度为100mg/L的AGEs。
实验6组:高剂量AGEs中药干预组,含20%中药含药血清的DMEM培养基+终浓度为100mg/L的AGEs。
1.5 酶联免疫吸附法测定视网膜Müller细胞HIF-1α表达量
各组相应条件下培育48h,取培养基上清液50μl,按HIF-1α试剂盒说明书方法加入检测试剂,酶标试剂和生物素标记二抗,37℃,培育1h,洗板5次,37℃,加入A、B显色液,于10min后加入终止液,10min内测定光密度(OD)计算HIF-1α浓度,单位ng/ml。
1.6 酶联免疫吸附法测定视网膜Müller细胞VEGF表达量
各组相应条件下培育48 h,取培养基上清液50 μl,按VEGF试剂盒说明书方法加入检测试剂,酶标试剂和生物素标记二抗,37℃,培育1 h,洗板5次,37℃,加入A、B显色液,于10min后加入终止液,10min内测定OD值计算HIF-1α浓度,单位ng/ml。
1.7 逆转录-聚合酶链法测定视网膜Müller细胞HIF-1αmRNA、VEGFmRNA表达量
各组相应条件下培育48 h后,逆转录-聚合酶链法(reverse transcriotion-polymerase chain reaction,RT-PCR)测定视网膜Müller细胞HIF-1αmRNA、VEGFmRNA表达量,具体方法同前期研究[9]
1.8 统计分析
应用SPSS 17.0软件进行统计学分析,定量资料采用x軃±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
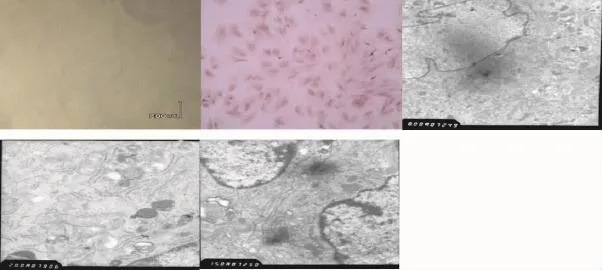
图1 SD大鼠P1代视网膜Müller细胞培养2 d后倒置显微镜像(×100)。图2 SD大鼠P2代视网膜Müller细胞培养5 d后谷氨酰胺合成酶(GS)染色像(×200)。图3~图5 SD大鼠P2代视网膜Müller细胞培养5 d后透射电镜像(×50000)
2 结果
2.1 视网膜Müller细胞鉴定结果
纯化培养原代视网膜Müller细胞,GS染色阳性率大于80%,表现为大量棕色阳性反应位于细胞核及细胞浆内,细胞周围可见稍浅的免疫阳性反应,勾勒出的带有终足以及蹼形爪的扁平细胞轮廓,P1代与P2代细胞GS染色阳性率均在85%以上(图1,图2)。透射电镜下见视网膜Müller细胞形态不规则,正常细胞结构完整,细胞表面大量微绒毛,胞质丰富,内含8~10 nm微丝、丰富的线粒体、高尔基体和散在溶酶体,细胞核大,可见1~2个核仁(图3~图5)。
2.2 各干预条件下体外纯化培养视网膜Müller细胞HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA表达量比较
低、高剂量AGEs组HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA值均较正常对照组升高,补肾活血方含药血清能降低两组AGEs干预条件下HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA的表达(P<0.05);补肾活血方含药血清对正常条件下Müller细胞HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA表达量无明显影响(P>0.05)(表1)。
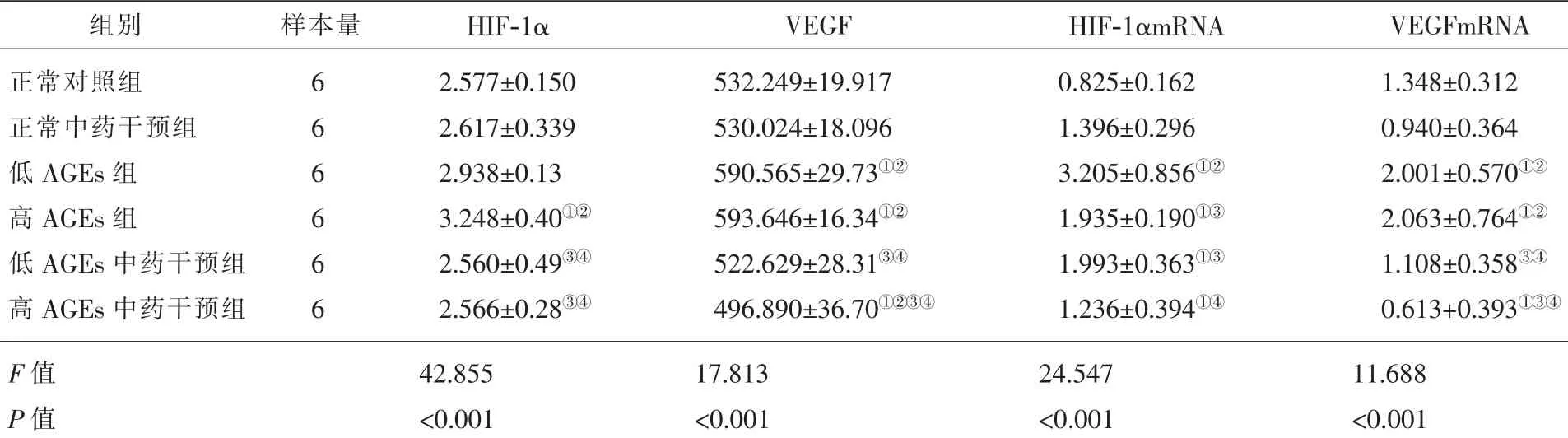
表1 各组大鼠视网膜Müller细胞HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA表达量比较(x軃±s)
3 讨论
DR属祖国医学“消渴目病”范畴,基本病机为气阴两虚、肝肾不足,瘀血阻络、痰浊内生及痰瘀互结,以肝肾亏虚为本,以瘀为标[10]。因此当以补益肝肾、滋补精血为治本之法,并以活血化瘀通络之法贯穿治疗始终。据此我们自拟补肾活血中药复方用于治疗DR。前期研究表明[3-8]它是治疗DR的一种有效方法。缺氧诱导因子-1(HIF-1)能够通过激活包括VEGF在内的与缺氧相关的众多因子,从而精确调节细胞代谢中的氧浓度,使组织细胞及机体适应外周环境氧浓度的变化,它是缺氧应答全局性调控因子[11-12]。HIF-1由HIF-lα、HIF-lβ两个亚单元组成,HIF-1β是基础表达蛋白,为HIF-1的组成性表达,而HIF-1α是HIF-1的活性亚基、调节亚基,氧分压严格调控其蛋白稳定性及转录活性[13],属于氧调节蛋白。VEGF是HIF-1α最主要的下游靶基因[14]。VEGF可以通过增加血管通透性,促使血管内皮细胞分裂、移行及细胞外基质形成,从而形成新生血管,是目前已知的最关键最主要的血管生成促进因子[15]。临床研究[16]也表明VEGF水平和增生型糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)有直接显著的关系。高血糖长期得不到有效控制会导致糖尿病患者机体细胞内、细胞外基质发生非酶糖化,形成AGEs的共价物,AGEs的不断过量形成与堆积,会导致白细胞黏滞性增加继而破坏血-视网膜屏障,从而引起视网膜持续性缺血缺氧状态。在此条件下,机体为适应异常低氧环境,HIF-1α作为一种缺氧信号蛋白,将被迅速激活,并诱导下游因子VEGF的异常高表达。Müller细胞自视网膜外界膜纵向向内伸展,穿过整个视网膜至内界膜,是视网膜中最主要的神经胶质细胞。有研究表明视网膜Müller细胞可影响视网膜的代谢状况,分泌多种生长因子,改变视网膜的免疫状态,破坏视网膜内的精细结构,并可能参与视网膜神经细胞的损伤及免疫细胞的增殖过程,这些都决定了Müller细胞在DR及其它视网膜血管病变中起到了重要作用[17]。同时,从Müller细胞的形态结构来看,它也最易受到病理因素的影响。在DR的早期即可发现视网膜电图b波的改变。而视网膜电图b波主要起源于神经元和Müller细胞[18],这就提示Müller细胞在DR的早期可能就发生了功能障碍。视网膜Müller细胞是视网膜缺氧代谢的重要环节,Müller细胞中HIF-1α介导缺氧信号通路,而VEGF是HIF-1α重要的下游靶基因。本次实验结果显示,低AGEs组较正常对照组HIF-1α值有升高趋势,但差异无统计学意义(P>0.05)。HIF-1αmRNA值明显升高,其差异有统计学意义(P<0.05),高AGEs组较正常对照组HIF-1α、HIF-1αmRNA值明显升高,其差异有统计学意义(P<0.05)。低、高AGEs组较正常对照组VEGF、VEGFmRNA值明显升高,其差异有统计学意义(P<0.05)。提示视网膜Müller细胞在AGEs条件下HIF-1α介导的缺氧信号通路高表达,这可能是导致DR发生发展的重要途径。
同时本实验结果显示,补肾活血方含药血清对正常条件下体外纯化培养视网膜Müller细胞HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA表达量无明显影响(P>0.05),提示补肾活血方含药血清对正常条件下视网膜Müller细胞HIF-1α介导缺氧信号通路无明显影响;加入中药干预的AGEs样本HIF-1α、VEGF、HIF-1αmRNA、VEGFmRNA表达量较对应AGEs剂量未加中药干预样本的数值明显降低(P<0.05),与正常对照组的数值相当或低于正常对照组(P<0.05),提示补肾活血方含药血清能明显抑制体外纯化培养视网膜Müller细胞HIF-1α介导缺氧信号通路的高表达。因此,笔者推测,补肾活血方能抑制糖尿病患者视网膜Müller细胞HIF-1α介导缺氧信号通路的高表达,这可能是补肾活血方防治DR的机制之一。
[1]Moore TC,Moore JE,Kaji Y,et al.The role of advanced glycation end products in retinal microvascular leukostasis[J].Invest OphthalmolVis Sci,2003,44(10):4457-4464.
[2]Treins C,Giorgetti-peraldiS,Murdaca J,etal.Regulation ofvascular endothelial growth factor expression by advanced glycation end products[J].JBiolChem,2001,276(47):43836-43841.
[3]马殿伟,谢学军,李晓微,等.TGF-β2干预的缺氧状态下补肾活血剂对Müller细胞及谷氨酰胺合成酶活性的影响[J].中国中医眼科杂志,2010,28(5):408-411.
[4]马荣,谢学军,万李,等.补肾活血中药血清对高糖条件下纯化培养的视网膜神经节细胞Glu释放量的影响[J].中国中西医结合杂志,2010,30(8):875-880.
[5]秦伟,谢学军,何宇,等.补肾活血中药复方对实验性糖尿病大鼠视路神经元病理损害的影响及机理探讨[J].辽宁中药杂志,2012,39(8):1614-1616.
[6]秦伟,谢学军,何宇,等.补肾活血中药对糖尿病大鼠视路SynI和Nissl小体的影响[J].中国中医眼科杂志,2012,22(1):1-4.
[7]秦伟,谢学军,何宇,等.补肾活血中药对糖尿病大鼠视路Nissl小体和Bcl-2的影响[J].江西中医学院学报,2011,23(6):65-67. [8]谢学军,李芳梅,张梅,等.补肾活血法对Müller细胞谷氨酸摄取功能的影响[J].中国中医眼科杂志,2008,18(1):19-22.
[9]宋明霞.补肾活血法对高糖及AGEs干预下视网膜Müller细胞HIF-1α介导缺氧信号通路影响的研究[D].成都:成都中医药大学,2012:10-11.
[10]王明芳,中医眼科学[M].北京:中国中医药出版社,2004:740.
[11]Semenza G L,Wang G L.A Nuclear Factor Induced by Hypoxla via de Novo Protein Synthesis Binds to the Human Erythropoletin Gene Enhancer at a Site Required For Transcripti0nal Activation[J].Mol CellBiol,1992,12(12):5447-5454.
[12]SemenzaGL.Hydroxylation ofHIF-1:oxygen sensingat themolecular level[J].Physiology,2004,19(2):176-182.
[13]Lee YK,Kim EJ,Lee JE,et al.Hypoxia induces connective tissue growth factor mRNA expression[J].JKorean Med Sci,2009,24 (Supp1):S176-S182.[14]Semenza GL.HIF-I:Mediator of physiologicaland pathophysiological response to hypoxia[J].Appl Phyaiol, 2000,88(4):1474-1480.
[15]Boyd SR,Tan D,Bunce C,etal.Vascular endothelial growth factor is elevated in ocular fluids of eyes harbouring uvealmelanoma:identification of a potential therapeutic window[J].Br JOphthalmol, 2002,86(4):448-452.
[16]周林,康建芳,冯军,等.糖尿病视网膜病变患者房水VEGF和IL-6水平的测定及其临床意义[J].中国实用眼科杂志,2011,29 (1):21-24.
[17]张承芬,张惠蓉.糖尿病的眼部并发症及治疗[M].北京:人民卫生出版社,2003:99-116.
[18]杨雄里.视觉的神经机制[M].上海:上海科技出版社,1996:71.
Study on influence of Bushen Huoxue decoction on signal pathwaymediated by HIF-1αof RMCs cul- tured in AGEscondition
QINWei,XIEXuejun,LIZhiying,etal.Zhongshan
Hospitalaffiliated to Guangzhou University of TraditionalChineseMedicine,Zhongshan 528400,China
OBJECTIVE To investigate the influence ofserum with Bushen Huoxue(BSHX)decoction on signalpathwaymediated by hypoxia-inducible factors 1α(HIF-1α)of retinalMüller cells(RMCs)cultured in advanced glycation end products(AGEs)condition.METHODS The serum containing Chinesemedicine BSHX decoction and blank serum was prepared using SD rats.The concentration of AGEs in 50mg/Lwas setas low AGEs condition,and 100mg/L as high AGEs condition.The purified P2 retinalMüller cells of newborn and 7 day-ratswere cultured by modified enzyme-digestionmethod.Purified RMCswere divided into 6 groups,allof them were cultured in Dulbecco'sModified Eagle'smedium(DMEM)and thenwereadded in blank serum,medicated serum,blank serum with low AGEs,blank serum with high AGEs,medicated serum with low AGEs,medicated serum with high AGEs under hypoxic condition respectively.After48hrs,the HIF-1α,vascularendothelialgrowth factor(VEGF)expression in extracellular fluid were detected by enzyme-linked immunosorbentassay(ELISA),while expression ofmRNA of HIF-1α and VEGF in Müller cellswere tested by reverse transcription polymerase chain reaction(RT-PCR)and results of different groups were compared.RESULTS The expression of HIF-1αin the low AGEs group was higher than normal controlgroup,but the differencewas of no statistic difference(Ρ>0.05),but the increase of HIF-1αmRNAmade a significantdifference(Ρ<0.05);the expression of HIF-1αand itsmRNA in the high AGEs was significantly higher in contrast to normal control group(Ρ<0.05).The expressionsof VEGFand itsmRNA in the low AGEsand high AGEsgroup were both significantly higher than normal controlgroup(Ρ<0.05).While BSHXmedicine-containing serum had no significanteffect on the expression of HIF-1α,VEGF and theirmRNA compared with normal control conditions(Ρ>0.05).Both the expression of HIF-1α,VEGF and theirmRNA decreasedmore dramatically by BSHX decoction intervention under different AGEs conditions in contrast to corresponding AGEs concentration without intervention(Ρ<0.05).CONCLUSIONS The BSHX serum inhibited the expression ofsignalpathwaymediated by HIF-1αin purified RMCsunder AGEs condition.Accordingly,it might be part of the mechanism explaining effects of BSHX on diabetic retinopathy.
Bushen Huoxue;Müller cells;hypoxia-inducible factors;advanced glycation end products;vascularendothelialgrowth factor
R285.5
A
1002-4379(2017)02-0071-05
10.13444/j.cnki.zgzyykzz.2017.02.001
国家自然科学基金(81072845);教育部博士点基金-博导类项目(2011513211000)
1广州中医药大学附属中山医院,广东中山528400 2成都中医药大学眼科教研室,成都610075 3广州中医药大学第一附属医院眼科,广州510000
谢学军,E-mail:xxj_chd@yahoo.com.cn

