七白散软膏皮肤毒性的动物实验研究
张 倩 熊亚敏 王荣帅 姜 波 张锦明
(哈尔滨医科大学附属第一医院,哈尔滨,150001)
七白散软膏皮肤毒性的动物实验研究
张 倩 熊亚敏 王荣帅 姜 波 张锦明
(哈尔滨医科大学附属第一医院,哈尔滨,150001)
目的:观察七白散软膏对动物皮肤的毒性作用。方法:通过七白散软膏对SD大鼠的皮肤急性毒性实验、单次、多次给药刺激性实验、眼部刺激性实验及皮肤主动过敏实验,以皮肤的刺激性评价分数为指标,对七白散软膏的体外安全性进行评价。结果:单次和多次给予受试药物,水肿和红斑现象在SD大鼠完整皮肤组均未显现;红斑现象在SD大鼠破损皮肤组单次和多次给药时均略有显现,但停用药物后可完全消退。基于皮肤的刺激强度评分标准,单次和多次给药的刺激指数均小于0.5,所以七白散软膏外用对皮肤无刺激性。皮肤主动过敏实验表明,阳性致敏物的致敏率为100%,即称之为极度致敏性;任何红斑和水肿等过敏现象在七白散软膏组和空白软膏组对于致敏接触中和激发接触试验中均未显现,即致敏率为0。结论:通过体外安全性考察,七白散软膏对皮肤无刺激性并不产生过敏现象,作为外用软膏制剂,七白散软膏安全可靠。
七白散;急性毒性;刺激性;致敏性
七白散作为一种上古名方,远至宋朝古书就有所记载。其中七白被制作的剂型也多种多样,有七白汤剂、七白微粉、七白膏剂等[1-3]。现代研究表明,七白散具有清除氧自由基[4],增强SOD活性和降低MDA含量并且抑制络氨酸酶活性的作用,从而达到治疗黄褐斑并具有美白功效[5-6]。软膏剂作为一种经皮给药的剂型,不仅能避免药物对于胃肠道的破坏[7],而且通过皮肤对药物的吸收起到治疗作用。现已在医院的皮肤科、外科得到广泛应用,并占有一定的比重[8-9]。“内病外治”现如今已成为中药软膏剂的研究发展方向之一。本文为考察“七白散”软膏剂的体外安全性,并为其开发和利用提供更多的实验依据,参照新药审批办法[10]中的关于毒理学实验技术要求及相关文献[11-12],对自制的七白散软膏进行皮肤急性毒性试验、皮肤刺激性试验、眼部刺激性试验和皮肤主动过敏试验的研究。
1 材料与方法
1.1 材料
1.1.1 动物 SD大鼠,体重250~300 g,雌雄各半(购于长春亿斯实验动物技术有限责任公司,编号SCXK(吉)-2011-0004)。本研究实验方案及实验动物的饲养与使用处置,均通过哈尔滨医科大学附属第一医学院实验动物伦理委员会审批。
1.1.2 药物 白术、白芷、白芨、白蒺藜、白僵蚕、白茯苓、浙贝母(七味中药饮片均由哈尔滨药材市场采购,由黑龙江中医药大学佳木斯学院陈效忠副教授鉴定)。取以上7种中药饮片共32.5 g,于温室下用70%的乙醇回流提取1 h后,再用旋转蒸发仪抽滤,滤液于旋转蒸发仪浓缩至5 mL左右,用真空干燥箱烘干,得到浸膏,将浸膏用研钵研磨制得浸膏粉。将16-18醇、白油、聚二甲基硅氧烷混合后在纯化水中加热至80 ℃,加入2,6-二叔丁基对甲酚进行溶解,待完全溶解后加入硬脂醇醚-2和硬脂醇醚-21,充分溶解混合后将此作为油相。待纯化水加热至80 ℃时,将溶解后的EDTA-2Na中加入甘油和丙二醇,最后加入七白散浸膏进行分散,将此作为水相。将水相加入到油相中,用匀质机进行匀质5 min,最后搅拌并降温至40 ℃,加入LGP搅拌均匀,即得成膏。
1.1.3 试剂与仪器 纳米速效脱毛膏(广州喜化妆品有限公司);2,4-二硝基氯代苯(天津市光复精细化工研究所);电子天平(BP211D,德国sartorius公司)。
1.2 方法
1.2.1 皮肤急性毒性实验 选取健康的SD大鼠30只,随机分为3个组,分为完整皮肤组、破损皮肤组和对照组(空白软膏组)。给药前24 h,用纳米速效脱毛膏将动物背部脊柱两侧的毛全部脱掉,SD大鼠去毛范围单侧约为3 cm×3 cm。脱毛后应检查皮肤是否因去毛而受到损伤,受伤的皮肤不宜作完整皮肤的实验。并用16号针头划“#”字作为标记,以渗血为度。将七白软膏均匀涂布并固定24 h后去除残留物,连续7 d观察SD大鼠的表现和死亡的情况。
1.2.2 单次皮肤刺激性实验 选取健康SD大鼠20只平均分为2组,即为完整皮肤组和破损皮肤组。同前方法用纳米速效脱毛膏将动物背部脊柱两侧的毛全部脱掉。通过SD大鼠自身两侧皮肤进行对照,分别在同1只SD大鼠脊柱两侧皮肤涂敷七白软膏和空白软膏各1 g,并固定。涂药6 h后去除残余物质,并分别在去除药物后的24 h、48 h和72 h肉眼观察并记录涂布部位有无红斑和水肿等情况,进行皮肤刺激强度评价。
1.2.3 多次皮肤刺激性实验 多次给药试验所应用的只数、分组和给药剂量同单次给药试验一致。涂抹1次/d,1 g/次,持续时间1周。末次给药24 h、48 h和72 h后用肉眼观察并记录涂布部位是否出现红斑和水肿等现象,进行皮肤刺激强度评价。
1.2.4 眼部刺激性试验 取健康的SD大鼠10只。试验前24 h对每只受试SD大鼠的双眼进行检查。如若发现有眼睛刺激症状、角膜缺陷或结膜损伤的SD大鼠不能用于试验。试验时慢慢拉开眼睑,将0.1 g软膏涂于SD大鼠一侧的眼结膜囊内,另一侧作为空白对照。给药后把SD大鼠的眼睛被动闭合10 s。分别在给药后的1、2、4、24、48、72 h对眼部进行检查。
1.2.5 皮肤主动过敏致敏接触试验 选取健康的SD大鼠30只,雌雄各半,随机分为3组,分别为七白散软膏组、空白软膏组和阳性对照组。选取2,4-二硝基氯代苯为阳性致敏物,试验前配制成0.1%的激发浓度和1%的致敏浓度。选取受试药物0.1 g涂布于同一SD大鼠的脱毛区,用适宜的方法固定。而另一侧涂抹生理盐水作为对照,连续作用6 h。分别在第7天和第14天,以同样方法重复。空白软膏组与阳性对照组方法同上。
1.2.6 皮肤主动过敏激发接触试验 健康的SD大鼠致敏14 d后,将受试药物0.1 g涂布在同一SD大鼠背部的脱毛区,6 h后去掉受试药物并观察,分别在24、48、72 h后再次观察皮肤的过敏反应情况,各组结果按照皮肤过敏反应评分表评分,并判断其致敏率。出现皮肤红斑或水肿的SD大鼠例数除以受试动物的总数为致敏率。
为了评价七白软膏对动物皮肤用药的安全性,我们进行了七白软膏和空白基质对SD大鼠脱毛皮肤单次和多次涂药的刺激性试验。试验的主要评价标准如下:红斑评分标准:无红斑为0,轻度红斑(勉强可见)为1,中度红斑(明显可见)为2,重度红斑为3,紫红色红斑到轻度结痂形成为4。水肿评分标准:无水肿为0,轻度水肿(勉强可见)为1,中度水肿(明显可见)为2,重度水肿(皮肤隆起1 mm,轮廓清楚)为3,严重水肿(皮肤隆起1 mm以上,并有扩大或水泡、破渍)为4。皮肤刺激强度评价标准:0~0.49时为无刺激性;0.5~2.99时为轻度刺激性;3.0~5.99时为中度刺激性;6.0~8.0时为强度刺激性。
1.3 统计学方法 采用SPSS 17.0统计软件进行统计学分析,组间比较采用单因素方差分析,组内用药前后比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 皮肤急性毒性试验 从去除受试物1 h后开始观察持续7 d,SD大鼠的活动、觅食均正常,呼吸无异常反应。全身中毒反应及死亡的情况在受试SD大鼠身上均无发生,表明七白散软膏外用无急性毒性反应。
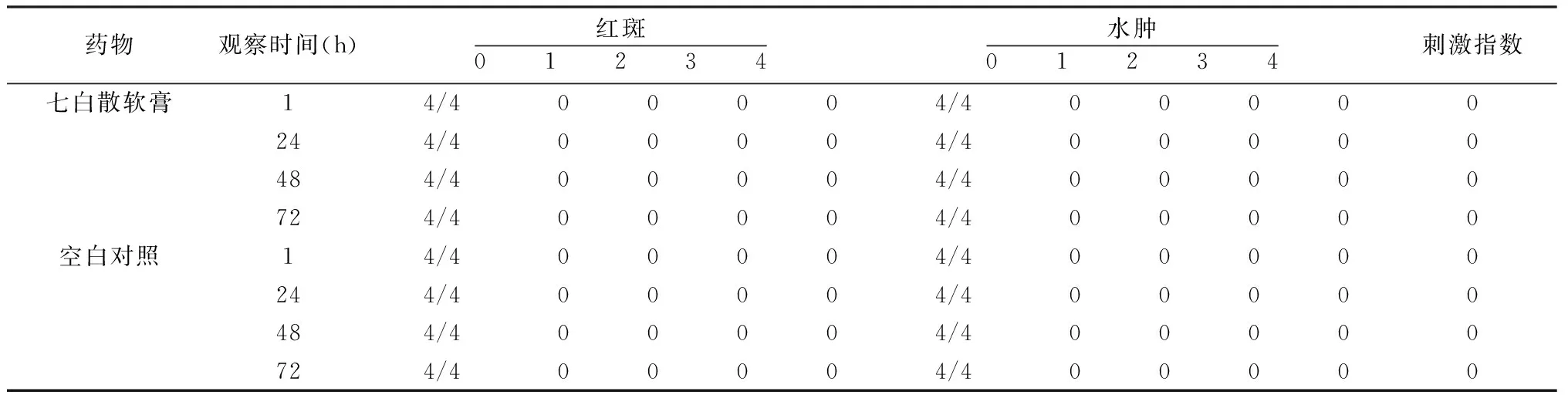
表1 单次给药完整皮肤刺激反应平均分值
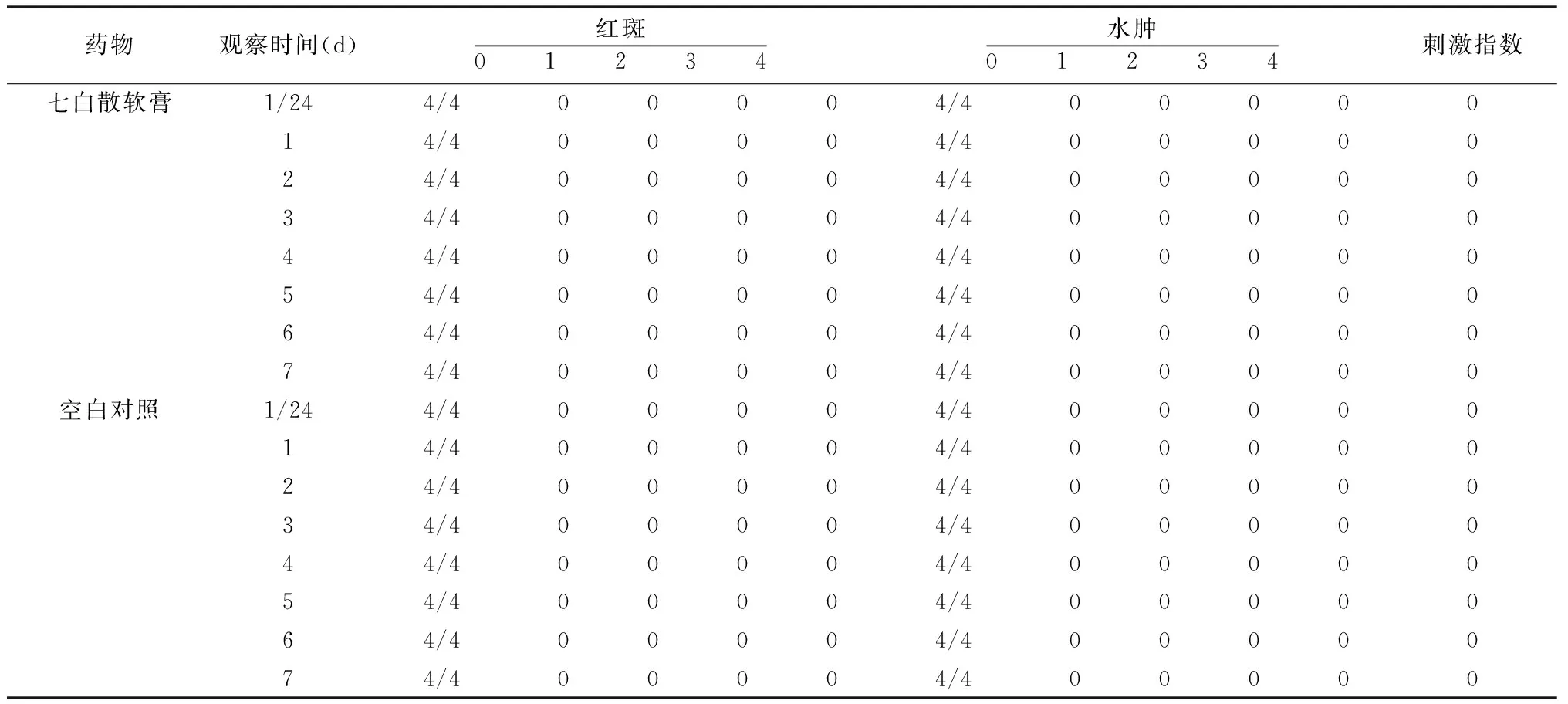
表2 多次给药完整皮肤刺激反应平均分值

表3 七白散软膏对皮肤致敏反应的评分结果±s)
注:与七白散软膏组对照组比较*P<0.01。

图 1单次给药对健康大鼠的影响
注:A空白软膏;B七白散软膏。
2.2 单次给药皮肤刺激性试验 单次给药皮肤刺激强度评分见表1。完整皮肤组给予受试物1~72 h内均未出现红斑或水肿现象。所有组别的平均反应分值均低于0.5分,表明受试物对正常皮肤及破损皮肤均无刺激性。受试物一次给药对完整皮肤与破损皮肤刺激的平均反应分值差异无统计学意义。
2.3 多次给药皮肤刺激性试验 多次给药皮肤刺激试验结果见表2。完整皮肤组多次给予七白散软膏和空白软膏后,动物皮肤均无红斑和水肿现象。其平均分值为0,表明受试物对大鼠完整皮肤无刺激性。破损皮肤组于给药的第4天,其中一只大鼠皮肤均略见红斑(分值为1),第5、6天程度略有加剧,并于给药后第7天消退。连续给药1周后,大鼠完整及破损皮肤均未见红斑及水肿。破损皮肤组的伤口已逐渐愈合。根据皮肤刺激强度评分标准,本试验结果的刺激指数<0.5,因此可以认为七白散软膏多次给药对皮肤无刺激性。
2.4 眼部刺激性试验 于给药1~72 h对眼部进行检查,未发现大鼠角膜混浊、虹膜异常、结膜充血、水肿或产生分泌物等现象。根据眼部刺激强度评分标准,本实验结果的刺激指数<0.5,表明七白散软膏对大鼠无眼部刺激作用。
2.5 皮肤主动过敏试验 激发接触后观察,2,4-二硝基氯苯阳性对照组在接触和激发试验中,所有的SD大鼠均出现不同程度的红斑现象,轻度红斑为2只,中度红斑为6只,重度红斑为2只,其中5只有轻度的水肿现象。七白散软膏组和空白软膏组在致敏接触和激发接触中均未出现任何的红斑和水肿等皮肤过敏反应。按公式计算致敏反应的发生率:致敏反应发生率(%)=有过敏反应的只数(不论程度轻重)/动物总数 100%,可知阳性致敏物的致敏率为100%,即有极度致敏性;七白散软膏和空白软膏致敏率为0,即表示外用时不产生过敏反应。
图2 2,4-二硝基氯代苯和七白散软膏分别对大鼠的影响
注:A 2,4-二硝基氯代苯;B七白散软膏。
3 讨论
七白散软膏作为一种传统的中药复方制剂,主要成分包括白术、白及、白茯苓、白僵蚕、白芷、白蒺藜和浙贝母[13]。由于传统的中药复方水煎剂,存在着制剂技术落后、制剂质量控制难,使用、携带、储存不便等诸多缺点。随着人们对健康的不断重视,对依从性认识的不断提高,传统汤剂固有的某些性质已越来越不适应社会的医疗要求[14]。因此我们选择了制备现代剂型软膏剂[15],这种剂型具有易于涂布、方便携带、质量易控制、科技含量高等特点。本实验结果表明,七白散软膏通过皮肤急性毒性试验、单次给药刺激性试验、多次给药刺激性试验、眼部刺激性试验、皮肤主动过敏试验对SD大鼠进行体外安全性考察,表明七白散软膏无刺激性和过敏性,体外给药安全可靠。具有良好的临床应用前景。
[1]蒋德泉,姜英,宋鹏,程岚.七白排毒凝胶剂提取工艺研究[J].辽宁中医药大学学报,2016,18(7):13-15.
[2]刘颖,潘德高,廖志航,等.七白散、七白微粉经皮给药的药效学对比研究[J].四川中医,2006,24(12):13-15.
[3]王萍.古方“七白膏”新用[J].甘肃中医学院学报,2007,24(4):31-33.
[4]蒋谷芬,贺霞,高娟,等.白芷祛斑霜治疗黄褐斑的疗效观察[J].中国医药导报,2013,19(14):4142.
[5]倪兴国,王红梅.叶腾辉七味白术散治疗黄褐斑[J].实用中医内科杂志,2015,(11):10-11.
[6]魏玮,刘宁.七白散隔姜灸背俞穴治疗黄褐斑初探[J].湖北中医杂志,2015,37(6):45-46.
[7]李宝芬,闫国强,陈淑兰,等.浅谈经皮给药制剂[J].天津中医学院学报,2004,23(2):86-87.
[8]胡倩,周凤,刘德和,马洪波.自制七白散面膜治疗黄褐斑86例[J].中国民间疗法,2012,20(2):19-20.
[9]李敏.七白散微粉粉体特性及其治疗黄褐斑的相关药效学研究[D].成都中医药大学,2007.
[10]国家药品监督管理局.新药审批办法[Z].北京:国家药品监督管理局局令第2号,1999-5-1.
[11]顾祖维.浅评《现代毒理学实验技术原理与方法》[J].环境与职业医学,2006,23(3):210.
[12]李立,王亚东,张焱,等.大豆异黄酮复合胶囊毒理学安全性评价[J].河南预防医学杂志,2010,21(1):38-41,50.
[13]全雪莲,张广中.七白膏的美白作用[J].吉林中医药,2015,35(2):167-169.
[14]张晨.逍遥散加减联合七白散面膜治疗肝郁气滞型黄褐斑的临床疗效观察[D].合肥:安徽中医药大学,2016.
[15]华玉铃,贺祝英,张建玲,等.中药软膏剂制备方法的研究进展[J].贵阳中医学院学报,2008,30(2):66-68.
(2017-05-15收稿 责任编辑:王明)
Experimental Animal Study on Skin Toxicity of Qibai Powder Ointment
Zhang Qian, Xiong Yamin, Wang Rongshuai, Jiang Bo, Zhang Jinming
(FirstAffiliatedHospitalofHarbinMedicalUniversity,Harbin150001,China)
Objective:To study the toxicity of Qibai Powder Ointment on animals. Methods:The safety of Qibai Powder Ointment for external use was evaluated with skin irritation scores as indicators through experiments on acute toxicity of Qibai Powder Ointment in SD rats, single or multiple dose active irritation, eye irritation and skin allergic test. Results:After single and multiple drug dose tests, no edema and erythema in SD rats with intact skin group appeared, but erythema appeared in SD rats with damaged skin group of both single and multiple dose and symptoms relieved after cease of the drug. Based on irritant of the skin scale, indexes of single and multiple dose tests were both less than 0.5, indicating that Qibai Powder Ointment on the skin has no irritation. Skin allergy tests showed that the positive allergic sensitization rate was 100%, that is to say, the extreme allergic. No allergic reaction such as erythema and edema appeared in both the Qibai Powder ointment group and blank ointment contrast group in allergenicity and irritant exposure tests and the allergenicity rate was 0. Conclusion:Through in vitro safety study, Qibai Powder Ointment on the skin irritation does not induce allergic reactions and without discomfort and it is safe and reliable as an ointment preparation for external use.
Qibai Powder; Acute toxicity; Irritant; Allergenicity
张倩(1986.07—),女,硕士研究生,住院医师,研究方向:神经疾病康复,E-mail:zhangqian531@yeah.net
熊亚敏(1979.03—),女,硕士研究生,主治医师,研究方向:神经疾病康复,E-mail:yayamin0000@126.com
R285.5
A
10.3969/j.issn.1673-7202.2017.07.037

