健脾活血方对大鼠24 h急性酒精中毒的保肝效应及机制研究
徐 琳 冯 琴 彭景华 傅琪琳 黄 甫 李晓飞 赵 瑜 胡义扬,5
(1 上海中医药大学附属曙光医院肾病科/上海中医药大学肾病研究所,上海,201203; 2 上海中医药大学附属曙光医院/上海中医药大学肝病研究所,上海,201203; 3 上海市中医临床重点实验室(14DZ2273200),上海,201203; 4 上海中医药大学肝肾疾病病证教育部重点实验室,上海,201203; 5 上海市高校中医内科学E-研究院,上海,201203)
实验研究
健脾活血方对大鼠24 h急性酒精中毒的保肝效应及机制研究
徐 琳1,3,4冯 琴2,3,4彭景华2,3,4傅琪琳2黄 甫2李晓飞2赵 瑜2,3,4胡义扬2,3,4,5
(1 上海中医药大学附属曙光医院肾病科/上海中医药大学肾病研究所,上海,201203; 2 上海中医药大学附属曙光医院/上海中医药大学肝病研究所,上海,201203; 3 上海市中医临床重点实验室(14DZ2273200),上海,201203; 4 上海中医药大学肝肾疾病病证教育部重点实验室,上海,201203; 5 上海市高校中医内科学E-研究院,上海,201203)
目的:研究健脾活血方对大鼠24 h急性酒精中毒的保肝效应及作用机制。方法:28只SD大鼠随机分为正常组(8只)、模型组和健脾活血方组(各10只)。予相应饮用水或健脾活血汤1.0 mL/100 gwt,连续3 d,2次/d。第3天末次给药后,禁食禁水16 h,再次灌胃饮用水或健脾活血汤1.0 mL/100 gwt。1 h后,予等剂量56%乙醇灌胃模型组和健脾活血方组大鼠复制酒精中毒模型。24 h后麻醉,留取血清及肝组织标本,检测相关指标。结果:与模型组比较,健脾活血方组血清ALT活性显著降低,差异有统计学意义(P<0.01)HE染色见肝细胞胞质内小空泡状改变减轻,库普弗细胞减少,肝组织GSH活性显著升高(P<0.01),肝组织TNOS、iNOS活性显著降低(P<0.05)。结论:健脾活血方通过提高24 h急性酒精中毒大鼠肝脏GSH含量,降低iNOS水平,起到抗氧化应激损伤保护肝脏的作用。
健脾活血方;急性酒精中毒;氧化应激;肝损伤
流行病学调查发现,酒精性肝病(Alcoholic Liver Disease,ALD)在我国的发病率呈逐年上升趋势[1]。ALD的发生与长期过量饮酒密切相关,单次超量饮酒可致使急性酒精中毒,也就是俗称的醉酒。《黄帝内经》将该病命名为“酒悖”与“酒风”。研究表明,体内大部分乙醇经肝脏乙醇脱氢酶代谢为乙醛,再由线粒体内乙醛脱氢酶氧化为乙酸,分解为水和二氧化碳。当乙醛蓄积过量时,产生肝细胞毒性,引起脂质过氧化、线粒体损伤及谷胱甘肽(GSH)缺乏[2]。历代医家关于酒伤之病的治法颇多,有效方药层出不穷,有用于解酒、戒酒者,也有用于治疗酒伤病者。课题组基于对既往酒精性脂肪性肝病的临床认识,创制具有健脾活血、升清降浊之功效的“健脾活血方”临床研究疗效确切[3]。动物实验研究发现其主要通过调节肠道菌群、保护肠道屏障,改善Lieber-Decarli酒精饲料诱导慢性和7 d急性酒精性肝损伤模型大鼠的肝功能损伤,抑制肝内脂肪沉积的作用[4-5]。同时,应用该方预防性治疗24 h大鼠急性酒精中毒模型,发现其可提高肝脏乙醇脱氢酶活性,发挥解酒保肝的作用[6]。鉴此,本研究在已往工作基础上,进一步探讨健脾活血方对24 h大鼠急性酒精中毒的保肝作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 SD雄性大鼠28只,SPF级,体重(180±10)g,由上海西普尔—必凯实验动物有限公司提供,合格证号:SCXK(沪)2008-0016。饲养于上海中医药大学实验动物中心,自由饮水。
1.1.2 药物 健脾活血方由白术、丹参、枳壳、白芍、葛根、泽泻、姜黄组成,其中蜜麸炒枳壳(上海华鹰药业有限公司生产,批号:HY2011090901);片姜黄:(上海德华国药制品有限公司生产,批号:DH2010031909);生丹参(上海余天成中药饮片有限公司生产,批号:YT2011091608);蜜麸炒白芍(上海华浦中药饮片有限公司生产,批号:HP2011100604);葛根(上海华鹰药业有限公司生产,批号:HY2011042701);泽泻(上海雷允上中药饮片厂生产,批号:LY2011080040);制北五味子(上海德华国药制品有限公司生产,批号:DH2011101201);蜜麸炒白术(上海华鹰药业有限公司生产,批号:HY2011101102)。
1.1.3 试剂与仪器 无水乙醇:国药集团化学试剂有限公司产品,分析纯,批号:20110907,56 mL无水乙醇与44 mL饮用水混合制成56%乙醇溶液。谷丙转氨酶(ALT)试剂盒;超氧化物歧化酶(SOD)试剂盒;总抗氧化能力(T-AOC)试剂盒;过氧化氢酶(CAT)试剂盒,;还原型谷胱甘肽(GSH)试剂盒;谷胱甘肽-过氧化物酶(GSH-Px)测试盒;一氧化氮合酶(NOS)试剂盒;血清铁试剂盒;考马斯亮兰试剂盒及苏木素-伊红(H-E)染液,上述试剂均购自南京建成生物工程研究所。CYP4502E1多克隆抗体(货号:ab4239),购自abcam公司;α-tublin多克隆抗体(货号:2251-1),购自EPITOMICS公司;BCA定量试剂盒(货号:NC13225CH),购自美国Thermo Fisher公司。ASP300自动脱水机、EG1160石蜡包埋机、RM2035轮转切片机、HI1210恒温水浴、HI1220烤片机,德国LEICA公司。倒置显微镜(37×B)、美国Denver公司。微孔多功能酶标仪,美国Molecular Devices公司。
1.2 方法
1.2.1 分组与模型制备 将28只SD大鼠,SPF级,体重(180±10)g,随机分为正常组(8只)、模型组和健脾活血方组(各10只)。模型组和健脾活血方组按照1.5 mL/100 gwt灌胃由56 mL无水乙醇混合44 mL饮用水配置而成的56%乙醇,复制大鼠酒精中毒模型。
1.2.2 给药方法 乙醇提取健脾活血方中白术、枳壳、姜黄、五味子分别在乙醇提取2~3次,1~2 h/次;水浸丹参、葛根、泽泻、白芍1 h,8~10倍水提取3次,80 ℃时,水提物浓缩至相对密度1.08~1.12,纯化处理。上述乙醇提取物、水提纯化物合并混匀,配制成生药含量0.9 g/mL。药物制备在上海中医药大学附属肝病研究所进行。予0.9 g/mL健脾活血汤灌胃健脾活血方组大鼠1.0 mL/100 gwt,正常组和模型组灌胃等剂量饮用水,连续3 d,2次/d。第3天末次给药后,禁食禁水16 h,健脾活血方组给予健脾活血汤1.0 mL/100 gwt灌胃,正常组和模型组给予等量的饮用水灌胃。1 h后,乙醇灌胃复制酒精中毒模型,24 h后,称取大鼠体重,腹腔注射3%戊巴比妥钠麻醉大鼠,留取血清及肝组织。
1.2.3 检测指标与方法 1)血清肝功能指标ALT活性测定,按试剂盒内提供方法检测;2)肝组织病理变化:苏木素—伊红(HE)染色;3)乙醇代谢酶CYP4502E1蛋白表达Western Blotting方法;4)脂质过氧化指标GSH及血清铁含量、GSH-Px、SOD、CAT、T-AOC、TNOS、iNOS活性依据试剂盒所供方法测定。
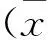
2 结果
2.1 一般情况 56%乙醇灌胃后,模型组内大鼠短时间即进入兴奋期,躁动不安至激惹,随后表现为萎靡不振,触之懒动,快速呈现醉酒酣睡状态。健脾活血方组大鼠长时间处于萎靡不振,触之即动,逐渐表现醉酒状态。模型组因灌饲不当死亡1只,其余2组均无死亡。
2.2 血清ALT活性变化 模型组与正常组比较,血清ALT水平显著升高,差异有统计学意义(P<0.05)。健脾活血方组与模型组比较,ALT水平有下降趋势,但差异无统计学意义(P>0.05);与正常组比较,ALT变化的差异无统计学意义(P>0.05)。
2.3 肝组织病理变化 模型组与正常组比较,肝小叶中央静脉结构正常,大部分肝细胞胞质内可见小空泡状脂肪变,细胞核仍居中,伴有中性粒细胞及库普弗细胞增多,未见肝血窦明显扩张。健脾活血方组与模型组相较,胞质中小空泡状脂肪变减少,肝小叶内中性粒细胞及库普弗细胞数量减少。见图1。

图1 各组大鼠肝组织HE染色(10×20)
注:N正常组;M模型组;J健脾活血方组。
2.4 肝组织乙醇代谢酶CYP4502E1蛋白表达 与正常组比较,模型组肝组织CYP4502E1蛋白表达显著升高(P<0.01)。与模型组比较,药物组肝组织CYP4502E1蛋白表达差异无统计学意义。见图2。
2.5 健脾活血方抗氧化应激机制研究 与正常组比较,模型组大鼠肝组织SOD、CAT、T-AOC、GSH-Px活性显著下降(P<0.01,P<0.05);TNOS、iNOS活性显著升高(P<0.01),GSH活性及血清铁含量变化的差异无统计学意义(P>0.05);与模型组比较,健脾活血方组经健脾活血方干预后能降低TNOS、iNOS活性(P<0.05);显著升高GSH活性(P<0.01),SOD、CAT、T-AOC、活性均有升高趋势,但无统计学差异(P>0.05),而GSH-Px活性及血清铁含量差异无统计学意义(P>0.05)。见表1、表2。
3 讨论
元代朱丹溪《本草衍义补遗》云:“酒,《神农本草经》止言其热而有毒,不言其湿中发热近于相火,大醉后振寒战栗者可见矣……必大伤耗。”乙醇口服后由食道入胃,其中约有90%乙醇被胃肠道吸收后由门静脉输入肝脏,主要经乙醇脱氢酶(ADH)系统关键酶ADH及微粒体乙醇氧化酶(MEOS)系统关键酶CYP4502E1代谢生成乙醛,由乙醛脱氢酶氧化成乙酸,参与三羧酸循环,最终分解成H2O和CO2[7-8]。一次性大量摄入乙醇可引起肝脏代谢紊乱,使氧自由基反应和脂质过氧化反应间平衡关系失调。过量的乙醇强烈诱导CYP4502E1表达,产生以超氧阴离子(O2-)为代表的大量活性氧(ROS),形成氧自由基连锁反应,损害生物膜及其功能,最终可导致急性酒精性肝损伤[9]。本研究采用了灌胃方式的急性酒精中毒模型,即予56%乙醇1.5 mL/100 g鼠重一次性灌胃。观察结果显示,模型组大鼠较健脾活血方组,更早出现短暂兴奋,易激惹,随即发生醉酒昏睡状态。与正常组比较,模型组大鼠ALT明显升高,肝组织病理见肝细胞内小空泡状改变,胞核尚居中,库普弗细胞数量增多,MEOS系统中关键酒精代谢酶CYP4502E1蛋白表达显著增高,提示急性酒精中毒模型复制成功,存在酒精性肝损伤伴大量的ROS产生。
短时间内乙醇代谢产物乙醛及ROS的大量堆积,可结合肝内GSH的巯基并使其失活[10-11]。其次,过量的乙醇还将激活过氧化氢酶系统和黄嘌呤氧化酶系统,使ROS和活性氮等自由基生成增加[12]。当自由基总量超过SOD等抗氧化酶系及GSH等非酶类抗氧化物质的清除能力时,则引起氧化应激[13]。值得一提的是,氧化应激促进iNOS高表达,诱导肝脏合成大量的NO与O2-生成强氧化剂ONOO-诱发硝化反应,造成细胞骨架构造改变;同时能灭活GSH-Px,增强氧化应激[14]。而Fe2+与O2-启动Haber-Weiss反应,直接损害线粒体内膜,导致活性氧溢出线粒体外,加重线粒体损伤[15]。本研究的模型组与正常组比较显示,体内T-AOC、T-SOD、GSH-Px、CAT水平均显著下降,提示氧化应激;TNOS、iNOS水平升高,提示硝化应激。正如明代周之干在《周慎斋遗书·卷八·伤酒》云:“凡酒客初病,发不甚重,解酒足矣;续自病重者,以内伤法立方,少加醒酒药味”。提前予以白术、白芍为君药,以丹参、葛根为臣药,佐以泽泻、枳壳、姜黄、五味子,共行健脾活血、升清降浊之效的“健脾活血方”干预,能显著升高GSH水平,拮抗氧化性毒物导致的中毒,提高T-AOC、T-SOD、CAT水平,清除O2-等自由基,促进H2O2分解为H2O,明显降低TNOS、iNOS水平,减少NO的合成,减轻氧化应激损伤。血清铁作为线粒体损伤的间接标志,各组间未有明显差异。
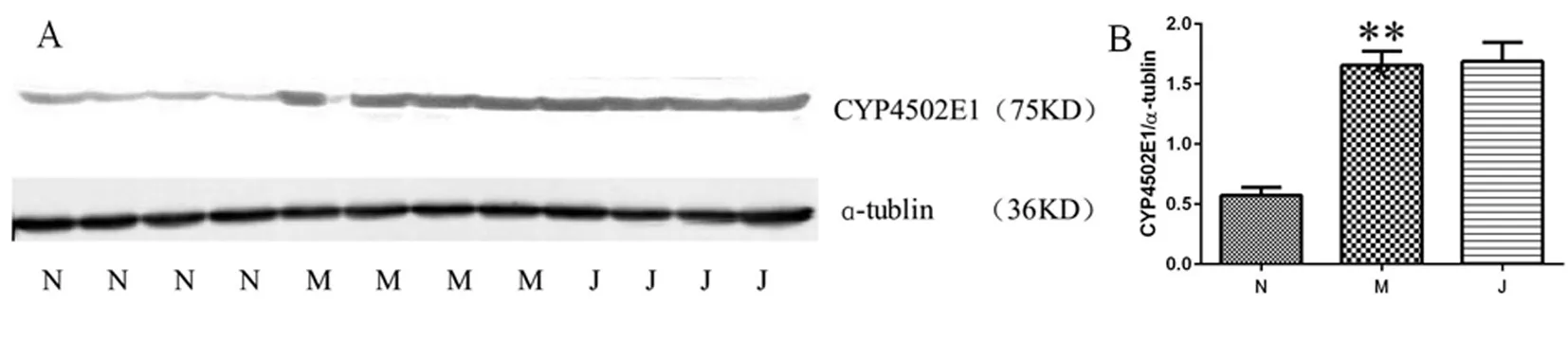
图2 肝组织CYP4502E1蛋白表达(n=4);A免疫印迹;B灰度积分
注:N正常组;M模型组;J健脾活血方组;与正常组比较,**P<0.01。

表1 各组大鼠血清ALT及肝组织T-AOC、T-SOD、CAT活性变化
注:与正常组比较,*P<0.05,**P<0.01。

表2 各组大鼠肝组织GSH、GSH-Px、TNOS、iNOS及血清铁含量变化
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
综上所述,本研究在前期证明该方通过提高肝脏ADH活性,发挥解酒保肝作用的基础上[8],进一步证明了其抗急性酒精中毒导致的肝损伤的作用机制,关键在于提高GSH含量抵抗急性酒精中毒造成的氧化应激损伤,降低iNOS水平抗硝化应激。结合课题组前期对7 d急性酒精性肝损伤大鼠模型和Lieber-Decarli酒精饮料诱导的大鼠慢性酒精性肝损伤的研究结果,证明健脾活血方对急、慢性酒精性肝损伤均具有良好的干预作用[5-7],有深入研究和开发的前景。
[1]厉有名.酒精性肝病的流行病学特点[J].实用肝脏病杂志,2012,15(3):180-182.
[2]高万露,汪小海.急性酒精中毒药物治疗新进展[J].药学与临床研究,2015,23(1):59-61.
[3]何东仪,胡义扬,薛惠明,等.健脾活血方治疗脂肪肝的临床疗效观察[J].中国中西医结合消化杂志,2001,9(1):35-37.
[4]成扬,汪海慧,胡义扬,等.健脾活血方对Lieber-DeCarli酒精性脂肪肝大鼠肠道菌群的影响[J].中国中西医结合杂志,2011,31(1):73-79.
[5]汪海慧,成扬,胡义扬,等.健脾活血方对大鼠急性酒精性肝损伤的干预作用[J].中西医结合肝病杂志,2009,19(4):221-223.
[6]徐琳,冯琴,彭景华,等.健脾活血方预防急性醉酒的实验研究[J].中华中医药杂志,2013,28(5):1313-1316,1635.
[7]Zima T.Alcohol[J].Case Lek Cesk,1996,135:458-465.
[8]Han KH,Hashimoto N,Fukushima M.Relationships among alcoholic liver disease,antioxidants,and antioxidant enzymes[J].World J Gastroenterol,2016,22(1):37-49.
[9]Mitchell T,Chacko B,Ballinger SW,et al.Convergent mechanisms for dysregulation of mitochondrial quality control in metabolic disease:implications for mitochondrial therapeutics[J].Biochem Soc Trans,2013,41(1):127-33.
[10]Liu J,Wang X,Peng Z,et al.The effects of insulin pre-administration in mice exposed to ethanol:alleviating hepatic oxidative injury through anti-oxidative,anti-apoptotic activities and deteriorating hepatic steatosis through SRBEP-1c activation[J].Int J Biol Sci,2015,11(5):569-86.
[11]王林元,陈绍红,屈胜胜,等.巴西莓对急性酒精中毒小鼠的解酒及保肝作用研究[J].世界中医药,2014,9(10):1334-1337.
[12]Cohen JI,Chen X,Nagy LE.Redox signaling and the innate immune system in alcoholic liver disease[J].Antioxid Redox Signal,2011,15(2):523-34.
[13]Diesen DL,Kuo PC.Nitric oxide and redox regulation in the liver:Part I.General considerations and redox biology in hepatitis[J].J Surg Res,2010,162(1):95-109.
[14]Gao L,Zhou Y,Zhong W,et al.Caveolin-1 is essential for protecting against binge drinking-induced liver damage through inhibiting reactive nitrogen species[J].Hepatology,2014,60(2):687-99.
[15]Mueller S,Rausch V.The role of iron in alcohol-mediated hepatocarcinogenesis[J].Adv Exp Med Biol,2015,815:89-112.
(2016-04-07收稿 责任编辑:王明)
Study on Mechanism of Hepatoprotective Effect of Jianpihuoxue Fang on 24 Hours Acute Alcohol Intoxication Rats
Xu Lin1,3,4, Feng Qin2,3,4, Peng Jinghua2,3,4, Fu Qilin2, Huang Fu2, LI Xiaofei2, Zhao Yu2,3,4, Hu Yiyang2,3,4,5
(1InstituteofKidneyDiseases,Departmentofnephrology,ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 2InstituteofLiverDiseases,ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 3ShanghaiKeyLaboratoryofTraditionalChineseClinicalMedicine(14DZ2273200),Shanghai201203,China; 4KeyLaboratoryofLiverandKidneyDiseases,MinistryofEducation,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 5E-instituteofTraditionalChineseInternalMedicineofShanghaiMunicipalEducationCommission,Shanghai201203,China)
Objective:To explore the mechanism of hepatoprotective effect of Jianpihuoxue Decoction on 24 hours acute alcohol intoxication rats and to discuss its mechanism of anti-oxidative stress. Methods:Twenty-eight Sprague Dawley rats were allocated to the normal group (8 rats), acute alcoholism model group (10 rats) and the jianpihuoxue decoction group (10 rats). Each group was given the jianpihuoxue decoction or water 1.0 mL/100 gwt twice a day for three days. The water and food were forbidden for 16 hours after the last administration three days later., then rats were given jianpihuoxue decoction or water 1.0 mL/100 gwt by gavage again.One hour later, acute alcoholism model group and the jianpihuoxue decoction group were given the same amount of 56% alcoholl 1.5 mL/100 gwt by gavage to reproduce the model of acute alcoholism. The serum and hepatic tissues were taken after 24 h to detected the related indexes. Results:Compared with the model group, Jianpihuoxue decoction reduced activities of serum ALT(P<0.01), alleviated microvesicular steatosis obviously and kupffer cells in the hepatocytes reduced, observed by H&E staining. The content of GSH of liver tissue increased significantly (P<0.01) while the expression of TNOS and iNOS lowered (P<0.05). Conclusion:Jianpihuoxue decoction protects the 24 hours acute alcoholism rats′ livers and resists the oxidative stress damage by increasing the level of hepatic GSH, decreasing the level of hepatic iNOS.
Jianpihuoxue decoction; Acute alcohol intoxication; Oxidative stress; Liver injury
国家自然科学基金项目(30801536;30371818)——基于均匀设计的健脾活血方抗酒精性肝损伤不同作用途径的主效应中药研究;酒精性肝损伤与小肠通透性改变的关系及健脾中药的干预
徐琳(1987.03—),女,博士,研究实习员,研究实习员,中医药防治慢性肝肾疾病,E-mail:xulin-02@163.com
胡义扬(1962.10—),男,博士,研究院、教授、主任医师,上海中医药大学附属曙光医院副院长、上海中医药大学附属肝病研究所副所长,中医药防治慢性肝病,E-mail:yyhuLiver@163.com
R256.4
A
10.3969/j.issn.1673-7202.2017.07.035

