魔芋ACE抑制肽的分离纯化及活性检测
毛跟年,周亚丽,贺磊,曹晴,王勇,2,李彦军,2
1(陕西科技大学 食品与生物工程学院, 陕西 西安,710021)2(陕西农产品加工技术研究院,陕西 西安,710021)
魔芋ACE抑制肽的分离纯化及活性检测
毛跟年1*,周亚丽1,贺磊1,曹晴1,王勇1,2,李彦军1,2
1(陕西科技大学 食品与生物工程学院, 陕西 西安,710021)2(陕西农产品加工技术研究院,陕西 西安,710021)
利用碱溶酸沉法从魔芋飞粉中提取魔芋蛋白,以魔芋蛋白为原料,利用碱性蛋白酶酶解制备魔芋ACE抑制肽粗品;其粗品通过超滤法除去大分子杂质,再经过Sephadex G-15柱层析分离,最后经过RP-HPLC纯化后得到纯度较高的魔芋ACE抑制肽,并且对超滤膜进行选择、Sephadex G-15柱层析分离进行条件优化;以马尿酸含量为指标,紫外分光光度法测其活性。实验结果表明:选择规格为1 kDa超滤膜;Sephadex G-15最佳分离条件为浓度为120 mg/mL、流速为0.8 mL/min、上样量为1.0 mL;经过RP-HPLC纯化后得到魔芋ACE抑制肽抑制率可达到92.85%。空白液中Hip含量为22.50 mg,反应液中Hip含量为9.22 mg,说明魔芋ACE抑制肽抑制活性较好。
魔芋蛋白;ACE抑制肽;分离纯化;活性
ACE抑制肽(angiotensin-converting enzyme inhibition,ACEI)是指血管紧张素转化酶抑制剂。ACEI对 ACE 活性区域结合能力较强,共同特点是与 ACE 活性部位的锌离子结合的能力比AngI或缓激肽更强,而且结合上之后不易从 ACE 结合区释放,从而阻碍ACE催化AngI 水解成 AngⅡ及催化舒缓激肽水解成为失活片段2个过程,起到降血压的作用。与化学降血压药比较,具有分子质量小,免消化、直接吸收等特点,更具有优势和广阔的市场前景[1]。
目前,已经从燕麦蛋白、玉米醇溶蛋白、牦牛乳酪蛋白[2-4]等多种蛋白中提取出ACE抑制肽,并且通过多种分离纯化方法得到高纯度ACE抑制肽。目前广泛采用超滤、离子交换层析、葡聚糖凝胶层析、RP-HPLC、毛细管电泳法、大孔树脂吸附法等,王双等[5]应用大孔吸附树脂 DA201-C、HPLC、SephadexG-15凝胶对燕麦ACE抑制肽进行分离纯化,得到纯度较高ACE抑制肽;王振斌[6]通过超滤法分离芝麻蛋白ACE抑制肽,结果表明分子质量分布为 3~10 kDa 和小于3 kDa 酶解液抑制活性较好。目前,已有研究者利用魔芋飞粉为原料,通过酶解法提取和柱层析法分离纯化制备出魔芋ACE抑制肽,但是其他方面有待于研究。
本文利用前期工作中优化地制备出了魔芋ACE抑制肽粗品,研究了魔芋ACE抑制肽超滤、Sephadex G-15和RP-HPLC的分离纯化工艺,并采用紫外分光光度法对其活性进行检测。
1 材料与方法
1.1 材料
1.1.1 原料与试剂
魔芋飞粉,购于陕西省镇安县雪樱花魔芋公司。碱性蛋白酶(酶活力≥20 万U/g),上海源叶生物技术有限公司;Sephadex G-15凝胶,上海源叶生物技术有限公司;HHL(马尿酰-组氨酰-亮氨酸),Sigma公司;ACE(血管紧张素转化酶)Sigma公司;Hip(马尿酸)标准品,上海源叶生物技术有限公司;NaOH、硼酸、硼砂、HCl、乙腈等,均为分析纯。
1.1.2 仪器与设备
TG16-WS型台式高速离心机,湖南湘仪实验室仪器开发有限公司;YP802N型电子天平,上海精密科学仪器有限公司;HH-2型数显恒温水浴锅,国华电器有限公司;PHS-3C型精密pH计,深圳市同奥科技有限公司;UV-5100紫外分光光度计,上海元析仪器有限公司;Waters制备型液相,上海科哲生化技术有限公司;超滤系统,美国Pellicon;自动部分收集器,上海精科实业有限公司。
1.2 实验方法
1.2.1 魔芋ACE抑制肽的制备
1.2.1.1 魔芋蛋白的提取
称取8 g魔芋飞粉,加入280 mL纯净水,搅拌均匀,用1.0 mol/L NaOH溶液调节飞粉液pH值至10,放入设定温度为50 ℃水浴锅中保温反应50 min,期间用1.0 mol/L的NaOH调节,保持飞粉液的pH不变。之后4 000 r/min离心15 min,收集上清液,用1.0 mol/LHCl液将上清液调至魔芋蛋白等电点pH 3.8,静置30 min,再在4 000 r/min下离心15 min,弃去上清液收集沉淀,用5倍的水对沉淀进行3次水洗后收集沉淀。将得到的蛋白质沉淀在-60 ℃下冷冻干燥24 h,即得魔芋蛋白质。根据公式得魔芋蛋白的平均提取率为60%。蛋白质提取率计算公式为:
蛋白质提取率/%=(提取的蛋白质含量/飞粉中总蛋白的含量)×100
(1)
1.2.1.2 魔芋ACE抑制肽的制备工艺
配制5份相同浓度魔芋蛋白质溶液,放在恒温磁力搅拌器上,分别加入一定量的碱性蛋白酶、复合蛋白酶、胶原蛋白酶、菠萝蛋白酶、风味蛋白酶进行酶解,以ACE抑制率和水解度为指标,得出碱性蛋白酶为最佳用酶。碱性蛋白酶的酶解条件为pH 10、底物浓度3%、加酶量5 000 U/g、酶解温度46 ℃,酶解时间3 h。然后高温条件下灭酶10 min,待酶解液冷却至室温,将酶解液pH值调至魔芋蛋白等电点,在10 000 r/min下离心20 min后收集上清液,测其ACE抑制率。5种蛋白的ACE抑制率和水解度测定结果见图1。

A-菠萝蛋白酶;B-碱性蛋白酶;C-风味蛋白酶;D-复合蛋白酶;E-胶原蛋白酶图1 不同蛋白酶酶解后水解度和ACE抑制率测定结果Fig.1 Hydrolysis degree and ACE inhibition rate after enzymatic hydrolysis of different proteases
1.2.1.3 ACE抑制率的测定[7]
取75 μL、HHL(马尿酰-组氨酰-亮氨酸)与25 μL、ACE抑制剂(多肽液)充分混匀。在37 ℃水浴锅中温育5 min,加入25 μL、25 mu/mL ACE硼酸盐溶液,在37 ℃水浴锅中反应40 min。结束后加入200 μL、1.0 mol/L HCl液破坏反应环境,终止反应进程。然后于各试管中加入乙酸乙酯1.7 mL,使其混匀;吸取1.2 mL乙酸乙酯层于另一试管中,放入100 ℃烘箱中,挥发溶剂40 min。取出冷却后加入去离子水3 mL,混匀后在波长228 nm下测定其吸光度。
(2)
式中:A1,ACE抑制肽和ACE都存在溶液的吸光度值;A2,不加ACE抑制肽存在溶液的吸光度值;A3,ACE与HHL存在空白溶液的吸光度值。
1.2.2 超滤
超滤过程:将上述制备的魔芋蛋白酶解液用规格为10、5和1 kDa的超滤膜进行超滤,收集3种组分:Ⅰ(M<10 kDa)、Ⅱ(M<5 kDa)、Ⅲ(M<1 kDa),各个组分经旋转蒸发浓缩后,用真空冷冻干燥机进行干燥,再测各个组分的ACE抑制率,选出ACE抑制率最高的组分进行下一步分离纯化。确定超滤膜:
以膜通量和 ACE 抑制率为参考指标对3种不同规格的超滤膜进行筛选,膜通量的计算公式如下
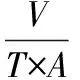
(3)
式中:V,透析液的体积,L;T,取样时间,h;A,膜面积,m2。
1.2.3 Sephadex G-15柱层析
采用Sephadex G-15对超滤所得分子质量小于1 kDa的组分进一步进行分离,为了达到最好的分离效果,本实验探讨了上样浓度、流速和上样量对分离效果的影响。
将处理好的Sephadex G-15凝胶装入1.6 cm×30 cm玻璃层析柱。洗脱剂为超纯水,用自动部分收集器收集洗脱液,每管收集5.0 mL,结合每管在220 nm[8]处的吸光值,考察不同上样浓度、流速和上样量对分离效果的影响,确定最佳分离条件。将最佳分离条件下不同峰段收集的组分测ACE抑制率,ACE抑制率最高组分浓缩后冷冻干燥,进一步进行纯化。
1.2.3.1 不同上样浓度对分离效果的影响
上样量为1.0 mL,控制流速为0.8 mL/min,设定不同上样浓度为:80、120、160 mg/mL。考察不同上样浓度对分离效果的影响,确定最适上样浓度。
1.2.3.2 不同流速对分离效果的影响
上样量为1.0 mL,控制上样浓度为120 mg/mL,设定不同流速为:0.6、0.8、1.0 mL/min。考察不同流速对分离效果的影响,确定最适流速。
1.2.3.3 不同上样量对分离效果的影响
流速为0.8 mL/min,控制上样浓度为120 mg/mL,设定不同上样量为:0.5、1.0、1.5 mL。考察不同上样量对分离效果的影响,确定最适上样量。
1.2.4 RP-HPLC
经Sephadex G-15分离后得到的ACE抑制率最高组分溶于水,配成20 mg/mL的溶液,利用RP-HPLC[9]进一步纯化,收集各洗脱峰经真空旋转蒸发浓缩、冷冻干燥后得到各分离组分,进行ACE抑制活性测定,抑制率最高组分测其体外抑制活性。
制备型高效液相Waters2489,色谱柱C18柱;检测波长:220 nm;柱温35℃;进样量5 mL;样品浓度:20 mg/mL;流速5 mL/min;洗脱条件:流动相A-乙腈,B-超纯水,0~10 min:20%A+80%B、10~15 min:40%A+60%B、15~20min:20%A+80%B。
1.2.5 魔芋ACE抑制肽体外活性检测
1.2.5.1 检测波长的确定
用pH值为8.3的硼酸缓冲液配制5 mmol/L的HHL溶液,用超纯水配制1 mmol/L的Hip,然后在190~350 nm波长处进行全波长扫描,确定Hip的检测波长。由图2可得到 Hip标准品溶液在波长228 nm 处有最大吸收峰。在228 nm 波长下测0.0、0.1、0.2、0.3、0.4、0.5 mg/mL Hip标准品溶液的吸光度,以吸光度为纵坐标,以浓度为横坐标绘制标准曲线。得到Hip标准品的曲线方程为:y=0.222 6x-0.001 5,相关系数为0.999 1,线性关系良好。由此可得出反应液和空白液中Hip浓度,并计算出含量,检测出魔芋ACE抑制肽的抑制活性。
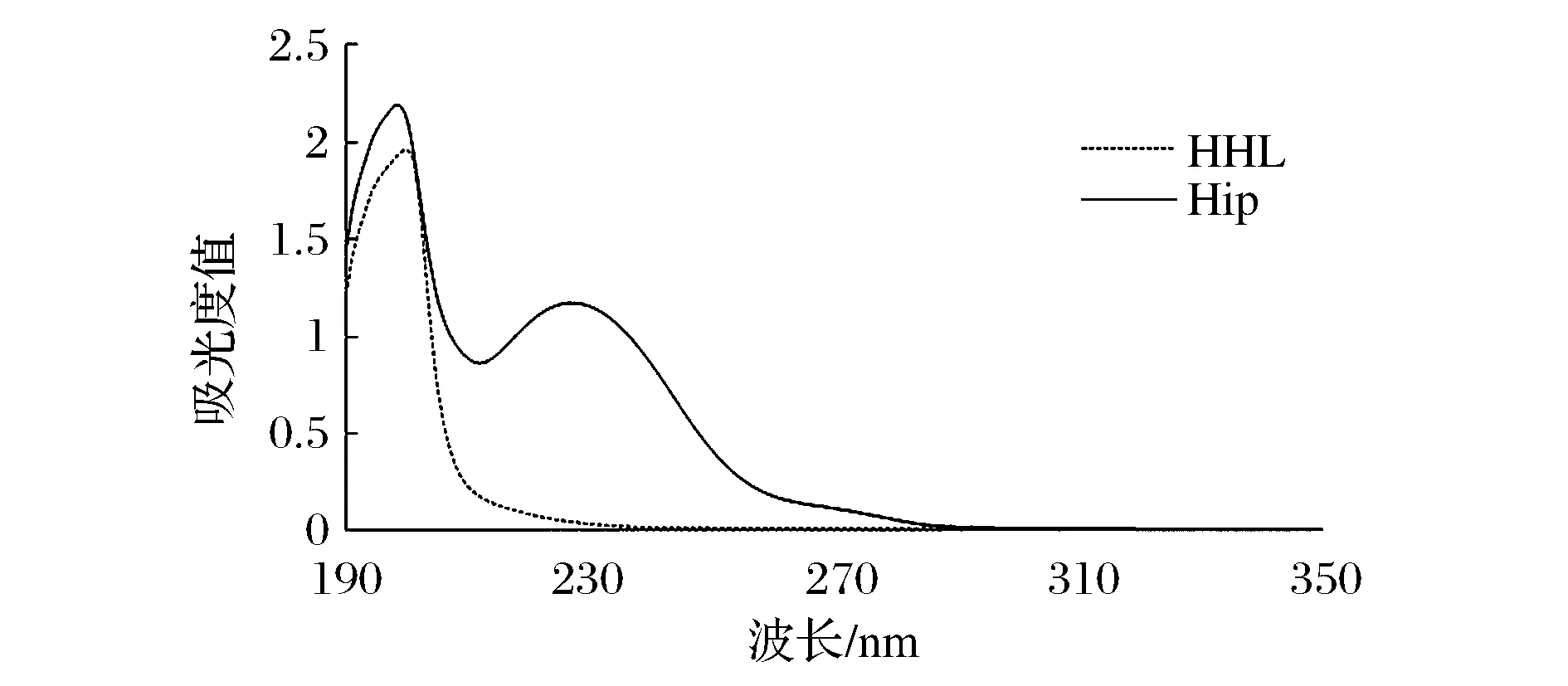
图2 Hip检测波长的确定Fig.2 Hip detection wavelength determined
1.2.5.2 魔芋ACE抑制肽体外活性检测
采用紫外分光光度法检测魔芋ACE抑制肽的体外活性。
反应液:150 μL HHL溶液,加入50 μL经分离纯化后魔芋ACE抑制肽溶液,在37 ℃下温育5 min后加入50 μL ACE溶液,溶液开始反应,在37 ℃条件下反应40 min后,加入200 μL、1.0 mol/L HCl中止反应,得到反应液;空白对照液:用50 μL 硼酸盐缓冲液替换魔芋ACE抑制肽溶液制备反应液,即空白对照液。在228 nm检测反应液和空白对照液的吸光度值,并计算它们各自的含量。
2 结果与分析
2.1 魔芋ACE抑制肽的分离纯化
2.1.1 超滤
2.1.1.1 超滤膜的确定
由图3、图4可知,用截留分子质量分别为10、5、1 kDa 3种超滤膜进行分离,膜通量的大小随着截留分子质量的增大而增加,当超滤膜的截留分子质量达到 10 kDa时,此时的膜通量达到最大值 7.5 L/(m2·h)。相反,ACE抑制率的大小则随着截留分子量的增大呈现出减小的趋势,当超滤膜截留分子质量大小为 1 KDa 时,ACE 抑制率达到最大值 85.30%。ACE抑制肽的结构较接近,分子质量较小,所以选择截留分子质量的大小为1 kDa的超滤膜。通过规格为1 kDa的超滤膜超滤后,将得到组分冷冻干燥,分子质量大于1 kDa和小于1 kDa 2种组分比例分别是25.10%和74.90%。

图3 超滤膜分子质量大小对膜通量的影响Fig.3 The molecular weight of ultrafiltration membrane flux membrane

图4 超滤膜分子质量大小对 ACE 抑制率的影响Fig.4 Ultrafiltration membrane molecular size of ACE inhibition rate
2.1.2 Sephadex G-15柱层析
样品浓度对分离效果有较大影响,由图5可知,当上样浓度为80 mg/mL和120 mg/mL时可得到3个洗脱峰,当浓度达到160 mg/mL时,得到,2个洗脱峰。但是上样浓度为80 mg/mL和160 mg/mL时,出现拖尾,并且分离效果不明显。这可能是因为样品浓度过大会导致黏度增大,而使层析分辨率下降,样品浓度过小分子质量黏度减小,流动性较大,导致洗脱峰分不开。因此,上样浓度选用120 mg/mL。

A-浓度为 80mg/mL;B-浓度为120mg/mL;C-浓度为160 mg/mL图5 样品浓度对分离效果的影响Fig.5 Sample concentration effects on the separation
合适的流速是凝胶柱层析分离的重要条件。由图6可知,当洗脱流速从0.6 mL/min增加到0.8 mL/min时,分离效果明显,3个洗脱峰随流速增大而分离效果较好。当流速达到1.0mL/min时,仅有2个洗脱峰且峰形不佳。流速过大时,ACE抑制肽不能得到较好分离。因为凝胶柱层析的分离主要取决于分子扩散进入凝胶的机会,流速过快一些分子来不及分开就被洗脱出来,速度较小时被分离的组分因扩散又混合在一起,因此,选择洗脱流速为 0.8 mL/min为分离最佳流速。

A-流速为0.6mL/min;B-流速为0.8mL/min;C-流速为1.0mL/min图6 流速对分离效果的影响Fig.6 Flow rate effects on the separation
上样量一般为凝胶床的1%~4%,上样量也直接影响分离效果。由图7可知,上样量0.5 mL时,可得到两个洗脱峰,出现拖尾现象,上样量太少、实验效率低。当上样量为1.5 mL时,洗脱峰明显的仅有1个,而且峰形较宽,这是因为凝胶颗粒的吸附容量已经达到饱和。当上样量为1 mL时,出现3个洗脱峰且峰形较好。由峰形和洗脱峰2个指标考虑,最佳上样量为1 mL。

A-上样量为0.5 mL;B-上样量为1.0 mL;C-上样量为1.5 mL图7 上样量对分离效果的影响Fig.7 Sample volume effects on the separation
由图7-B可见,经过Sephadex G-15凝胶柱层析分离后,分子质量为小于1 kDa的组分被分离为1、2和3三个组分。分别收集这3个组分冷冻干燥,并进行ACE抑制率的测定,其中组分2的抑制活性较大,可达到90.20%,对该组分进一步进行纯化。
2.1.3 RP-HPLC
由图8可知,在RP-HPLC的C18柱上进一步纯化分离出2个主要肽峰,纯化得到的的2个主要肽峰1和2有较好的分离度,分别收集这2个肽峰,冷冻干燥后测定各峰ACE抑制率,其中峰2抑制率最高,其ACE抑制率为92.85%。并对组分2进行进一步的抑制活性检测。

图8 RP-HPLC纯化魔芋ACE抑制肽图谱Fig.8 RP-HPLC purifiedkonjac ACE inhibitory peptides Atlas
2.2 魔芋ACE抑制肽体外活性检测
以HHL为AngI的模拟底物,ACE可催化分解HHL生成马尿酸,加入ACE抑制肽后,与ACE活性区域作用,ACE活性受到抑制,于是阻止了ACE对HHL的催化分解作用,导致马尿酸的生成量减少。如图9,空白液中的马尿酸含量远远大于反应液中马尿酸的含量,其含量大约是反应液的3倍。说明魔芋ACE抑制肽对HHL分解产物Hip具有抑制作用,魔芋ACE抑制肽活性较好。
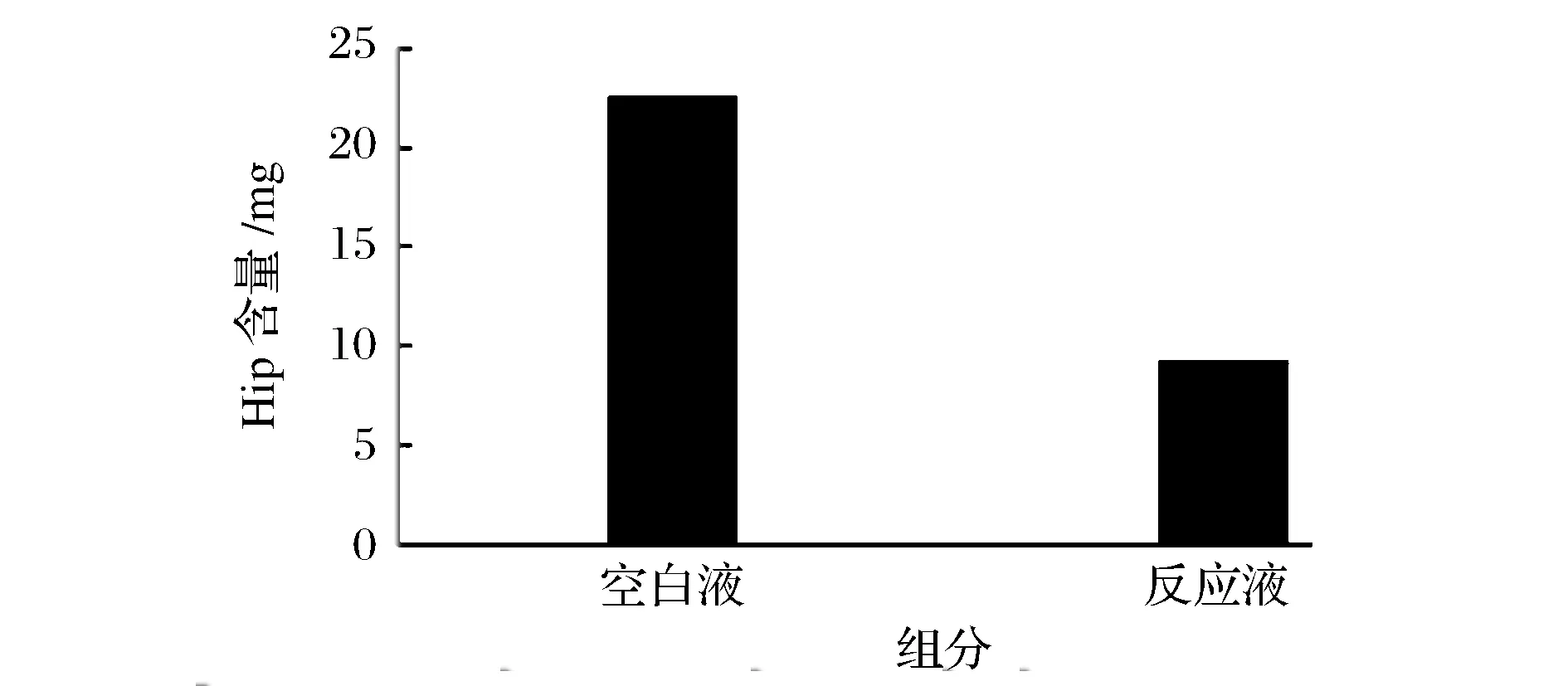
图9 魔芋ACE抑制肽抑制活性检测结果Fig. Konjac ACE inhibitory peptide inhibitory activity test results
3 小结
本研究将魔芋飞粉通过碱溶酸沉法提取魔芋蛋白,以魔芋蛋白为原料经过碱性蛋白酶酶解,得到魔芋ACE抑制肽粗品;通过超滤除去大分子杂质,分子质量为1 kDa的超滤膜分离效果较好;然后用Sephadex G-15凝胶柱层析进一步分离,将分子质量小于1 kDa的多肽区段分离为1、2和3三个组分,测3个组分ACE抑制率,其中组分2的抑制活性最高达到90.20%;最后经过RP-HPLC纯化,得到两个肽峰1和2,其中组分2的抑制活性最高,达到92.85%。利用紫外分光光度法测纯品的抑制活性,魔芋ACE抑制肽对HHL分解产物Hip具有较强抑制作用,说明魔芋ACE抑制肽活性较好。本研究以魔芋蛋白质为原料,经过分离纯化工艺得到纯度较高的魔芋ACE抑制肽,既拓宽了魔芋ACE抑制肽的分离纯化方法,也为魔芋飞粉的开发利用及生产高附加值产品开辟了一条新途。
[1] 李慧,吕莹,丁轲,等.食物源降血压肽的制备与功能评价[J].中国食物与营养,2015,21(1):26-30.
[2] 耿静静.超声波辅助酶法制备燕麦蛋白ACE抑制肽的研究[D]镇江:江苏大学,2010.
[3] 刘国志,刘生毅,王亚林,等.玉米醇溶蛋白酶解制备ACE抑制肽的研究[J].食品研究与开发,2006,27(2):138-141.
[4] 宋礼,孙文静,冯丹,等.牦牛乳酪蛋白降血压肽制备工艺及分离纯化研究[J].食品工业科技,2015,36(3):223-226.
[5] 王双,王昌涛,韩扬.燕麦 ACE 抑制肽的分离纯化及其活性研究[J].食品科学,2010,31(24): 222-229.
[6] 王振斌,裴娟娟,闫景坤,等.超滤精制对芝麻蛋白水解液 ACE 抑制活性和抗氧化活性的影响[J].中国粮油学报,2015,30(8): 58-63.
[7] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of angiotensin-converting of rabbit lung [J]. Biochemical Pharmacology, 1971, 20:1 637-1 648.
[8] WANG Bin, LI Li, CHI Changfeng, et al. Purification and characterization of a novel antioxidant peptide derived from blue mussel (Mytilusedxilis) protein hydrolysate[J].Food Chemistry,2013,138(1):1 713-1 719.
[9] SAMARAKOON K W,LEE J H,KANG M C,et al. Purification and identification of novel angiotensin-I converting enzyme (ACE ) inhibitory peptides from cultured marine microalgae (Nannochloropsisoculata) protein hydrolysate[J].Journal of Applied Phycology,2013,25(5) :1 595-1 606.
Separation and purification of konjac ACE inhibitory peptides and active substance detection
MAO Gen-nian1*,ZHOU Ya-li1, HE Lei1, CAO Qing1,WANG Yong1,2, LI Yan-jun1,2
(School of Food and Biological Engineering ,Shaanxi Unversity of Science & Technology, Xi’an 710021,China)2(Shaanxi Research Institute of Agricultural Products Processing Technology,Xi'an 710021,China)
Protein was extracted from konjac powder by alkali extraction and acid precipitation method; konjac protein is material, konjac ACE inhibitory peptides crude were prepared by alkaline hydrolysis protease on konjac protein; its crude macromolecular impurities were removed by ultrafiltration, Sephadex G-15 column chromatography, and RP-HPLC purification. Highly purified konjac ACE inhibitory peptide was obtained. The ultrafiltration, Sephadex G-15 column chromatographic separation conditions were optimized; hippuric acid was used as the index and Spectrophotometric was used to determine the activity. The results showed that an ultrafiltration membrane has a molecular weight of 1 kDa, The optimal separation condition for Sephadex G-15 was 120 mg/mL, flow rate was 0.8 mL/min, sample volume was 1.0 mL. After RP-HPLC purified, konjac ACE inhibitory peptide inhibition rate was reached to 92.85%. Blank solution Hip content was 22.50 mg, the reaction mixture Hip content was 9.22 mg, which indicates that konjac ACE inhibitory peptide inhibitory activity was better.
konjac protein; ACE inhibitory peptides; separation and purification;activity
学士,教授(本文通讯作者,E-mail:maogn@sust.edu.cn)。
陕西省科技攻关项目(2016NY-167);西安市科技计划项目(NC1405(3));陕西省农业科技创新与攻关项目(2015NY010、2016NY-142);陕西省协同创新计划项目(2016XT-21)
2016-09-28,改回日期:2016-11-23
10.13995/j.cnki.11-1802/ts.201706027

