Snail在IgA肾病组织中的表达及其与肾小管上皮-间质转化的关系
李 静,高慧敏,王 弦,秦 蓉
Snail在IgA肾病组织中的表达及其与肾小管上皮-间质转化的关系
李 静,高慧敏,王 弦,秦 蓉
目的 探讨在组织和细胞水平上Snail的表达与肾小管上皮-间质转化(epithelial-mesenchymal transition, EMT)及肾小管间质纤维化(tubulointerstitial fibrosis, TIF)的关系;观察转染Snail基因后人肾小管上皮细胞(HK-2)miRNA表达谱的变化,以深入阐明EMT机制中miRNA的重要性。方法 采用免疫组化法检测Snail及EMT相关蛋白vimentin、SMA、E-cadherin在40例IgA肾病患者肾穿刺组织中的表达。采用RT-PCR及Western blot法检测Snail、E-cadherin、vimentin、SMA在HK-2细胞正常对照组、空转染组、Snail基因转染组中的表达,进一步借助基因芯片筛选出差异表达的miRNA。结果 免疫组化结果显示,IgA肾病组织中Snail与vimentin及SMA蛋白的表达呈正相关,与E-cadherin蛋白的表达呈负相关,且TIF程度越高,Snail蛋白表达越强。RT-PCR及Western blot检测结果显示,与对照组相比,Snail转染组Snail、vimentin、SMA在基因和蛋白水平表达均升高,E-cadherin蛋白表达降低,差异具有统计学意义(P<0.05)。基因芯片结果表明,Snail转染HK-2细胞后,筛选出5个明显差异表达的miRNA,预测出5 026个可能的潜在靶基因。结论 Snail表达与肾小管EMT及TIF关系密切,可作为新靶点,在EMT防治中起重要作用;差异表达的miRNAs可能参与Snail促进EMT及TIF过程的发生、发展。
肾病;肾小管上皮细胞;Snail;上皮-间质转化;免疫组织化学;miRNA;基因芯片
肾小管间质纤维化(tubulointerstitial fibrosis, TIF)是各种慢性肾脏疾病进展为终末期肾病的最终共同途径[1]。研究发现,上皮-间质转化(epithelial-mesenchymal transition, EMT)是TIF发生、发展的重要机制[2]。EMT是指上皮细胞在外界因素作用下失去上皮特性而获得间质细胞特性的一种现象,表现为上皮细胞标志物角蛋白、E-cadherin等表达下调,间质细胞标志物α-SMA、vimentin等蛋白表达上调[3]。在EMT过程中,多种信号分子参与其中并发挥重要作用[4],研究发现锌指转录因子Snail家族成员对EMT的发生、发展起重要的促进作用[5]。但Snail在人肾小管上皮细胞EMT过程中作用机制的研究却鲜有报道。本组前期研究结果表明,miRNA在EMT及TIF过程中发挥着重要作用,目前有极少量研究报道在EMT过程中miRNA的表达谱变化。为进一步探讨Snail与肾小管EMT及TIF的关系以及miRNA的调控作用,本实验采用免疫组化法检测Snail蛋白及EMT相关蛋白vimentin、SMA、E-cadherin在IgA肾病患者的肾脏组织中的表达,从而探讨Snail与EMT和TIF的相关性;同时构建过表达Snail基因的HK-2细胞,应用qPCR、RT-PCR、Western blot等分子生物学技术,在细胞水平研究Snail过表达对EMT相关蛋白vimentin、SMA、E-cadherin表达的影响;并利用基因芯片技术筛选出Snail转染组HK-2细胞差异表达的miRNA,从miRNAs水平进一步探讨Snail基因对肾小管EMT的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 标本来源与分组 选取40例2010~2014年安徽医科大学第二附属医院病理科经肾穿刺活检诊断为IgA肾病的肾组织,已排除过敏性紫癜、系统性红斑狼疮等继发性肾小球肾炎。另收集4例正常肾组织作为对照组。根据光镜下肾小管萎缩和TIF所占皮质部间质总面积的百分比将IgA肾病TIF程度分为3级:(1)轻度:肾小管萎缩和TIF程度不超过皮质部间质总面积的25%;(2)中度:肾小管萎缩和TIF程度占皮质部间质总面积25%~50%;(3)重度:肾小管萎缩和TIF程度超过皮质部间质总面积的50%[6]。对入选的40例IgA肾病组织根据TIF严重程度分为轻度病变组12例、中度病变组14例和重度病变组14例。
1.1.2 细胞株和质粒 人肾皮质近曲小管上皮细胞(HK-2、FDCC-HSC145)购于复旦IBS细胞库;人Snail基因表达质粒由广州辉骏公司构建。
1.1.3 主要试剂 鼠抗人Snail多克隆抗体(浓缩型),工作浓度(1 ∶50)购自Abcam公司;鼠抗人SMA、vimentin、E-cadherin单克隆抗体(即用型)及PV-6000免疫组化染色试剂盒和DAB显色试剂盒均购自北京中杉金桥公司。DMEM/F12培养液购自美国Hyclone公司,胎牛血清购自杭州四季青公司,胰酶、RIPA蛋白提取液细胞裂解液购自碧云天公司,质粒小量抽提试剂盒、Trizol RNA抽提试剂盒购自美国Invitrogen公司,DMSO购自美国AMRESCO公司,兔抗人E-cadherin、vimentin、α-SMA抗体、鼠抗人Snail抗体均购自美国Abcam公司,小鼠抗人β-actin抗体、辣根过氧化物酶标记兔抗小鼠IgG二抗、辣根过氧化物酶标记山羊抗兔IgG二抗均购自北京中杉金桥公司。
1.2 方法
1.2.1 免疫组化法检测肾组织中Snail、vimentin、SMA、E-cadherin的表达及结果判定 标本均经10%中性福尔马林固定后石蜡包埋,3 μm厚连续切片。采用EnVision两步法,具体操作步骤按PV-6000试剂盒说明书进行,经DAB显色,苏木精复染细胞核,中性树胶封固。已知阳性组织作为阳性对照,以PBS代替原一抗作为阴性对照进行抗体有效性验证。Snail、vimentin、SMA及E-cadherin结果判断:按照染色细胞所占面积百分比进行半定量分析。光镜下每张切片不包含肾小球和血管的间质区域随机选取5个高倍镜视野(×400倍),计算所选区域阳性细胞占整个视野面积的百分比,然后求其平均值作为比较指标。阳性细胞所占面积≤10%为阴性(-),10%~25%为弱阳性(1+),25%~50%为中等阳性(2+),≥50%为强阳性(3+)[3],最终结果将(-~1+)判断为阴性,(2+~3+)判断为阳性。
1.2.2 人Snail基因表达载体的构建、鉴定、扩增及提取 构建Snail基因表达载体,并将含有目的片段的重组质粒菌株送与上海生工公司测序鉴定。然后转化DH-5a感受态细胞,经涂板、挑选、单克隆后扩增;采用质粒小提试剂盒(Invitrogen公司)从大肠杆菌中抽提质粒,操作方法参照说明书;用紫外分光光度仪测定OD260/280比值来计算DNA的浓度及纯度,-20 ℃保存。
1.2.3 Snail质粒瞬时转染及细胞形态学观察 HK-2细胞常规培养,按每孔1×106个接种在6孔板中,待细胞达70%~80%融合后,在细胞生长状态良好的情况下进行转染,转染步骤参照Lipofectamine 2000说明书。实验分组:(1)空白对照组:只接种细胞,无转染质粒,无转染试剂;(2)空转染组:无转染质粒,有转染试剂;(3)实验组:转染Snail质粒。将处理后的细胞置于37 ℃ 5%CO2的培养箱中培养48 h后,采用倒置显微镜观察各组细胞形态的改变。
1.2.4 Western blot 细胞转染48 h后,加入RIPA裂解液,冰上均质,4 ℃,12 000 r /min,离心10 min,取上清液,4 ∶1加入上样缓冲液,100 ℃煮沸变性10 min。配制10% SDS-PAGE凝胶,依次加入预染蛋白Marker和待分析样品后80 V电压下电泳分离,200 mA电流转膜1.5 h,5%脱脂奶粉封闭2 h。加入一抗4 ℃摇床孵育过夜。其中抗体浓度β-catenin(1 ∶5 000)、Snail(1 ∶1 000)、vimentin(1 ∶1 000)、α-SMA(1 ∶1 000)、E-cadherin(1 ∶1 000)、二抗(1 ∶10 000)。使用Pierce ECL Western blotting KIT显色。
1.2.5 qPCR、RT-PCR和miRNA表达谱芯片检测 细胞转染48 h后,使用Trizol法提取细胞总RNA并进行逆转录。qPCR采用SYBR Green染色法,qPCR反应条件:95 ℃ 10 s,95 ℃ 15 s、60 ℃ 40 s 40个循环。样本做3个复孔。CT值代表荧光信号到达所设定的阈值时所经历的循环数,以β-actin作为内参,通过2-△△Ct法计算目的基因Snail的相对表达量。建立25 μL的PCR反应体系:cDNA 模板2 μL、上游引物1 μL、下游引物1 μL、PCR Master Mix 12.5 μL、去离子水8.5 μL。PCR扩增条件:预变性95 ℃ 3 min,变性95 ℃ 30 s、退火30 s(Snail 51 ℃、vimentin 50 ℃、SMA 55 ℃、E-cadherin 54 ℃)、延伸72 ℃ 45 s共进行35个循环,后72 ℃延伸10 min,最后4 ℃终止,-20 ℃保存,PCR产物使用1.5%琼脂糖凝胶电泳检测并分析。引物序列如下:β-actin上游5′-TGACGTGGACATCCGCAAAG-3′,下游5′-CTGGAAGGTGGACAGCGAGG-3′;Snail上游5′-TTTACCTTCCAGCAGCCCTA-3′,下游5′-GACAGAGTCCCAGATGAGCA-3′;vimentin上游5′-CCTTGAACGCAAAGTGGAAT-3′,下游5′-TTTGGACATGCTGTTCCTGA-3′;SMA上游5′-GCGTGGCTATTCCTTCGTTA-3′,下游5′-TTCTCAAGGGAGGATGAGGA-3′;E-cadherin上游5′-TGATTCTGCTGCTCTTGCTG-3′,下游5′-CTCTTCTCCGCCTCCTTCTT-3′。同时委托上海伯豪公司对空转染组和Snail转染组总RNA进行miRNA芯片分析。

2 结果
2.1 Snail、vimentin、SMA及E-cadherin在IgA肾病组织中的表达 Snail在正常肾小管上皮细胞胞质中有少量表达,当发生TIF时,Snail主要在肾小管上皮细胞及间质纤维细胞和(或)纤维母细胞、少量炎细胞胞质及胞核中表达,且Snail染色强度随TIF程度加重而增加(图1);vimentin主要在萎缩的肾小管上皮细胞和基膜、肾小球毛细血管壁和内皮细胞及间质细胞胞质表达(图2);SMA主要在肾小管上皮细胞、肾小球系膜细胞、血管壁及间质细胞胞质表达(图3);E-cadherin主要在肾小管上皮细胞的胞膜和胞质表达(图4)。进一步统计分析表明,Snail、vimentin及SMA蛋白随TIF程度加重而表达增强;E-cadherin蛋白随TIF程度加重而表达降低(P<0.05,表1)。Spearman相关性分析表明Snail蛋白与vimentin、SMA蛋白表达呈正相关,与E-cadherin蛋白表达呈负相关(表2)。

①A①B①C②A②B②C③A③B③C④A④B④C
图1 Snail蛋白在肾小管间质纤维化轻度(A)、中度(B)和重度(C)病变组织中的表达,EnVision两步法 图2 vimentin蛋白在肾小管间质纤维化轻度(A)、中度(B)和重度(C)病变组织中的表达,EnVision两步法 图3 SMA蛋白在肾小管间质纤维化轻度(A)、中度(B)和重度(C)病变组织中的表达,EnVision两步法 图4 E-cadherin蛋白在肾小管间质纤维化轻度(A)、中度(B)和重度(C)病变组织中的表达,EnVision两步法

表2 Snail与vimentin、SMA、E-cadherin蛋白表达的相关性分析
2.2 重组质粒的鉴定 经测序结果显示:重组质粒的碱基序列与GenBank中的序列完全一致,表明目的片段成功插入载体质粒。
2.3 Snail基因转染前后细胞形态学变化 借助倒置相差显微镜观察,空白对照组及空转染组HK-2细胞形态呈铺路石样,Snail基因转染组中HK-2细胞形态呈纺锤形,间隙增宽,两者形态上有明显差别(图5)。
2.4 Snail、vimentin、SMA及E-cadherin在各组HK-2细胞中的表达
2.4.1 qPCR结果 Snail转染组中Snail mRNA的相对表达量明显高于空白对照组及空转染组(图6),差异有统计学意义(P<0.01)。
2.4.2 Western blot结果 Snail转染组中Snail、vimentin及SMA蛋白的表达量明显高于空白对照组及空转染组,而E-cadherin蛋白的表达明显低于空白对照组及空转染组(图7、8),差异有统计学意义(P<0.05)。

图6 肾小管上皮细胞HK-2转染Snail后Snail mRNA的表达与空白对照组及空转染组比较,**P<0.01
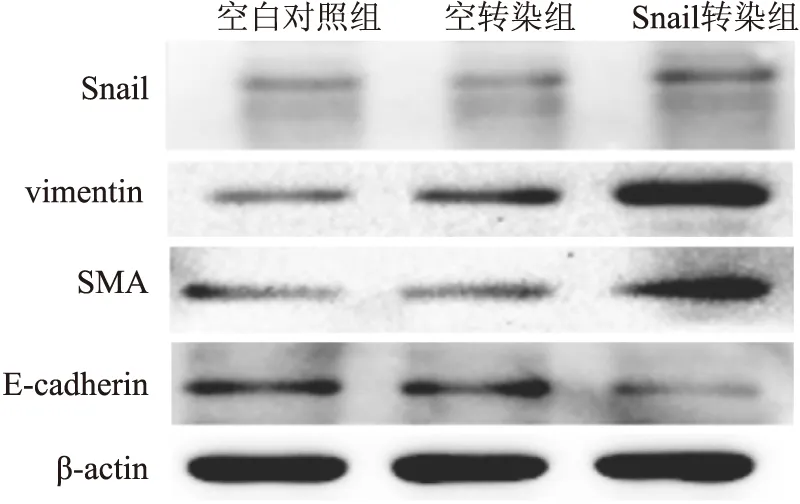
图7 Western blot法检测Snail转染HK-2细胞后Snail、vimentin、SMA及E-cadherin蛋白的表达
2.4.3 RT-PCR结果 Snail转染组中Snail、vimentin及SMA蛋白的表达量明显高于空白对照组及空转染组,而E-cadherin蛋白的表达量明显低于空白对照组及空转染组(图9、10),差异有统计学意义(P<0.05)。
2.5 过表达Snail质粒诱导的miRNA异常表达 为筛选Snail转染HK-2细胞内miRNA的差异性表达,对空转染组及Snail转染组进行基因芯片分析,结果显示:在两组细胞中,筛选出24个差异表达的miRNA(fc≤0.7,fc≥1.5)(图9、10),其中hsa-miR-1268a、hsa-miR-5703及hsa-miR-6165表达水平差异为2≤fc≤3,hsa-miR-5787和hsa-miR-630表达水平差异为fc≥3,且均表现为表达上调(表3)。
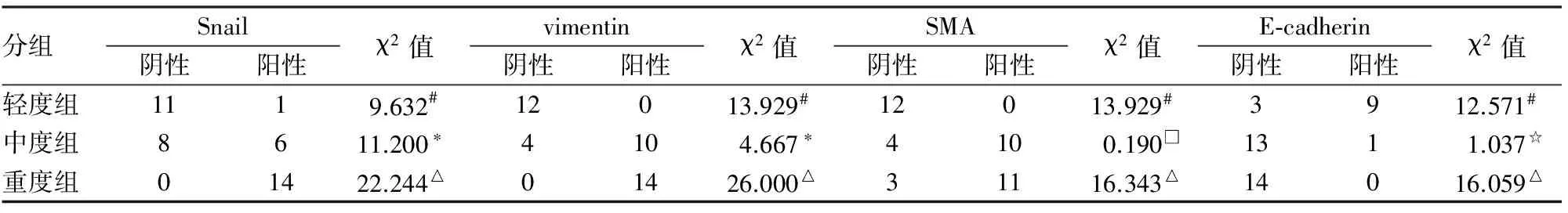
表1 Snail、vimentin、SMA及E-cadherin蛋白在IgA肾病组织中的表达
轻度组与中度组比较,#P<0.01;中度组与重度组比较,*P<0.01;轻度组与重度组比较,△P<0.01;中度组与重度组比较,□P=0.663、☆P=0.309

ABC
图5 Snail转染HK-2细胞后形态学变化:A.空白对照组;B.空转染组;C.Snail转染组

图8 Snail转染HK-2细胞后Snail(A)、vimentin(B)、SMA(C)及E-cadherin(D)蛋白的表达与空白对照组比较,*P<0.05;与空转染组比较,#P<0.05

图9 RT-PCR法检测Snail转染HK-2细胞后Snail、vimentin、SMA及E-cadherin mRNA的表达
1.Marker;2.空白对照组;3.空转染组;4.Snail转染组

表3 Snail质粒转染后空转染组和转染组内表达差异最明显的5个miRNA
3 讨论
近年来人们对TIF研究日益增多,然而引起TIF的确切机制尚无共识,但EMT在TIF早期却起到关键作用。人Snail蛋白主要表达于胎盘、胚胎中胚层、心肌、肝脏、骨骼肌及某些未分化组织[7],具有调控细胞分化、游动、循环及凋亡作用[8-9]。Boutet等[7]研究发现胚胎期Snail基因参与组织、器官分化,成人Snail基因的激活破坏上皮组织的完整性和稳定性,引起脏器纤维化。大量研究[10-11]发现,Snail作为转录因子,与E-cadherin启动子区结合,调节E-cadherin基因转录,进而抑制E-cadherin的表达,破坏细胞间紧密连接,促使细胞发生迁移。Chen等[12]研究结果显示,Snail基因敲除小鼠在TGF-β高水平表达情况下,EMT过程受到抑制。以上实验结果表明Snail参与EMT过程。在TIF的过程中同时伴有miRNA表达谱的变化[13],miRNA是一类具有调控作用的内源性非编码RNA[14],长20~25个核苷酸。既往研究[15]发现,miRNA-200家族特别是miRNA-200b可以通过与E-cadherin基因结合,抑制E-cadherin表达,从而促进EMT过程,此外,miRNA-192[16]、miRNA-21[17]、miRNA-34a[18]等均可通过影响E-cadherin基因表达,调控EMT过程。

图10 Snail转染HK-2细胞后Snail(A)、vimentin(B)、SMA(C)及E-cadherin(D) mRNA的表达与空白对照组相比,*P<0.05;与空转染组相比,#P<0.05
本实验以IgA肾病患者的肾穿刺组织为研究对象,发现肾组织中Snail与vimentin及SMA蛋白的表达呈正相关,与E-cadherin蛋白的表达呈负相关;且Snail蛋白表达与TIF呈正相关。其次本实验构建了Snail基因过表达质粒,转染体外培养的HK-2细胞,观察细胞形态发现细胞由上皮样转变为长梭形细胞,且在细胞水平进一步验证Snail高表达可明显上调vimentin、SMA的表达而下调E-cadherin的表达。以上结果表明Snail参与肾小管上皮细胞EMT的发生、发展过程,并与TIF密切相关。
近年来围绕TIF相关的miRNA研究比较多,前期研究也表明,miRNA在EMT及TIF过程中发挥重要作用;但目前对EMT过程中miRNA的表达谱变化研究较少,本实验利用Human miRNA 8×60K v21.0对空转染组和Snail转染组的HK-2细胞进行芯片分析,结果表明,Snail转染组有5个miRNA的表达发生了显著变化,本实验进一步针对hsa-miR-1268a、hsa-miR-5703、hsa-miR-5787、hsa-miR-6165和hsa-miR-630进行靶基因预测,通过TargetScan软件分析,共筛选5 026个靶基因,其中FUT8、LEF-1、MMP-1、MMP-2和MDM-2等靶基因的既往生物学功能研究与EMT及TIF有关。FUT8(α1-6岩藻糖基转移酶)可以对TGF-βR、E-cadherin、EGFR等进行岩藻糖基化修饰,改变两者生物学活性,进而参与TIF过程[19]。Snail过表达上调基质金属蛋白酶(matrix metalloproteinase, MMPS)家族成员MMP-1、MMP-9的表达,从而引发EMT[20]。Shibata等[21]研究发现MMP-7可以通过减少E-cadherin蛋白的表达和上调β-连环蛋白/LEF-1信号传导而诱导EMT。Medici等[22]研究认为Snail和LEF-1的相互作用参与TGF-β1诱导EMT的过程,进而引起E-cadherin的完全抑制。
总之,Snail可引起肾小管上皮细胞的生物学特性发生改变,EMT的发生、发展是一个复杂的病理过程,在此过程中,Snail处于细胞内各种信号通路的交汇点,参与构成了复杂的细胞内信号传导系统。因此,Snail作为EMT的潜在标志物,有望成为防治肾脏纤维化的新靶点。但有关Snail及其mRNA的具体调节机制以及Snail与已知的调节因子的相互作用,有待进一步探讨。
[1] Zeisberg M, Neilson E G. Mechanisms of tubulointerstitial fibrosis[J]. J Am Soc Nephrol, 2010,21(11):1819-1834.
[2] Nieto M A. Epithelial plasticity: a common theme in embryonic and cancer cells[J]. Science, 2013,342(6159):1234850.
[3] Kim M K, Maeng Y I, Sung W J,etal. The differential expression of TGF-β1, ILK and wnt signaling inducing epithelial to mesenchymal transition in human renal fibrogenesis: an immunohistochemical study[J]. Int J Clin Exp Pathol, 2013,6(9):1747-1758.
[4] 郑月娥, 李里香. EMT诱导因子的最新研究进展[J]. 临床与实验病理学杂志, 2013,29(3):321-324.
[5] Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition[J]. Prog Mol Biol Transl Sci, 2013,116:317-336.
[6] Mezzano S, Droguett A, Burgos M E,etal. Expression of gremlin, a bone morphogenetic protein antagonist, in glomerular crescents of pauci-immune glomerulonephritis[J]. Nephrol Dial Transplant, 2007,22(7):1882-1890.
[7] Boutet A, Esteban M A, Maxwell P H, Nieto M A. Reactivation of Snail genes in renal fibrosis and carcinomas: a process of reversed embryogenesis[J]. Cell Cycle, 2007,6(6):638-642.
[8] Zheng H, Kang Y. Multilayer control of the EMT master regulators[J]. Oncogene, 2014,33(14):1755-1763.
[9] Stock S, Gott C, Grifka J,etal. Snail Modulates proliferation and expression of osteogenic markers of adipose-derived stem cells(ASC)[J]. Cell Physiol Biochem, 2013,31(4-5):703-717.
[10] Dong W, Yongjun L, Nan D,etal. Molecular networks and mechanisms of epithelial-mesenchymal transition regulated by miRNAs in the malignant melanoma cell line[J]. Yi Chuan, 2015,37(7):673-682.
[11] Cao Y W, Wan G X, Sun J P,etal. Implications of the Notch1-Snail/Slug-epithelial to mesenchymal transition axis for lymph node metastasis in infiltrating ductal carcinoma[J]. Kaohsiung J Med Sci, 2015,31(2):70-76.
[12] Chen X H, Liu Z C, Zhang G,etal. TGF-β and EGF induced HLA-I downregulation is associated with epithelial-mesenchymal transition (EMT) through upregulation of snail in prostate cancer cells[J]. Mol Immunol, 2015,65(1):34-42.
[13] 尤小寒, 章慧娣, 苏 震, 等. 与大鼠肾间质纤维化相关microRNA的初步研究[J]. 中华肾脏病杂志, 2012,28(10):785-789.
[14] Berindan N I, Monroig P C, Pasculli B,etal. MicroRNAome genome: a treasure for cancer diagnosis and therapy[J]. CA Cancer J Clin, 2014,64(5):311-336.
[15] Xiong M, Jiang L, Zhou Y,etal. The miR-200 family regulates TGF-β1-induced renal tubular epithelial to mesenchymal transition through Smad pathway by targeting ZEB1 and ZEB2 expression [J]. Am J Physiol Renal Physiol, 2012,302(3):369-379.
[16] Jenkins R H, Martin J, Phillips A O,etal. Pleiotropy of microRNA-192 in the kidney[J]. Biochem Soc Trans, 2012,40(4):762-767.
[17] Kang W K, Lee J K, Oh S T,etal. Stromal expression of miR-21 in T3-4a colorectal cancer is an independent predictor of early tumor relapse[J]. BMC Gastroenterol, 2015,15(1):1-10.
[18] Du R, Sun W, Xia L,etal. Hypoxia-induced down-regulation of microRNA-34a promotes EMT by targeting the Notch signaling pathway in tubular epithelial cells[J]. PLoS One, 2012,7(2):e30771.
[19] Hu P, Shi B, Geng F,etal. E-cadherin core fucosylation regulates nuclear beta-catenin accumulation in lung cancer cells[J]. Glycoconj J, 2008,25(9):843-850.
[20] Sun L, Diamond M E, Ottaviano A J,etal. Transforming growth factor betal promotes matrix metalloproteinase 9 mediated oral cancer invasion through snail expression[J]. Mol Cancer Res, 2008, 6(1):10-20.
[21] Shibata S, Marushima H, Asakura T,etal. Three-dimensional culture using a radial flow bioreactor induces matrix metalloprotease 7-mediated EMT-like process in tumor cells via TGF beta 1/Smad pathway[J]. Int J Oncol, 2009,34(5):1433-1448.
[22] Medici D, Hay E D, Goodenough D A. Cooperation between snail and LEF-1 transcription factors is essential for TGF-bete1-induced epithelial-mesenchymal transition [J]. Mol Biol Cell, 2006,17(4):1871-1879.
Expression of Snail in IgA nephropathy and its relationship with renal tubular epithelial mesenchymal transition
LI Jing, GAO Hui-min, WANG Xian, QIN Rong
(DepartmentofPathology,AnhuiMedicalUniversity,Hefei230032,China)
Purpose To investigate the relationship between Snail and renal tubular epithelial-mesenchymal transition (EMT) or tubulointerstitial fibrosis (TIF) at tissue and cellular levels and to observe the changes of miRNA profile after transfecting Snail gene into human renal tubular epithelial cells (HK-2), to further elucidate the importance of miRNA in the pathogenesis of renal fibrosis. Methods The expression of Snail and EMT-related proteins vimentin, SMA, E-cadherin was detected by immunohistochemistry in renal tissues of 40 patients with IgA nephropathy. The expression of Snail, E-cadherin and SMA in normal control group, empty transfection group and Snail gene transfection group was detected by Western blot and RT-PCR. Furthermore, differentially expressed miRNAs were screened by gene chip. Results By immunohistochemistry, Snail expression was positively correlated with vimentin and SMA, negatively correlated with E-cadherin in IgA nephropathy. The higher degree of the TIF, the stronger the expression of Snail. Compared with the control group, the expression of Snail, vimentin and SMA in the snail transfected group increased. However, E-cadherin decreased at gene and protein level by the RT-PCR and Western blot (P<0.05). The difference was statistically significant. Five distinctly different miRNAs were screened by gene chip after Snail gene was transfected into HK-2 cells, and then 5 026 potential target genes were predicted. Conclusion Snail expression is closely related with renal tubular epithelial mesenchymal transition and tubulointerstitial fibrosis, and it may be used as a new target in EMT prevention. Differentially expressed miRNAs may be involved in the development of EMT and TIF.
nephropathy; renal tubular epithelial cells; Snail; epithelial-mesenchymal transition; immunohistochemistry; miRNA; gene chip
安徽医科大学校科研基金(2015xkj121)
安徽医科大学病理学教研室,合肥 230032
李 静,女,硕士研究生。E-mail: sunny_xiaoai@163.com 秦 蓉,女,硕士生导师,通讯作者。E-mail: qinrong0717@163.com
时间:2017-6-20 11:18 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170620.1117.008.html
R 692
A
1001-7399(2017)06-0629-07
10.13315/j.cnki.cjcep.2017.06.008
接受日期:2017-02-13

