哈克尼西棉细胞质雄性不育相关线粒体基因多态性分析
巩养仓,张雪林,吴建勇,张兴平,彭凡嘉,张志刚,贺云新,梅正鼎,周德桂,邢朝柱*
(1.湖南省棉花科学研究所,湖南常德415101;2.棉花生物学国家重点实验室/中国农业科学院棉花研究所,河南安阳455000)
哈克尼西棉细胞质雄性不育相关线粒体基因多态性分析
巩养仓1,张雪林1,吴建勇2,张兴平1,彭凡嘉1,张志刚1,贺云新1,梅正鼎1,周德桂1,邢朝柱2*
(1.湖南省棉花科学研究所,湖南常德415101;2.棉花生物学国家重点实验室/中国农业科学院棉花研究所,河南安阳455000)
【目的】研究棉花细胞质雄性不育的相关线粒体基因。【方法】利用线粒体基因atpA、atp6、atp9、cob、coxⅠ、coxⅡ、coxⅢ、nad3、nad6、nad9探针,对哈克尼西棉细胞质雄性不育系S、保持系F、杂种一代H进行限制性片段长度多态性分析。【结果】atpA、coxⅢ、nad3、nad6在3个材料间具有多态性。atpA、nad6基因探针与所有酶的杂交结果均显示出多态性,且在不育系与杂种一代中表现一致,而在保持系中差异明显。atpA/EcoRⅠ在3个材料中的杂交结果均显示2条带,其中1条2.2 kb的杂交带在3个材料中相同,另一条在不育系和杂种一代中大小为3.2 kb,而在保持系中为4.8 kb;atpA/PstⅠ杂交结果中,在不育系和杂种一代中的条带大小为17.0 kb,而在保持系中为10.2 kb。nad6探针与4个酶的杂交结果均为不育系和杂种一代比保持系多1~2条杂交带。coxⅢ/EcoRⅠ在3个材料中均有1条2.5 kb的杂交带,但在保持系与杂种一代中比不育系多1条1.7 kb的弱带。nad3/BamHⅠ的杂交结果在不育系与保持系中表现一致,而在杂种一代中缺少1条9.5 kb的杂交带。【结论】推测atpA、nad6基因参与调控不育系的形成,而coxⅢ、nad3可能受到恢复系核基因的调控,在不育系育性恢复过程中发挥较为重要的作用。
棉花;细胞质雄性不育;线粒体基因;限制性片段长度多态性
利用二倍体野生棉——哈克尼西棉(Gossypium harknessiiBrandegee)育成的细胞质雄性不育系(Cytoplasmic male sterility,CMS)是首个棉花CMS品系[1]。目前已有多个哈克尼西棉三系杂交组合通过国家和省级审定,但因受恢复系来源狭窄和恢复能力不稳定等影响,对其高优势组合的筛选十分困难,三系杂交种至今还未在生产上大面积应用。因此,研究不育系形成机理,挖掘不育相关基因及其标记,建立哈克尼西棉三系杂交棉分子标记辅助育种体系,提高育种效率,成为高优势三系杂交棉选育的重要基础。
很多研究[2-5]表明,线粒体基因与CMS密切相关。植物线粒体基因组在200~2900 kb[6],包含atp、cox、nad、cob、rps、rrn、ccm等基因家族[7]。线粒体基因组功能非常复杂,存在正向或反向重复、重组重排、缺失或迁入、RNA编辑、转录后调控等,这些因素是CMS产生的分子基础[8-9]。Dewey等在T型胞质玉米中发现了第1个CMS相关基因T-urf13,它编码1个13 kDa的蛋白[10],该蛋白聚集在线粒体内膜上,参与膜孔组成[11]。在萝卜[12]、向日葵[13]、水稻[14]、油菜[15]、辣椒[16]、小麦[17]等作物中均发现了与CMS相关的线粒体基因或开放阅读框(Open reading frame,ORF)。在棉花上,王学德[18]对棉花线粒体蛋白质和DNA分析发现,不育系线粒体DNA缺少1个与coxⅡ基因具有同源序列的1.9 kb片段,败育时期不育系花药线粒体缺少1个约31 kDa的多肽。李双双等[19]研究发现,在atp4下游发现1个哈克尼西棉细胞质不育系特有的orf160,全长480 bp,N端与atp6序列部分同源,C端序列与核序列部分同源,其编码的159个氨基酸序列,与膜蛋白、细胞周期蛋白具有部分同源性。黄晋玲[20]对晋A细胞质雄性不育系和保持系线粒体基因的限制性片段长度多态性 (Restriction fragment length polymorphism,RFLP)分析结果显示,atp6和coxⅡ基因在两系间存在差异。张晓等[21]对棉花细胞质雄性不育系104-7A与其保持系线粒体基因的RFLP分析显示,atpA、atp9、ccmB、nad1bc、nad6、nad7c、rrn18等基因表现出了多态性。本课题组前期对哈克尼西棉细胞质雄性不育系及其保持系[22]研究发现,atpA、nad6、coxⅢ基因表现出多态性。有研究[23-25]认为,相关线粒体基因与核基因的共同作用影响细胞质雄性不育的表达及育性恢复。杂种一代是CMS系与其恢复系的杂交后代,其线粒体基因来源于CMS系。本研究把杂种一代作为试验材料,与CMS系、保持系一并进行RFLP多态性分析,研究可能参与棉花CMS形成的线粒体基因,为棉花CMS形成的分子机理研究奠定基础。
1 材料与方法
1.1 试验材料
哈克尼西棉细胞质雄性不育系S、保持系F及杂种一代H,由中国农业科学院棉花研究所提供。不育系S来源于原始的哈克尼西棉细胞质不育系DES-HAMS277,是以保持系F作父本经多代严格授粉、性状鉴定和多年株系选育而成,性状稳定。保持系F经多年多代封花自交,株系筛选,性状稳定。杂种一代H是利用多年培育的恢复系与不育系S配制的杂交组合,可育度100%。
1.2 试验方法
1.2.1总DNA提取。参考宋国立等[26]的方法提取试验材料叶片总DNA,并用RNase A对DNA进行纯化、干燥,溶于灭菌水,紫外分光光度计检测浓度并稀释,使3个材料浓度一致。
1.2.2引物设计。选择10个线粒体基因atpA、atp6、atp9、cob、coxⅠ、coxⅡ、coxⅢ、nad3、nad6、nad9,通过文献查询与软件设计,针对每个基因选择1对高特异性引物(表1),引物由上海生物工程技术服务有限公司合成。
1.2.3线粒体基因片段扩增。分别以S、F、H的总DNA为模板,进行聚合酶链式反应(Polymerase chain reaction,PCR)扩增。反应体系20 μL:模板DNA 2 μL,10×PCR buffer 2 μL,dNTP(10 mmol· L-1each dNTP)0.4 μL,Fwd primer(10 μmol·L-1)1 μL,Rev primer(10 μmol·L-1)1 μL,MgCl2(25 mmol·L-1)1.6 μL,TaqDNA polymerase(5×106U·L-1)0.2 μL,ddH2O 11.8 μL。扩增程序:94℃3 min;94℃30 s,57℃30 s,72℃1 min,28个循环;72℃10 min。反应结束后,进行琼脂糖凝胶电泳检测扩增结果。分离、回收保持系的扩增特异条带,连入pGEM-T easy vector,经转化、克隆、测序,与美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库序列比对分析。

表1 线粒体基因扩增引物Table 1 Primer sequence for mitochondrial genes
1.2.4探针标记。以连入基因片段的菌液为模板,进行PCR扩增,扩增程序同上,反应体系放大为50 μL。回收特异条带,测定回收基因片段浓度,采用地高辛标记,操作参照“DIG high prime DNA labeling and detection starter kitⅠ”说明书,每个基因探针制备10 μL,37℃孵育24 h,完成探针标记。每个标记探针与试剂盒提供的对照标准样各取1 μL,分别稀释成1000、10、3、1、0.3、0.1、0.03和0.01 μg·L-18个质量浓度梯度,依次点在尼龙膜上,1200 kJ紫外交联3 min,超纯水漂洗后,马来酸平衡2 min,封闭30 min,抗体反应30 min,洗涤2次,显色,检测探针标记效率。根据标记效率结果确定各探针用于Southern杂交的稀释倍数。
1.2.5DNA酶切与分离。选择限制性内切酶BamHⅠ、bsp143Ⅰ、EcoRⅠ、HindⅢ、HinfⅠ、PstⅠ、SacⅠ消化总DNA。根据扩增片段测序结果,结合酶切位点分析,针对每个探针选择4种限制性内切酶(表2)。根据酶切效率试验结果,BamHⅠ、EcoRⅠ、HindⅢ、PstⅠ、SacⅠ反应体系使用200 U,反应时间12 h;bsp143Ⅰ和HinfⅠ反应体系使用60 U,反应时间4 h。酶切完成后,向各反应体系中加入2.5 V的无水乙醇,置于-20℃0.5 h沉淀酶切产物,1×104r·min-1离心15 min,收集沉淀,真空干燥,溶于25 μL TE(Tris-EDTA)缓冲液中。酶切产物分离用0.5×TBE缓冲液制备12 g·L-1的琼脂糖凝胶,上样体系30 μL:25 μL酶切产物、5 μL上样缓冲液 (溴酚蓝为指示剂),电泳电压2~3 V·cm-1,待溴酚蓝跑出点样孔约8 cm时停止电泳。荧光灯下检测、拍照,切除Marker泳道和点样孔。
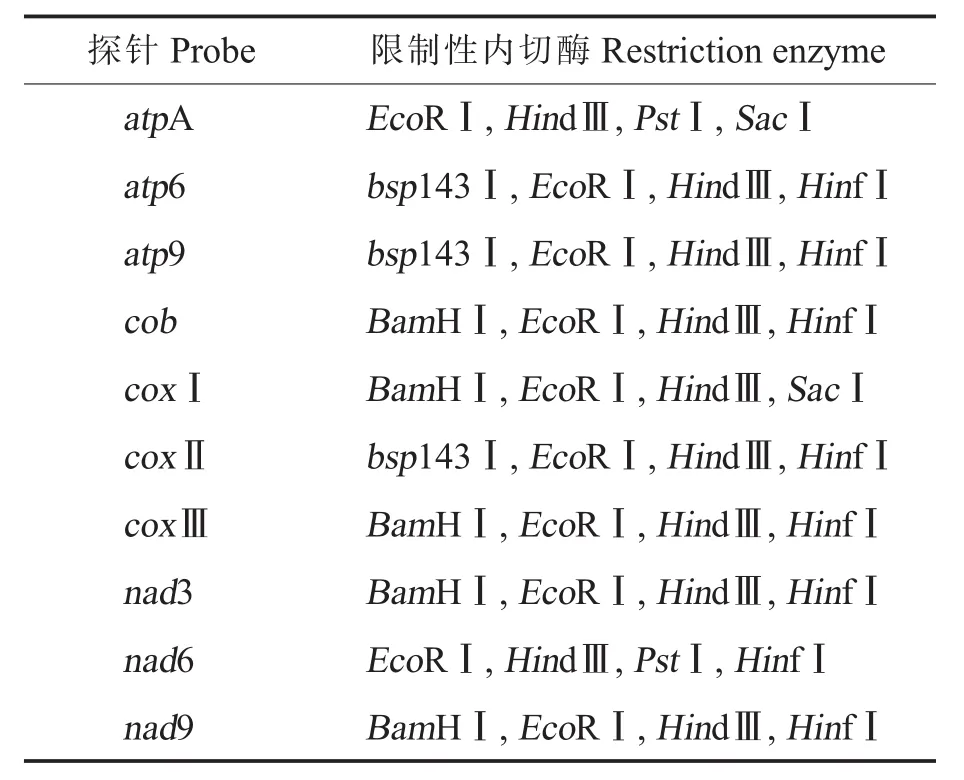
表2 各探针对应选择的限制性内切酶Table 2 Restriction enzymes for each probe
1.2.6Southern杂交。参考《分子克隆实验指南》(第3版)第六章方案8的操作方法[27],将凝胶分离的酶切产物转移到尼龙膜上,转膜时间22 h左右。将转移后的凝胶和紧贴尼龙膜的滤纸用EB染色检验,验证转膜是否彻底。按照 “DIG high prime DNA labeling and detection starter kitⅠ”说明书进行Southern预杂交、杂交、显色、拍照。参照切除的Marker,确定显色条带大小。
2 结果与分析
2.1 引物扩增结果分析
以总DNA为模板,10对基因引物在3个材料中均扩增出了单一条带(图1),回收保持系F的特异条带,利用BLASTN V2.3.1+程序将测序结果在nr数据库中进行比对分析,这些片段与哈克尼西棉线粒体序列(JX944506.1)的一致性超过99%(表3),说明选择设计的引物特异性高,基因片段均被有效扩增。
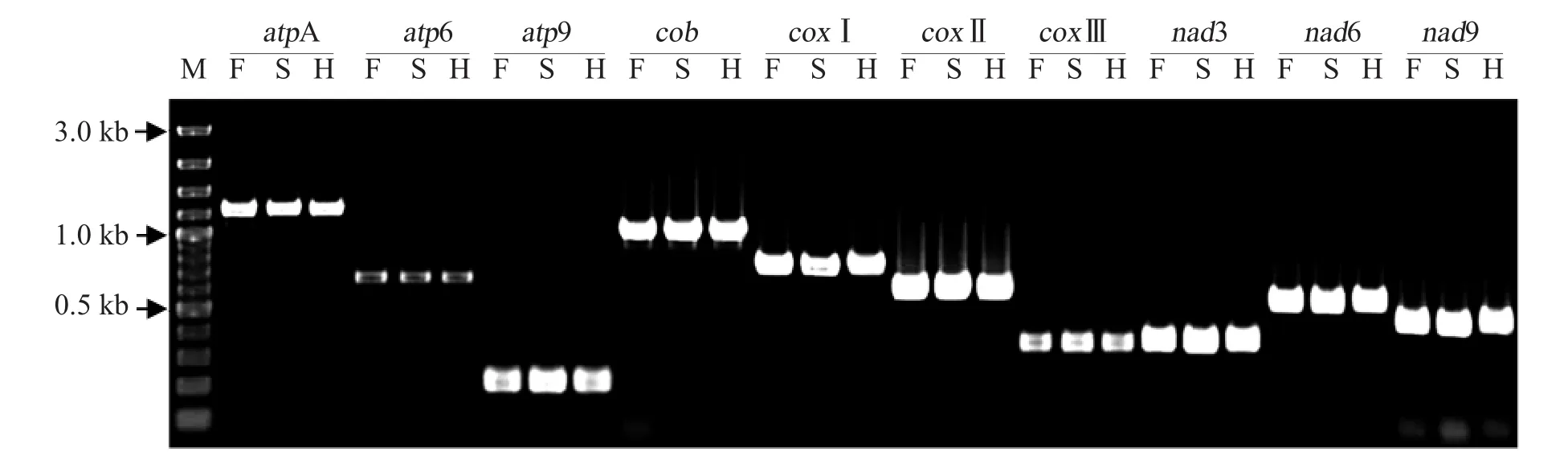
图1 线粒体基因PCR扩增结果Fig.1 PCR amplification for mitochondrial genes

表3 扩增序列与NCBI数据库哈克尼西棉线粒体基因序列比对结果Table 3 Sequence alignment between PCR amplification and mitochondrial sequence of G.harknessiiBrandegee in NCBI database
2.2 探针标记效率分析
探针标记效率检测结果表明,所有探针标记效率都与对照标准样相当或者高于对照 (图2),说明探针标记效率较高。比对标记探针与对照标准样样点显示亮度认为,用于Southern杂交时,探针cob、coxⅠ稀释30倍,探针atpA、coxⅡ、coxⅢ、nad6、nad9稀释 10倍,探针atp6、atp9、nad3不稀释。
2.3 Southern杂交结果分析
EB染色检验证明,转膜彻底。Southern杂交结果显示,10个基因探针都显示了杂交信号。在40个探针/酶组合杂交结果中,30个探针/酶显示较强的杂交信号,6个探针/酶杂交信号较弱,4个探针/酶没有杂交信号;16个探针/酶显示多个杂交信号,10个探针/酶在3个材料间表现出多态性(表4)。
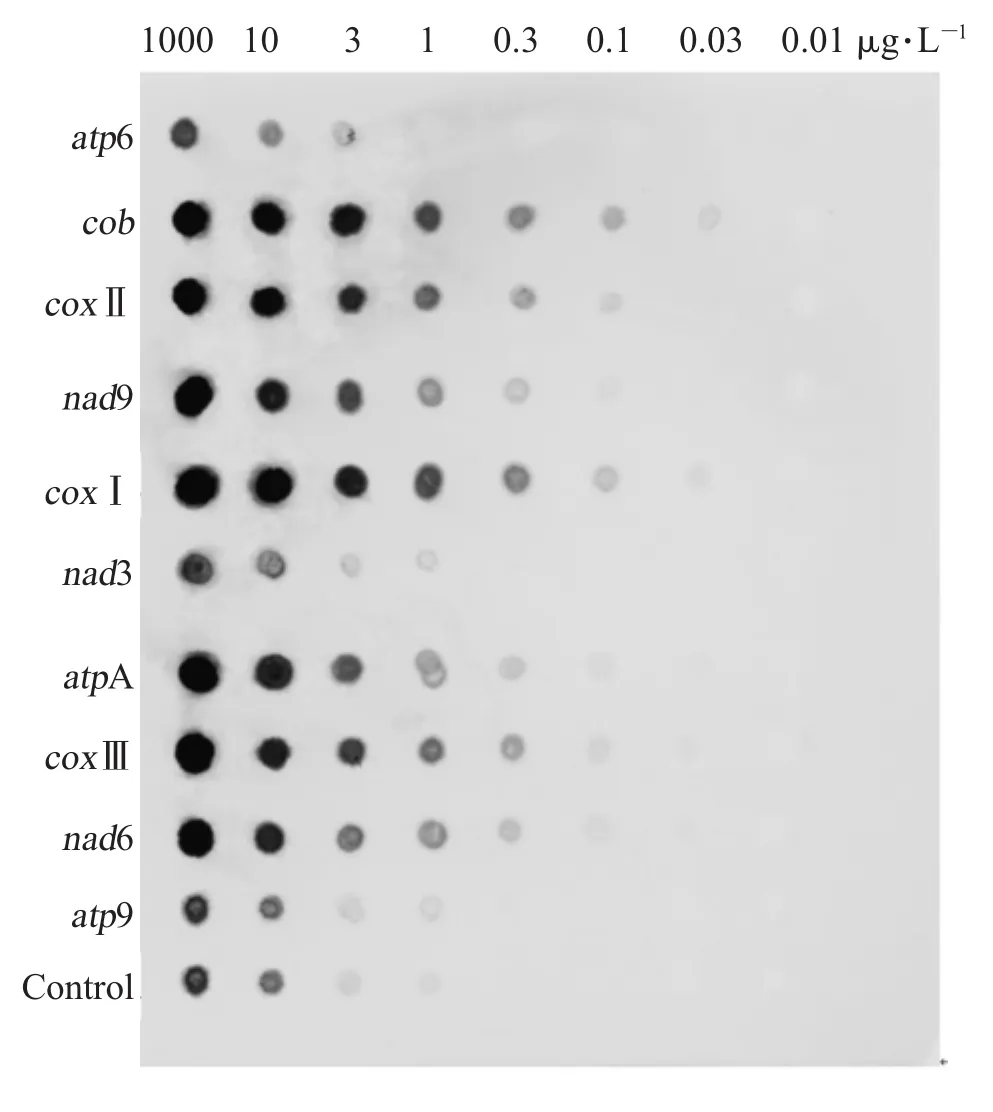
图2 探针标记效率检测结果Fig.2 Probe labeling efficiency detection
不育系、保持系与杂种一代的杂交结果主要分为 4种类型:(1)3个材料无差异类型:atp6、cob、coxⅠ、coxⅡ、nad9所有的探针/酶组合,其条带大小、亮度在3个材料间高度一致,说明这些基因是哈克尼西棉线粒体中非常保守的基因,能够稳定遗传。根据杂交结果和酶切位点分析,这5个基因在3个材料中均表现为单拷贝。因atp6探针序列内含有2个相隔81 bp的HindⅢ酶切位点,atp6/HindⅢ表现为2条杂交带。在内切酶HindⅢ作用下,探针cob杂交结果除显示1条1.2 kb的主带外,还在3.0 kb处有1条弱带;在内切酶EcoRⅠ、HindⅢ作用下,探针coxⅠ杂交结果除显示1条主带外,还分别在1.4 kb、18.0 kb出现1条弱带,且3个材料表现一致,基因组中可能存在部分同源序列。(2)不育系与杂种一代一致、与保持系存在差异类型:atpA、nad6基因在3个材料中均表现为多拷贝,且所有的探针/酶组合杂交结果均存在差异条带 (图 3)。at-pA/EcoRⅠ杂交结果中,1条2.2 kb的条带在3个材料中相同,另一条差异条带在保持系中为4.8 kb, 在不育系和杂种一代中为 3.2 kb;atpA/HindⅢ差异条带在保持系中为11.0 kb,在不育系和杂种一代中为14.8 kb;atpA/PstⅠ杂交结果中,差异条带在保持系为10.2 kb,在不育系和杂种一代中为17.0 kb;atpA/SacⅠ杂交结果中,保持系比不育系及杂种一代缺失1条大小2.8 kb的条带。nad6探针与所有酶的杂交结果均表现为保持系比不育系及杂种一代缺失 1~2条带,nad6/EcoRⅠ缺失7.5 kb、1.3 kb条带,nad6/HindⅢ缺失12.0 kb、2.8 kb条带,nad6/HinfⅠ缺失1.0 kb条带,nad6/PstⅠ缺失15.0 kb、9.2 kb条带。这表明atpA、nad6基因在后代与母系中能够稳定地遗传,而在父系中存在一定的差异。atp9表现为单拷贝,在EcoRⅠ消化作用下,3个材料的杂交结果均显示了大小相同的杂交带(4.3 kb),但保持系的条带亮度明显高于不育系及杂种一代。(3)保持系与杂种一代一致、与不育系存在差异类型:coxⅢ基因在3个材料中均表现为单拷贝,coxⅢ/EcoRⅠ在3个材料中的杂交结果均显示1条2.5 kb的主带,且在保持系与杂种一代中还显示1条1.7 kb的弱带(图3)。(4)不育系与保持系一致、与杂种一代存在差异类型:nad3基因在3个材料中表现为多拷贝,且具有多态性 (图3);nad3/BamHⅠ的杂交信号显示:在20.5 kb处,3个材料均有较强的杂交信号;13.0 kb处,不育系与保持系有较强的杂交信号,杂种一代的杂交信号很弱;9.5 kb处,不育系与保持系的杂交信号较强,而杂种一代没有杂交信号。
3 讨论
应用分子标记技术寻找细胞质雄性不育相关线粒体基因,是目前最为常用的方法。作为传统的分子标记技术,RFLP结果可靠性强,是分析线粒体基因差异应用最广泛的技术。本研究利用该技术筛选出了哈克尼西棉不育相关线粒体差异基因,而且在不育系、保持系、杂种一代3个材料间具有多态性,为棉花不育系相关线粒体基因的深入研究提供了重要基础信息。但是这些差异是相对较为稳定的DNA序列差异,且对差异序列的定位尚不精细,也尚未研究其在棉花中的时空表达差异,因此,需要对其进一步研究。一方面,可通过测定侧翼序列,寻找差异位点,并开发出相应的分子标记,用于细胞质雄性不育系的改良及鉴定,辅助新品种选育;另一方面,可对差异基因进行表达分析,进一步揭示其与棉花细胞质雄性不育的关系。
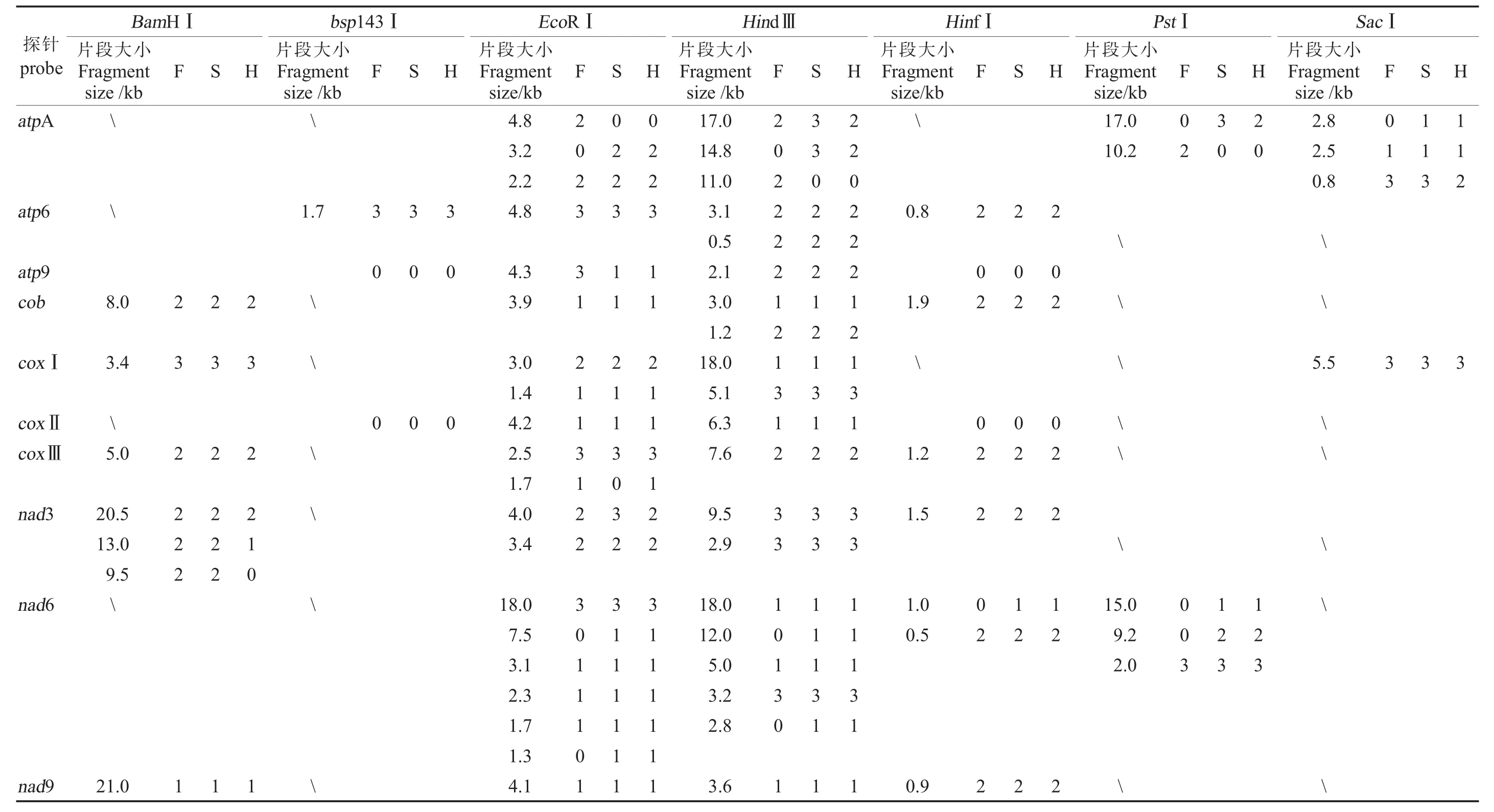
表4 RFLP结果统计Table 4 Summary of RFLP patterns
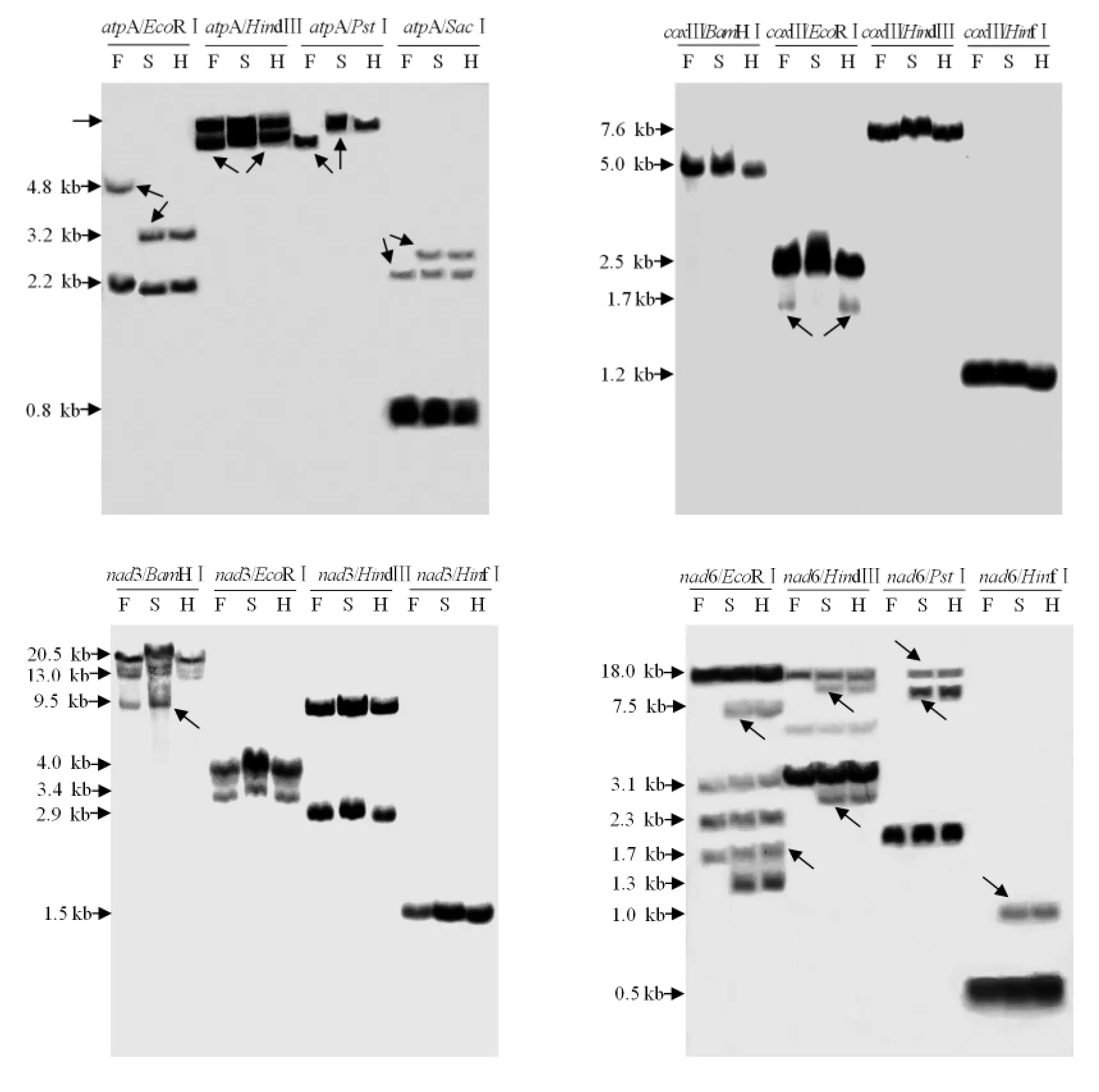
图3 线粒体基因atpA、coxⅢ、nad3、nad6 Southern杂交结果Fig.3 Southern blot results of mitochondrial geneatpA,coxⅢ,nad3 andnad6
由线粒体基因组复制而引起的内部重组或重排是序列获得和缺失的主要原因,其中一些重组造成异常的ORF,这些ORF常与细胞质雄性不育有关。此外,植物线粒体基因产生功能蛋白通常需要RNA编辑过程,如果这种编辑发生在基因转录区内,可能导致基因转录本的变异,如转录本的提前终止或不能表达,导致基因的功能缺陷或丧失等,这也是造成不育的原因之一。线粒体作为植物的能量细胞器,在花粉发育中起至关重要的作用。线粒体atpA基因编码腺苷三磷酸(Adenosine triphosphate,ATP)合酶亚基基因,ATP合酶参与线粒体膜上的腺苷二磷酸(Adenosine diphosphate,ADP)与Pi生成ATP,是能量形成的关键环节。nad6基因是线粒体内还原型辅酶Ⅰ(Reduced form of nicotinamide adenine dinucleotide,NADH)脱氢酶亚基基因,NADH脱氢酶是1种氢传递体,把NADH转变成烟酰胺腺嘌呤二核苷酸 (Nicotinamide adenine dinucleotide,NAD+),释放出游离的H+,在植物呼吸链中具有重要的作用[28]。atpA、nad6基因是植物线粒体序列突变相对较为活跃的基因[29-31],如水稻线粒体35个蛋白的编码基因存在26个单核苷酸多态性,其中nad6基因含有11个[32]。本研究结果中,不育系的atpA基因与nad6基因序列与保持系存在差异,这种差异可能导致ATP合酶、NADH脱氢酶亚基氨基酸组成序列或结构的变化,制约酶的功能发挥,从而影响花粉发育过程中的能量供应而导致败育。由于核质互作效应,细胞色素氧化酶亚基基因coxⅢ与NADH脱氢酶亚基基因nad3有可能在恢复系核基因的调控下发生碱基改变,导致杂种一代coxⅢ、nad3基因与不育系存在差异。推测coxⅢ、nad3基因在杂种一代基因表达和生理代谢过程中有可能参与调控相关基因表达产物的功能修复,从而恢复杂种一代育性。当然,花粉发育是1个十分复杂的过程,涉及到特定基因的时空表达和多基因的调控,任何1个基因的结构或表达变化都可能引起花粉发育异常而导致雄性不育。因此,在棉花细胞质雄性不育的败育机制和育性恢复机理方面,还需要开展更深入、更广泛、更系统的分子生物学研究。
4 结论
据对哈克尼西棉细胞质雄性不育系、保持系、杂种一代的多态性研究推测,线粒体基因atpA、nad6、coxⅢ、nad3与细胞质雄性不育相关,atpA、nad6基因可能参与调控不育系的形成过程,coxⅢ、nad3基因可能受到恢复系核基因的调控,在不育系育性恢复机制中发挥较为重要的作用。
[1]中国农业科学院棉花研究所.中国棉花遗传育种学[M].济南:山东科学技术出版社,2003:302-305.Institute of Cotton Research of Chinese Academy of Agricultural Science.Genetics and breeding of cotton in China[M].Jinan: Shandong Science and Technology Press,2003:302-305.
[2]Handa H,Ohkawa Y,Nakajima K.Mitochondrial genome of rapeseed (Brassica napusL.).1.Intraspecific variation of mito chondrial DNA[J].Japanese Journal of Genetics,1990,65:17-24.
[3]Huang Wei,Wang Li,Yi Ping,et al.RFLP analysis for mitoch ondrial genome of CMS-rice[J].Acta Genetica Sinica,2006,33 (4):330-338.
[4]Hanson M R.Plant mitochondrial mutations and male sterility[J].Annual Review of Genetics,1991,25:461-486.
[5]Ivanov M K,Dymshits G M.Cytoplasmic male sterility and restoration of pollen fertility in higher plants[J].Genetika,2007, 43(4):451-468.
[6]Sloan D B,Alverson A J,Chuchalovcak J P,et al.Rapid evolution of enormous,multichromosomal genomes in flowering plant mitochondria with exceptionally high mutation rates[J].PLoS Biology,2012,10(1):e1001241 (2012-01-17)[2016-06-20].http://dx.plos.org/10.1371/journal.pbio.1001241.
[7]肖莉莉,黄原.线粒体DNA复制及其调控[J].中国生物化学与分子生物学报,2006,22(6):435-441.Xiao Lili,Huang Yuan.Mitochondrial DNA replication and its regulation[J].Chinese Journal of Biochemistry and Molecular Biology,2006,22(6):435-441.
[8]Levings C S.The Texas cytoplasm of maize:cytoplasmic male sterility and disease susceptibility[J].Science,1990,250(4983): 942-947.
[9]Mower J P,Palmer J D.Patterns of partial RNA editing in mitochondrial genes ofBeta vulgaris[J].Molecular Genetics and Genomics,2006,276:285-293.
[10]Dewey R E,Timothy D H,Levings C S.A mitochondrial protein associated with cytoplasmic male sterility in the T cytoplasm of maize[J].Proceedings of the National Academy of Sciences of USA,1987,84:5374-5378.
[11]Hack E,Lin C,Yang H,et al.T-URF 13 protein from mitochondria of Texas male-sterile maize(Zea maysL.):Its purification and submitochondrial localization,and immunogold labeling in anther tapetum during microsporogenesis[J].Plant Physiology, 1991,95(3):861-870.
[12]Iwabuchi M,Koizuka N,Fujimoto H,et al.Identification and expression of the kosena radish(Raphanus sativuscv.Kosena) homologue of the ogura radish CMS-associated gene,orf138[J].Plant Molecular Biology,1999,39:183-188.
[13]Moneger F,Smart C J,Leaver C J.Nuclear restoration of cytoplasmic male sterility in sunflower is associated with the tissue-specific regulation of a novel mitochondrial gene[J].EMBO Journal,1994,13(1):8-17.
[14]Akagi H,Sakamoto M,Shinjyo C,et al.A unique sequence located downstream from the rice mitochondrialatp6 may cause male sterility[J].Current Genetics,1994,25:52-58.
[15]Handa H,Gualberto J M,Grienenberger J M.Characterization of the mitochondrialorfB gene and its derivative,orf224,a chimeric open reading frame specific to one mitochondrial genome of the"Polima"male-sterile cytoplasm in rapeseed (Brassica napusL.)[J].Current Genetics,1995,28(6):546-552.
[16]Kim D H,Kang J G,Kim B D.Isolation and characterization of the cytoplasmic male sterility-associatedorf456 gene of chili pepper(Capsicum annuumL.)[J].Plant Molecular Biology, 2007,63:519-532.
[17]Song J,Hedgcoth C.A chimeric gene(orf256)is expressed as protein only in cytoplasmic male-sterile lines of wheat[J].Plant Molecular Biology,1994,26(1):535-539.
[18]王学德.细胞质雄性不育棉花线粒体蛋白质和DNA的分析[J].作物学报,2000,26(1):35-39.Wang Xuede.Analyses of mitochondrial protein and DNA from cytoplasmic male sterile cotton[J].Acta Agronomica Sinica, 2000,26(1):35-39.
[19]李双双,刘国政,陈志文,等.哈克尼西棉细胞质陆地棉雄性不育系orf160的克隆及遗传转化[J].作物学报,2013,39(9): 1538-1547.Li Shuangshuang,Liu Guozheng,Chen Zhiwen,et al.A uniqueorf160 cloning and genetic transformation ofGossypium harknessiicytoplasmic male sterile line in upland cotton[J].Acta A-gronomica Sinica,2013,39(9):1538-1547.
[20]黄晋玲.棉花晋A细胞质雄性不育系的遗传研究[D].太谷:山西农业大学,2003.Huang Jinling.Genetic study on Jin A cytoplasmic male sterile line in cotton(Gossypium)[D].Taigu:Shanxi Agricultural University,2003.
[21]张晓,张锐,史计,等.陆地棉胞质雄性不育系与保持系线粒体基因组RFLP分析[J].中国农业科学,2012,45(2):208-217.Zhang Xiao,Zhang Rui,Shi Ji,et al.RFLP analysis of mitochondrial genomes between cytoplasmic male sterile line and maintainer line in upland cotton[J].Scientia Agricultura Sinica, 2012,45(2):208-217.
[22]巩养仓.棉花细胞质雄性不育相关线粒体基因筛选[D].北京:中国农业科学院,2008.Gong Yangcang.Screening of mitochondrial genes associated with cytoplasmic male sterility in cotton[D].Beijing:Chinese Academy of Agricultural Sciences,2008.
[23]Carlsson J,Leino M,Sohlberg J,et al.Mitochondrial regulation of flower development[J].Mitochondrion,2008,8(1):74-86.
[24]Hanson M R,Bentolila S.Interactions of mitochondrial and nuclear genes that affect male gametophyte development[J].Plant Cell,2004,16(Suppl):154-169.
[25]Fujii S,Toriyama K.Genome barriers between nuclei and mitochondria exemplified by cytoplasmic male sterility[J].Plant and Cell Physiology,2008,49(10):1484-1494.
[26]宋国立,崔荣霞,王坤波,等.改良CTAB法快速提取棉花DNA[J].棉花学报,1998,10(5):273-275.Song Guoli,Cui Rongxia,Wang Kunbo,et al.A rapid improved CTAB method for extraction of cotton genomic[J].Cotton Science,1998,10(5):273-275.
[27]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3版.黄培堂,译.北京:科学出版社,1993:492-498.Sambrook J,Rusell D W.Molecular cloning:A laboratory manual[M].3rded.Translated by Huang Peitang.Beijing:Science Press,1993:492-498.
[28]潘瑞炽.植物生理学[M].北京:高等教育出版社,2004:108-110.Pan Ruichi.Plant physiology[M].Beijing:Higher Education Press,2004:108-110.
[29]李传友,王斌.小麦K型及V型细胞质雄性不育系线粒体DNA的比较分析[J].植物生理学报,1998,24(2):153-158.Li Chuanyou,Wang Bin.Mitochondrial DNAs of cytoplasmic male sterile lines of K-and V-type in wheat[J].Acta Phytophysiologica Sinica,1998,24(2):153-158.
[30]Ashutosh,Kumar P,Kumar V D,et al.A novelorf108 co-transcribed with the atpA gene is associated with cytoplasmic male sterility inBrassica junceacarryingMoricandia arvensiscytoplasm[J].Plant and Cell Physiology,2008,49(2):284-289.
[31]段继强,李建永,杜光辉,等.苎麻线粒体基因coxⅡ和atpA与细胞质雄性不育相关性分析[J].中国农业科学,2009,42 (2):434-445.Duan Jiqiang,Li Jianyong,Du Guanghui,et al.Relationship of mitochondrial genescoxⅡandatpA with cytoplasmic male sterility in Ramie[J].Scientia Agricultura Sinica,2009,42(2): 434-445.
[32]Osada N,Akashi H.Mitochondrial-nuclear interactions and accelerated compensatory evolution:Evidence from the primate cytochrome C oxidase complex[J].Molecular Biology and Evolution,2012,29(1):337-346.
Polymorphism Analysis of Mitochondrial Genes Associated Cytoplasmic Male Sterility in Cotton(Gossypium harknessiiBrandegee)
Gong Yangcang1,Zhang Xuelin1,Wu Jianyong2,Zhang Xingping1,Peng Fanjia1,Zhang Zhigang1,He Yunxin1, Mei Zhengding1,Zhou Degui1,Xing Chaozhu2*
(1.Hunan Cotton Research Institute,Changde,Hunan415101,China;2.State Key Laboratory of Cotton Biology/Institute of Cotton Research of the Chinese Academy of Agricultural Sciences,Anyang,Henan455000,China)
[Objective]Cytoplasmic male sterility (CMS)is closely associated with the mitochondrial genome.The aim of this study was to identify CMS-related mitochondrial genes in cotton.[Method]Ten mitochondrial gene probes(i.e.,atpA,atp6,atp9,cob,coxI,coxII,coxIII,nad3,nad6,andnad9)were used to analyze restriction fragment length polymorphisms in aGossypium harknessiiBrandegee cytoplasmic male sterile line(S),maintainer line(F),and hybrid(H).[Result]Ten probe/enzyme combinations for four probes(i.e.,atpA,coxIII,nad3,andnad6)revealed polymorphisms among lines S,F,and H.All enzyme digestions for two probes(i.e.,atpA andnad6)displayed the polymorphisms in three lines,with the same patterns for lines S and H.ForatpA,theEcoR I digestion revealed two fragments in the three lines.The 2.2 kb fragment was common to all three lines,while the second fragment was 3.2 kb in lines S and H,but 4.8 kb in line F.TheatpA/PstI combination produced a 17.0 kb fragment in lines S and H,but a 10.2 kb fragment in line F.Fornad6,one or two additional fragments of the same length were detected in lines S and H,while line F had more than two additional fragments.WithcoxIII as a probe,theEcoR I digestion resulted in a 2.5 kb fragment in three lines,as well as a 1.7 kb fragment in lines F and H,but not in line S.With thenad3 probe,the same patternswere observed for lines S and F,while the pattern for line H differed because of a lack of a 9.5 kb fragment.[Conclusion]BothatpA andnad6 are involved in regulating the development of CMS,whilecoxIII andnad3 may be regulated by nuclear genes to help restore fertility in cytoplasmic male sterile lines.
cotton;cytoplasmic male sterility;mitochondrial genes;restriction fragment length polymorphism
S562.03
A
1002-7807(2017)04-0327-09
10.11963/1002-7807.gycxcz.20170630
2016-07-04
巩养仓 (1981―),男,副研究员,硕士,mksgyc@163.com。*通信作者:chaozhuxing@126.com
国家科技重大专项——转基因生物新品种培育(2014ZX08005001-007);国家科技支撑计划——棉花种质资源发掘与创新利用(2013BAD01B03-05)

