仰韶陶融型白酒大曲可培养微生物多样性研究
樊建辉,侯建光,郭福祥,陈蒙恩,杨方玉,陈文强*
(1.河南仰韶酒业有限公司,河南渑池472400;2.陕西理工大学生物工程与科学学院,陕西汉中723001)
仰韶陶融型白酒大曲可培养微生物多样性研究
樊建辉1,侯建光1,郭福祥1,陈蒙恩1,杨方玉1,陈文强2*
(1.河南仰韶酒业有限公司,河南渑池472400;2.陕西理工大学生物工程与科学学院,陕西汉中723001)
研究陶融型白酒大曲可培养微生物的多样性。采用组织培养方法分离陶融型白酒大曲的微生物,提取分离菌株DNA,用酵母通用引物NL1/NL4、细菌通用引物799F/1492R和真菌通用引物ITS1/ITS4对酵母26S rRNA、细菌16S rRNA、霉菌28S rRNA序列扩增,提交测序分析,构建系统发育树。仰韶陶融型白酒大曲酒曲中共分离到酵母213株、细菌386株、霉菌73株,酵母归分为72株形态种,细菌归分为77株形态种,霉菌归分为7株形态种,根据测序结果不同,陶融型白酒大曲微生物被分为21个分类单元。仰韶陶融型白酒大曲可培养微生物具有多样性特征,为其发酵及开发利用提供理论参考。
陶融型白酒;大曲;微生物多样性;系统发育树
大曲在我国白酒酿造中起着重要的作用,作为白酒的酿造动力源,首先为白酒酿造提供了大量的酶类以及香味生成基础物质[1],同时也为白酒酿造提供了大量产香微生物,其中含有丰富的兼性可培养微生物,对白酒中脂类、醛类、醇类等有机物的形成有着直接作用[2-3],并且大曲对白酒的风味形成也至关重要[4-6]。目前有关大曲的研究已经取得很大成果,如YAO S等[7]从山东扳倒井高温大曲中分离到一株高温放线菌属新种H-18T;XIONG X M等[8]对白云边手工制作大曲和机器制作大曲研究发现,两者微生物的优势种属和Shannon指数基本相同,机器制作大曲完全可以代替手工制作大曲;SHI J H等[9]对汾酒大曲研究中发现,放线菌目和乳杆菌目只在大曲表皮部被分离到,芽孢杆菌目主要存在于大曲内部,真菌主要分布于大曲表皮部;黄晓宁等[10]对同一酒厂酱香型和浓香型两种大曲微生物研究发现,两者大曲在真菌种属差异性很大,细菌差异性较小。仰韶陶融型白酒大曲是由小麦、豌豆以及大麦为原料,经过大曲成型、曲房培养、大曲后熟三个阶段而成。仰韶陶融型白酒大曲在整个形成过程中属于开放式接种培养,增加了仰韶陶融型白酒大曲微生物的多样性。
陶融型白酒是我国第十三种香型白酒[11],以浓香型、酱香型、清香型、芝麻香型于一体的创新型香型白酒,其酒体香气优雅、细腻,口感醇厚丰满、余味净爽的特点而被广大消费者喜爱[12]。目前有关陶融型白酒大曲微生物多样性研究,国内鲜有报道。本次研究以陶融白酒发酵使用的大曲为材料,研究陶融白酒大曲中微生物的多样性和菌落分布,以便为陶融型白酒的发酵提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
仰韶陶融型白酒大曲由河南仰韶酒业有限公司提供,将样品放入无菌保藏管中,置于4℃冰箱保存备用。
1.1.2 主要试剂
葡萄糖、MgSO4·7H2O、KH2PO4(均为分析纯):国药集团化学试剂有限公司;琼脂粉:北京奥博星生物技术有限公司;2×TapPCR Master Mix、BioSpin试剂盒:西安热摩尔公司;T-19载体、DH5α感受态细胞:TAKARA公司;酵母DNA基因组快速提取试剂盒、溴酚蓝、DL2000DNAMarker、Tris平衡酚、接触酶、氧化酶、木糖、甘露醇、阿拉伯糖、淀粉、明胶、H2S、吲哚、丙二酸盐、孟加拉红培养基、纳他霉素、氨苄青霉素、引物等:上海生物工程有限公司。
1.1.3 培养基
(1)细菌分离培养基:葡萄糖15 g/L,胰蛋白胨5 g/L,牛肉膏5g/L,NaCl5g/L,纳他霉素1g/L,琼脂粉12g/L,pH7.0。
(2)酵母分离培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,豆芽200 g/L,氨苄青霉素1 g/L,琼脂粉12 g/L,pH 6.0。
(3)霉菌分离培养基:去皮马铃薯200g/L,葡萄糖20g/L,蛋白胨0.5g/L,KH2PO45g/L,MgSO4·7H2O3g/L,VB10.1g/L,琼脂粉12 g/L,氨苄青霉素1 g/L,pH自然。
1.2 仪器与设备
GT9611PCR仪:杭州晶格科学仪器有限公司;SF-CJ-2净化工作台:上海三发科学仪器有限公司;WD-9403A型紫外分光光度仪:北京六一生物科技有限公司:HYG-B全温摇瓶柜:苏州培英实验设备有限公司;1-14SIGMA高速台式离心机:美国SIGMA公司;LPZM-80KCS-Ⅱ立式压力蒸汽灭菌器:上海申安医疗器械厂;eppendorf移液器:德国Eppendorf公司。
1.3 方法
1.3.1 菌株的分离和纯化
称取仰韶陶融适量大曲,将其彻底粉碎,溶于无菌水中,分别置于28℃和37℃恒温摇床中预培养2 h。采用梯度稀释法,将预培养样品分别稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7,将大曲按照梯度稀释,经过预培养,吸取10-5梯度样品1 mL涂布于霉菌分离培养基,吸取10-7梯度样品1 mL涂布于酵母和细菌分离培养基,放入恒温培养箱中培养。细菌分离培养基置于37℃恒温培3 d,酵母和霉菌分离培养基置于28℃恒温培5~7 d,挑取平板上形态特征不同的单菌落,通过划线纯化,并接种于斜面(4℃)保藏和甘油冷冻(-80℃)保藏。
1.3.2 仰韶陶融大曲微生物形态学鉴定
根据分离真菌菌落形态特征,采用插片法对菌株菌丝,孢子及产孢结构,进行显微形态结构观察,进行分类鉴定。将分离到的细菌依照菌落形态特征,参照《常见细菌系统鉴定手册》,对待鉴定细菌进行生理生化指标检测。
1.3.3 DNA的提取和PCR扩增测序
使用酵母DNA基因组快速提取试剂盒提取酵母基因组DNA,改良冻融法[13]提取细菌基因组DNA,十六烷基三甲基澳化铵(hexadecyltrimethylammonium bromide,CTAB)法[14]提取霉菌DNA。用酵母通用引物NL1/NL4[15]扩增26S rRNA基因片段,细菌通用引物799F/1492R[16]扩增16S rRNA基因片段,霉菌通用引物ITS1/ITS4[13]扩增ITS基因片段。细菌聚合酶链式反应(polymerasechainreaction,PCR)反应体系和扩增程序参照参考文献[15],酵母PCR反应体系和扩增程序参照参考文献[16],霉菌PCR反应体系和扩增程序参照参考文献[17]。将PCR产物经1.2%琼脂糖凝胶电泳检测,切胶回收纯化PCR产物,连接T-19载体,并转化到DH5α感受态细胞中,挑取阳性克隆子送上海杰李生物公司测序。
1.3.4 分离菌株的系统发育分析
将所得序列提交GenBank数据库中进行BLAST检索,整理修剪所测序列,提交NCBI,并索取序列登录号。下载同源性较高的数据,生成Fasta格式文件。用Clusta-X[18]软件对序列进行比对及人工校正,利用Mega5.1[19]软件构建邻接法(neighbor-joining,NJ)系统发育树[20],Bootstrap值设置为1000。
2 结果与分析
2.1 大曲微生物的分离和纯化
将分离到的菌株菌落,通过多次划线纯化挑取,并接种于平板培养基中。从仰韶陶融大曲中总共分离到672株菌,其中真菌286株菌,细菌386株菌。经过菌落形态特征排重,结果表明,共分离到156株菌形态种,包括细菌77株、酵母菌72株、霉菌7株。
2.2 仰韶陶融大曲微生物的鉴定
2.2.1 大曲微生物形态学观察
(1)真菌
将分离纯化到的菌株接种到孟加拉红平板培养基上,观察部分菌株的形态特征(见图1),依据真菌分类鉴定手册[21],初步确定分离真菌菌株分类地位,结果见表1。

图1 部分陶融型大曲可培养真菌形态特征Fig.1 Part morphological characters of culturable fungi in Pottery-flavorBaijiuDaqu

表1 部分陶融型大曲可培养真菌的形态特征及分类学地位Table 1 Part morphological features and taxonomic status of culturable fungi in Pottery-flavorBaijiuDaqu
由表1可知,接合菌亚门分离到2株菌,毛霉属(Mucor)和根霉属(Rhizopus)各1株,担子菌亚门分离到1株,只有锁掷酵母属(Sporobolomyces)1株菌,子囊菌亚门分离到76株菌,其青霉属(Penicillium)、翘孢霉属(Emericella)、有孢圆酵母属(Torulaspora)及季也蒙酵母属(Meyerozyma)各分离到1株,伊萨酵母属(Issatchenkia)和假丝酵母属(Candida)2株,曲霉属(Aspergillus)分离到3株,地丝菌属(Geotrichum)4株,覆膜孢酵母属(Saccharomycopsis)6株,酵母属(Saccharomyces)8株,毕赤酵母属(Pichia)18株,异常维克汉姆酵母属(Wickerhamomyces)29株。
(2)细菌
壁厚菌门共分离到54株细菌,其中杆菌属(Bacillus)51株:菌落大小一致,边缘多整齐,菌落多为白色。短小杆菌属(Brevibacillus)3株:菌落大小一致,边缘多整齐,菌落多为乳白色。变形菌门共分离到23株菌,其中假单胞菌属(Pseudomonas)20株,菌落边缘多为不规则状,菌落颜色多为棕色。泛菌属1株,菌落乳白色,边缘整齐。肠杆菌属1株:菌落大小整齐,表面光滑,边缘整齐,菌落颜色为灰白色。克洛诺菌属1株,菌落大小整齐,表面光滑,边缘整齐,菌落颜色为白色。
2.2.2 大曲微生物生理生化鉴定
依据细菌形态学特征和《伯杰细菌鉴定手册》[22],将分离到的细菌全部进行生理生化特征鉴定,部分代表菌株的鉴定结果见表2。
由表2可知,菌株YSB03和YSB54革兰氏反应呈阳性,其余为阴性;除菌株YSB09外,其余菌株的接触酶试验、葡萄糖产酸试验、甘露醇试验、吲哚试验、甲基红试验结果均为阳性;除菌株YSB03外,其余菌株的氧化酶反应均为阴性;菌株YSB27和YSB44木糖反应为阳性,其余为阴性;菌株YSB03、YSB09、YSB54的阿拉伯糖试验为阴性,其余为阳性;菌株YSB03、YSB27、YSB74的淀粉试验反应呈阴性,其余为阳性;菌株YSB09和YSB44的明胶反应呈阴性;所有菌株的H2S反应均呈阴性;除菌株YSB44外,其他菌株的丙二酸盐反应呈阴性;菌株YSB27和YSB74的VP试验呈阳性,其他菌株试验结果呈阴性。

表2 部分细菌的生理生化特性Table 2 Physiological and biochemical characteristics of part bacteria

图2 陶融型大曲可培养微生物基因片段的部分PCR扩增电泳图Fig.2 Part PCR amplification electrophoretogram of gene fragments of culturable microorganism in Pottery-flavorBaijiuDaqu
2.2.3 大曲微生物菌株PCR扩增结果通过酵母DNA提取试剂盒获得酵母DNA,用引物NL1/NL4对酵母26S rRNA序列扩增,1.2%琼脂糖凝胶电泳检测菌株PCR产物结果见图2。由图2可知,得到600 bp大小片段(图2a);采用CTAB法提取分离纯化后霉菌DNA,使用引物ITS1/ITS4对霉菌ITS序列进行扩增,得到600 bp大小的片段(图2b);采用冻融法提取分离到细菌DNA,使用引物799F/1492R对细菌16S rRNA序列扩增,得到750 bp大小的片段(图2c)。
2.2.4 分离菌株系统发育进化树分析
所测菌株的序列在NCBI数据中BLAST结果比对,选取排在比对结果前面的部分同源序列构建系统发育树,结果见图3、图4。
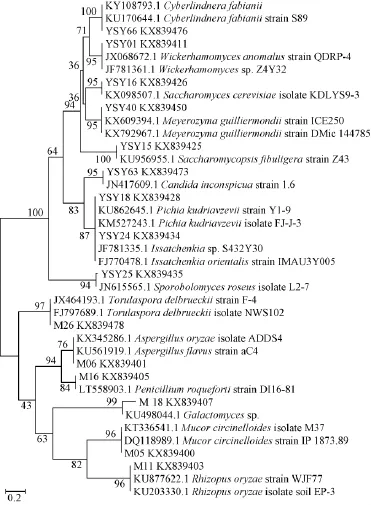
图3 陶融型大曲可培养真菌的系统发育树Fig.3 Phylogenetic tree of culturable fungi from Pottery-flavor BaijiuDaqu
由图3可知,真菌被归分为3个类群,接合菌亚门(Zygomycotina)包含Mucor、Rhizopus属2个分类单元,所占类群为9.5%,担子菌亚门(Basidiomycotina)包含Sporobolomyces属1个分类单元,所占类群为4.8%,子囊菌亚门(Ascomycotina)包含Aspergillus、Penicillium、Emericella、Wickerhamomyces、Saccharomycopsis、Saccharomyces、Issatchenkia、Torulaspora、Pichia、Meyerozyma、Candida、Geotrichum属12个分类单元,所占类群为57.1%,为最优势类群。

图4 陶融型大曲可培养细菌的系统发育树Fig.4 Phylogenetic tree of culturable bacteria from Pottery-flavor BaijiuDaqu
由图4可知,以菌株StreptomycesparvusNBRC3388(T)为外群建树,细菌被归分为2个类群,壁厚菌门(Firmicutes)包含Bacillus、Brevibacillus属2个分类单元,所占类群为9.5%,变形菌门(Proteobscteria)包含Pseudomonas、Pantoea、Escherichia、Cronobacter属4个分类单元,所占类群为19.0%。
2.3 大曲微生物多样性分析
通过形态学和分子生物学鉴定,仰韶陶融型大曲中共分离到可培养微生物156株,其中杆菌属(Bacillus)51株,约占32.70%;异常维克汉姆酵母属(Wickerhamomyces)29株,约占18.60%;假单胞菌属(Pseudomonas)20株,约占12.82%;毕赤酵母属(Pichia)18株,约占11.54%;酵母属(Saccha romyces)8株,约占5.13%;覆膜孢酵母属(Saccharomycopsis)6株,约占3.85%;地丝菌属(Geotrichum)4株,约占2.56%;短小杆菌属(Brevibacillus)和曲霉属(Aspergillus)均占1.92%(3株),伊萨酵母属(Issatchenkia)和假丝酵母属(Candida)均占1.28%(2株),泛菌属(Pantoea)、肠杆菌属(Escherichia)、克洛诺菌属(Cronobacter)、青霉属(Penicillium)、翘孢霉属(Emericella)、毛霉属(Mucor)、根霉属(Rhizopus)、锁掷酵母属(Sporobolomyces)、有孢圆酵母属(Torulaspora)及季也蒙酵母属(Meyerozyma)均占0.64%,分离菌株均为1株。
3 结论
本次通过纯培养方法分离仰韶陶融型大曲微生物,分离到77株细菌,72株酵母菌,7株霉菌。经系统发育学分析细菌被鉴定为6属,包括:51株杆菌属(Bacillus),3株菌短小杆菌属(Brevibacillus),20株菌假单胞菌属(Pseudomonas),泛菌属(Pantoea)、肠杆菌属(Escherichia)和克洛诺菌属(Cronobacter)均分离到1株菌;其中杆菌属(Bacillus)为第一优势菌属,假单胞菌属(Pseudomonas)为第二优势菌属。
真菌被鉴定为15属,包括:异常维克汉姆酵母属(Wickerhamomyces)29株,毕赤酵母属(Pichia)18株,酵母属(Saccharomyces)8株,覆膜孢酵母属(Saccharomycopsis)6株,地丝菌属(Geotrichum)4株,曲霉属(Aspergillus)3株,伊萨酵母属(Issatchenkia)和假丝酵母属(Candida)均分离到2株菌,青霉属(Penicillium)、翘孢霉属(Emericella)、毛霉属(Mucor)、根霉属(Rhizopus)、锁掷酵母属(Sporobolomyces)、有孢圆酵母属(Torulaspora)及季也蒙酵母属(Meyerozyma)均分离到1株菌,真菌物种多样性丰富,真菌第一优势菌属为异常维克汉姆酵母属(Wickerhamomyces),其中酵母菌的菌属为主要菌属,占真菌种属的73.3%。
[1]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-A traditional Chinese liquor fermentation starter[J].J Inst Brew,2011,117(1):82-90.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:45-81.
[3]WU Q,XU Y,CHEN L.Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J].Lett Appl Microbiol,2012,55(4):301-307.
[4]LE V D,ZHENG X W,CHEN J Y,et al.Characterization of volatile compoundsinFen-Daqu-a traditional Chinese liquor fermentation starter [J].J Inst Brew,2012,118(1):107-113.
[5]申孟林.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[6]闫宗科,冯亚芳,孟勤燕,等.西凤酒大曲可培养微生物多样性及理化指标研究[J].酿酒,2015,42(3):36-41.
[7]YAO S,LIU Y,ZHANG M,et al.Thermoactinomyces daqussp.nov.a thermophilic bacterium isolated from high-temperature Daqu[J].Int J Syst Evol Microb,2014,64(1):206-210.
[8]XIONG X M,HU Y,YAN N,et al.PCR-DGGE analysis of the microbial communities in three different Chinese"Baiyunbian"liquor fermentation starters[J].J Microbiol Biotechn,2014,24(8):1088-1095.
[9]SHI J H,XIAO Y P,LI X R,et al.Analyses of microbial consortia in the starter of Fen liquor[J].Lett Appl Microbiol,2009,48(4):478-485.
[10]黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[11]龙晓,王静.仰韶“陶香”开创中国白酒新纪元[J].新食品,2013(17):172.
[12]侯建光,韩素娜,樊建辉,等.应用HS-SPME和GC-MS浅析陶香型白酒中挥发性成分[J].酿酒,2016,43(3):37-40.
[13]冯广达,陈美标,羊宋贞,等.用于PCR扩增的细菌DNA提取方法比较[J].华南农业大学学报,2013,34(3):439-442.
[14]ZHANG D,YANG Y,CASTLEBURY L A,et al.A method for the large scale isolation of high transformation efficiency fungal genomic DNA [J].FEMS Microbiol Lett,1996,145(2):261-265.
[15]ARIAS C R,BURNS J K,FRIDERICH L M,et al.Yeast species associated with orange juice:evaluation of different identification methods[J]. Appl Environ Microbiol,2002,68(4):1955-1961.
[16]张晶晶,兰阿峰,邓百万,等.红豆杉免培养内生细菌多样性的初步研究[J].微生物学通报,2013,40(5):766-774.
[17]HUANG Y,WU Q,XU Y.Isolation and identification of a black Aspergillus,strain and the effect of its novel protease on the aroma of Moutai-flavoured,liquor[J].J Inst Brew,2014,120(3):268-276.
[18]THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The Clustal X windows interface:flexible strategies for multiple sequence alignment aided byqualityanalysis tools[J].Nucl Acid Res,1997,24:4876-4882.
[19]樊永军,赵艳玲,陈秀莉,等.2种块菌的物种分子鉴定与系统地位分析[J].西北植物学报,2016,36(8):1560-1565.
[20]SAITOU N,NEI M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4:406-425.
[21]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:58-346. [22]布坎南.伯杰细菌鉴定手册[M].北京:科学出版社,1984:274-795.
Microbial diversity of culturable microorganism from Yangshao pottery-flavorBaijiuDaqu
FAN Jianhui1,HOU Jianguang1,GUO Fuxiang1,CHEN Mengen1,YANG Fangyu1,CHEN Wenqiang2*
(1.He′nan Yangshao Liquor Industry Co.,Ltd.,Mianchi 472400,China;2.School of Biological Science and Engineering, Shaanxi University of Technology,Hanzhong 723001,China)
The diversity of culturable microorganism in Pottery-flavorBaijiu(Chinese liquor)Daqu was studied.The Daqu microorganisms in PotteryflavorBaijiuwere isolated by tissue culture method.When microbial DNA was extracted,yeast universal primers NL1/NL4 was used for 26S rRNA sequences amplification,bacteria universal primer 799F/1492R was used for 16S rRNA sequences amplification,mold universal primer ITS1/ITS4 was used for 28S rRNA sequences amplification,the sequences were analyzed and results were submitted,to construct phylogenetic tree.Results showed that there were 213 yeasts,386 bacteria and 73 mould strains isolated from Pottery-flavorBaijiuDaqu,including 72 yeasts species,77 bacteria species,and 7 moulds species.Based on sequencing results,the isolated strains were classified into 21 operational taxonomic units(OUTs).The culturable microorganism in Yangshao Pottery-flavorBaijiuDaqu had microbial diversity,which provided theoretical foundation for fermentation and utilization.
Pottery-flavorBaijiu;Daqu;microbial diversity;phylogenetic tree
TS261
0254-5071(2017)07-0071-05
10.11882/j.issn.0254-5071.2017.07.016
2017-03-03
樊建辉(1976-),男,工程师,大专,主要从事白酒酿造工艺的研究工作。
*通讯作者:陈文强(1956-),男,教授,本科,主要从事微生物资源的保护与利用工作。

