甲状腺癌靶向化疗进展
靳雨辰 综述,陈立波 审校
上海交通大学附属第六人民医院核医学科,上海 200233
甲状腺癌靶向化疗进展
靳雨辰 综述,陈立波 审校
上海交通大学附属第六人民医院核医学科,上海 200233

陈立波,留德医学博士,上海交通大学附属第六人民医院核医学科主任医师、教授、博士研究生导师,核医学研究室副主任,上海市抗癌协会甲状腺肿瘤专业委员会委员,中国临床肿瘤学会(CSCO)甲状腺癌专业委员会副主任委员。曾任德国海德堡大学与德国癌症研究中心客座科学家、横滨市立大学客座研究员。曾获世界核医学与生物学联盟“杰出贡献奖”、日本核医学会“亚洲青年研究者奖”、上海市“医学科技奖”、上海市“科技启明星”等奖项和荣誉。主持国家自然科学基金、上海市科技启明星计划等科研课题6项,临床和研究方向为甲状腺疾病的诊治和肿瘤分子影像诊断。以第一作者或通信作者在Thyroid、J Nucl Med及J Clin Endocrinol Metab等专业期刊上发表20余篇甲状腺疾病诊治临床和基础研究的SCI论文。
由于传统治疗方法疗效所限,晚期甲状腺癌患者的死亡风险居高不下。近年来,靶向化疗在抑制甲状腺癌生长及延长患者无进展生存期上显示出良好的疗效,但也带来了一些临床困惑。该文综述了激酶抑制剂在甲状腺癌靶向化疗中的应用现状及面临的临床问题,更新甲状腺癌的治疗策略并提出未来的研究方向。
甲状腺癌;靶向化疗;激酶抑制剂
据美国国立癌症研究所监测、流行病学和结果(Surveillance, Epidemiology and End Results,SEER)数据库统计,2016年美国甲状腺癌新发病例达64 300例,1 980例患者因甲状腺癌死亡[1]。和许多其他国家相似,在过去的近20年里,中国甲状腺癌的发病率也出现了持续快速的增长[2]。从组织病理学上,分化型甲状腺癌(differentiated thyroid carcinoma,DTC)约占95%,甲状腺髓样癌(medullary thyroid carcinoma,MTC)占2%~5%,另外1%~3%为甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)[3]。大多数DTC患者可采用手术、促甲状腺激素(thyroid stimulating hormone,TSH)抑制及放射性碘(radioactive iodine,RAI)进行治疗。而MTC和ATC并非分化型甲状腺滤泡细胞,因而无法进行RAI治疗,主要依赖于手术治疗[3-5]。
在预后方面,虽然大多数DTC患者的预后良好,5年总生存率可达97.8%[3],但仍有5%~15%的DTC由于失去摄碘功能而成为放射性碘难治性DTC(radioactive iodine refractory-DTC,RR-DTC),此类患者的5年生存率为66%,10年生存率仅为10%[6-8]。其中,伴有远处转移的RR-DTC患者的存活时间仅为2.5~3.5年[6,9]。晚期RR-DTC构成了甲状腺癌相关死亡病例的主要部分[3]。未分化或间变性甲状腺癌恶性程度最高,其5年总生存率小于5%[5,10-11]。MTC的预后与DTC相似,缺乏有效且持久的系统治疗是晚期MTC和DTC生存率低的主要原因[12]。1974年,美国批准多柔比星用于治疗晚期甲状腺癌,该药物随即成为此类患者标准系统治疗模式,但其临床疗效十分有限且不良反应显著限制了其在临床上的广泛应用[13-15]。
随着甲状腺癌分子病理机制研究的不断深入,以激酶抑制剂为代表的靶向化疗逐步在晚期甲状腺癌的治疗中得到越来越广泛的应用,该技术的出现标志着甲状腺癌治疗跨入了新时代。目前认为,进展性复发或转移性RR-DTC患者可考虑接受分子靶向药物治疗(图1)。但新治疗方式在取得疗效的同时,也带来了适应证、治疗时机、对总生存的影响及靶向化疗策略的优化等关乎其未来研究方向的诸多问题。
在作用机制方面,靶向化疗主要通过抑制肿瘤血管生成或抑制肿瘤细胞增殖及存活而发挥其治疗作用。肿瘤生长依赖于血管形成向肿瘤组织提供营养物质。血管内皮生长因子(vascular endothelial growth factor,VEGF)驱动肿瘤血管形成,并与肿瘤大小和预后差相关。血小板衍生生长因子(platelet derived growth factor,PDGF)在血管形成中起辅助作用。多靶点化疗药大多可抑制VEGF和PDGF,从而抑制血管形成并截断肿瘤血供。靶向化疗也可以干扰丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和磷脂酰肌醇3激酶(phosphoinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)途径调节肿瘤细胞信号通路并控制其增殖和存活[6]。
根据文献检索结果,用于治疗进展性晚期RR-DTC、MTC和ATC的靶向化疗药物主要包括凡德他尼、卡博替尼、索拉非尼、乐伐替尼、阿昔替尼、帕唑帕尼、舒尼替尼、司美替尼、伊马替尼、莫特塞尼、达拉非尼和维罗非尼等。其中,凡德他尼、卡博替尼、索拉非尼和乐伐替尼治疗晚期甲状腺癌的适应证已通过美国食品药品监督管理局(Food and Drug Administration,FDA)等相关机构的批准,而其他靶向化疗药物仍处于研究中。现就不同组织病理类型甲状腺癌的靶向化疗的疗效和不良反应等进行综述。

图1 晚期甲状腺癌的诊治流程Fig. 1 Algorithm for the management of advanced thyroid cancer
1 RR-DTC
RR-DTC是目前甲状腺癌治疗领域的主要难题之一,RR-DTC患者常伴有广泛转移灶而无法采用局部治疗手段[16]。当患者出现咯血、呼吸困难及疼痛等症状或病情快速进展(通常定义为14个月内)时建议进行靶向化疗。
1.1 索拉非尼
索拉非尼是一种多激酶抑制剂,可抑制的靶点包括VEGF受体(VEGF receptor,VEGFR)、PDGF受体(PDGF receptor,PDGFR)、RET和RAF[17]。它是第1个获得FDA批准用于治疗RR-DTC的靶向化疗药(2013年),疗效显著且不良反应较低[18-22]。在1项纳入417例患者的Ⅲ期临床随机对照试验中[23],索拉非尼组的中位无进展生存期(progression free survival,PFS)达10.8 个月,而安慰剂组仅为5.8个月,疾病进展或死亡风险降低约41%(HR=0.59,95%CI:0.45~0.76,P<0.000 1)。索拉非尼组的客观反应率(objective response rate,ORR)为12.2%,而安慰剂组仅为0.5%( P<0.000 1)。64%的患者因不良反应而减量,其中手足皮肤反应和腹泻最常见。其他严重不良反应包括高血压(9.7%)、体质量减轻(5.8%)、疲劳(5.8%)和低钙血症(9.2%)。此外,33%的患者在治疗过程中出现血清促甲状腺激素(thyroid stimulating hormone,TSH)升高,18.8%的患者出现药物戒断不良反应。4.3%的治疗组患者出现继发恶性肿瘤(皮肤鳞状细胞癌最常见),而安慰剂组仅为1.9%。
此外,1项Ⅱ期临床研究评价了索拉非尼诱导RR-DTC再分化的作用。该研究共纳入32例患者,尽管经26周的治疗后有19例患者(59%)取得临床获益,但对21例患者进行诊断性碘扫后发现所有远处转移灶均无RAI的再摄取表现[24]。
1.2 乐伐替尼
乐伐替尼的靶点包括了VEGFR、成纤维生长因子受体(fibroblast growth factor receptor,FGFR)、PDGFR、RET和KIT[25]。2015年,乐伐替尼成功获得FDA批准用于治疗RR-DTC[19,26]。该Ⅲ期临床随机对照研究共纳入392例进展性RR-DTC患者。其中,乐伐替尼组的中位PFS达18.3个月,安慰剂组仅为3.6个月(HR=0.21,95%CI:0.14~0.31,P<0.001);ORR分别为62.1%和3.7%。严重不良反应主要包括高血压(43%)、蛋白尿(10%)和血栓栓塞(6.5%)。其他不良反应包括QTc间期延长(8%)、肾衰竭(4.2%)和胃肠瘘(1.5%)。虽然67.8%的患者在接受乐伐替尼治疗的过程中因严重不良反应而减量,但大多数不良反应在对症处理或减量后可以得到缓解[27]。
1.3 帕唑帕尼
帕唑帕尼可靶向V E G F R、P D G F和c-KIT[28]。在1项纳入39例进展迅速的转移性RR-DTC患者的Ⅱ期临床研究中,18例(49%)获得了部分缓解(partial response,PR)[29]。此外,一项纳入68例RR-DTC患者的研究发现,帕唑帕尼治疗下的疗效反应与Tg值的变化并不一致,治疗后获得PR的20例患者甲状腺球蛋白最低值高于获得疾病稳定(stable disease,SD)的28例[30]。
1.4 舒尼替尼
舒尼替尼可靶向PDGFR、VEGFR和FGFR[31]。1项纳入23例RR-DTC患者的Ⅱ期临床试验结果表明,舒尼替尼治疗可使26%的患者获得客观缓解,无完全缓解(complete response,CR)病例,中位PFS为8.0个月[32]。另1项Ⅱ期试验纳入了35例患者(28例RR-DTC,7例MTC),总体ORR为31%[33]。其中,RRDTC的ORR为28%,MTC的ORR为50%。在另1项纳入57例RR-DTC患者的回顾性分析中,舒尼替尼治疗的PR率为35%。其中,25例将舒尼替尼作为二线药物的患者的ORR为20%,而作为首选治疗时,ORR则高达47%[34]。
1.5 司美替尼
司美替尼是一种MEK1/2特异性抑制剂[35]。与上述其他药物不同,虽然司美替尼的直接抗肿瘤作用不佳,但其可恢复甲状腺癌对RAI的摄取[36-38]。1项纳入24例晚期RR-DTC患者的研究发现,60%的患者在司美替尼治疗后出现RAI摄取增加,在随后的RAI治疗中,PR率高达62%。研究还发现,具有NRAS突变的患者摄取RAI增加显著[38]。 此外,Ⅱ期临床研究还发现司美替尼可以提高中危至高危DTC患者甲状腺残留消融成功率[39]。
1.6 其他药物
在达拉非尼诱导再分化的小样本临床研究中,10例接受达拉非尼治疗的BRAFV600E突变型PTC患者中有6例患者可发现新的RAI摄取灶。其中,2例在接受RAI治疗后获得PR,ORR达20%[40]。上述分子靶向化疗药物诱导甲状腺癌再分化研究纳入的患者数量较小,尚需更大样本量的研究予以证实。
凡德他尼和卡博替尼在RR-DTC患者中的应用尚处于临床试验阶段。1项纳入145例RR-DTC患者的凡德他尼Ⅱ期随机对照研究提示,治疗组的中位PFS为11.1个月,安慰剂组的中位PFS为5.9个月(HR=0.63;60%CI:0.54~0.74)。亚组分析显示,凡德他尼治疗PTC患者的中位PFS为16.2个月,安慰剂组为5.9个月;凡德他尼治疗滤泡状甲状腺癌(follictalar thyroid carcinoma,FTC)或ATC患者的中位PFS为7.7个月,安慰剂组为5.6个月[41]。应特别指出,治疗组FTC患者甲状腺球蛋白水平并无明显降低,因此有学者提出凡德他尼更适合PTC患者,而不适合FTC和ATC[42]。卡博替尼也可作为RR-DTC患者的二线用药,在RR-DTC患者的Ⅰ期临床试验中,15例患者中有53%(95%CI:27%~79%)达到PR[43]。
2 MTC
MTC较为少见,预后较差。疾病的进展常通过降钙素、CEA倍增时间及影像学检查来确定。根据现有文献,MTC的分子靶向治疗指征为进展性晚期患者。
2.1 凡德他尼
2011年,凡德他尼成为第1个被FDA批准用于治疗MTC的多靶点靶向化疗药,可抑制RET、VEGFR和EGFR靶点[19,44-45]。1项纳入331例晚期MTC患者的Ⅲ期随机对照临床试验评估了凡德他尼的疗效和安全性[45],研究发现,凡德他尼组的中位PFS达30.5个月,而安慰剂组为19.3个月(HR=0.46,95%CI:0.31%~0.69,P<0.001)。凡德他尼治疗组的ORR达45%,而安慰剂组仅为13%。随机分配到安慰剂组后因病情进展而交叉进行凡德他尼治疗后,患者的降钙素和癌胚抗原水平亦显著降低。凡德他尼最常见的严重不良反应包括腹泻(11%)、高血压(9%)和QT间期延长(8%)。
2.2 卡博替尼
卡博替尼为靶向RET、VEGFR和MET的多靶点靶向化疗药[19,46]。2012年,卡博替尼获得FDA批准用于治疗MTC。1项共纳入330例不可切除的局部晚期或进展性MTC患者的Ⅲ期随机对照临床研究发现,卡博替尼组的中位PFS为11.2个月,安慰剂组为4个月(HR=0.28,95%CI:0.19~0.40,P<0.001)[47]。卡博替尼组ORR为28%,而安慰剂组为0(P<0.001)。与安慰剂组相比,卡博替尼组降钙素和癌胚抗原水平显著下降。卡博替尼最常见的严重不良反应包括腹泻(16%)、手足皮肤反应(13%)、疲劳(10%)、高血压(8.4%)和胃肠道穿孔(3%)。79%的患者因不良反应需要中止服药或换药。
2.3 阿昔替尼
阿昔替尼是第2代VEGFR抑制剂,可靶向VEGFR1、VEGFR2和VEGFR3[48]。1项共纳入60例患者的Ⅱ期临床研究提示,阿昔替尼治疗MTC的ORR达30%(95%CI:19%~43%),中位PFS为21个月(95%CI:13%~46%)[49]。另1项纳入52例晚期MTC和进展性RR-DTC病例的Ⅱ期研究发现,阿昔替尼治疗(5 mg,每天2次)可获得高达34.6%的PR,中位总生存期(overall survival,OS)为118.4周[50]。
2.4 乐伐替尼
Schlumberger等[51]开展的Ⅱ期临床研究发现,乐伐替尼在治疗晚期MTC中的ORR和疾病控制率均较高, 中位至反应期(time to response,TTR)短。该研究共纳入59例患者,ORR为36% (95%CI:24%~49%),PR率达80%(95%CI:67%~89%),44%的患者达到SD,TTR为3.5个月(95%CI:1.9~3.7),中位PFS为9.0个月(95%CI:7.0~NE)。主要的3/4级不良反应包括腹泻(14%)、高血压(7%)、食欲下降(7%)、乏力(5%)、吞咽困难(5%)和丙氨酸转移酶增加(5%)。研究还发现,RET原癌基因与预后无关。
2.5 帕唑帕尼
帕唑帕尼治疗转移性MTC的疗效较好且总体不良反应可控。1项共纳入35例患者的多中心Ⅱ期临床研究发现,有5例患者(14.3%)达到PR(90%CI:5.8%~27.7%),中位PFS和中位OS分别为9.4和19.9个月,主要不良反应包括高血压(33%)、乏力(14%)、腹泻(9%)和肝功能异常(6%)。3例患者(8.6%)因不良反应停药,1例患者因停药死亡[52]。
2.6 莫特塞尼和索拉非尼
莫特塞尼治疗MTC的ORR仅为2%[53]。而1项纳入15例MTC患者的Ⅱ期研究提示,索拉非尼治疗组的ORR可达25%[54]。鉴于卡博替尼和凡德他尼尚未在中国上市,开展索拉非尼治疗晚期MTC的临床研究或指征外用药似乎更加可行。
3 ATC
ATC是恶性程度最高的罕见甲状腺肿瘤,此类患者的中位生存期约为6个月。长期以来,ATC患者的临床管理以手术、化疗、放疗和临终关怀为主[55]。目前以单独使用或联合靶向化疗药物进行的临床研究包括索拉非尼、舒尼替尼、伊马替尼和帕唑帕尼。
3.1 帕唑帕尼
Bible等[56]进行了临床前研究并对15例患者进行了多中心单臂Ⅱ期临床研究提示,15例接受帕唑帕尼治疗(800 mg/d)的患者的中位TTP为62 d,中位OS为111 d。有4例患者需要降低剂量,12例患者因疾病进展而停止治疗,1例因肿瘤出血死亡。最终,患者全部死亡,其中2例患者在治疗后分别存活9.9和35.0个月。严重不良反应包括高血压(13%)和咽喉痛(13%)。
3.2 伊马替尼
伊马替尼是一种多靶点酪氨酸激酶抑制剂,可选择性抑制v-A b l、c-K i t和PDGFR[57-58]。Ha等[59]对11例ATC患者进行了伊马替尼治疗,治疗后8周无患者CR,2例PR,4例SD,6个月的无进展生存率为36%(95%CI:9%~65%)。6个月的总生存率为45%(95%CI:16%~70%)。最常见的不良反应是水肿(25%),其他3级不良反应包括疲劳和低钠血症(12.5%),无4级不良反应或治疗相关死亡,总体耐受性良好。
3.3 索拉非尼
Savvides等[60]进行了1项共纳入20例ATC患者的多中心Ⅱ期临床研究结果显示,20例患者中有10%的患者PR,25%的患者SD。中位OS为1.9个月,1年存活率达20%。主要不良反应包括高血压和皮疹。
4 结语
总之,随着Ⅲ期临床研究对分子靶向化疗药物疗效和不良反应研究结果的陆续公布,FDA等机构快速批准了凡德他尼、卡博替尼治疗MTC和索拉非尼、乐伐替尼治疗RR-DTC,晚期甲状腺癌的治疗已跨入新的时代(表1)。
当前,靶向化疗药物在甲状腺癌领域的推荐适应证仍应是进展性或晚期RR-DTC和MTC患者。但在相对较长的治疗过程中,药物相关不良反应不容忽视。其他靶向化疗药物由于缺乏大样本随机对照临床研究予以验证,可作为二线治疗策略。虽然上述靶向化疗药物在治疗局部复发或转移性的晚期甲状腺癌中显示出一定的疗效和安全性,有望在未来得到更为广泛的临床应用。但是,与其他类型的肿瘤相比,甲状腺癌的分子靶向药物治疗研究和应用才刚刚起步,积累的数据还十分有限,还有许多问题尚待解决。例如:靶向化疗对患者总生存的影响究竟如何?如何选择靶向治疗的最佳时机?应该单独使用还是联合用药?如何提升靶向药物介导131I治疗的有效性?能否根据甲状腺癌的基因突变类型或其他分子标志物优化靶向化疗药物的选择?解决这些实际问题迫切需要开展更多的基础和临床研究。
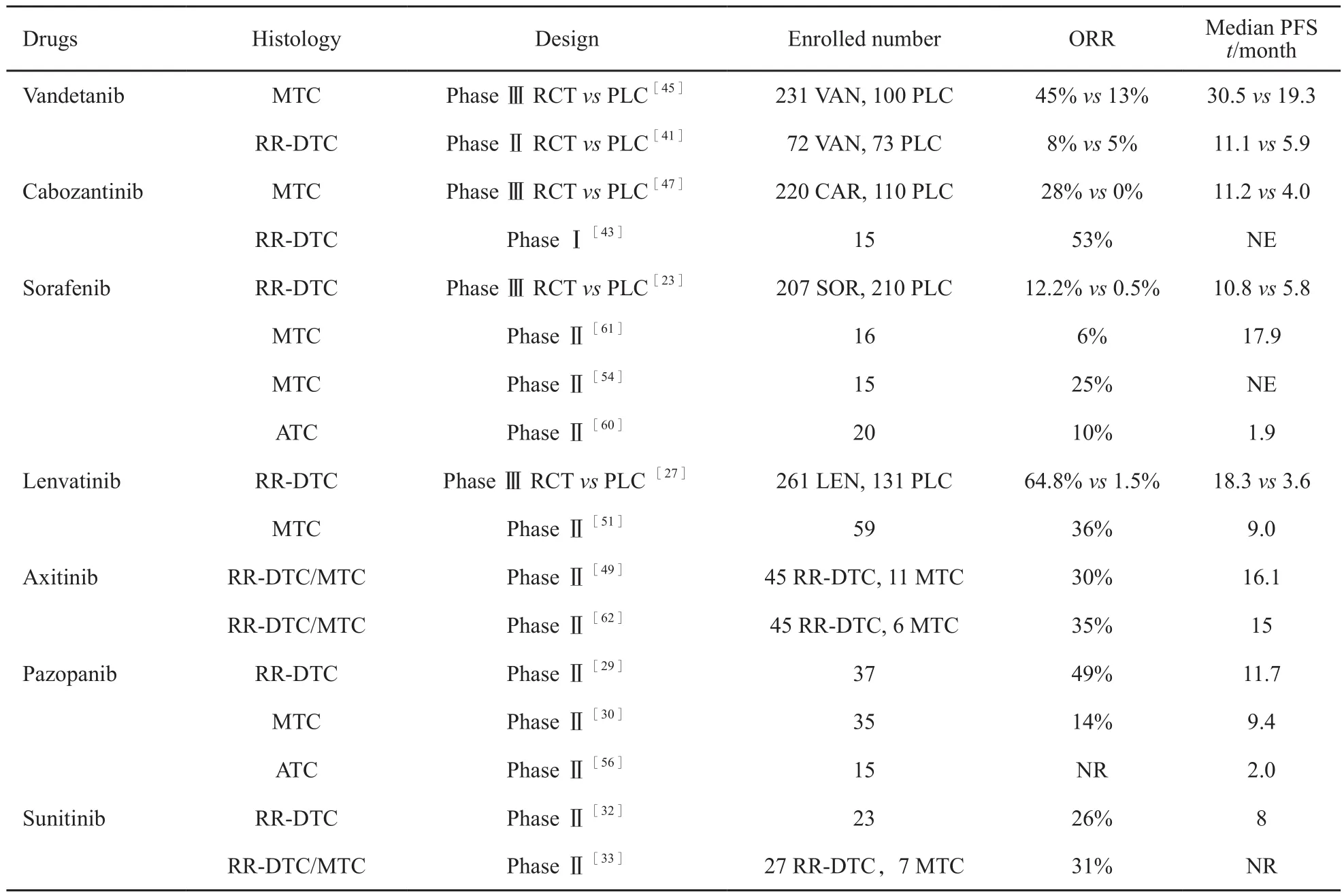
表1 甲状腺癌靶向化疗药物Tab. 1 Targeted chemotherapeutic drugs for thyroid cancer
[1] Cancer Stat Facts. Surveillance, Epidemiology, and End Results (SEER) stat fact sheets: Thyroid cancer[EB/OL]. 2017-03[2017-03]. https://seer.cancer.gov/statfacts/html/ thyro.html.
[2] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[3] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133.
[4] WELLS S A, ASA S L, DRALLE H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma[J]. Thyroid, 2015, 25(6): 567-610.
[5] HADDAD R I, LYDIATT W M, BALL D W, et al. Anaplastic thyroid carcinoma, version 2.2015[J]. J Natl Compr Canc Netw, 2015, 13(9): 1140-1150.
[6] WORDEN F. Treatment strategies for radioactive iodinerefractory differentiated thyroid cancer[J]. Ther Adv Med Oncol, 2014, 6(6): 267-279.
[7] BIBLE K C, RYDER M. Evolving molecularly targeted therapies for advanced-stage thyroid cancers[J]. Nat Rev Clin Oncol, 2016, 13(7): 403-416.
[8] CATARGI B, GUYOT M, TEYNIÉ J, et al. New therapies for refractory differenciated thyroid cancer: Who, when, how, why?[J]. Med Nucl, 2012, 36(1): 29-33.
[9] SU D H, CHANG S H, CHANG T C. The impact of locoregional recurrences and distant metastases on the survival of patients with papillary thyroid carcinoma[J]. Clin Endocrinol (Oxf), 2015, 82(2): 286-294.
[10] VEIGA L H S, NETA G, ASCHEBROOK-KILFOY B, et al. Thyroid cancer incidence patterns in Sao Paulo, Brazil, and the U.S. SEER program, 1997-2008[J]. Thyroid, 2013, 23(6): 748-757.
[11] SHI X, LIU R, BASOLO F, et al. Differential clinicopathological risk and prognosis of major papillary thyroid cancer variants[J]. J Clin Endocrinol Metab, 2016, 101(1): 264-274.
[12] MASSOLL N, MAZZAFERRI E L. Diagnosis and management of medullary thyroid carcinoma[J]. Clin Lab Med, 2004, 24(1): 49-83.
[13] MARTINS R G, RAJENDRAN J G, CAPELL P, et al. Medullary thyroid cancer: options for systemic therapy of metastatic disease?[J]. J Clin Oncol, 2006, 24(11): 1653-1655.
[14] SHERMAN S I. Cytotoxic chemotherapy for differentiated thyroid carcinoma[J]. Clin Oncol (R Coll Radiol), 2010, 22(6): 464-468.
[15] ALI S M, HE J, CARSON W, et al. Extended antitumor response of a BRAF V600E papillary thyroid carcinoma to vemurafenib[J]. Case Rep Oncol, 2014, 7(2): 343-348.
[16] RIESCO-EIZAGUIRRE G, GALOFRÉ J C, GRANDE E, et al. Spanish consensus for the management of patients with advanced radioactive iodine refractory differentiated thyroid cancer[J]. Endocrinol Nutr, 2016, 63(4): e17-e24.
[17] WILHELM S M, CARTER C, TANG L Y, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res, 2004, 64(19): 7099-7109.
[18] CHEN L, SHEN Y, LUO Q, et al. Response to sorafenib at a low dose in patients with radioiodine-refractory pulmonary metastases from papillary thyroid carcinoma[J]. Thyroid, 2011, 21(2): 119-124.
[19] Center for Drug Evaluation and Research. Approved Drugs - Hematology/Oncology (Cancer) Approvals & Safety Notifications[EB/OL]. https://www.fda.gov/Drugs/ InformationOnDrugs/ApprovedDrugs/ucm279174.htm.
[20] GUPTA-ABRAMSON V, TROXEL A B, NELLORE A, et al. Phase Ⅱ trial of sorafenib in advanced thyroid cancer[J]. J Clin Oncol, 2008, 26(29): 4714-4719.
[21] SHAH M H, KLOOS R T, RINGEL M D, et al. Phase Ⅱ trial of sorafenib in metastatic thyroid cancer[J]. J Clin Oncol, 2009, 27(10): 1675-1684.
[22] PASCHKE R, BROSE M S, JARZAB B, et al. Updated overall survival analysis of patients with locally advanced or metastatic radioactive iodine-refractory differentiated thyroid cancer (RAI-rDTC) treated with sorafenib on the phase 3 DECISION trial[J]. J Clin Oncol, 2014, 37(Suppl 5): 120.
[23] BROSE M S, NUTTING C M, JARZAB B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial[J]. Lancet, 2014, 384(9940): 319-328.
[24] HOFTIJZER H, HEEMSTRA K A, MORREAU H, et al. Beneficial effects of sorafenib on tumor progression, but not on radioiodine uptake, in patients with differentiated thyroid carcinoma[J]. Eur J Endocrinol, 2009, 161(6): 923-931.
[25] MATSUI J, YAMAMOTO Y, FUNAHASHI Y, et al. E7080, a novel inhibitor that targets multiple kinases, has potent antitumor activities against stem cell factor producing human small cell lung cancer H146, based on angiogenesis inhibition[J]. Int J Cancer, 2008, 122(3): 664-671.
[26] SCOTT L J. Lenvatinib: first global approval[J]. Drugs, 2015, 75(5): 553-560.
[27] SCHLUMBERGER M, TAHARA M, WIRTH L J, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J]. N Engl J Med, 2015, 372(7): 621-630.
[28] HARRIS P A, BOLOOR A, CHEUNG M, et al. Discovery of 5-[[4-[(2,3-dimethyl-2H-indazol-6-yl)methylamino]-2-pyrimidinyl]amino]-2-methyl-benzenesulfonamide (Pazopanib), a novel and potent vascular endothelial growth factor receptor inhibitor[J]. J Med Chem, 2008, 51(15): 4632-4640.
[29] BIBLE K C, SUMAN V J, MOLINA J R, et al. Efficacy of pazopanib in progressive, radioiodine-refractory, metastatic differentiated thyroid cancers: results of a phase 2 consortium study[J]. Lancet Oncol, 2010, 11(10): 962-972.
[30] BIBLE K C, SUMAN V J, MOLINA J R, et al. 15thinternational thyroid congress program and meeting abstracts[C]. Thyroid, 2015, 25(S1): P1-A337.
[31] SUN L, LIANG C, SHIRAZIAN S, et al. Discovery of 5-[5-fluoro-2-oxo-1,2-dihydroindol-(3Z)-ylidenemethyl]-2,4-dimethyl-1H-pyrrole-3-carboxylic acid (2-diethylaminoethyl) amide, a novel tyrosine kinase inhibitor targeting vascular endothelial and platelet-derived growth factor receptor tyrosine kinase [J]. J Med Chem, 2003, 46(7): 1116-1119.
[32] BIKAS A, KUNDRA P, DESALE S, et al. Phase 2 clinical trial of sunitinib as adjunctive treatment in patients with advanced differentiated thyroid cancer[J]. Eur J Endocrinol, 2016, 174(3): 373-380.
[33] CARR L L, MANKOFF D A, GOULART B H, et al. PhaseⅡ study of daily sunitinib in FDG-PET-positive, iodinerefractory differentiated thyroid cancer and metastatic medullary carcinoma of the thyroid with functional imaging correlation[J]. Clin Cancer Res, 2010, 16(21): 5260-5268.
[34] ATALLAH V, HOCQUELET A, DO CAO C, et al. Activity and safety of sunitinib in patients with advanced radioiodine refractory thyroid carcinoma: a retrospective analysis of 57 patients[J]. Thyroid, 2016, 26(8): 1085-1092.
[35] HUYNH H, SOO K C, CHOW P K H, et al. Targeted inhibition of the extracellular signal-regulated kinase kinase pathway with AZD6244 (ARRY-142886) in the treatment of hepatocellular carcinoma[J]. Mol Cancer Ther, 2007, 6(1): 138-146.
[36] ADJEI A A, COHEN R B, FRANKLIN W, et al. Phase Ⅰpharmacokinetic and pharmacodynamic study of the oral, small-molecule mitogen-activated protein kinase kinase 1/2 inhibitor AZD6244 (ARRY-142886) in patients with advanced cancers[J]. J Clin Oncol, 2008, 26(13): 2139-2146.
[37] HAYES D N, LUCAS A S, TANVETYANON T, et al. PhaseⅡ efficacy and pharmacogenomic study of selumetinib (AZD6244; ARRY-142886) in iodine-131 refractory papillary thyroid carcinoma with or without follicular elements[J]. Clin Cancer Res, 2012, 18(7): 2056-2065.
[38] HO A L, GREWAL R K, LEBOEUF R, et al. Selumetinibenhanced radioiodine uptake in advanced thyroid cancer[J]. N Engl J Med, 2013, 368(7): 623-632.
[39] Pazopanib hydrochloride in treating patients with advanced thyroid cancer[EB/OL]. [2017-05-08]. https:// clinicaltrials.gov/ct2/show/NCT00625846.
[40] HUILLARD O, TENENBAUM F, CLERC J, et al. Redifferentiation of iodine-refractory BRAF V600E-mutant metastatic papillary thyroid cancer with dabrafenib-letter[J]. Clin Cancer Res, 2015, 21(24): 5639-5639.
[41] LEBOULLEUX S, BASTHOLT L, KRAUSE T, et al. Vandetanib in locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 2 trial[J]. Lancet Oncol, 2012, 13(9): 897-905.
[42] NARAYANAN S, COLEVAS A D. Current standards in treatment of radioiodine refractory thyroid cancer[J]. Curr Treat Options Oncol, 2016, 17(6): 30.
[43] CABANILLAS M E, BROSE M S, HOLLAND J, et al. A phase Ⅰ study of cabozantinib (XL184) in patients with differentiated thyroid cancer[J]. Thyroid, 2014, 24(10): 1508-1514.
[44] ROBINSON B G, PAZ-ARES L, KREBS A, et al. Vandetanib (100 mg) in patients with locally advanced or metastatic hereditary medullary thyroid cancer[J]. J Clin Endocrinol Metab, 2010, 95(6): 2664-2671.
[45] WELLS S A Jr, ROBINSON B G, GAGEL R F, et al. Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phaseⅢ trial[J]. J Clin Oncol, 2012, 30(2): 134-141.
[46] KURZROCK R, SHERMAN S I, BALL D W, et al. Activity of XL184 (Cabozantinib), an oral tyrosine kinase inhibitor, in patients with medullary thyroid cancer[J]. J Clin Oncol, 2011, 29(19): 2660-2666.
[47] ELISEI R, SCHLUMBERGER M J, MÜLLER S P, et al. Cabozantinib in progressive medullary thyroid cancer[J]. J Clin Oncol, 2013, 31(29): 3639-3646.
[48] HU-LOWE D D, ZOU H Y, GRAZZINI M L, et al. Nonclinical antiangiogenesis and antitumor activities of axitinib (AG-013736), an oral, potent, and selective inhibitor of vascular endothelial growth factor receptor tyrosine kinases 1, 2, 3[J]. Clin Cancer Res, 2008, 14(22): 7272-7283.
[49] LOCATI L D, LICITRA L, AGATE L, et al. Treatment of advanced thyroid cancer with axitinib: phase 2 study with pharmacokinetic/pharmacodynamic and quality-of-life assessments[J]. Cancer, 2014, 120(17): 2694-2703.
[50] Study Of AG-013736 in patients with131I-refractory thyroid cancer - full text view [EB/OL]. 2017-05-08 [2017-05-08]. https://clinicaltrials.gov/ct2/show/NCT00389441.
[51] SCHLUMBERGER M, JARZAB B, CABANILLAS M E, et al. A phase Ⅱ trial of the multitargeted tyrosine kinase inhibitor lenvatinib (E7080) in advanced medullary thyroid cancer[J]. Clin Cancer Res, 2016, 22(1): 44-53.
[52] BIBLE K C, SUMAN V J, MOLINA J R, et al. A multicenter phase 2 trial of pazopanib in metastatic and progressive medullary thyroid carcinoma: MC057H [J]. J Clin Endocrinol Metab, 2014, 99(5): 1687-1693.
[53] SCHLUMBERGER M J, ELISEI R, BASTHOLT L, et al. Phase Ⅱ study of safety and efficacy of motesanib in patients with progressive or symptomatic, advanced or metastatic medullary thyroid cancer[J]. J Clin Oncol, 2009, 27(23): 3794-3801.
[54] AHMED M, BARBACHANO Y, RIDDELL A, et al. Analysis of the efficacy and toxicity of sorafenib in thyroid cancer: a phase Ⅱ study in a UK based population[J]. Eur J Endocrinol, 2011, 165(2): 315-322.
[55] KEUTGEN X M, SADOWSKI S M, KEBEBEW E. Management of anaplastic thyroid cancer[J]. Gland Surg, 2015, 4(1): 44-51.
[56] BIBLE K C, SUMAN V J, MENEFEE M E, et al. A multiinstitutional phase 2 trial of pazopanib monotherapy in advanced anaplastic thyroid cancer[J]. J Clin Endocrinol Metab, 2012, 97(9): 3179-3184.
[57] BUCHDUNGER E, ZIMMERMANN J, METT H, et al. Selective inhibition of the platelet-derived growth factor signal transduction pathway by a protein-tyrosine kinase inhibitor of the 2-phenylaminopyrimidine class[J]. Proc Natl Acad Sci U S A, 1995, 92(7): 2558-2562.
[58] HEINRICH M C, GRIFFITH D J, DRUKER B J, et al. Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor[J]. Blood, 2000, 96(3): 925-932.
[59] HA H T, LEE J S, URBA S, et al. A phase Ⅱ study of imatinib in patients with advanced anaplastic thyroid cancer[J]. Thyroid, 2010, 20(9): 975-980.
[60] SAVVIDES P, NAGAIAH G, LAVERTU P, et al. PhaseⅡ trial of sorafenib in patients with advanced anaplastic carcinoma of the thyroid[J]. Thyroid , 2013, 23(5): 600-604.
[61] LAM E T, RINGEL M D, KLOOS R T, et al. Phase Ⅱ clinical trial of sorafenib in metastatic medullary thyroid cancer[J]. J Clin Oncol, 2010, 28(14): 2323-2330.
[62] COHEN E E W, TORTORICI M, KIM S, et al. A phase Ⅱtrial of axitinib in patients with various histologic subtypes of advanced thyroid cancer: long-term outcomes and pharmacokinetic/pharmacodynamic analyses[J]. Cancer Chemother Pharmacol, 2014, 74(6): 1261-1270.
Research progress in targeted chemotherapy for thyroid cancer
JIN Yuchen, CHEN Libo (Department of Nuclear Medicine, Shanghai Jiao Tong University Affiliated Sixth People’s Hospital, Shanghai 200233, China)
CHEN Libo E-mail: libochen888@hotmail.com
Due to the limited efficacy of traditional therapies, the risk of death in patients with advanced thyroid cancer remains high. In recent years, targeted chemotherapy has shown prospective effects on inhibiting the growth of thyroid cancer and prolonging progression-free survival in these patients, but also brings some clinical confusion. Consequently, this paper reviewed the application status and clinical problems of targeted chemotherapy in thyroid cancer. In addition, treatment strategies of thyroid cancer and the future perspectives were also presented.
Thyroid cancer; Targeted chemotherapy; Kinase inhibitor
10.19401/j.cnki.1007-3639.2017.06.009
R736.1
A
1007-3639(2017)06-0451-08
2017-04-10)
国家自然科学基金(81671711,81271609);上海启明星计划(12QH1401600)。
陈立波 E-mail: libochen888@hotmail.com

