碘难治性甲状腺癌的诊治进展
林岩松,杨 雪
中国医学科学院北京协和医院核医学科,北京100730
碘难治性甲状腺癌的诊治进展
林岩松,杨 雪
中国医学科学院北京协和医院核医学科,北京100730

林岩松,北京协和医院主任医师、教授,中国医学科学院博士研究生导师,北京协和医院核医学科副主任,兼任中国临床肿瘤学会(CSCO)甲状腺癌专业委员会主任委员、中华医学会核医学分会治疗学组副组长、国际原子能机构IAEA RAS6082项目中国区协调员。围绕分化型甲状腺癌病因探讨和131I靶向治疗前评估等进行系列研究,以第一或通信作者发表相关论著70余篇,其中SCI收录文章20篇,其创新性内容被业界最高影响因子杂志J Nucl Med录用并得到优先发表,为131I治疗甲状腺疾病增加了来自中国的循证医学证据。先后四次承担国家自然科学基金,作为第一完成人两次获得中华医学科技奖。
多数分化型甲状腺癌(differentiated thyroid cancer,DTC)经过规范的手术、选择性131I治疗及促甲状腺激素抑制治疗后预后良好,然而,仍有部分转移性DTC的患者在早期或131I治疗过程中失去了摄碘能力发展为碘难治性DTC(radioiodine-refractory DTC,RAIR-DTC)。RAIR-DTC病情进展快,死亡率高,为这些患者寻找有效的治疗手段一直是甲状腺癌领域研究的热点。该文对碘难治性甲状腺癌的诊断及治疗进展进行综述,为及早识别这些患者,并为其他可能获益的治疗手段如靶向治疗及放疗等的早期干预争取时间。
甲状腺癌;放射性碘;碘难治性;进展
甲状腺乳头状癌(papillary thyroid cancer,PTC)及滤泡状癌(follicular thyroid cancer,FTC)占甲状腺癌的90%以上,由于它们在一定程度上保留了甲状腺滤泡细胞的功能,如钠碘同向转运体(sodium iodide symporter,NIS)的表达及摄碘的能力、分泌甲状腺球蛋白(thyroglobulin,Tg)的能力、依赖于促甲状腺激素(thyrotropin,TSH)生长的方式等,被称为分化型甲状腺癌(differentiated thyroid cancer,DTC)。远处转移是DTC患者主要的致死原因。有研究显示,远处转移病灶的摄碘特征与其预后密切相关[1-2],摄碘的患者10年生存率可达56%,而不摄碘患者10年生存率不足10%[2],这部分碘难治性DTC(radioiodinerefractory DTC,RAIR-DTC)的早期诊断及后续治疗已成为目前甲状腺癌领域的难点和热点。
1 RAIR-DTC的定义
RAIR-DTC应涵盖所有经过规范的131I治疗后仍出现复发及转移或已知病灶进展的DTC患者。在2015年美国甲状腺协会(American Thyroid Association,ATA)指南中对RAIR-DTC进一步界定,在TSH刺激及无外源性碘负荷干扰的低碘状态下,符合以下之一:① 肿瘤组织或转移病灶不摄碘(在清甲成功后的首次诊断性或治疗性131I全身显像未出现甲状腺床以外的碘摄取);② 曾经摄碘的病灶在131I治疗后逐渐丧失摄碘能力;③131I治疗后仅部分病灶摄碘,部分病灶不摄碘;④ 尽管病灶存在碘摄取,但经131I治疗后仍出现进展[3-4]。目前,对这一诊断标准仍存在一定争议,例如,目前焦点主要集中在患者的病灶是否摄碘,而病灶摄碘的判断可受患者体内碘负荷、TSH水平及SPECT分辨率等多种因素的影响。其次,在RAIR-DTC的界定中,应强调病灶是否摄碘,还是碘治疗后的反应,还是两者并重?
2 RAIR-DTC的发生机制及诊断评估体系
NIS是一种DTC细胞基底膜上表达的糖蛋白,可利用细胞跨膜的钠离子浓度梯度将碘逆浓度梯度转运至细胞内,这也是放射性碘治疗DTC的基础。RAIR-DTC主要是由于NIS表达水平的下降或出现基底膜以外的异位表达,致使131I治疗无法奏效,多种分子影像学、血清学及分子遗传学特征的变化提示RAIR-DTC的发生涉及多种机制,因此可利用多种分子特征进行诊断评估。
2.1 分子遗传学特征
2.1.1 双链复合蛋白-8(paired box gene-8,PAX-8)-过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)重排
甲状腺特异蛋白包括NIS、TSH受体(thyroid stimulating hormone receptor,TSHR)、Tg及甲状腺过氧化物酶(thyriod peroxidase,TPO),其表达受特异性转录因子控制,即甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、甲状腺转录因子-2(thyroid transcription factor-2,TTF-2)及PAX-8。PAX-8与NIS基因上游增强子结合,促进NIS的表达。有研究发现,失分化和未分化甲状腺癌的TTF-1和PAX-8表达水平显著降低[5]。有研究显示,将TTF-1和PAX-8基因转染入甲状腺癌细胞后,检测到NIS、Tg及TPO表达水平升高[6],这或将为治疗RAIR-DTC提供新思路。
PPAR属于类固醇-甲状腺-维甲酸受体超家族,包括PPAR-α、β、γ三种亚型。其中PPAR-γ对于维持甲状腺细胞生长、增殖及分化具有重要作用。PAX-8-PPAR-γ染色体质量排是t(2;3) (q13;p25)染色体易位造成的异常分子事件,导致PAX-8基因与PPARs基因的融合,使得PAX-8-PPAR-γ融合蛋白(PAX-8-PPAR-γ fusion protein,PPFP)表达增高。PPFP一方面可以通过下调PAX-8的表达活性抑制NIS的表达,另一方面还能降低PPAR-γ的表达并干扰PPAR-γ与其反应元件(PPAR-γ reaction elements,PPREs)的结合,促使甲状腺细胞快速增殖与异常分化[7]。该分子事件可见于50%的FTC,而在PTC中则较少发生[8]。以调节PPARs通路为靶点的治疗,如维甲酸及PPAR-γ激动剂噻唑烷二酮类(罗格列酮、比格列酮和曲格列酮)可以诱导DTC失分化细胞再分化,恢复NIS的表达,进而增强病灶的摄碘能力。然而考虑到其治疗的不良反应及实际应用效果仍存在争议,目前并未广泛应用于临床。
2.1.2 BRAF突变
BRAF V600E突变是DTC最常见的基因改变形式,突变率约为60%,通过MAPK/ERK通路引起丝氨酸/苏氨酸激酶持续活化[9]。BRAF基因突变后,BRAF蛋白持续激活,不需要依赖RAS信号即可使MEK和ERK磷酸化激活[10]。多项研究证实,BRAF突变与DTC细胞NIS表达降低、摄碘下降相关[11-12]。已有研究显示,BRAF突变可引起NIS、TSHR、Tg和TPO的表达显著下降,同时在转录后水平使NIS的膜定位发生障碍[13-14]。Ricarte-Filho等[15]的研究显示,39%的RAIR-DTC含有BRAF突变。Riesco-Eizaguirre等[14]研究发现,BRAF V600E能引起转化生长因子β(transforming growth factor-β,TGF-β)表达增加。TGF-β的表达可降低PAX-8 mRNA水平并抑制PAX-8与NIS启动子的结合,使NIS表达下降。本课题组以往研究发现,BRAF突变的肺转移DTC患者肺转移病灶的不摄碘率达84.2%,而BRAF野生组仅为5.6%,这为RAIR-DTC的预判断及早期诊断提供了预测信息,有可能为该类患者避免不必要的131I治疗及尽早开始更为有效的治疗争取时间[16]。
2.1.3 TERT突变
端粒酶反转录酶(telomerase reverse transcriptase,TERT)是端粒酶不可缺少的催化亚单位之一,限制了端粒酶的活性,而使正常细胞的端粒修复延长。端粒酶在正常人体组织中活性被抑制。TERT启动子突变可导致端粒酶活性增强,促进细胞增殖,与肿瘤发生相关。多项研究发现,TERT基因启动子突变(主要为C228位点突变)与甲状腺滤泡细胞来源的PTC、FTC及未分化癌的侵袭性特征如甲状腺外侵犯、淋巴结转移、远处转移、复发乃至死亡相关[17-20]。且有研究发现,TERT启动子与BRAF均突变可导致更高的侵袭性及复发风险[21]。
最近,本课题组对66例远处转移性DTC患者中位随访46.5个月后发现,TERT启动子突变与远处转移患者的不摄碘特征密切相关,所有TERT启动子突变患者在随访终点均出现碘难治的情况,阳性预测值高达100%;且与BRAF突变相比,TERT启动子突变导致的远处转移病灶的不摄碘现象发生更早[22]。目前,TERT启动子突变对DTC细胞摄碘机制的影响暂不明确。虽目前循证医学证据较少,但对于远处转移的DTC患者,TERT启动子突变或可为预测远处转移病灶的碘难治状态提供新的分子标志。
2.1.4 长链非编码RNA(long non-coding RNA,lncRNA)
LncRNA是一类转录本长度超过200个核苷酸的非编码RNA,缺乏明显的开放阅读框,无或少有编码蛋白质的功能。近年来研究显示,lncRNA在表观遗传水平、转录水平及转录后水平调控基因的表达,参与了染色体沉默、基因组印记、转录激活、转录干扰及原癌基因活化等多种生物学过程[23]。LncRNA在DTC中的研究处于起步阶段,一项DTC摄碘相关的研究显示,lncRNA-SLC6A9-5:2在碘抵抗的细胞及局部复发不摄碘的甲状腺癌组织中显著低表达[24]。Qiu等[25]对5例碘难治肺转移DTC与5例摄碘肺转移DTC患者进行血浆lncRNA表达谱芯片研究,并在20对独立样本中进行了PCR验证,结果表明,血浆ENST00000462717、ENST00000415582高表达及TCONS_00024700、NR_028494低表达的肺转移DTC患者更容易出现碘难治状态且预后更差。但由于受单中心研究、样本量较小的局限,临床应用前尚需进一步验证。利用循环外周血标本筛选差异表达的lncRNA,或可为RAIR-DTC的早期识别提供转化医学的依据。
2.1.5 miRNA
miRNA是一类20~24个核苷酸长度的非编码小分子RNA,通常与信使RNA的3’非翻译区互补结合,在后转录水平调节信使RNA的表达[26]。
以往DTC中miRNA表达谱的研究多集中在PTC及FTC与良性结节的鉴别诊断[27-30],近年来深入到DTC复发及侵袭性方面。有研究显示,miR-146b、miR-21和miR-203的高表达与DTC的侵袭性相关[31-33]。Lee等[34]的研究表明,miRNA-222及miRNA-146b在PTC肿瘤及循环外周血中的高表达可作为PTC复发的指标。Minna等[35]的研究显示,miRNA不仅促进致癌基因的表达,miR-199a-3p也可在PTC中发挥肿瘤抑制作用,在PTC细胞系中降低MET及mTOR蛋白表达,抑制迁移及增殖。近期有研究显示,miRNA-339-5p的过表达可使HEK293细胞系中NIS介导的131I摄取降低,并使NIS信使RNA的表达下降[36]。而在DTC失分化细胞系中敲降miRNA-146b,可上调NIS信使RNA的表达[37]。目前,国内外对RAIR-DTC的miRNA研究尚局限于体外水平,缺乏不摄碘肿瘤组织或患者外周血miRNA的研究。
2.2 分子影像学手段
NIS的表达下降或易位表达在131I全身显像中表现为显影的减淡或缺失,不摄碘病灶常用CT、超声等影像学手段结合血清Tg水平的变化进行甄别。在临床工作中,常见两种情况:①Tg可疑升高,131I全身显像阴性,其他影像学亦未提示可疑病灶,该情况探查定位难度大;②Tg阴性、131I全身显像阴性,但超声或CT等影像学提示存在可疑病灶。
2.2.1 18FDG-PET/CT
近年来,核医学分子影像学手段在RAIRDTC判断中的作用备受瞩目。有研究显示,18FDG-PET/CT探查不摄碘病灶的灵敏度及特异度均高达80%以上[38],且可灵敏提示DTC病灶的去分化趋势[17]。2015年ATA指南强烈推荐18FDG-PET应用于131I全身显像阴性且Tg大于10 ng/mL的高危DTC患者[3]。
2.2.2 99mTc-MIBI显像
18FDG-PET显像由于价格昂贵限制了其在中国RAIR-DTC评估及随访中的应用。有研究提示,99mTc-MIBI作为一种肿瘤非特异度阳性显像剂可探查到91%的DTC转移病灶[39]。本课题组以往的研究提示,99mTc-MIBI显像也可用于RAIR-DTC病灶的定位[40]。
2.2.3 RGD显像
本课题组曾首次在国际上针对RAIR-DTC远处转移病灶采用反应肿瘤新生血管生成的整合素ανβ3受体显像研究,提示99mTc-RGD整合素受体SPECT可探查到摄碘较差的病灶,且病灶对示踪剂的摄取与肿瘤生长呈正相关[41]。68Ga-RGD PET整合素ανβ3受体显像具有相对于99mTc-RGD SPECT更高的灵敏度和分辨率,更有利于病灶的定量分析,有研究显示出利用68Ga-RGD PET监测碘扫描阴性且Tg升高的DTC病灶的有效性[42]。
2.3 血清学特征
多项研究证实,血清Tg与DTC的远处转移、风险分层及治疗反应密切相关[43-45]。Tg的动态水平变化被用于DTC碘治疗前评估及监测复发或转移。由于受到手术后残余甲状腺组织、血清TSH及Tg抗体水平等因素的影响,目前的ATA指南并未给出明确的Tg临界点用以指导131I治疗决策。本课题组一项对244例DTC患者的研究显示,碘治疗前刺激性Tg预测远处转移的最佳临界点为52.75 ng/mL,该结果为治疗前影像学评估阴性仅由131I治疗后显像发现的远处微转移患者提供了依据,避免了这部分患者的治疗不足问题[43]。另一项研究证实,高刺激性Tg水平(大于26.75 ng/mL)为碘治疗后影像学反应不佳的独立预测因素[45]。因此,Tg的动态监测有助于RAIR-DTC的预测及疗效评估。
3 碘治疗推荐
2015年ATA指南强烈推荐:一旦DTC患者被诊断为碘难治,即不再适合给予进一步的碘治疗[3]。然而上述4类RAIR-DTC经碘治疗后的临床获益略有不同并且仍存在争议。对于存在可见的摄碘病灶,但经过几次131I治疗后病灶稳定、无法治愈且无进展的患者,尤其是在接受了超过600 mCi的131I后,是否应该继续131I治疗或何时放弃131I治疗尚未达成共识。目前指南中,针对131I治疗后通过18FDG-PET/CT与131I全身显像对比发现仅部分病灶摄碘的患者治疗意见尚无定论,部分倾向于先对摄碘病灶进行碘治疗,再针对不摄碘病灶调整治疗方案[46-47]。但尚未有针对摄碘及不摄碘病灶负荷的定量评估及权重后决策治疗的研究证据。
4 分子靶向治疗
4.1 多靶点抑制剂
4.1.1 索拉非尼
索拉非尼是一种口服多激酶抑制剂,可抑制RAF-1、B-RAF激酶活性,以及VGFR-2、VGFR-3、PDGFR-β、KIT等多种受体的酪氨酸激酶活性。不仅可阻断由RAF/MEK/ERK介导的细胞信号通路而直接抑制肿瘤细胞增殖,而且可直接作用于VEGFR和PDGFR,阻断肿瘤新生血管的生成、切断肿瘤细胞的营养供应,从而间接抑制肿瘤细胞的生长。美国食品药品监督管理局(Food and Drug Administration,FDA)曾于2005年批准索拉非尼用于治疗晚期肾癌,2007年又扩大了该药的适应证,还用于治疗不能手术切除的肝癌。
2014年,索拉非尼用于碘难治性分化型甲状腺癌的Ⅲ期临床研究结果表明,其相较于安慰剂可以延长5个月(10.8个月vs 5.8个月)的无进展生存期(progression free survival,PFS) (HR=0.59,95%CI:0.46~0.76,P<0.001)[48]。2013年11月,FDA通过优先审查批准了索拉非尼用于治疗局部复发或转移的进展性RAIRDTC。2017年3月,中国国家食品药品监督管理局(China Food and Drug Administration,CFDA)也批准了索拉非尼这一适应证。推荐剂量:400 mg/次,每天2次。
4.1.2 乐伐替尼
乐伐替尼是另外一种口服多受体酪氨酸激酶抑制剂,可选择性抑制VEGFR1-3、FGFR1-4、PDGFR、RET和c-Kit激酶活性[49-50]。2015年Schlumberger等[51]的随机、对照临床Ⅲ期研究结果显示,其效果较索拉非尼更为显著,可以延长14.7个月(18.3个月 vs 3.6个月,HR=0.21,99%CI:0.14~0.31,P<0.001)的PFS。乐伐替尼获得的缓解率(完全缓解率+部分缓解率)可达64.8%。目前,该研究的总生存期(overall survival,OS)数据尚未获得。近期研究显示,不同BRAF/RAS突变类型的RAIR-DTC患者服用乐伐替尼后获得的PFS差异无统计学意义[52]。
2015年2月,FDA批准了乐伐替尼可用于治疗局部复发或转移的进展性RAIR-DTC。推荐剂量:24 mg/次,每天1次。乐伐替尼在中国的Ⅲ期临床研究正在开展中,CFDA暂未批准其在国内上市。
其他多靶点抑制剂包括舒尼替尼、卡博替尼和帕唑替尼的Ⅰ期/Ⅱ期临床试验正在研究中。
4.2 选择性BRAF抑制剂
4.2.1 维罗非尼
维罗非尼为一种选择性BRAF抑制剂。一项Ⅱ期研究对51例伴有BRAF突变的RAIR-DTC患者给予口服维罗非尼治疗,960 mg/次,每天2次。结果显示,以往未经TKI治疗的患者的总有效率高于以往接受过TKI治疗的患者,中位PFS分别为18.2和8.9个月[53]。
4.2.2 达拉非尼
达拉非尼在一项Ⅰ期临床研究中显示出其对治疗BRAF突变的进展期甲状腺癌患者的显著疗效,14例BRAF突变的进展期DTC患者在接受达拉非尼治疗后,4例部分缓解,6例疾病稳定[54]。
4.3 选择性VEGFR抑制剂
阿帕替尼是中国自主研制的一种新型小分子TKI,可高选择性阻断VEGFR-2及其下游信号通路,从而抑制肿瘤血管内皮细胞的增殖及迁移,达到治疗肿瘤的效果[51,55-56]。在阿帕替尼的Ⅱ期临床研究中,中国医学科学院北京协和医院核医学科对10例进展性RAIR-DTC患者服用阿帕替尼后的短期疗效进行评价,结果显示,8例患者的Tg水平在治疗8周后较基线水平下降了81.4%,短期疾病控制率和客观缓解率分别高达100%和90%[57]。这一结果初步证实了其短期、快速的疗效,但有关其长期疗效及对患者生存的获益尚有待进一步研究。目前,中国已开展阿帕替尼的Ⅲ期临床研究。
4.4 诱导再分化治疗
司美替尼为小分子MAPK激酶(MEK-1和MEK-2)抑制剂。其作为分子靶向治疗药物在诱导再分化中的作用日益凸显,通过逆转碘抵抗,有可能使患者再次接受碘治疗,提高RAIRDTC患者的OS。而以往传统诱导再分化治疗的药物如维甲酸类、PPAR-γ激动剂的临床研究并不成功。2013年Ho等[58]报道了司美替尼治疗RAIR-DTC,较之前的药物明显改善了病灶的摄碘能力和碘滞留时间,且基因携带RAS突变的患者获益可能更大[58]。但其长期疗效尚在观察中。推荐剂量:75 mg/次,每天2次。
4.5 分子靶向治疗挑战
近年来针对RAIR-DTC分子机制的研究取得了很多进展,许多分子靶向治疗药物呈现出广阔的应用前景(表1)。但同时,应指出即使处于碘难治性的状态,部分RAIR-DTC患者仍可生存3~5年甚至更长时间,有关靶向治疗时机的把握仍是难题。在无症状、病情稳定或缓慢无快速进展趋势时,目前各指南均建议可继续TSH抑制治疗,同时每3~12个月密切随访血清学及影像学变化,不必开始相关其他治疗[59-61]。
此外,目前靶向药物的获益仅在于改善了患者的PFS,在一定程度上使肿瘤缩小,但尚无任何一种靶向药物的研究证实其延长患者的OS,且由于均具有一定的不良反应,一旦患者入组临床试验,获益或风险如何权衡,给用药前患者的选择、适应证的把握带来难度。用药前后患者的评估、长期随访的评价及撤药原则均缺乏统一的标准。
5 局部治疗
对于脑、肺、肝及骨转移病灶,通常应用局部治疗而非手术治疗。在远处转移病灶出现症状时,局部治疗应优先于全身系统治疗。局部治疗也适用于全身系统治疗过程中某一个病灶的进展。这部分患者可通过局部治疗预防局部并发症,减轻疼痛,延迟系统治疗开始的时间,进而延长生存时间。立体定向放疗(stereotactic body radiotherapy,SBRT)、调强放疗(intensity-modulated radiotherapy,IMRT)、射频消融(radiofrequency ablation,RFA)及冷冻治疗为常用的局部治疗手段。2015年ATA指南强烈推荐:对于有症状的、伴有局部并发症高危风险的远处转移RAIR-DTC,SBRT、RFA或冷冻治疗应优先于全身系统治疗[3]。
由于治疗甲状腺癌远处转移病灶的经验及研究较少,大多可借鉴的数据来自其他原发部位肿瘤的转移病灶。SBRT常被用于治疗脑、肝、肺及骨转移病灶。对于1~3个脑转移病灶的RAIR-DTC,SBRT的有效性与手术治疗相当[62]。而SBRT在累积剂量20~75 Gy时,肺转移病灶的控制率为63%~98%,肝转移病灶的控制率为57%~100%[63]。SBRT骨转移病灶的控制率为88%~100%,疼痛缓解率为30%~83%[64]。SBRT治疗甲状腺癌远处转移病灶的相关研究较少,目前的治疗推荐主要基于其他实体肿瘤的临床试验证据。RFA常用于治疗肝、肺及骨转移病灶。临床试验显示,肝转移病灶应用RFA,局部控制率可达40%~80%[65-66]。关于远处转移性DTC的研究显示,RFA治疗肺、骨及肝转移病灶可获得较好的局部控制率[63,67-68]。而冷冻治疗已尝试用于DTC骨转移病灶的治疗,可减轻癌痛,控制局部病情[69-70]。
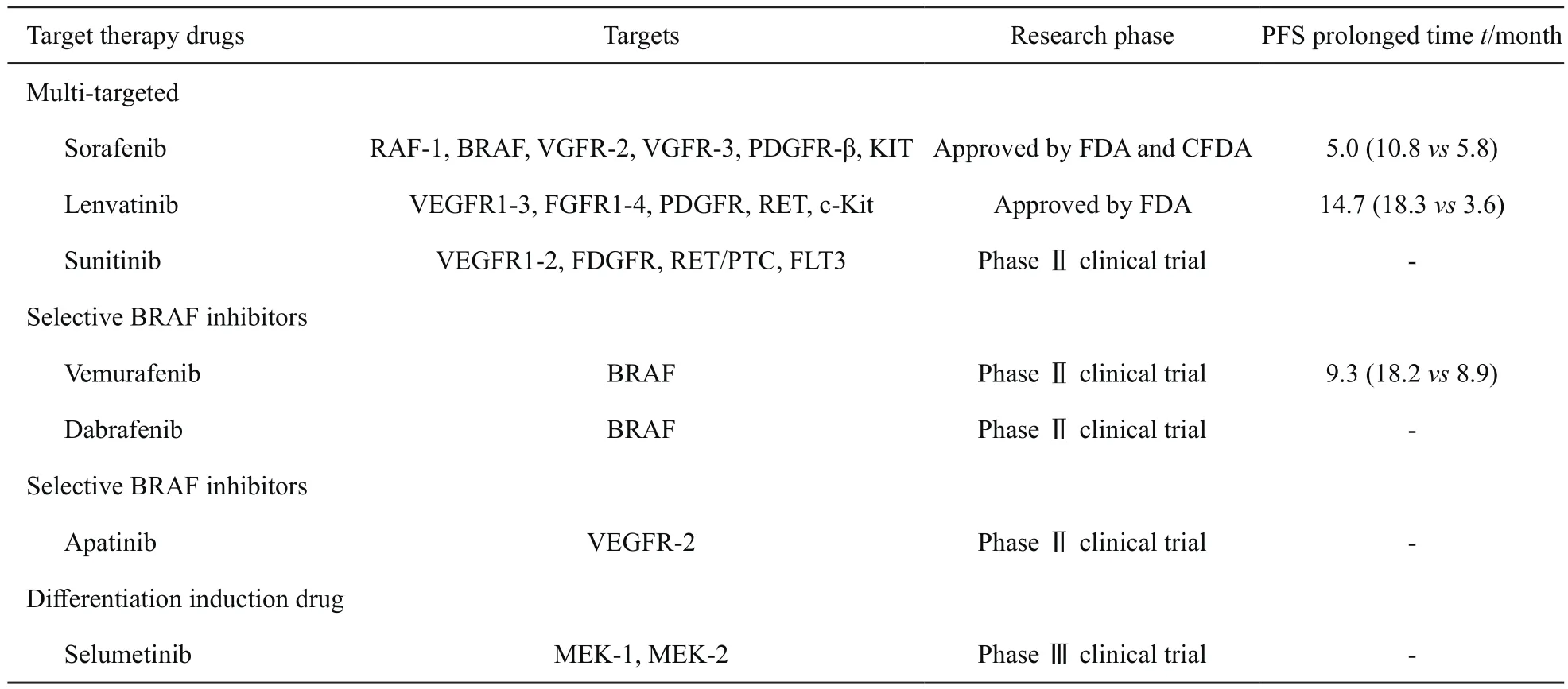
表1 用于治疗RAIR-DTC的分子靶向药物Tab. 1 Targeted therapy for RAIR-DTC
目前尚缺乏针对上述不同局部治疗措施的有效性、可耐受程度的前瞻性随机对照实验研究,临床医师的治疗选择多根据临床实践中积累的经验、转移病灶的实际情况及患者的身体条件进行决策。
6 全身化疗
1974年FDA批准多柔比星用于治疗转移性甲状腺癌。该药仅能使5%上皮细胞来源的甲状腺癌获得部分缓解,多用于综合性姑息治疗[71]。
7 小结
综上所述,RAIR-DTC是甲状腺癌临床诊断治疗中的难点,目前RAIR-DTC的诊断体系亟待完善,分子影像学、分子遗传学及血清学指标的联合应用,将有可能为RAIR-DTC的及早发现并避免不必要的131I治疗提供分子依据,并为其他可能获益的治疗手段如手术、IMRT、RFA及分子靶向治疗等的尽早干预争取时间。靶向药物治疗的指征把握、疗效及评估手段等仍存在争议,因此如何进行RAIR-DTC的个体化治疗,如何在疗效及不良反应间平衡取舍,并提高这部分患者的OS仍是今后努力的方向和在临床研究中需要密切关注的重点。
[1] VAN TOL K M, JAGER P L, DE VRIES E G, et al. Outcome in patients with differentiated thyroid cancer with negative diagnostic whole-body scanning and detectable stimulated thyroglobulin[J]. Eur J Endocrinol, 2003, 148(6): 589-596.
[2] DURANTE C, HADDY N, BAUDIN E, et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy[J]. J Clin Endocrinol Metab, 2006, 91(8): 2892-2899.
[3] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer[J]. Thyroid, 2016, 26(1): 1-133.
[4] SCHLUMBERGER M, BROSE M, ELISEI R, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer[J]. Lancet Diabetes Endocrinol, 2014, 2(5): 356-358.
[5] FABBRO D, DI LORETO C, BELTRAMI C A, et al. Expression of thyroid-specific transcription factors TTF-1 and PAX-8 in human thyroid neoplasms[J]. Cancer Res, 1994, 54(17): 4744-4749.
[6] MU D, HUANG R, LI S, et al. Combining transfer of TTF-1 and Pax-8 gene: a potential strategy to promote radioiodine therapy of thyroid carcinoma[J]. Cancer Gene Ther, 2012, 19(6): 402-411.
[7] AU A Y, MCBRIDE C, WILHELM K G, et al. PAX8-peroxisome proliferator-activated receptor gamma (PPARgamma) disrupts normal PAX8 or PPARgamma transcriptional function and stimulates follicular thyroid cell growth[J]. Endocrinology, 2006, 147(1): 367-376.
[8] REDDI H V, MCIVER B, GREBE S K, et al. The paired box-8/peroxisome proliferator-activated receptor-gamma oncogene in thyroid tumorigenesis[J]. Endocrinology, 2007, 148(3): 932-935.
[9] ZHANG Q, LIU S Z, GUAN Y X, et al. Meta-analyses of association between BRAF(V600E) mutation and clinicopathological features of papillary thyroid carcinoma[J]. Cell Physiol Biochem, 2016, 38(2): 763-776.
[10] DAVIES H, BIGNELL G R, COX C, et al. Mutations of the BRAF gene in human cancer[J]. Nature, 2002, 417(6892): 949-954.
[11] ZHANG Z, LIU D, MURUGAN A K, et al. Histone deacetylation of NIS promoter underlies BRAF V600E-promoted NIS silencing in thyroid cancer[J]. Endocr Relat Cancer, 2014, 21(2): 161-173.
[12] DURANTE C, PUXEDDU E, FERRETTI E, et al. BRAF mutations in papillary thyroid carcinomas inhibit genes involved in iodine metabolism[J]. J Clin Endocrinol Metab, 2007, 92(7): 2840-2843.
[13] SOARES P, LIMA J, PRETO A, et al. Genetic alterations in poorly differentiated and undifferentiated thyroid carcinomas[J]. Curr Genomics, 2011, 12(8): 609-617.
[14] RIESCO-EIZAGUIRRE G, RODRIGUEZ I, DE LA VIEJA A, et al. The BRAF V600E oncogene induces transforming growth factor beta secretion leading to sodium iodide symporter repression and increased malignancy in thyroid cancer[J]. Cancer Res, 2009, 69(21): 8317-8325.
[15] RICARTE-FILHO J C, RYDER M, CHITALE D A, et al. Mutational profile of advanced primary and metastatic radioactive iodine-refractory thyroid cancers reveals distinctpathogenetic roles for BRAF, PIK3CA, and AKT1[J]. Cancer Res, 2009, 69(11): 4885-4893.
[16] YANG K, WANG H, LIANG Z, et al. BRAFV600E mutation associated with non-radioiodine-avid status in distant metastatic papillary thyroid carcinoma[J]. Clin Nucl Med, 2014, 39(8): 675-679.
[17] LIU X, BISHOP J, SHAN Y, et al. Highly prevalent TERT promoter mutations in aggressive thyroid cancers[J]. Endocr Relat Cancer, 2013, 20(4): 603-610.
[18] LIU T, WANG N, CAO J, et al. The age- and shorter telomere-dependent TERT promoter mutation in follicular thyroid cell-derived carcinomas[J]. Oncogene, 2014, 33(42): 4978-4984.
[19] SHI X, LIU R, QU S, et al. Association of TERT promoter mutation 1 295 228 C>T with BRAF V600E mutation, older patient age, and distant metastasis in anaplastic thyroid cancer[J]. J Clin Endocrinol Metab, 2015, 100(4): 632-637.
[20] MUZZA M, COLOMBO C, ROSSI S, et al. Telomerase in differentiated thyroid cancer: promoter mutations, expression and localization[J]. Mol Cell Endocrinol, 2015, 399: 288-295.
[21] XING M, LIU R, LIU X, et al. BRAF V600E and TERT promoter mutations cooperatively identify the most aggressive papillary thyroid cancer with highest recurrence[J]. J Clin Oncol, 2014, 32(25): 2718-2726.
[22] YANG X, LI J, LI X, et al. TERT promoter mutation predicts radioiodine refractory in distant metastatic differentiated thyroid cancer[J]. J Nucl Med, 2017, 58(2): 258-265.
[23] WANG K C, CHANG H Y. Molecular mechanisms of long noncoding RNAs[J]. Mol Cell, 2011, 43(6): 904-914.
[24] XIANG C, ZHANG M L, ZHAO Q Z, et al. LncRNASLC6A9-5:2: A potent sensitizer in131I-resistant papillary thyroid carcinoma with PARP-1 induction[J]. Oncotarget, 2017, 8(14): 22954-22967.
[25] QIU Z L, SHEN C T, SUN Z K, et al. Circulating long noncoding RNAs act as biomarkers for predicting131I uptake and mortality in papillary thyroid cancer patients with lung metastases[J]. Cell Physiol Biochem, 2016, 40(6): 1377-1390.
[26] GHILDIYAL M, ZAMORE P D. Small silencing RNAs: an expanding universe[J]. Nat Rev Genet, 2009, 10(2): 94-108.
[27] ZHANG X, LI M, ZUO K, et al. Upregulated miR-155 in papillary thyroid carcinoma promotes tumor growth by targeting APC and activating Wnt/beta-catenin signaling[J]. J Clin Endocrinol Metab, 2013, 98(8): E1305-E1313.
[28] CHOU C K, CHEN R F, CHOU F F, et al. miR-146b is highly expressed in adult papillary thyroid carcinomas with high risk features including extrathyroidal invasion and the BRAF (V600E) mutation[J]. Thyroid, 2010, 20(5): 489-494.
[29] LIU X, HE M, HOU Y, et al. Expression profiles of microRNAs and their target genes in papillary thyroid carcinoma[J]. Oncol Rep, 2013, 29(4): 1415-1420.
[30] ROSSING M, BORUP R, HENAO R, et al. Down-regulation of microRNAs controlling tumourigenic factors in follicular thyroid carcinoma[J]. J Mol Endocrinol, 2012, 48(1): 11-23.
[31] CHEN Y T, KITABAYASHI N, ZHOU X K, et al. MicroRNA analysis as a potential diagnostic tool for papillary thyroid carcinoma[J]. Mod Pathol, 2008, 21(9): 1139-1146.
[32] CHOU C K, YANG K D, CHOU F F, et al. Prognostic implications of miR-146b expression and its functional role in papillary thyroid carcinoma[J]. J Clin Endocrinol Metab, 2013, 98(2): 196-205.
[33] HUANG Y, LIAO D, PAN L, et al. Expressions of miRNAs in papillary thyroid carcinoma and their associations with the BRAF V600E mutation[J]. Eur J Endocrinol, 2013, 168(5): 675-681.
[34] LEE J C, ZHAO J T, CLIFTON-BLIGH R J, et al. MicroRNA-222 and microRNA-146b are tissue and circulating biomarkers of recurrent papillary thyroid cancer[J]. Cancer, 2013, 119(24): 4358-4365.
[35] MINNA E, ROMEO P, DE CECCO L, et al. miR-199a-3p displays tumor suppressor functions in papillary thyroid carcinoma[J]. Oncotarget, 2014, 5(9): 2513-2528.
[36] LAKSHMANAN A, WOJCICKA A, KOTLAREK M, et al. microRNA-339-5p modulates Na+/I- symporter-mediated radioiodide uptake[J]. Endocr Relat Cancer, 2015, 22(1): 11-21.
[37] BASTOS A U, OLER G, NOZIMA B H, et al. BRAF V600E and decreased NIS and TPO expression are associated with aggressiveness of a subgroup of papillary thyroid microcarcinoma[J]. Eur J Endocrinol, 2015, 173(4): 525-540.
[38] LEBOULLEUX S, SCHROEDER P R, SCHLUMBERGER M, et al. The role of PET in follow-up of patients treated for differentiated epithelial thyroid cancers[J]. Nat Clin Pract Endocrinol Metab, 2007, 3(2): 112-121.
[39] CAMPENNI A, VIOLI M A, RUGGERI R M, et al. Clinical usefulness of99mTc-MIBI scintigraphy in the postsurgical evaluation of patients with differentiated thyroid cancer[J]. Nucl Med Commun, 2010, 31(4): 274-279.
[40] WANG J, ZHANG R. Evaluation of 99mTc-MIBI in thyroid gland imaging for the diagnosis of amiodarone-induced thyrotoxicosis[J]. Br J Radiol, 2017, 90(1071): 20160836.
[41] ZHAO D, JIN X, LI F, et al. Integrin alphavbeta3 imaging of radioactive iodine-refractory thyroid cancer using99mTc-3PRGD2[J]. J Nucl Med, 2012, 53:1872-1877.
[42] VATSA R, SHYKLA J, MITTAL B R, et al. Usefulness of68Ga-DOTA-RGD (ανβ3) PET/CT imaging in thyroglobulin elevation with negative iodine scintigraphy[J]. Clin Nucl Med, 2017, 42(6): 471-472.
[43] LIN Y, LI T, LIANG J, et al. Predictive value of preablation stimulated thyroglobulin and thyroglobulin/thyroid-stimulating hormone ratio in differentiated thyroid cancer[J]. Clin Nucl Med, 2011, 36(12): 1102-1105.
[44] YANG X, LIANG J, LI T J, et al. Postoperative stimulated thyroglobulin level and recurrence risk stratification in differentiated thyroid cancer[J]. Chin Med J (Engl), 2015, 128(8): 1058-1064.
[45] YANG X, LIANG J, LI T, et al. Preablative stimulated thyroglobulin correlates to new therapy response system in differentiated thyroid cancer[J]. J Clin Endocrinol Metab, 2016, 101(3): 1307-1313.
[46] ROBBINS R J, WAN Q, GREWAL R K, et al. Real-time prognosis for metastatic thyroid carcinoma based on 2-[18F]fluoro-2-deoxy-D-glucose-positron emission tomography scanning[J]. J Clin Endocrinol Metab, 2006, 91(2): 498-505.
[47] LEBOULLEUX S, EL BEZ I, BORGET I, et al. Postradioiodine treatment whole-body scan in the era of 18-fluorodeoxyglucose positron emission tomography for differentiated thyroid carcinoma with elevated serum thyroglobulin levels[J]. Thyroid, 2012, 22(8): 832-838.
[48] BROSE M S, NUTTING C M, JARZAB B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial[J]. Lancet, 2014, 384(9940): 319-328.
[49] MATSUI J, YAMAMOTO Y, FUNAHASHI Y, et al. E7080, a novel inhibitor that targets multiple kinases, has potent antitumor activities against stem cell factor producing human small cell lung cancer H146, based on angiogenesis inhibition[J]. Int J Cancer, 2008, 122(3): 664-671.
[50] MATSUI J, FUNAHASHI Y, UENAKA T, et al. Multi-kinase inhibitor E7080 suppresses lymph node and lung metastases of human mammary breast tumor MDA-MB-231 via inhibition of vascular endothelial growth factor-receptor (VEGF-R) 2 and VEGF-R3 kinase[J]. Clin Cancer Res, 2008, 14(17): 5459-5465.
[51] SCHLUMBERGER M, TAHARA M, WIRTH L J, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J]. N Engl J Med, 2015, 372(7): 621-630.
[52] TAHARA M, SCHLUMBERGER M, ELISEI R, et al. Exploratory analysis of biomarkers associated with clinical outcomes from the study of lenvatinib in differentiated cancer of the thyroid[J]. Eur J Cancer, 2017, 75: 213-221.
[53] BROSE M S, CABANILLAS M E, COHEN E E, et al. Vemurafenib in patients with BRAF(V600E)-positive metastatic or unresectable papillary thyroid cancer refractory to radioactive iodine: a non-randomised, multicentre, openlabel, phase 2 trial[J]. Lancet Oncol, 2016, 17(9): 1272-1282.
[54] FALCHOOK G S, MILLWARD M, HONG D, et al. BRAF inhibitor dabrafenib in patients with metastatic BRAF-mutant thyroid cancer[J]. Thyroid, 2015, 25(1): 71-77.
[55] LI J, QIN S, XU J, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer: results from a randomized, placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219-3225.
[56] LI J, QIN S, XU J, et al. Randomized, double-blind, placebo-controlled phase Ⅲ trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J]. J Clin Oncol, 2016, 34(13): 1448-1454.
[57] LIN Y, WANG C, GAO W, et al. Overwhelming rapid metabolic and structural response to apatinib in radioiodine refractory differentiated thyroid cancer[J]. Oncotarget, 2017. [Epub ahead of print].
[58] HO A L, GREWAL R K, LEBOEUF R, et al. Selumetinibenhanced radioiodine uptake in advanced thyroid cancer[J]. N Engl J Med, 2013, 368(7): 623-632.
[59] HAUGEN B R. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: What is new and what has changed?[J]. Cancer, 2017, 123(3): 372-381.
[60] 谭 建, 蒋宁一, 李 林, 等.131I治疗分化型甲状腺癌指南(2014版)[J].中华核医学与分子影像杂志, 2014, 34(4): 264-278.
[61] 林岩松, 张 彬, 梁智勇, 等. 复发转移性分化型甲状腺癌诊治共识[J].中国癌症杂志, 2015, 25(7): 481-496.
[62] KOCHER M, SOFFIETTI R, ABACIOGLU U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study[J]. J Clin Oncol, 2011, 29(2): 134-141.
[63] BONICHON F, PALUSSIERE J, GODBERT Y, et al. Diagnostic accuracy of18F-FDG PET/CT for assessing response to radiofrequency ablation treatment in lung metastases: a multicentre prospective study[J]. Eur J Nucl Med Mol Imaging, 2013, 40(12): 1817-1827.
[64] LO S S, FAKIRIS A J, TEH B S, et al. Stereotactic body radiation therapy for oligometastases[J]. Expert Rev Anticancer Ther, 2009, 9(5): 621-635.
[65] DE BAERE T, ELIAS D, DROMAIN C, et al. Radiofrequency ablation of 100 hepatic metastases with a mean follow-up of more than 1 year[J]. AJR Am J Roentgenol, 2000, 175(6): 1619-1625.
[66] SOLBIATI L, LIVRAGHI T, GOLDBERG S N, et al. Percutaneous radio-frequency ablation of hepatic metastases from colorectal cancer: long-term results in 117 patients[J]. Radiology, 2001, 221(1): 159-166.
[67] MONCHIK J M, DONATINI G, IANNUCCILLI J, DUPUY D E. Radiofrequency ablation and percutaneous ethanol injection treatment for recurrent local and distant well-differentiated thyroid carcinoma[J]. Ann Surg, 2006, 244(2): 296-304.
[68] WERTENBROEK M W, LINKS T P, PRINS T R, et al. Radiofrequency ablation of hepatic metastases from thyroid carcinoma[J]. Thyroid, 2008, 18(10): 1105-1110.
[69] SUSA M, KIKUTA K, NAKAYAMA R, et al. CT guided cryoablation for locally recurrent or metastatic bone and soft tissue tumor: initial experience[J]. BMC Cancer, 2016, 16(1): 798.
[70] HEGG R M, KURUP A N, SCHMIT G D, et al. Cryoablation of sternal metastases for pain palliation and local tumor control[J]. J Vasc Interv Radiol, 2014, 25(11): 1665-1670.
[71] GOTTLIEB J A, HILL C S. Chemotherapy of thyroid cancer with adriamycin. Experience with 30 patients[J]. N Engl J Med, 1974, 290(4): 193-197.
Research progress in diagnosis and treatment of radioiodine-refractory differentiated thyroid cancer
LIN Yansong, YANG Xue (Department of Nuclear Medicine, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Beijing 100730, China)
LIN Yansong E-mail: linys@pumch.cn
Surgery, selective radioiodine therapy and thyroid stimulating hormone suppressive therapy are the standard treatment modalities for differentiated thyroid cancer (DTC). After therapy, most DTC patients could get good prognosis. However, some patients with distant metastasis lose the ability to concentrate radioiodine at early time or during the treatment, and develop radioiodine-refractory DTC (RAIR-DTC). These patients progress quickly and have high mortality. Looking for effective treatments for these patients has been the hot spot in research of thyroid carcinoma. In this paper, we summarized the recent advances in the diagnosis and treatment of RAIR-DTC, hoping to early identify these patients and buy time for early intervention of other possible beneficial treatments such as targeted therapy and radiotherapy.
Thyroid cancer; Radioiodine; Refractory; Progress
10.19401/j.cnki.1007-3639.2017.06.008
R736.1
A
1007-3639(2017)06-0442-09
2017-03-15)
国家自然科学基金资助项目(81571714)。
林岩松 E-mail: linys@pumch.cn

