液态活检miR-509-5p/miR-124比值诊断膀胱癌的临床应用
沈益君,谢湖阳,万方宁,卞晓洁,肖文军,朱一平,戴 波,叶定伟
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032
液态活检miR-509-5p/miR-124比值诊断膀胱癌的临床应用
沈益君,谢湖阳,万方宁,卞晓洁,肖文军,朱一平,戴 波,叶定伟
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:液态活检是一种从血液、尿液等非实体生物组织中取样分析,主要用于恶性肿瘤诊断、监测及判断预后的方法。该研究通过优化尿液miRNA的提取方法,建立标准化的液态活检手段,筛选并验证膀胱癌患者尿液miRNA标志物以阐明其临床应用价值。方法:收集2014年1月—2015年9月膀胱癌患者及健康对照者的尿液,应用miRNA表达谱芯片进行筛选,在78例膀胱癌患者及23例健康对照者的晨尿中进行实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)验证,分析液态活检的miRNA标志物与膀胱癌临床病理的关系及其诊断价值。结果:通过对6例膀胱癌及6例健康对照者的尿液miRNA表达谱进行分析,筛选出了10个miRNA有差异表达,结合既往文献报道的膀胱癌尿液miRNA标志物,我们挑选了20个miRNA进行RTFQ-PCR验证,发现miR-509-5p/miR-124比值在膀胱癌患者尿液中表达水平较健康对照者高,差异有统计学意义(P<0.000 1)。尿液miR-509-5p/miR-124比值随着患者肿瘤分期和肿瘤分级的上升而升高(P=0.003)。当界值定在0.41时,miR-509-5p/miR-124比值对膀胱癌的诊断灵敏度为73.1%,特异度为82.6%,曲线下面积(area under the curve,AUC)达到0.864,比尿液脱落细胞学的诊断价值高(P=0.000 2)。结论:该研究优化了尿液miRNA的提取方法,建立了标准化的液态活检尿液miRNA标志物的检测手段,发现miR-509-5p/miR-124比值可能是膀胱癌理想的诊断标志物。
膀胱癌;miRNA;诊断;液态活检
膀胱癌是我国最常见的泌尿系统恶性肿瘤[1]。近年来,许多尿液肿瘤标志物成功应用于临床实践,较传统的尿脱落细胞学提高了膀胱癌诊断的灵敏度和特异度[2]。液态活检是一种从血液、尿液等非实体生物组织中取样分析,主要用于恶性肿瘤诊断、监测及判断预后的方法,其中包括对miRNA的活检分析。该研究通过优化尿液中miRNA的提取方法,建立标准化的液态活检手段,筛选并验证膀胱癌患者尿液中的miRNA标志物以阐明其临床价值。
1 材料和方法
1.1 样本收集
收集复旦大学附属肿瘤医院2014年1月—2015年9月收治的膀胱癌患者及健康对照者的尿液,留取晨起第1次排尿的尿液约300 mL,收集后1 h内1 000×g室温离心10 min,取上清2 mL,-80 ℃保存。余下尿沉渣标本送检尿液脱落细胞学检查。膀胱癌诊断均由手术病理证实,采用TNM 2002分期和WHO 1973分级系统对肿瘤进行分期分级。所有样本留存者皆签署知情同意书。
1.2 miRNA表达谱芯片
选用膀胱癌患者及健康对照者各6例,使用mirVanaTmPARIS miRNA提取试剂盒(购自美国ABI公司)抽提其尿液中的miRNA,抽提后的RNA样品用带有茎环的特异引物进行反转录(Taqman miRNA逆转录试剂盒,购自美国ABI公司),具体操作参照试剂盒说明书进行。12例患者进行miRNA表达谱芯片实验(TaqMan® Array Human MicroRNA A+B Cards Set v3.0,购自美国ABI公司),该芯片共包含人类常见的miRNA探针754条。采用实时荧光定量聚合酶链反应(real-time fl uorescent quantitative polymerase chain reaction,RTFQ-PCR)。
1.3 液态活检miRNA标志物的验证
选取78例膀胱癌患者及23例健康对照者的晨尿进行验证。miRNA抽提及逆转录方法同1.2。样本加样于384孔板,置于ABI PRISM 7900 system(购自美国ABI公司)上进行RTFQPCR。反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 10 s,60 ℃ 60 s,45个循环。RTFQ-PCR完成后,经电脑自动分析,查看每个miRNA的扩增情况,导出相应的域值循环数Ct值。采用2-△Ct法,以U6为内参,计算每个miRNA的相对表达量。每个样本重复3次。
1.4 统计学处理
比较miRNA标志物及尿脱落细胞学诊断膀胱癌的灵敏度、特异度及曲线下面积(area under the curve,AUC),应用SPSS 16.0统计软件分析,组间比较采用非参数检验,双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 液态活检膀胱癌尿液miRNA标志物的筛选
通过对6例膀胱癌及6例健康对照者的尿液miRNA表达谱分析,筛选出10个miRNA(表1)。这些miRNA在12个标本中均能检测到相应的Ct值,且Ct值均小于30,其平均Ct值在肿瘤组和对照组间存在一定差异,可以作为候选miRNA标志物进行验证。
2.2 液态活检膀胱癌尿液miRNA标志物的验证
除了本研究筛选出的尿液miRNA外,我们还根据既往文献报道的膀胱癌尿液miRNA标志物,挑选了以下miRNA做验证,包括hsa-miR-499-3p、hsa-miR-1236、hsa-miR-330-5p、hsamiR-126、hsa-miR-182、hsa-miR-513-5p、hsamiR-183、hsa-miR-510、hsa-miR-375和hsa-miR-323-3p,总共20个miRNA进行RTFQ-PCR验证。结果显示,这些候选miRNA标志物在78例膀胱癌患者和23例对照者的尿液中表达水平差异无统计学意义(P>0.05)。miR-509-5p、miR-375、miR-183和miR-124在所有尿液标本中均能检测出Ct值,miR-509-5p、miR-375和miR-183在膀胱癌患者尿液中表达水平较健康对照者高,而miR-124在对照者尿液中表达水平较膀胱癌患者高。进一步分析后发现,miR-509-5p/miR-124比值在膀胱癌患者尿液中表达水平较对照者高,差异有统计学意义(P<0.000 1,图1)。

表1 尿液miRNA表达谱芯片结果Tab. 1 Result of urine miRNA microarray
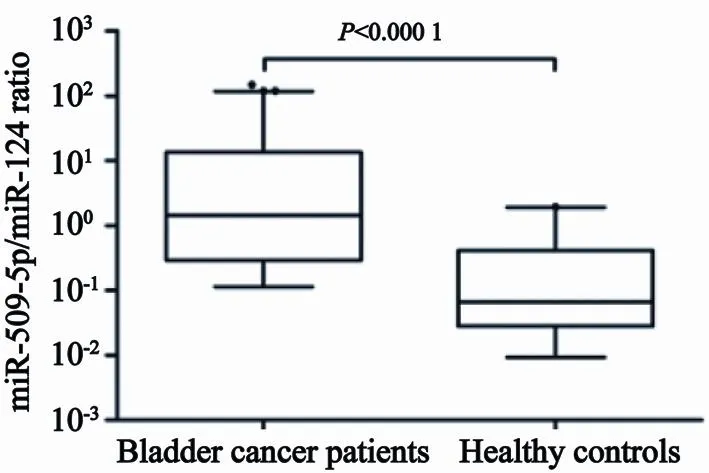
图1 miR-509-5p/miR-124比值在膀胱癌患者及健康对照者尿液中表达水平比较Fig. 1 Compare expression level of miR-509-5p/miR-124 ratio between bladder cancer patients and healthy controls
2.3 液态活检miR-509-5p/miR-124比值与膀胱癌临床病理的关系
78例膀胱癌患者中,Ta期20例,T1期21例,T2-4期37例,G1级24例,G2级34例,G3级20例,尿液miR-509-5p/miR-124比值随着肿瘤分期和肿瘤分级的上升而升高(P=0.003,图2)。该比值与患者年龄、性别及肿瘤大小无关(P>0.05)。
2.4 液态活检miR-509-5p/miR-124比值诊断膀胱癌的价值
我们进一步分析了尿液miR-509-5p/miR-124比值及尿脱落细胞学诊断膀胱癌的价值。当界值定在0.41时,miR-509-5p/miR-124比值对膀胱癌的诊断灵敏度为73.1%,特异度为82.6%,AUC为0.864,而尿脱落细胞学诊断膀胱癌的灵敏度为43.6%,特异度为95.7%,AUC为0.696,两者相比,差异有统计学意义(图3,表2,P=0.000 2)

图2 miR-509-5p/miR-124比值与膀胱癌临床分期及分级的关系Fig. 2 Relationship among miR-509-5p/miR-124 ratio, bladder cancer clinical stage and grade

图3 miR-509-5p/miR-124比值及尿脱落细胞学诊断膀胱癌的AUCFig. 3 The AUC in diagnosis of bladder cancer by miR-509-5p/ miR-124 ratio and urine cytology
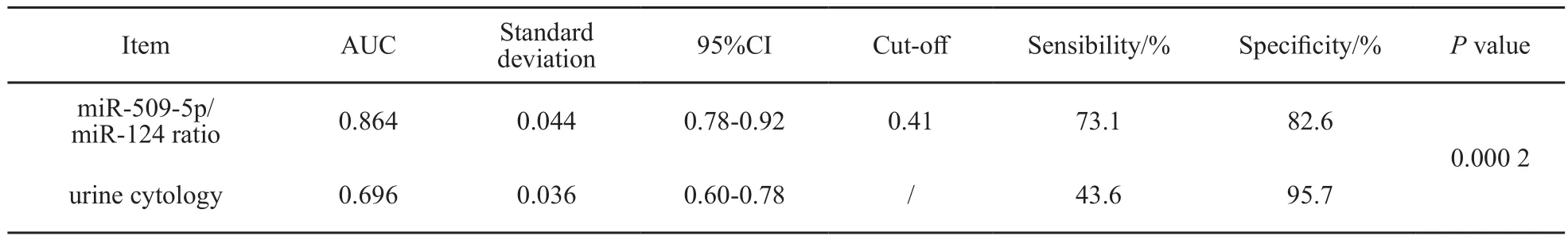
表2 尿液miR-509-5p/miR-124比值及尿脱落细胞学诊断膀胱癌的价值Tab. 2 The value in diagnosis of bladder cancer by miR-509-5p/miR-124 ratio and urine cytology
3 讨 论
目前,临床上主要依靠膀胱镜和尿脱落细胞学对膀胱癌进行诊断和监测随访。前者虽然是确诊膀胱癌的金标准,但却是一种创伤性的手段,并且膀胱内的一些扁平病变及微小的乳头状病变,会出现遗漏或误诊。后者虽然是一种无创伤性手段,特异度高,但灵敏度较低,对于高分级的肿瘤灵敏度则更低,这使其临床应用受到很大限制[3]。
近年,膀胱肿瘤抗原、核基质蛋白、透明质酸、端粒酶和存活素等生物标志物以及荧光原位杂交技术的运用虽然在膀胱癌中显示出了一定的临床价值,较传统的尿脱落细胞学方法提高了诊断的灵敏度,但特异度较尿脱落细胞学检查降低,并容易受到膀胱炎症、手术及腔内药物治疗等的影响[4]。因此,开发无创性、更高灵敏度和特异度的膀胱癌生物标志物依然是临床上的一个重要课题。
随着近年细胞分离技术、测序技术等的发展,液态活检在肿瘤个体化精准治疗中的地位越来越高。液态活检可以包含检测患者血液和尿液中的循环肿瘤细胞、外泌体、循环肿瘤脱氧核糖核酸及循环miRNA等[5]。
miRNA是一类长度为20~24个核苷酸的非编码小分子RNA,广泛存在于人类血液、唾液、痰液、脑脊液及尿液等体液中,可用于许多恶性肿瘤的早期诊断、预后判断及监测随访[6]。miRNA在组织、细胞中的表达表现为显著的肿瘤相关性、组织特异性和表达稳定性,在肿瘤发生、发展的病理进程中,miRNA会出现相应改变[7-8]。尿液检查是一种较为理想的无创伤性检查手段,临床上容易反复获取,普遍较其他体液如血液、脑脊液、羊水及胸腔积液等更易被受检者接受。
有研究发现,miR-96和miR-183在膀胱癌患者尿液中表达量明显较健康人群和尿路感染者高,诊断灵敏度分别为71%和74%,特异度分别为89.2%和77.3%,尿液中miR-96和miR-183的水平与膀胱癌患者的病理分期和肿瘤分级相关[9]。Hanke等[10]筛选了36例膀胱癌患者、泌尿系统感染及健康人群的细胞外尿液中的miRNA,发现miR-126和miR-182在膀胱癌患者中明显升高,经过miR-152校正后,miR-126和miR-182诊断膀胱癌的灵敏度分别为72%和67%,特异度均为82%。Puerta-Gil等[11]通过对37例膀胱癌患者及57例对照者尿液细胞内miRNA的RTFQ-PCR分析发现,当以miR-16为内参校正后,miR-452和miR-222对膀胱癌诊断的AUC分别达到0.848和0.718,准确性较好。以上研究均显示出尿液miRNA标志物应用于膀胱癌诊断的价值,虽然得出了不错的结论,但各研究间发现的miRNA各不相同,因此如何优化现有的尿液miRNA提取方法,特别是对尿液细胞外的微量miRNA进行富集,建立统一的标准化流程,以使各研究结果间具有重复性和可比性,是目前开展液态活检膀胱癌尿液标志物的关键。
为此,本研究从建立简单、易行、重复性好的尿液细胞外miRNA提取流程着手,发现使用mirVanaTmPARIS miRNA提取试剂盒提取的miRNA在RNA的浓度和纯度方面较为满意,同时参考既往研究[12],在尿液样本中加入了糖原,以进一步沉淀和富集miRNA。在miRNA标志物的验证过程中,我们综合了本研究筛选出的差异表达miRNA,以及既往文献中曾报道过的尿液miRNA标志物。在候选的20条miRNA中,没有发现在膀胱癌患者的尿液中呈现明显高表达的单个miRNA。原因可能为:① 选择进行RTFQ-PCR验证的样本数较少,无法得出统计学结论;② 与其他不同的研究平台、不同的样本选择(尿液细胞内外miRNA)及不同的样本处理和miRNA提取方法有关。但进一步分析后发现,miR-509-5p/miR-124比值在膀胱癌患者尿液中表达水平较对照组高,当界值定在0.41时,miR-509-5p/miR-124比值对膀胱癌的诊断灵敏度为73.1%,特异度为82.6%,AUC为0.864,与既往报道的尿液其他miRNA标志物,包括miR-126/miR-152、miR-182/miR-152、miR-452/ miR-16、miR-222/miR-16、miR-96和miR-183诊断膀胱癌的AUC(0.72~0.85)相比,诊断价值更好[9-11]。
本研究也分析了miR-509-5p/miR-124比值与膀胱癌临床病理的关系,发现miR-509-5p/miR-124比值与膀胱肿瘤的分期和肿瘤分级有关,可见miR-509-5p与miR-124在膀胱癌的发生、发展过程中可能具有一定作用,具体机制需要进一步阐明。
综上,本研究通过优化尿液中miRNA的提取方法,建立了标准化的液态活检miRNA标志物的检测手段,筛选并验证出miR-509-5p/miR-124比值能较好的诊断膀胱癌。随着未来进一步扩大病例数及多中心的验证,液态活检miR-509-5p/miR-124比值有望成为膀胱癌早期诊断、预后判断及监测随访的理想肿瘤标志物。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] 叶章群, 李 凡. 膀胱癌的基础与临床研究进展 [J]. 中华实验外科杂志, 2014, 31(6): 1162-1164.
[3] BUDMAN L I, KASSOUF W, STEINBERG J R. Biomarkers for detection and surveillance of bladder cancer [J]. Can Urol Assoc J, 2008, 2(3): 212-221.
[4] 杨国良, 薄隽杰. 尿液中膀胱肿瘤标志物检测的研究进展[J]. 中国癌症杂志, 2009, 19(7): 557-561.
[5] BIRKENKAMP-DEMTRÖDER K, NORDENTOFT I, CHRISTENSEN E, et al. Genomic alterations in liquid biopsies from patients with bladder cancer [J]. Eur Urol, 2016, 70(1): 75-82.
[6] WEBER J A, BAXTER D H, ZHANG S, et al. The microRNA spectrum in 12 body fluids [J]. Clin Chem, 2010, 56(11): 1733-1741.
[7] MANIKANDAN J, AARTHI J J, KUMAR S D, et al. Oncomirs: the potential role of non-coding microRNAs in understanding cancer [J]. Bioinformation, 2008, 2(8): 330-334.
[8] CHO W C. OncomiRs: the discovery and progress of microRNAs in cancers [J]. Molecular cancer, 2007, 6: 60.
[9] YAMADA Y, ENOKIDA H, KOJIMA S, et al. MiR-96 and miR-183 detection in urine serve as potential tumor markers of urothelial carcinoma: correlation with stage and grade, and comparison with urinary cytology [J]. Cancer Sci, 2011, 102(3): 522-529.
[10] HANKE M, HOEFIG K, MERZ H, et al. A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-182 are related to urinary bladder cancer[J]. Urol Oncol, 2010, 28(6): 655-661.
[11] PUERTA-GIL P, GARCIA-BAQUERO R, JIA A Y, et al. miR-143, miR-222, and miR-452 are useful as tumor stratification and noninvasive diagnostic biomarkers for bladder cancer [J]. Am J Pathol, 2012, 180(5): 1808-1815.
[12] BARANISKIN A, KUHNHENN J, SCHLEGEL U, et al. Identification of microRNAs in the cerebrospinal fluid as marker for primary diffuse large B-cell lymphoma of the central nervous system [J]. Blood, 2011, 117(11): 3140-3146.
The miR-509-5p/miR-124 ratio of liquid biopsies in diagnosis of bladder cancer
SHEN Yijun, XIE Huyang, WAN Fangning, BIAN Xiaojie, XIAO Wenjun, ZHU Yiping, DAI Bo, YE Dingwei (Department of Urology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YE Dingwei E-mail: dwyeli@163.com
Background and purpose: Liquid biopsy is a kind of blood, urine and other non-solid biological tissue sampling analysis, mainly for malignant tumor diagnosis, monitoring and predicting its prognosis. In this research, we optimized the extraction of miRNA in urine, established a standardized means of liquid biopsy, screened and verified the miRNA markers in patients with bladder cancer. Methods: From Jan. 2014 to Sept. 2015, we used miRNA microarray in six patients with bladder cancer and six healthy controls. Samples of 78 cases of bladder cancer and 23 healthy controls were tested by real-time fl uorescent quantitative polymerase chain reaction (RTFQ-PCR) to verify the relationship between miRNA markers in liquid biopsy and clinical pathological parameters. The diagnostic value of miRNA markers was also analyzed and compared. Results: We screened 10 miRNAs differential expression in urine. Combined with previous literature, we selected 20 miRNAs to verify their expression levels in bladder cancers and healthy controls. miR-509-5p/miR-124 ratio in the urine was found higher in patients with bladder cancer than in healthy controls (P<0.000 1). With the rise of miR-509-5p/miR-124 ratio in urine, tumor stage and grade were also increased (P=0.003). When the cutoffwas set at 0.41, the diagnostic sensitivity and specificity of miR-509-5p/miR-124 ratio were 73.1% and 82.6%, respectively. The AUC of miR-509-5p/miR-124 ratio to detect bladder cancer was 0.864, higher than that of urinary exfoliated cells (P=0.000 2). Conclusion: We optimized the extraction of miRNAs in urine,established a standardized liquid biopsy of miRNA markers. The miR-509-5p/miR-124 ratio could be an ideal diagnostic marker for bladder cancer.
Bladder cancer; miRNA; Diagnosis; Liquid biopsy
10.19401/j.cnki.1007-3639.2017.06.016
R737.14
A
1007-3639(2017)06-0496-05
2017-01-25
2017-03-15)
上海市卫生计生委科研课题(2010Y014)。
叶定伟 E-mail: dwyeli@163.com

