丛集性头痛患者炎症细胞因子分析☆
朱莎莎王晓辉王晓琳吴士文○☆
丛集性头痛患者炎症细胞因子分析☆
朱莎莎*△王晓辉*王晓琳※吴士文*○☆
目的应用抗体芯片分析丛集性头痛患者在头痛急性发作期及发作间期血清中炎性细胞因子的表达变化,探索炎性细胞因子在丛集性头痛发病中可能的作用。方法收集6例丛集性头痛患者急性发作期及发作间期的全血标本离心取血清藏于-80℃冰箱。将生物素做标记的上述12份血清标本,与预先备好的40个主要炎症相关细胞因子特异抗体芯片行膜反应,目标蛋白与红外荧光剂标记的抗链霉生物素抗体结合并曝光,采用红外荧光扫描仪扫描为图像文件后进行分析。结果与发作间期相比,丛集性头痛患者急性发作期血清中多种炎性细胞因子表达水平明显升高,其中炎性因子IL-1β(44.18 vs.68.46)、IL-6(23.08 vs.36.40)、IL-8(151.87 vs.328.12)、IL-13(23.93 vs.38.87)、MCP-1(454.80 vs.725.75)及MIP-1β(265.08 vs.515.74)在两组间表达差异有统计学意义(P<0.05)。结论多种炎性细胞因子在丛集性头痛的发病过程中有升高,提示可能有炎症参与丛集性头痛的发病,但具体机制尚需进一步的研究。
抗体芯片丛集性头痛炎症细胞因子
丛集性头痛(cluster headache,CH)是原发性头痛的一种,以头痛伴典型的三叉神经自主神经症状为特点,其发病机制目前仍然不明[1-2]。下丘脑和三叉神经自主神经系统功能异常是目前接受程度最高的两大机制。近年来有研究表明免疫及炎症机制也参与了CH的发生,但具体哪些炎症细胞因子参与发病尚不明确。本研究采用自身对照的方法,应用抗体芯片技术,同步检测CH患者血清中40个重要炎症相关细胞因子在头痛发作期和头痛发作间期表达的变化,探索可能的参与丛集性头痛发病的炎性细胞因子及其机制。
1 对象与方法
1.1 研究对象收集2012年3月至2014年3月在中国人民解放军总医院及武警总医院神经内科门诊就诊的典型CH患者6例,编号分别为01~06,患者资料详见表1。入组标准:①符合《国际头痛分类第二版(ICHD-Ⅱ)》[1]丛集性头痛的诊断标准;②纳入对象均为男性;③年龄25~46岁;④近2周内未服用激素;⑤近2周内无上呼吸道感染史。排除标准:①继发于其他躯体疾病的头痛发作;②伴有引起疼痛的内科或外科疾病;③平时间断口服止痛剂者;④研究者认为不愿意配合抽血及随访困难等不适宜纳入者。本研究经中国人民解放军总医院及武警总医院伦理委员会批准,所有纳入对象均在抽血前签署书面知情同意。
1.2 标本收集、处理及分组6例CH患者均在其急性头痛发作后半小时以内及发作间期晨起8点半左右抽血,抽取的全血样品在4 h内被离心,并将分离的血清标本置于冷冻管中做好标记,然后置于-80℃冰箱冷冻保存。12份血清标本分为急性发作期组(B组)及发作间期组(A组)。
1.3 炎性细胞因子的检测应用人炎性细胞因子抗体芯片试剂盒Ⅲ同步检测40个主要的炎症细胞因子。主要步骤如下:①封闭和孵育:在孵育盒中加入2mL封闭缓冲液,将膜芯片缓慢浸没其中,盖盖室温振荡孵育1 h;抽去封闭液,每张膜芯片加入1mL样品。包上塑料薄膜,4度过夜振荡孵育;抽去样品,每个孵育孔中加入约2mL的1×洗液I(20×洗液用去离子水稀释)室温振荡洗膜3次,每次5min;抽去1×洗液I,加入1×洗液II室温振荡洗膜3次,每次5min;配制生物素标记抗体,快速离心生物素标记抗体的小管,加入100μL的1×封闭液,混合均匀后,将所有液体转移至离心管中,混匀后分别加入1mL在两张膜上孵育,室温孵育2 h;清洗同前;抽去1×洗液II,每张膜加入2mLCW800-链霉亲和素。室温避光振荡孵育2 h;再次清洗同前。②将膜夹在两塑料薄膜之间,用红外荧光扫描仪扫描芯片。③图像和数据采集。X-射线胶片曝光后,用红外荧光扫描仪扫描胶片上的图像并将其转换为灰度TIFF格式的图片文件保存。运行ScanAlyze软件,将上述灰度TIFF格式图片的点阵转化为数字型吸光度值,同时将此原始数据储存。
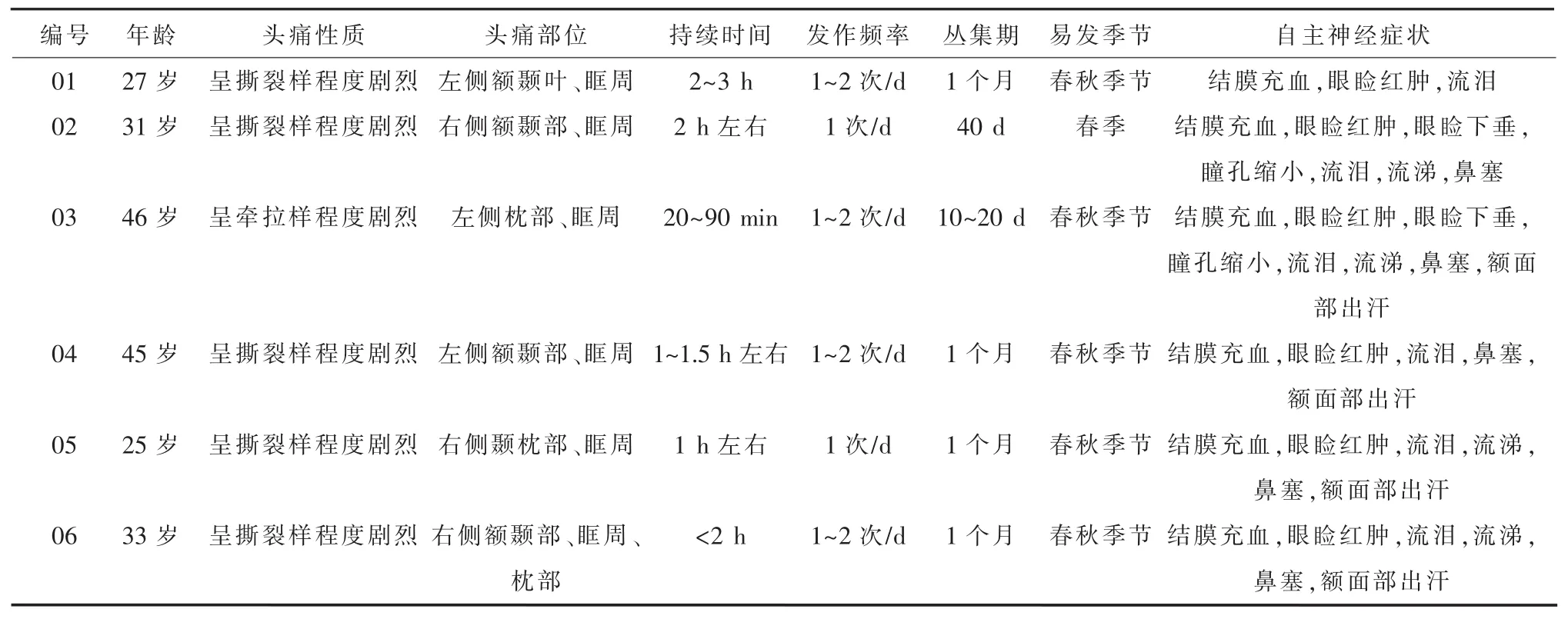
表1 6例丛集性头痛患者临床资料
1.4 统计学方法将芯片膜上各点测得的原始灰度值以第一个样本(01A)为标准进行标准化,得出的灰度值用来进行统计学分析,标准灰度值=芯片膜上各点测得的原始灰度值/第一个样本(01A)芯片中4个阳性对照值的平均值。急性发作期与发作间期相比,变化倍数>1.5为高表达,<0.66为低表达,同时对高表达的炎性细胞因子进行差异性评估。采用IBM SPSSStatistics 19.0软件对实验数据进行统计分析。以每个炎症细胞因子为分析对象,两组间比较采用配对样本t检验。检验水准α=0.05,双侧检验。
2 结果
2.1 炎性细胞因子在CH不同时期的表达及变化与发作间期相比,CH患者急性发作期血清中多种炎性细胞因子的表达水平明显升高,其中变化倍数>1.5的炎性细胞因子包括Eotaxin、I-309、IL-1a、IL-1β、IL-3、IL-6、IL-8、IL-10、IL12-p40、IL-13、IL-16、MCP-1、MCP-2、MIP-1α、MIP-1β、TGF-β1、TNF-β及sTNF-RII,而未发现下调的炎性细胞因子(见表2)。

图1 两组间存在差异性表达的炎性因子筛选结果,其中*代表该炎症细胞因子表达有统计学意义,即P<0.05
2.2 两组间存在差异性表达的炎性因子筛选结果在变化倍数>1.5的18个炎性细胞因子中,仅炎性因子IL-1β、IL-6、IL-8、IL-13、MCP-1及MIP-1β的表达差异有统计学意义(P<0.05,n=6)(见图1)。

表2 两组间40个炎性细胞因子的表达变化分析结果
3 讨论
丛集性头痛是原发性头痛的一种,其人群患病率为50~70/10万,男女比例为3.5:1[2]。CH发作呈丛集性,主要表现为一侧眶周、颞、额等部位为主的剧烈疼痛,常伴同侧球结膜充血、眼睑红肿及眼睑下垂、流泪、流涕、鼻塞等自主神经症状,可依其发作情况分为急性发作期、发作间期及缓解期[1]。为避免性别所致差异,本实验所有纳入者均为男性。既往研究显示炎性细胞因子参与了CH的发生,而其差异性表达见于急性发作期,缓解期与发作间期的表达未见明显差异[5-7]。本实验利用特异性好、灵敏度高的抗体芯片技术,采用自身对照的方法,对患者急性发作期及发作间期的炎性细胞因子表达变化进行分析。
实验结果显示炎性细胞因子IL-1β、IL-6、IL-8、IL-13、MCP-1及MIP-1β的表达水平在CH急性发作期明显高于发作间期,且有统计学意义(P<0.05,n=6)。提示在丛集性头痛发作期可能有炎症反应参与其中,但上述细胞因子与CH的关系,目前仍不明,也缺乏相关研究报道。三叉神经血管系统与下丘脑的激活与CH的发生密切相关。三叉神经血管系统是头痛发生的共同通路,是CH发生的最终环节[3],当中枢神经系统功能发生紊乱时,三叉神经感觉C纤维释放神经源性炎症因子、降钙素基因相关肽(CGRP)、P物质(SP)和神经激肽等物质,引起颅内外血管扩张、局部炎症因子释放,表现为脑膜血管扩张、血浆外渗、血小板活化及肥大细胞脱颗粒等改变,使神经纤维敏感性增加,疼痛反应阈降低。IL-1β在下丘脑区域高度表达,且IL-1及IL-6均可致下丘脑激活,上述炎症因子在CH患者头痛发作期血清中表达增加,到底是丛集性头痛发病的使动因素还是三叉血管反射系统激活后血管源性炎症的结果尚不明确,但其参与了丛集性头痛发病是毋庸置疑的。
在既往研究中,很多学者认为促炎细胞因子的释放代表着CH的一种炎性机制,而激素治疗CH的有效性可能是通过抑制致炎性细胞因子和促进抗炎性细胞因子的产生,同时也抑制血管活性肠肽和CGRP的释放而发挥作用[4]。NO作为一种炎性因子,可调节血管张力,在CH的发病机制中起着一定作用,而IL-1β及IL-6可通过促进NO的释放来导致CH发作[5]。同时,IL-1β及IL-6可以作为致痛物质参与CH的发生。有研究显示,在CH急性发作期,患者血清IL-1β水平较对照组升高[6],这与我们的实验结果一致。EMPL等[7]也发现同缓解期及对照组相比,CH患者急性发作期可溶性IL-2受体(sIL-2R)水平升高。一项关于IL-2基因表达的研究显示:CH发作期IL-2基因表达上调,而发作间期与急性发作期相比,IL-2基因表达上调更为显著[8],这与我们的实验结果也一致,由此推测IL-2基因表达上调并非导致CH发作的因素。IL-13作为一种炎症抑制因子,可通过抑制相关炎性因子的释放而起到一定的抗炎作用,然而其具体的作用机制及与CH的关系仍不明确。而趋化因子IL-8,MCP-1及MIP-1β是否参与丛集性头痛的发生目前国内外尚未报道。
综上所述,IL-1β及IL-6可能是通过激活三叉神经血管系统或下丘脑参与CH的发生,而IL-8、IL-13、MCP-1及MIP-1β与CH的关系需要进一步探索。由于丛集性头痛患者少见,导致本实验的样本量相对较少,限制了本实验的结果信度,扩大样本量进一步研究,并与其他三叉神经自主神经性头痛的研究结合起来,进一步明确炎性细胞因子与CH的关系是未来实验研究的方向。
[1]Headache Classification Committee of the International Headache Society.Classification anddiagnostic criteria for headache disorders,cranial neuralgias,and facial pain.Second Edition[J].Cephalalgia,2004,24(S 1):1.
[2]SCHURKSM,KURTH T,DE JESUS J,et al.Cluster headache: clinical Presentation,life style features,and medicaltreatment [J].Headache,2006,46(8):1246-54.
[3]GOADSBY PJ,EDVINSSON L.Human in vivo evidence for trigeminovascular activation in cluster headache.Neuropeptide changesand effectsofacuteattacks therapies[J].Brain,1994,117 (Pt3):427-434.
[4]黄焰,朱凯云,田新良.泊尼松治疗24例丛集性头痛的疗效观察[J].中华神经医学杂志,2006,5(5):527-528.
[5]ANNA STEINBERG A,INGELA M.Role of Nitric Oxide in Cluster Headache[J].Curr Pain Headache Rep,2012,16(2): 185-190.
[6]MARTELLETTIP,GRANATA M,GIACOVAZZOM.Serum interleukin-1βisincreased in clusterheadache[J].Cephalalgia,1993, 13(5):343.
[7]EMPLM,FORDERREUTHER S,SCHWARZM,et al.Soluble interleukin-2 receptors increase during the active periods in cluster headache[J].Headache,2003,43(1):63-68.
[8]STEINBERG A,SOMINANDA A,FOGDELL-HAHN A,et al. Interleukin-2 gene expression in different phases of episodic clusterheadache-apilotstudy[J].ActaNeurolScand,2011,124(2): 130-134.
Analysis of Inflammatory cytokine expression in cluster headache.
ZHU Shasha,WANG Xiaohui,WANG Xiaolin,WU Shiwen.The sixth people's hospital of anyang city,Anyang 455000,China.Tel:0372-5020103.
Objective To analysis the expression levels of inflammatory cytokines in patients with cluster headache during headache attack period and intermittent period using antibody chips to explore the role of inflammatory cytokines in the pathogenesis of cluster headache.M ethods Blood samples from 6 patients with cluster headache were collected during headache attack period and intermittent period.Samples were then centrifugated and stored at-80 degrees refrigerator.Samples were further labeled with biotin and reacted with antibody chips against 40 major inflammatory cytokines.The target proteins were conjugated with streptomycin antibody labeled with infrared fluorescent agent,and signals were transformed to images by Licor-odyssey scanner.Results In pairwise comparisons, the levels of some inflammatory cytokines were significantly increased during attacks compared to intermittent period including interleukin-1β(44.18 vs.68.46,P<0.05),interleukin-6(23.08 vs.36.40,P<0.05),interleukin-8(151.87 vs. 328.12,P<0.05),interleukin-13(23.93 vs.38.87,P<0.05),monoeyte chemoattraetant protein(454.80 vs.725.75,P< 0.05)and macrophage inflammatory protein-1β(265.08 vs.515.74,P<0.05).Conclusion Inflammatory cytokines may play an important role in the pathogenesis of cluster headache.However,the mechanism needs further investigation.
Antibody chip Cluster headache Cytokine
R747.8
A
2016-10-10)
(责任编辑:李立)
10.3969/j.issn.1002-0152.2017.05.004
☆苗圃基金(编号:WZ20130401)
*中国人民武装警察部队总医院(北京100039)△安阳市第六人民医院
※中国人民解放军总医院
○☆通信作者(E-mai:neurowu@gmail.com)

