左半结肠切除术的争议和基于膜解剖的脾曲游离技巧
池畔 王枭杰
左半结肠切除术的争议和基于膜解剖的脾曲游离技巧
池畔 王枭杰

池畔 现任福建医科大学附属协和医院普通外科(结直肠外科)科主任、教授、主任医师、博士生导师、英格兰皇家外科学院院士(FRCS),享有国务院特殊津贴专家。担任中华医学会外科学分会结直肠肛门外科学组副组长、中国抗癌协会大肠癌专业委员会腹腔镜外科学组副组长、中国医师协会内镜医师分会第一届腹腔镜专业委员会副主任委员、中国医师协会结直肠肿瘤专业委员会第一届腹腔镜专业委员会副主任委员、中国研究型医院学会机器人与腹腔镜外科专业委员会副主任委员、福建省外科学会副主任委员、福建省医学会外科学分会胃肠外科学组组长、大中华腹腔镜结直肠外科学院顾问教授、国际外科、消化及肿瘤医师协会(IASGO)委员以及美国胃肠与内镜外科医师学会(SAGES)委员等职务。担任《中华胃肠外科杂志》《中国实用外科杂志》《中华消化外科杂志》《Annals of Surgery(中文版)》及《Diseases of Colon & Rectum(中文版)》等15家杂志编委。
左半结肠切除术主要适用于横结肠近脾曲癌、降结肠癌和乙状结肠癌。对于左半结肠癌根治术的具体肠段切除范围、区域淋巴结清扫范围目前尚存在争议。在全结肠系膜切除时代,目前尚缺乏专门针对左半结肠癌具体肠段切除范围及淋巴结清扫范围的前瞻性随机对照研究。另一方面,由于结肠脾曲的筋膜、系膜关系复杂,对结肠脾曲的游离一直是腹腔镜手术的主要难点与研究热点。本文拟从以上方面进行讨论。并结合笔者经验,介绍基于膜解剖理论的脾曲游离方法。
结肠肿瘤; 外科手术; 膜解剖; 脾曲
由于左半结肠癌的供血系统处于两套肠系膜血管系统的交界处,且缺乏相关前瞻性研究,因此左半结肠切除术的具体定义、肠段切除范围和淋巴结清扫范围尚存在争议。而腹腔镜下的操作难度主要体现在对结肠脾曲的游离,尤其是对于脾曲位置高、肥胖、大网膜粘连严重的病例。此外,对于左半结肠癌的脾曲游离,其目的不仅为了近远端肠管的无张力吻合,还要保证肿瘤的根治。目前,对脾曲游离的改良是目前左半结肠切除研究的热点。故本文拟从左半结肠癌肠段切除范围的争议、区域淋巴结清扫范围的争议和基于膜解剖的结肠脾曲游离三个方面进行论述。
一、肠段切除范围的争议
(一)左半结肠切除术的定义
关于左半结肠切除术的切除范围及命名,目前国内外未形成共识,标准较多,命名较混乱。我国学者对左半结肠的切除主要以具体切除肠段构成命名。李春雨和汪建平主编的《肛肠外科手术学》定义的左半结肠切除术切除范围包括“左侧1/2或1/3横结肠及其相应系膜、降结肠及其系膜和部分乙状结肠及其系膜”。而对肿瘤两端的肠管切除范围,要求“肠管两切缘距离肿瘤边缘需大于10 cm”[1]。
日本及欧美学者主要以供血血管的切除数目进行命名。高桥孝采用正方形模型作为结直肠的基本骨架定义了4条主要供血动脉,分别为回结肠动脉(ileocolic artery,ICA)、结肠中动脉(middle colic artery,MCA)右支、左结肠动脉(left colic artery,LCA)及乙状结肠动脉(sigmoid artery,SA)。根据处理大肠主要供血动脉数进行术式定义。当处理1条主要供血动脉,定义为段结肠切除术;处理2条主要供血动脉,定义为半结肠切除术。当半结肠切除的手术范围涉及MCA的附属动脉,称为扩大切除[2]。
因此,根据该定义,对于左半结肠癌,当仅结扎LCA时,为左(段)结肠切除术;当同时结扎LCA和SA时,为左半结肠切除术;当同时结扎SA、LCA以及MCA左支(MCA的附属动脉)时,则定义为扩大左半结肠切除(图1)。
(二)段结肠切除范围的争议
关于左半结肠癌的肠段切除范围,即肿瘤两端的肠管切除长度,目前亦存在争议。根据第7版日本《大肠癌处理规约》要求,需要根据术中滋养血管、淋巴结清扫范围决定切断线。对于左半结肠癌,当肿瘤位于横结肠时,其供血动脉多为MCA左支;当肿瘤位于降结肠时,其供血动脉多为LCA。在此基础上,再结合“10+5”原则决定肠段切除范围[3]。而欧美国家大多采用“10 cm原则”(10 cm-rule),即肿瘤两端各切除10 cm正常肠管[4]。一项近期发表的系统综述结果提示,结肠癌周围>10 cm肠管的肠旁淋巴结转移仅1~2%。而直乙交接区远端的肠旁淋巴结转移范围很少超过5 cm[5]。北京大学人民医院胃肠外科曾开展一项基于全结肠系膜切除术(complete mesocolic excision,CME)的淋巴结转移规律的前瞻性单中心研究,结果提示:肿瘤周围<5 cm、5~10cm、>10 cm的肠旁淋巴结转移率分别为37.7%、6.9%和1.3%[6]。由此可见,结肠癌两端超过10 cm的肠旁淋巴结转移率很低,这为“10 cm原则”提供了证据支持。但这些研究均未考虑肿瘤滋养血管在肠旁淋巴结转移规律中的作用。CME的提出者Hohenberger等认为肠旁淋巴结很少会转移至超过肿瘤8 cm的正常肠管,但该观点目前尚无循证医学证据支持。
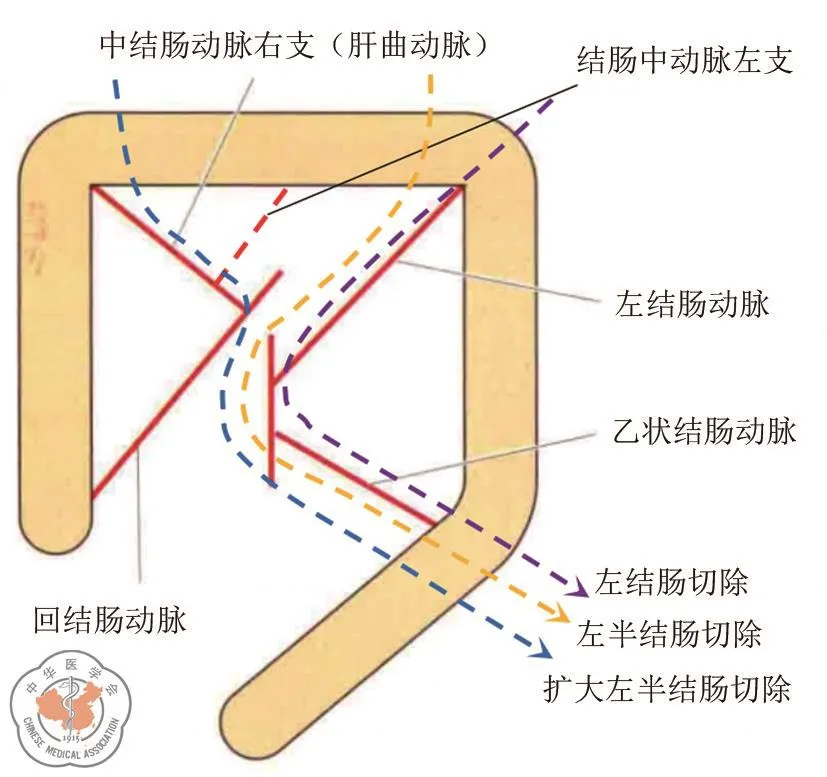
图1 左半结肠癌各种术式图示
(三)左半结肠切除或段结肠切除?
关于左半结肠癌需要行左半结肠切除或仅需段结肠切除,目前仍存在争议。仅一项RCT比较规则左半结肠切除和左结肠部分肠段切除的近远期预后。该研究纳入左1/3横结肠至直乙交界水平以上的癌肿。左半结肠切除组切除横结肠左1/3至直乙交界水平之间的肠管,根部结扎肠系膜下动脉(inferior mesenteric artery,IMA)。而左段结肠切除组肿瘤近段至少切除15 cm,远端至少切除5 cm,于LCA根部结扎,常规清扫253组淋巴结。结果提示:两组间术中和术后并发症发生率无差异,术后总体生存率在两组间无差异。术后1年内左半结肠切除组患者排便次数增多概率高于左段结肠切除组,但1年后两组间的便频概率无差异[7]。但该研究年代久远(1994年),尚未实行CME概念。近期发表的一项回顾性研究,纳入98例横结肠近脾曲及降结肠癌近脾曲癌患者,其中64例患者行扩大右半结肠切除术,结扎血管包括ICA、右结肠动脉、MCA及LCA的升支;另外34例患者行左半结肠切除,结扎血管包括MCA左支及LCA。结果提示虽然扩大右半结肠切除组的术后标本长度及淋巴结数量优于左半结肠切除组,但两组间的近期及远期预后没有明显差异[8]。因此,基于以上研究,在段结肠切除的基础上,目前暂无证据支持进一步扩大肠段切除范围能提高预后。
二、区域淋巴结清扫范围的争议
目前尚缺乏专门针对指导左半结肠癌淋巴结清扫范围的指南共识。关于左半结肠癌淋巴结转移规律的研究亦较少。临床实践中,有3个问题需要澄清。
(一)D2或D3?
根据《中国结直肠癌诊疗规范(2015版)》,对于结肠癌,当肿瘤为T1N0M0且具有预后良好的组织学特征(如分化程度良好、无脉管浸润)时,建议局部切除。当T2~4N0~2M0时,建议首选的手术方式是相应结肠切除联合区域淋巴结清扫。区域淋巴结清扫必须包括肠旁、中间和系膜根部淋巴结。如果怀疑清扫范围以外的淋巴结有转移推荐完整切除[9]。由此可见,中国结直肠癌诊疗规范仅推荐早期结肠癌(T1N0)行局部切除,除此之外的非转移性结肠癌均推荐行D3淋巴结清扫术。而日本《大肠癌处理规约》推荐略有差异:临床分期Tis可行局部切除(D0)或肠段切除(D1),SM(T1)N0者可行D2手术,分期为MP(T2)N0者可行D2或D3手术。对于临床分期为II~III期的则应行D3手术[3]。也就是说,仅cT3~T4或cTis~2但临床怀疑区域淋巴结转移的患者建议行D3手术。然而,目前关于结肠癌淋巴结转移规律的研究主要集中于右半结肠,指南的制定也多基于右半结肠癌的临床病理研究。尚缺乏专门针对左半结肠癌区域淋巴结转移规律的研究。笔者单位曾对收治的556例左半结肠癌患者资料进行回顾性分析,结果提示仅T1期的第3站淋巴结不会发生转移,而T2、T3、T4期的第3站淋巴结转移率分别为3.2%、4.8%、8.9%,提示T1期左半结肠癌可行D2根治术,T2~4期则应行D3根治术[10]。
(二)第3站淋巴结是什么,223组或253组?肠系膜下静脉(inferior mesenteric vein,IMV)的结扎水平?
左半结肠肿瘤的供血动脉位于肠系膜上动脉系统及肠系膜下动脉系统的交汇处,而肠系膜上动脉系统、肠系膜下动脉系统关于中间淋巴结(第2站)和系膜根部淋巴结(第3站)的界定有所不同。对于肠系膜上动脉系统,第3站淋巴结主要指ICA根部淋巴结、右结肠动脉(right colic artery,RCA)根部淋巴结、MCA根部淋巴结;而在肠系膜下动脉系统中,第3站淋巴结指IMA根部淋巴结。从左半结肠癌供血的角度上看,直接参与左半结肠供血的主要动脉包括MCA及IMA发出的LCA。因此,从理论上说,行D3根治术时,当肿瘤位于横结肠时供血动脉多为MCA左支,有必要清扫223组淋巴结;降结肠癌的供血动脉多为LCA,有必要清扫253组淋巴结[11];乙状结肠癌供血动脉多为LCA或SA,有必要清扫253组淋巴结(图2)。笔者所在科室曾对既往14年间的556例左半结肠癌患者的淋巴结转移情况进行回顾性分析,结果提示结肠脾曲癌可出现223组(7.3%)及253组(2.4%)淋巴结转移,降结肠癌仅出现253组淋巴结转移(4.1%)。提示横结肠近脾曲及结肠脾曲肿瘤D3根治术应清扫223组和253组淋巴结;降结肠肿瘤D3根治术仅需清扫253组淋巴结(图3)。
但临床实践中,由于左半结肠供血系统变异较多,文献报道副左结肠动脉(left accessory aberrant colic artery,LAACA)的发生率为4~49.2%[12],其于胰腺下缘从肠系膜上动脉(superior mesenteric artery,SMA)发出,发出点位于MCA根部的近端,支配脾曲及部分降结肠[13]。一项基于吲哚菁绿示踪淋巴流向的研究提示,当LACCA存在时,脾曲癌主要从该动脉进行淋巴结回流,因此,当LACCA存在时,D3手术也应于LAACA根部结扎(图4)。

图2 左半结肠癌D3站淋巴结图示[11] 图3 结肠脾曲癌和降结肠癌区域淋巴结转移分布[10] 图4 A图:副左结肠动脉行走路径[13];B图:吲哚菁绿示踪LACCA的淋巴流向[12]
关于IMV的结扎水平,目前尚无临床研究。传统认为,结肠癌的淋巴回流主要是沿着动脉系统。但基于吲哚菁绿示踪淋巴流向的研究证实了沿IMV淋巴回流通路的存在,其发生率为41.9%。脾曲癌可通过两条路径发生IMV根部的淋巴回流(图5)[12]:(1)先沿着LCA回流,在LCA于IMV交叉处过渡至IMV,再回流到其根部,占25.8%;(2)直接通过IMV回流到其根部,占16.1%。因此,该作者建议在行左半CME的D3清扫时,应于IMV根部,即胰腺下缘水平进行结扎。但该结论尚有待进一步的临床研究证实。

图5 吲哚菁绿示踪IMV根部淋巴结回流的两条路径[12]
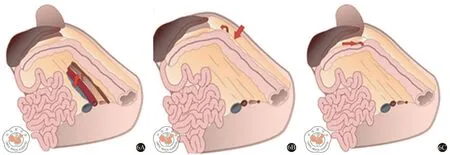
图6 脾曲游离的3种主要入路。A图:中间入路;B图:外侧入路;C图:前方入路[17]
(三)系膜外淋巴结是否清扫(如胃网膜弓淋巴结)?
左半CME的系膜外淋巴结主要指胃网膜弓淋巴结。就如幽门下淋巴结和胃网膜弓淋巴结并非右半结肠癌的常规引流区域淋巴结,胃网膜弓淋巴结也不是左半结肠癌的常规引流区域淋巴结,而属于“系膜外”淋巴结(extramesocolic lymph node)。根据膜解剖理论,胃网膜弓淋巴结属于胃系膜封套内的淋巴结,目前认为左半结肠癌发生胃网膜弓淋巴结转移可能与系膜间的畸形血管沟通有关[14]。文献报道横结肠癌和脾曲癌存在4~5%的胃网膜动脉弓淋巴结转移[15],基于此,Hohenberger提出了CME时的“网膜弓原则”:清扫距离癌肿10 cm以内的网膜弓、胰腺下缘淋巴结以及相应的大网膜[16]。但目前尚缺乏专门针对左半结肠癌胃网膜弓淋巴结转移情况的临床研究。
三、左半结肠癌的结肠脾曲游离
(一)脾曲游离的入路与争议
目前主流的脾曲游离策略主要包括:外侧入路、中间入路、前方入路(图6),以及部分改良术式,如“三路包抄”和横向入路脾曲游离。外侧入路是最常使用的脾曲游离办法,但术中并发症(结肠损伤、脾损伤、胰尾损伤、术中出血)及术后并发症发生率(术后出血、切口感染)均较高,且容易走深间隙,对于脾曲位置较高的病例亦较困难[17]。相比于外侧入路,中间入路更易进入左Toldt′s间隙,辨别输尿管的解剖层次,防止对输尿管的损伤。清扫253组淋巴结亦更方便,便于结扎IMA或LCA,达到彻底的肿瘤根治。中间入路常常并非单独使用,需要结合外侧入路切开剩余的左结肠旁沟。前入路时,较容易进入网膜囊,有研究显示,前入路的术中总体并发症发生率最低,术中脾和胰腺的显露较为清晰,副损伤较少。而“三路包抄”以中间入路为主,将3种入路进行融合,将脾曲游离的困难分3步完成,降低了脾曲游离的难度。刁德昌等[18]在中间入路的基础上,提出了横向入路,即先切断横结肠系膜后叶,提前进入并充分扩展胰腺前间隙后,再切断胰腺后方下缘附着的筋膜与左侧Toldt′s间隙汇合。该方法的优势在于,可防止在由下向上的中间入路中,因胰腺下缘辨认不清,导致手术层面误入胰腺后间隙而损伤胰腺。
(二)脾曲游离的膜解剖基础
笔者体会,对胚胎时期脾曲局部肠管的旋转融合过程的理解,有助于理解脾曲的膜解剖关系,从而指导脾曲游离的临床实践,达到高效、微出血的脾曲游离。
胚胎时期,肠管以SMA为中心发生旋转,旋转结束后,降结肠背侧系膜和后腹膜下筋膜(即肾前筋膜)发生融合,使降结肠固定于后腹膜下筋膜。而横结肠系膜根从胰体尾的尾侧缘走形于胰体尾的后方,从胰体尾部尾侧缘呈扇形展开,将横结肠悬吊于后腹膜。另一方面,胃的背侧系膜向外囊袋样展开,形成大网膜,其中,大网膜第2层与第3层向延续,形成网膜囊背侧壁;大网膜第4层逐渐覆盖于横结肠系膜腹侧叶并融合,形成融合筋膜,共同作为横结肠系膜根的一部分,走行于胰体尾后方(图7)。

图7 胚胎时期大网膜与横结肠系膜腹侧叶的融合过程

图8 离断横结肠系膜根,第1次进入网膜囊经历的3层膜结构 图9 第1次进入网膜囊3层膜结构的术中图示
(三)基于膜解剖的脾曲游离
笔者采用以中间入路为主的“三路包抄”方式进行脾曲游离,结合脾曲局部膜解剖原理,共3次进入网膜囊:
1.离断横结肠系膜根,第1次进入网膜囊
中间入路进入左侧Toldt′s间隙,清扫253组淋巴结,根据肿瘤部位结扎LCA及第1~2支乙状结肠动脉,保留IMA根部。沿已经分离的左侧Toldt′s间隙向上拓展,离断横结肠系膜根,第1次进入网膜囊。该过程共需切开3层筋膜,分别为横结肠系膜腹侧叶、大网膜第4层,最后切开大网膜第3层。其中横结肠系膜腹侧叶和大网膜第4层相融合,形成融合筋膜。进入网膜囊后,可透视胃后壁(图8,图9)。然后沿着胰腺下缘,从内向外切断横结肠系膜根至胰体尾下缘,并与已经拓展的左侧Toldt′s间隙汇合,尽量拓展左Toldt′s间隙至左侧结肠旁沟。
2.离断胃结肠韧带,第2次进入网膜囊
向下翻转横结肠,离断胃结肠韧带,第2次进入网膜囊。该过程需要切开2层膜结构:大网膜第1层与第2层。对T4期左半结肠癌,根据“网膜弓原则”,需在距离肿瘤10 cm处进入胃大弯网膜弓内,清扫第4组淋巴结。对浆膜层未突破的肿瘤,可于距离横结肠约1 cm处的胃结肠韧带处离断,进入网膜囊。然后由内侧向外切开胃结肠韧带(图10)。
3.离断膈结肠韧带、脾结肠韧带,第3次进入网膜囊
由于胃的背侧系膜在胚胎发育过程中向外囊袋样展开,形成大网膜。因此,大网膜第2层与第3层相延续,构成网膜囊内壁。大网膜第1层与第4层相延续。从外侧入路自下向上切开左结肠旁沟,与内侧游离的左Toldt′s间隙会师,并离断膈结肠韧带、脾结肠韧带,第3次进入网膜囊。该过程共需切开2层膜结构:大网膜第2层与第3层的延续筋膜、大网膜第1层与第4层的延续筋膜。值得注意的是,对于局部侵犯浆膜层的T4期左半结肠癌,应该紧贴着脾脏下缘进行网膜囊的切除并游离脾曲。而对于浆膜层未突破的左半结肠癌,可紧贴着脾曲结肠进行游离(图10)。游离过程中,助手需夹持肠钳将降结肠向内侧及腹侧翻起,配合主刀左手钳,共同显露胰体尾及内侧游离的Toldt′s间隙,避免损伤胰体尾及脾曲结肠。最后与前方入路会师,完成脾曲的完全游离(图11)。

图10 网膜囊的膜解剖图示 图11 三次进入网膜囊膜解剖图示
综上,左半结肠癌根治术的具体肠段切除范围、区域淋巴结清扫范围仍需进一步前瞻性随机对照研究以确定。基于膜解剖原理、3次进入网膜囊、以中间入路为主的“三路包抄”方式有助于完成腹腔镜下高效、微创的脾曲游离。
[ 1 ] 李春雨. 汪建平, 主编. 肛肠外科手术学 [M]. 北京: 人民卫生出版社, 2015.
[ 2 ] 三毛牧夫. 腹腔镜下大肠癌手术 [M]. 辽宁: 科学技术出版社, 2015: 15.
[ 3 ] Watanabe, Itabashi, Shimada, et al. Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2010 for the treatment of colorectal cancer [J]. International Journal of Clinical Oncology, 2012, 17(1): 1-29.
[ 4 ] Kim NK, Kim YW, Han YD, et al. Complete mesocolic excision and central vascular ligation for colon cancer: Principle, anatomy, surgical technique, and outcomes [J]. Surgical Oncology, 2016, 25(3): 252-262.
[ 5 ] Bertelsen, Kirkegaard-Klitbo, Nielsen, et al. Pattern of Colon Cancer Lymph Node Metastases in Patients Undergoing Central Mesocolic Lymph Node Excision: A Systematic Review [J]. Diseases of the Colon & Rectum, 2016, 59(12): 1209-1221.
[ 6 ] 叶颖江——结肠癌完整结肠系膜切除术(CME)研究进展及单中心经验 [EB/OL]. http://wx.bjcscrs.com/article/index/foznpb, 2016-5-16.
[ 7 ] Rouffet F, Hay JM, Vacher B, et al. Curative resection for left colonic carcinoma: Hemicolectomy vs. Segmental colectomy [J]. Diseases of the Colon & Rectum, 1994, 37(7): 651.
[ 8 ] Gravante G, Elshaer M, Parker R, et al. Extended right hemicolectomy and left hemicolectomy for colorectal cancers between the distal transverse and proximal descending colon [J]. Annals of the Royal College of Surgeons of England, 2016, 98(5): 1.
[ 9 ] 中华人民共和国卫生和计划生育委员会医政医管局. 结直肠癌诊疗规范(2015年版) [J]. 中国实用外科杂志, 2015, 53: 881-894.
[ 10 ] 蔡东汉, 官国先, 刘星, 等. 左半结肠癌淋巴结转移规律的临床分析 [J]. 中华胃肠外科杂志, 2016, 19(6): 659-663.
[ 11 ] 渡边昌彦, 上西纪夫, 后藤满一, 等. 小肠结肠外科手术操作要领与技巧 [M]. 戴朝六, 张雪峰, 金红旭, 译. 北京: 人民卫生出版社, 2012: 109-124.
[ 12 ] Watanabe J, Ota M, Suwa Y, et al. Evaluation of lymph fl ow patterns in splenic flexural colon cancers using laparoscopic real-time indocyanine green fluorescence imaging [J]. Int J Colorectal Dis, 2017, 32(2):201-207.
[ 13 ] Rusu MC, Vlad M, Voinea LM, et al. Detailed anatomy of a left accessory aberrant colic artery [J]. Surgical and Radiologic Anatomy, 2008, 30(7): 595-599.
[ 14 ] Søndenaa K, Quirke P, Hohenberger W, et al. The rationale behind complete mesocolic excision (CME) and a central vascular ligation for colon cancer in open and laparoscopic surgery : proceedings of a consensus conference [J]. International Journal of Colorectal Disease, 2014, 29(4): 419-428.
[ 15 ] Perrakis A, Weber K, Merkel S, et al. Lymph node metastasis of carcinomas of transverse colon including fl exures. Consideration of the extramesocolic lymph node stations [J]. International Journal of Colorectal Disease, 2014, 29(10): 1223-1229.
[ 16 ] Hohenberger W, Weber K, Matzel K, et al. Standardized surgery for colonic cancer: complete mesocolic excision and central ligation--technical notes and outcome [J]. Colorectal Disease, 2009, 11(4): 354–364.
[ 17 ] Benseler V, Hornung M, Iesalnieks I, et al. Different approaches for complete mobilization of the splenic flexure during laparoscopic rectal cancer resection [J]. International Journal of Colorectal Disease, 2012, 27(11): 1521-1529.
[ 18 ] 刁德昌, 万进, 王伟, 等. 横向入路法腹腔镜左半结肠癌根治术的临床应用 [J]. 中华胃肠外科杂志, 2015, (10):1056-1059.
The controversy of left hemicolectomy and the key technology of mobilization of the splenic flexure basing membrane anatomical theory
Chi Pan, Wang Xiaojie. Department of Colorectal Surgery, Union Hospital, Fujian Medical University, Fuzhou 350001, China
Chi Pan, Email: cp3169@163.com
Left hemicolectomy is indicated for patients with transverse colon cancer at splenic fl exure, descending colon cancer and sigmoid colon cancer. No standard management policy as to the exact length of the colonic resection and extent of lymph node excision has emerged to date. In era of recent developments in surgical concept of complete mesocolic excision for colon cancer, no randomized trial to date is available that examines the standard colonic reseciton length and extent of lymph node excision. In addition, laparoscopic mobilization of the splenic fl exure is a diff i cult procedure because of complexity of fascial anatomy regarding this surgical area. We aim to discuss these issues basing membrane anatomy.
Colonic neoplasms; Surgical procedures, operative; Membrane anatomy; Splenic fl exure
2017-05-11)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2017.04.004
国家临床重点专科建设资助项目[卫办医政函(2012)649号];福建医科大学启航基金项目(No.2016QH027)
350001 福州,福建医科大学附属协和医院结直肠外科
池畔,Email:cp3169@163.com
池畔, 王枭杰.左半结肠切除术的争议和基于膜解剖的脾曲游离技巧[J/CD].中华结直肠疾病电子杂志, 2017, 6(4): 284-289.

