3.0T磁共振动态增强、扩散加权成像对乳腺癌的诊断价值与病理学对照研究
高才良,乐暾,曾文兵,蔡福玲,邬山,刘兴华
(1 重庆三峡中心医院;2 重庆三峡医药高等专科学校,重庆 万州 404000;3.川北医学院,四川 南充 637000)
3.0T磁共振动态增强、扩散加权成像对乳腺癌的诊断价值与病理学对照研究
高才良1,乐暾3,曾文兵1,蔡福玲2,邬山2,刘兴华1
(1 重庆三峡中心医院;2 重庆三峡医药高等专科学校,重庆 万州 404000;3.川北医学院,四川 南充 637000)
目的:结合病理结果探讨3.0T磁共振动态增强、扩散加权成像对乳腺癌的诊断价值。方法:结合手术或穿刺活检病理结果回顾性分析53例乳腺癌患者及34例乳腺良性疾病患者的3.0 T磁共振成像图像。评估两组病灶的形态学征象、动态增强表现、及扩散加权成像表现,并作统计学分析。形态学征象包括:病灶的形状和边缘、病灶周围组织水肿、皮肤增厚、乳头受累、及腋窝淋巴结肿大等;动态增强包括病灶强化特征及时间-信号强度曲线(time-signal intensity curve,TIC)表现;扩散加权成像(diffusion-weighted imaging,DWI)包括良恶性病灶的ADC值,对侧正常组织的ADC值,及相对ADC(relative ADC,rADC)值。结果:乳腺癌患者组与乳腺良性疾病患者组形状及边缘等征象存在统计学差异,病灶周围水肿、皮肤增厚、乳头受累、腋窝淋巴结肿大等征象无统计学差异。乳腺癌患者组与乳腺良性疾病患者组的强化方式及TIC分型存在统计学差异。乳腺癌患者组与乳腺良性疾病患者组DWI信号表现无统计学差异。乳腺癌患者组病灶侧ADC值为[(1.042±0.019)×10-3mm2/s],对侧正常组织的 ADC 值为[(1.812±0.017)×10-3mm2/s],病灶与对侧正常组织的 ADC 值比较差异有统计学意义;乳腺良性疾病患者组病灶侧ADC值为[(1.558±0.022)×10-3mm2/s],对侧正常组织的 ADC 值为[(1.806±0.018)×10-3mm2/s],病灶与对侧正常组织的 ADC 值比较差异有统计学意义;良恶性组病灶侧ADC 值组间差异有统计学意义。良恶性组对侧正常组织间的 ADC 值组间差异无统计学意义。良恶性组相对ADC(rADC)值分别为 (0.865±0.014) 、(0.580±0.013),组间差异有统计学意义。结论:良恶性肿瘤的MRI的形态学征象有一定重叠,动态增强扫描及扩散加权成像的定量参数有助于鉴别乳腺良恶性肿瘤。
乳腺病变;磁共振成像;动态增强磁共振成像;弥散加权成像
据美国癌症协会2011年统计的数据结果显示乳腺恶性肿瘤已为女性最常见的癌症,占女性恶性肿瘤的23%,且病死率仅仅低于肺癌[1]。近年来,我国的乳腺癌发病率也以 2%到7% 的速度递增,患病率居女性癌症的首位[2]。早期发现乳腺病变,并对其及时做出准确的诊治,可以减轻患者身心上的煎熬。随着磁共振成像技术(magnetic resonance imaging,MRI)的飞跃,磁共振成像技术以其独特的优势,在乳腺病变中的应用逐年递增,目前已经成为乳腺病变最敏感的医学影像学检查技术[3]。本文结合手术或穿刺活检病理结果,回顾性分析53例乳腺癌患者及34例乳腺良性疾病患者的3.0T磁共振成像图像特征,探讨动态增强磁共振成像(dynamic contastenhancement MR imaging,DCE-MRI)、扩散加权成像技术(diffusion weighted imaging,DWI)对乳腺癌的诊断价值。
1 材料与方法
1.1 一般资料
回顾性分析2013年6月至2016年3月三峡中心医院经穿刺活检或手术病理证实的乳腺恶性肿瘤患者53例及良性病变患者34例的磁共振成像资料。患者都为女性患者,都为放化疗前的磁共振成像资料。其中乳腺癌组患者年龄40~86岁,平均(53±8)岁;乳腺良性疾病组患者年龄26~76岁,平均(43±14)岁。所有受检者均签署知情同意书。
1.2 检查方法
采用德国西门子公司Verio型3.0T超导磁共振扫描成像仪,乳腺专用成像线圈。受检患者都采取头先进俯卧位的检查体位,双侧乳腺都选择自然状态下悬垂于检查线圈内。磁共振扫描序列主要包括:(1)快速自旋回波序列(TSE):T2WI,TR4 100 ms,TE 85 ms;快速反转恢复磁化准备自旋回波(Tirm)抑脂 T2WI 序列,TR 4 300 ms,TR 61 ms,TI 230 ms,层厚3.5 mm,间隔0.6 mm;(2)横断位扩散加权成像:采用单次激发平面回波,b值=800 s/mm2,TR10 000ms,TE81 ms,层厚4 mm,FOV 340 mm×38 mm,矩阵172×96,平均次数2;(3)磁共振动态增强扫描序列:采用快速小角度激发三维成像(Flash-3D)抑脂T1WI序列,TR 4.7 ms,TE 1.7 ms,层厚 1.7 mm,层数72,单期扫描时间60 s,于第1次扫描结束后左(或右)手臂静脉注射对比剂钆喷替酸葡甲胺0.1 mmol/kg及生理盐水20 mL,速率2~3 mL/s,然后再扫描5次,共6个回合,第1、2次扫描间隔约30 s,采集时间共约390 s。
1.3 资料分析
图像分析均在工作站上进行(SIEMENS SYNGO软件),由有经验的2名放射科医师在未知病理结果的情况下共同探讨分析乳腺病变,遇有分歧时协商解决。(1) 形态学的图像分析:形态学征象主要包括:乳腺内病变的形状和边缘、病变周围邻近组织的水肿情况、皮肤增厚情况、乳头受累情况、及腋窝区淋巴结肿大。根据BI-RADS[4]形态学表现,将病灶的形态分为圆形或椭圆形、分叶状、不规则形3种;病灶的边缘分为毛刺、不规则、光滑3类。(2)DCE-MRI分析:①乳腺内病灶的强化特征分为:环状强化、不均匀性强化、均匀性强化、不强化4类。②DCE-MRI的TIC曲线类型:根文献报道[5]将TIC曲线分3种类型,即流入型(I型),主要表现为磁共振动态增强观察期间信号持续强化(2~7 min信号强化升高超过10%);平台型(II型):表现为信号强度早期达到最大峰值后,增强的中后期信号强化维持在1个平台期(2~7 min信号强化升高或降低维持在10%以内);廓清型(III型):早期快速强化后,在增强中后期信号迅速下降(2~7 min信号强化程度降低超过10%)。(3)DWI分析:①DWI信号表现(病灶信号相对对侧正常部位相近区域正常乳腺组织的DWI信号):均匀性高信号、不均匀性高信号、均匀性等信号、不均匀性等信号、均匀性低信号、不均匀性低信号。②表观系数(apparent diffusion coefficien,ADC)值(×10-3mm2/s):结合增强时病灶的表现,选择手工绘制感兴趣区(ROI),以期感兴趣区内病变组织具有较好的代表性,选取病变最大层面中心区域进行测量,尽量避开病变组织的囊变、坏死或出血区域。ROI面积根据病变组织的大小而定,ROI小于病灶,单个ROI面积约为20~40 mm2,测量每个ROI的ADC值(×10-3mm2/s),并于病灶对侧正常部位相近区域测量正常乳腺组织的ADC值,重复放置3次取平均值。相对表观扩散系数值(rADC值)即乳腺病变组织的平均ADC值与正常部位乳腺组织的平均ADC值的比值。
1.4 统计学分析
统计软件使用SPSS 16.0软件包,计量资料比较选择t检验,计数资料比较选择χ2检验,以P<0.05为有统计学意义。(1)采用χ2检验比较乳腺癌患者组和乳腺良性疾病患者的形态学特征、DWI信号及动态增强表现特征。(2)采用t检验分析ADC值及rADC值在乳腺良、恶性病变组之间的统计学差异。
2 结果
2.1 病理结果
53例乳腺癌患者中,共63个病灶(含乳腺浸润性导管癌20个、乳腺导管原位癌10个、乳腺导管原位癌伴微浸润13个、乳腺导管内癌8个、乳腺黏液腺癌5个、乳腺浸润性小叶癌4个、乳腺浸润性微乳头状癌2个、乳腺髓样癌1个)。34例乳腺良性疾病患者,共43个病灶(含乳腺纤维腺瘤15个、乳腺炎症5个、乳腺增生4个、乳腺导管内乳头状瘤4个、乳腺导管扩张3个、乳腺脓肿3个、乳腺导管内乳头状瘤伴局部假浸润2个、乳腺囊肿2个、乳腺炎性肌纤维母细胞瘤2个、乳腺良性叶状肿瘤2个、乳腺局灶性非典型性导管增生1个)。
2.2 形态学分析
乳腺癌患者组与乳腺良性疾病患者组形状及边缘等征象存在统计学差异,病灶周围水肿、皮肤增厚、乳头受累、腋窝淋巴结肿大等征象差异无统计学意义(表1、图1)。
2.3 动态增强表现
(1)强化特征:乳腺癌患者组与乳腺良性疾病患者组的强化方式存在统计学差异(表1)。(2)TIC类型:乳腺癌患者组Ⅰ、Ⅱ、Ⅲ型病例分别为7、18、28例,乳腺良性疾病患者Ⅰ、Ⅱ、Ⅲ型病例分别为19、10、5例,两者TIC类型病例数差异比较有统计学意义 (表1)。
2.4 DWI分析
(1)DWI信号表现:乳腺癌患者组与乳腺良性疾病患者组DWI信号表现无统计学差异(表1)。(2)ADC值(×10-3mm2/s):乳腺癌患者组病灶侧ADC值(b=800 s/mm2)为[(1.042±0.019)×10-3mm2/s],对侧正常组织的 ADC 值为[(1.812±0.017)×10-3mm2/s],病灶与对侧正常组织的 ADC 值比较差异有统计学意义(t=-29.503,P=0.001)。乳腺良性疾病患者组病灶侧ADC值为[(1.558±0.022)×10-3mm2/s],对侧正常组织的ADC值为[(1.806±0.018)×10-3mm2/s],病灶与对侧正常组织的ADC值比较差异有统计学意义(t=-8.547,P=0.001)。良恶性组病灶侧ADC值两者间有统计学差异(t=-17.237,P=0.001)。良恶性组对侧正常组织间的ADC值比较差异无统计学意义(t=0.237,P=0.813)。良恶性组rADC值分别为 (0.865±0.014) 、(0.580±0.013),组间差异有统计学意义(t=-15.029,P=0.001)。
表1 乳腺良恶性病变形态学征象、DWI信号及动态增强表现差异比较
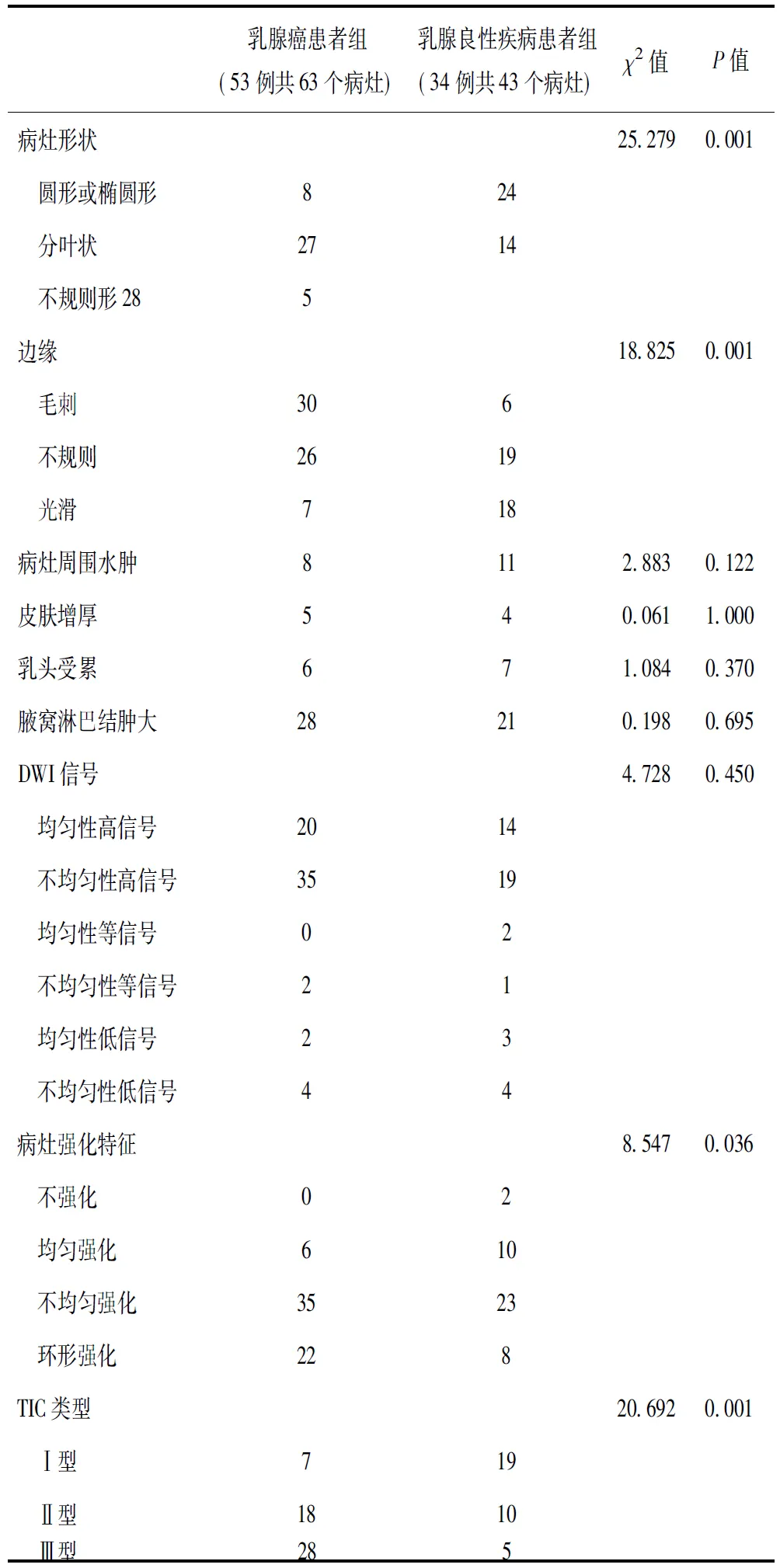
乳腺癌患者组(53例共63个病灶)乳腺良性疾病患者组(34例共43个病灶)χ2值P值病灶形状25 2790 001 圆形或椭圆形824 分叶状2714 不规则形285边缘18 8250 001 毛刺306 不规则2619 光滑718病灶周围水肿8112 8830 122皮肤增厚540 0611 000乳头受累671 0840 370腋窝淋巴结肿大28210 1980 695DWI信号4 7280 450 均匀性高信号2014 不均匀性高信号3519 均匀性等信号02 不均匀性等信号21 均匀性低信号23 不均匀性低信号44病灶强化特征8 5470 036 不强化02 均匀强化610 不均匀强化3523 环形强化228TIC类型20 6920 001 Ⅰ型719 Ⅱ型1810 Ⅲ型285

3 讨论
乳腺疾病日益影响女性健康。良、恶性乳腺疾病的治疗与预后迥异。乳腺MR的优势日益突出,逐渐用于乳腺良恶性疾病的鉴别诊断。
3.1 常规MRI对乳腺癌的诊断价值
目前乳腺常规MRI一般通过观察病灶的形态、边缘、病变周围有无水肿、皮肤有无增厚、乳头受累有无凹陷、腋窝区淋巴结有无肿大等征象来判断病变的良恶性。由于多数恶性肿瘤呈浸润性生长方式,形态一般表现为不规则,边缘呈星芒状或蟹足样毛刺,边界不清。本组研究发现,乳腺癌患者组与乳腺良性疾病患者组病灶的形状及边缘等征象存在统计学差异,但病灶周围水肿、皮肤增厚、乳头受累、腋窝淋巴结肿大等征象无统计学差异。这可能是因为乳腺良恶性肿瘤的常规MRI表现有一定的重叠性,缺乏特征性。且乳腺疾病在发生发展过程中可出现多种组织结构的紊乱,进而表现出多种多样的影像学征象;而且即使同一种乳腺病变的在不同的阶段也可能表现出不同的影像学征象。常规MRI所提供的信息量有限,其诊断价值与 X线钼靶、超声检查等相比无明显优势[6]。
3.2 DCE-MRI对乳腺癌的诊断价值
在MR众多参数成像技术中,DCE-MRI被认为是一个发现与诊断乳腺病变的重要成像技术之一。不同类型的乳腺疾病因其病理组织学基础的不同,其增强后强化模式也不相同。乳腺病灶动态增强时的强化程度与病变组织的微血管密度、血管的通透性及细胞外的间隙等因素密切相关[7-8]。与正常的组织结构对比发现,肿瘤性病变的血管具有更高的通透性;而且恶性肿瘤的级别越高,细胞外间隙会越大。本组研究中,将乳腺病灶的强化特征分为不强化、均匀强化、不均匀强化、环形强化等4种,通过统计发现乳腺良恶性病变的强化方式存在统计学差异。这也说明具有病理组织的乳腺疾病,其增强模式也不相同。
单单凭借人类的肉眼来判定病变组织增强的强化程度及消退情况会与实际的测量值存有较大的差异。TIC因其能准确的、直观的评估病变组织动态增强的变化过程受到人们的重视[9]。TIC作为病变组织血液灌注和流出等多种因素的综合反映,更是临床实践工作中一个能够反映出病灶血供情况的最佳指标。国内外研究[10-11]发现TIC鉴别诊断乳腺疾病具有较高的敏感性和特异性,并对 TIC类型及其对应的乳腺良恶性病变关系趋于统一[12-13]。即良性病变多以Ⅰ型曲线为主,恶性病变多以Ⅲ型曲线为主,而Ⅱ型曲线在良恶性病变中有重叠。本组研究也得出相同结果,TIC类型:乳腺癌患者组Ⅰ、Ⅱ、Ⅲ型病例分别为7、18、28例,乳腺良性疾病患者Ⅰ、Ⅱ、Ⅲ型病例分别为19、10、5例,两者TIC类型病例数差异比较有统计学意义,Ⅰ型中良性病变占73.1%(19/26),Ⅲ型中恶性病变占84.8%(28/33),而Ⅱ型中良恶性病变各占35.7%(10/28) 、64.3%(18/28)。
3.3 DWI对乳腺癌的诊断价值
DWI是一种能活体评价组织中水分子弥散程度的无创性影像学方法,能反映局部微观结构中水的自由扩散程度。这也就使得磁共振成像技术对人体的研究深入到了细胞水平的微观世界[14]。DWI成像技术在乳腺病灶的应用已较为成熟,DWI作为活体内检查水分子活动自由度的一种方法,ADC值取决于水分子运动扩散的程度。水分子运动扩散越缓慢,ADC值就越小,DWI信号也越高。不论是乳腺的良性病变,还是乳腺的恶性肿瘤,都较正常的乳腺组织具有更多的细胞,从而造成肿瘤组织中水分子扩散受限[15]。本组研究中,在b=800 s/mm2时,乳腺癌患者组病灶侧ADC值为[(1.042±0.019)×10-3mm2/s],对侧正常组织的 ADC 值为[(1.812±0.017)×10-3mm2/s];乳腺良性疾病患者组病灶侧ADC值为[(1.558±0.022)×10-3mm2/s],对侧正常组织的 ADC 值为[(1.806±0.018)×10-3mm2/s];良恶性组病灶侧ADC值均低于对侧,且比较差异均有统计学意义。这主要是因为在肿瘤的发生发展过程中,随着肿瘤组织细胞密度的加大,从而导致细胞外体积分数的降低,也就使得 ADC 值的降低。即肿瘤细胞的密度与ADC值呈负相关性[16]。本研究还发现,乳腺癌患者组病灶侧ADC值(b=800 s/mm2)为[(1.042±0.019)×10-3mm2/s]较良性疾病患者组病灶侧ADC值为[(1.558±0.022)×10-3mm2/s]更低,且两者间差异有统计学意义。这可能与恶性肿瘤的细胞密度更大和血管密度更高、细胞外容积更少,以及大分子物质对水分子的吸附作用更强和细胞生物膜的限制作用更厉害等因素有关。国内外就有文献[17]报道指出乳腺癌的恶性程度越高,单位面积内乳腺腺管结构数量就越多、细胞密度就越大及细胞异型性更显著,细胞核浆比更大,水分子扩散受限更显著,导致ADC值更低。
DWI为诊断乳腺病变提供了更多、更有效的评估信息,是乳腺检查中必不可少的序列之一[18]。但作为一种腺体器官的乳腺,在不同的年龄时间阶段、个体、月经周期等都有一定的差异性,且不同的磁共振扫描成像仪器和扫描成像参数对ADC值都有一定的影响,可以部分消除这些ADC值个体差异的rADC值也就被学者们提了出来。王远梅等[19]研究指出rADC值较ADC值对鉴别诊断乳腺良恶性病变有更好的诊断效能。Khouli等[20]也有过相仿的报道。本组研究中,在b=800 s/mm2时,良恶性组rADC值分别为(0.580±0.013)、(0.865±0.014),组间差异也有统计学意义(t=-15.029,P=0.001)。
综上所述,良恶性肿瘤的MRI的形态学征象虽有一定重叠,但3.0T MR 动态增强扫描为观察病变的血流动力学提供了良好基础,乳腺良恶性疾病的TIC曲线类型、扩散加权成像的定量参数ADC值以及rADC值对于鉴别乳腺良恶性病变有较高价值,所以通过准确分析DCE-MRI及DWI提供的多种信息可有助于提高乳腺良恶性病变的诊断准确性。
[1] Jemal A,Bray F,Center MM,etal.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] 汪登斌.乳腺MRI应用现状和我国乳腺MRI应用中存在的问题[J].中华放射学杂志,2014,48(3):177-179.
[3] 万芸,陈树良,田铁桥,等.乳腺MR T1WI动态增强与T2*WI首过灌注成像相结合对乳腺良恶性病变的鉴别诊断[J].临床放射学杂志,2012,31(2):184-187.
[4] Ikeda DM,Hylton NM,Kinkel K,etal.Development, standardization,and testing of a lexicon for reporting contrast-enhanced breast magnetic resonance imaging studies[J].Magn Rason Imaging,2001,13(6):889-895.
[5] 汪晓红,耿道颖,顾雅佳,等.动态增强MRI鉴别乳腺良恶性病变的价值[J].放射学实践,2005,20(8):662-666.
[6] Gohagan JK,Spitznagel EL,Murphy WA,etal.Multispectral analysis of MRI images of the breast[J].Radiology,1987,163(3):703-707.
[7] Vincesini D,Dedieu V,Eliat PA,etal.Magnetic resonance imaging measurements of vascular permeability and extracellular volume fraction of breast tumors by dynamic Gd-DTPA-enhanced relaxometry[J].Magnetic Resonance Imaging,2007,25(3):293-302.
[8] Su MY,Chenung YC,Fruehauf JP,etal.Correlation of dynamic contrast enhancement MRI parameters with microvessel density and VEGF for assessment of angiogenesis in breast cancer[J].J Magn Reson Imaging,2003,18(4):467-477.
[9] 高才良,乐暾,蔡福玲,等.动态增强MRI及扩散加权成像对乳腺癌的诊断价值研究进展[J].磁共振成像,2016,7(3):235-240.
[10]赵红兰,刘颖,程丽,等.3.0T磁共振在乳腺成像中的应用[J].中国CT和MR杂志,2009,7(1):18-22.
[11]Orel SG,Schnall MD.MR imaging of the breast for the detection,diagnosis,and staging of breast cancer[J].Radiology,2001,220(1):13-30.
[12]Khouli RH,Macura KJ,Jacobs MA,etal.Dynamic contrast-enhanced MRI of the breast:quantitative method for kinetic curve type assessment[J].AJR Am J Roentgenol,2009,193(4):295-300.
[13]张小安,刘真真,赵鑫,等.动态增强MRI结合DWI对乳腺病变性质的诊断价值[J].实用放射学杂志,2013,29(4):561-564.
[14]Park SH,Choi HY,Hahn SY.Correlations between apparent diffusion coeffcient values of invasive ductal carcinoma and pathologic factors on diffusion-weighted MRI at 3.0 Tesla[J].J Magn Reson Imaging,2015,41(1):175-182.
[15]Koh DM,Padhani AR.Diffusion-Weighted MRI:a new functional clinical technique for tumour imaging[J].Br J Radiol,2006,79(944):633-635.
[16]徐茂林,苏丹柯,谢东,等.非肿块型强化的乳腺癌磁共振成像表观扩散系数值与HER-2表达的相关性分析[J].磁共振成像,2015,6(3):513-517.
[17]邓丹琼,涂蓉,尤小光,等.磁共振扩散加权成像ADC值与乳腺癌病理组织分级的相关性研究[J].临床放射学杂志,2013,32(10):1428-1431.
[18]赵斌,蔡世蜂,高佩虹,等.MR扩散加权成像鉴别乳腺良恶性病变的研究[J].中华放射学杂志,2005,39(5):497-450.
[19]王远梅,陈昌毅,汪卫兵,等.MRI扩散加权成像对乳腺良恶性病变的诊断[J].放射学实践,2012,27(6):616-619.
[20]Khouli RH,Jacobs MA,Mezban SD,etal.Diffusion-weighted imaging improves the diagnostic accuracy of conventional 3.0-T breast MR imaging[J].Radioiogy,2010,256(1):64-73.
(学术编辑:董国礼)
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
The value of 3.0T MRI DCE-MRI and DWI for the diagnosis of breast cancer combined with histopathology
GAO Cai-liang1,YUE Tun3,ZENG Wen-bing1,CAI Fu-ling2,WU Shan2,LIU Xing-hua1
(1.ChongqingThreeGorgesCentralHospital,Wanzhou404000,Chongqing;2.ChongqingThreeGorgesMedicalCollege,Wanzhou404000,Chongqing;3.NorthSichuanMedicalCollege,Nanchong637000,Sichuan,China)
Objective:To investigate the value of 3.0T MRI dynamic contrast enhanced imaging (DCE-MRI) and diffusion-weighted imaging (DWI) for the diagnosis of breast cancer combined with histopathology.Methods:3.0T MRI data of 53 patients with breast cancer and 34 patients with benign tumor were reviewed;all of patients were confirmed with surgery or biopsy and histopathology.Morphological feature,MRI dynamic contrast enhanced imaging (DCE-MRI),and diffusion-weighted imaging (DWI) manifestation of the lesions were evaluated and statistical difference was compared between breast cancer and benign tumor.Morphological feature included configuration,edge,peri-focal edema,skin thickening,nipple involvement and axillary lymph nodes enlargement.MRI dynamic contrast enhanced imaging (DCE-MRI) included lesion enhancement features and time-signal intensity curve (TIC) performance.DWI included ADC value of benign or malignant lesions,ADC value of the contralateral normal tissue,and relative ADC (rADC) value.Results:There were significant statistical differences among configuration,edge between breast cancer and benign tumor,respectively.No statistical differences could be found among peri-focal edema,spiculated sign,skin thickening,nipple involvement and axillary lymph nodes enlargement.There were significant statistical differences among lesion enhancement features,TIC performance between breast cancer and benign tumor,respectively.No statistical differences could be found DWI signal performance.There were significant statistical differences among ADC value between breast cancer [(1.042±0.019)×10-3mm2/s] and contralateral normal tissue [(1.812±0.017)×10-3mm2/s].There were significant statistical differences among ADC value between benign tumor [(1.558±0.022)×10-3mm2/s] and contralateral normal tissue [(1.806±0.018)×10-3mm2/s].There were significant statistical differences among ADC value between breast cancer [(1.042±0.019)×10-3mm2/s] and benign tumor [(1.558±0.022)×10-3mm2/s].No statistical differences could be found the ADC value of the contralateral normal tissue.There were significant statistical differences among relative ADC (rADC) between breast cancer (0.865±0.014) and benign tumor (0.580±0.013).Conclusion:Benign and malignant tumors MRI morphological signs have some overlapping, dynamic enhancement scanning and DWI quantitative parameters can help identify breast tumors.
Breast lesions;Magnetic resonance imaging;Dynamic contastenhancement MR imaging;Diffusion weighted imaging
10.3969/j.issn.1005-3697.2017.03.016
重庆三峡医药高等专科学校科研苗圃工程项目资助(2014mpxz17); 重庆市万州区科学技术项目(201503016)
2016-10-18
高才良(1984-),男,硕士,住院医师。
曾文兵,E-mail:422817593@qq.com
时间:2017-6-21 18∶09 网络出版地址:http://kns.cnki.net/kcms/detail/51.1254.R.20170621.1809.032.html
1005-3697(2017)03-0371-05
R445.2;R737.9
A

