猪流行性腹泻病毒YL112株的M基因序列分析及其在Vero细胞的传代适应性研究
蓝日国,张书晴,张金秋,苗晋锋,通信作者
(1. 南京农业大学 动物医学院,南京 210095;2. 江苏省农业科学院 国家兽医疫苗工程技术研究中心,南京 210014)
猪流行性腹泻病毒YL112株的M基因序列分析及其在Vero细胞的传代适应性研究
蓝日国1,张书晴1,张金秋2,苗晋锋1,通信作者
(1. 南京农业大学 动物医学院,南京 210095;2. 江苏省农业科学院 国家兽医疫苗工程技术研究中心,南京 210014)
为了解PEDV YL112株与其他不同来源PEDV毒株之间在分子生物学上的差异,对PEDV YL112株的M基因进行了扩增和序列分析。结果表明:PEDV YL112株与参考株的M基因核苷酸同源性在97.9%~99.8%之间,显示出高度保守性。系统进化树分析表明,PEDV YL112株与经典株CV777的亲缘关系较远,而与我国地方流行毒株HLJBY分离株以及HN-XYYYP-2007的亲缘关系较近。为进一步了解该毒株的复制特征,采用Vero 细胞对PEDV YL112株进行体外细胞传代适应性研究。结果表明:经过连续传代培养后,PEDV YL112株对Vero细胞的适应性显著增强,其滴度从第5代的 104.8TCID50/0.1mL 提高至第 40 代的 107.6TCID50/0.1mL。本研究对于分析PEDV的遗传变异规律、了解病毒的致病特征及开发新型疫苗等均具有重要理论和现实意义。
PEDV YL112株;M基因;序列分析;Vero细胞;适应性
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起猪的一种高度接触性肠道传染病,以呕吐、水样腹泻、脱水和仔猪的高死亡率为特征[1-2]。各个阶段的猪群都会发病,尤其是10日龄以内的仔猪,死亡率高达100%。近年来,PED在我国呈高发趋势,给养猪业造成了巨大的经济损失[3-4]。
PEDV属于尼多病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coraonavirus),是具有囊膜的单股正链RNA病毒,基因组全长约28 knt,主要编码纤突蛋白(S)、膜蛋白(M)、囊膜蛋白(E)和核衣壳蛋白(N)等[5]。其中 M蛋白在病毒的组装和出芽过程中起着关键的作用,它不仅与E蛋白一起完成病毒囊膜的组装过程,还可以指导S蛋白[6-7]和核衣壳[8]形成具有出芽能力的病毒颗粒。机体在M蛋白刺激下会产生免疫保护作用,诱导机体产生IFN-α和调控病毒的表达。因此,M蛋白可用于研制PEDV的基因工程疫苗[9-11]。
虽然PEDV只有一个血清型,但各毒株的基因组之间却存在差异[12]。近年来,对我国流行的PEDV毒株出现变异的报道不断增多[13-14]。本研究采用生物信息学软件对PEDV YL112株的M基因进行分析,并与GenBank登录的PEDV参考序列进行核苷酸同源性比较,然后构建系统进化树,以阐明PEDV YL112株的M基因与参考毒株的M基因之间在分子生物学水平上的差异,并采用Vero细胞对PEDV YL112株进行体外适应性培养,为今后开展 PEDV的流行病学研究、病原学研究及疫苗的研制提供理论依据。
1 材料与方法
1.1 病毒和细胞
PEDV YL112株由广西丽原生物股份有限公司于2009年11月至2010年3月期间,分离自广西玉林市某疑似感染PEDV的猪场。Vero细胞由广西丽原生物股份有限公司研发部提供,经检测无外源病毒或支原体污染。
1.2 试剂
胰酶、胎牛血清、DMEM细胞培养基均购自Gibco公司;病毒核酸提取试剂盒(TaKaRaMini BESTViralRNA/DNA Extraction Kit Ver.5.0)、反转录试剂盒【PrimeScriptTMRT Master Mix(Perfect Real Time)】均购自宝生物(大连)工程有限公司;PCR酶FastStart Universal SYBR Green Master (ROX)(Cat.No.04 913 850 001)购自Roche公司;无水乙醇、琼脂糖、DL2000 DNAMarker等购自南京寿德试验器材有限公司;DNA凝胶回收试剂盒购自Axygen公司。
1.3 引物
根据GenBank报告的PEDV M 基因序列(登录号 DQ072726),利用 Oligo6.0软件设计引物,用于扩增PEDV的全长M 基因(854 bp),引物序列如下:
上游引物P1:5′-ACACCTATAGGGCGCCTG TA-3′;
下游引物P2:5′-AACCCTAAGAGGGGCATA GA-3′。
引物由上海英骏生物工程有限公司合成。
1.4 PEDV YL112株 M基因的扩增
取200 µL细胞毒,用TaKaRa核酸提取试剂盒提取病毒RNA,溶于30 μL的RNase Free dH2O中,置于-80 ℃保存备用。然后按照TaKaRa反转录试剂盒使用说明书进行反转录。反应条件:37 ℃作用15 min,85 ℃作用5 s,暂存4 ℃,完成后将反转录产物于-20 ℃保存备用。下一步进行M基因的PCR扩增,在25 µL反应体系中加入1 µL反转录产物,相应的上、下游引物各10 pmol,Mix12.5 µL,灭菌三蒸水补足25 µL。反应条件:94 ℃预变性 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃1 min,33个循环;72 ℃延伸10 min。PCR产物(扩增长度 854 bp)于 2%琼脂糖凝胶中电泳检测,凝胶成像系统下观察PCR扩增结果后,按照Axygen公司的凝胶回收试剂盒说明回收PCR产物后,送往上海华大基因测序。
1.5 PEDV YL112株M基因遗传进化分析
用DNAStar软件将PEDV YL112株M基因测序结果与GenBank登录的PEDV不同毒株的M基因序列进行核苷酸同源性分析,并应用生物信息学软件MEGA 7. 0绘制系统发育树(NJ方法,比对值为1 000次重复)。参考毒株见表1。

表1 PEDV参考毒株
1.6 Vero细胞染色体的制备及核型分析
将Vero细胞用含10% FBS的DMEM进行常规培养,显微镜观察细胞的形态学特征,并记录每代Vero细胞长成致密的单层所需的时间。向处于对数生长期的Vero细胞中加入适量的秋水仙素使其终浓度为0.1 μg/mL,继续培养5~6 h后,消化、离心并弃上清。于离心管中加入7 mL 0.075 mol/L的氯化钾溶液,低渗处理细胞30 min后,向其中加入少量新鲜配制的固定液(V甲醇:V冰醋酸=3:1),轻轻混匀后置于37 ℃水浴10 min,1 000 r/min离心10 min,弃上清。沿管壁缓慢加入上述固定液8 mL,轻轻混匀后于37 ℃水浴20 min,1 000 r/min离心10 min,弃上清,重复该步骤3次。第3次弃上清后于离心管中加入0.5 mL固定液,轻轻重悬细胞。用该细胞悬液向已预冷的载玻片上滴片(2~3滴/片),姬姆萨染液染色5~10 min后,用细水冲去多余染料。于油镜下观察细胞染色体核型,并记录其染色体的数量。
1.7 PEDV YL112株的体外细胞适应性传代
将 PEDV YL112毒株用含 10 µg/mL胰酶的DMEM作10-4稀释,接种于正常生长的Vero细胞,每瓶1 mL,37 ℃、5% CO2条件下吸附1 h后,每个小方瓶补充4 mL含有10 µg/mL胰酶的DMEM维持液继续培养2~3 d,待细胞80%出现病变时收获病毒,放置于-70 ℃保存,得第1代毒。同样方法,将上述第1代毒在Vero细胞上进行细胞适应性传代。收集各代次病毒,-70 ℃保存备用。
1.8 毒价测定
将常规培养的Vero细胞接种于96孔细胞培养板中,待细胞达到90%融合度时,弃去培养液,并用无菌PBS清洗细胞两遍。然后将PEDV YL112病毒按 10倍比稀释法用维持液(含有 10 µg/mL胰酶的DMEM)进行梯度稀释,10-1~10-8每个稀释度分别接种于96孔板中的Vero细胞,每个稀释度接种5孔,每孔100 µL,并设置5孔细胞对照。37 ℃、5% CO2条件下吸附1 h后,加入维持液至200 µL,置于CO2培养箱中37 ℃继续培养。逐日观察,记录结果。从原代起,每隔5代进行一次病毒含量测定。按Reed-Muench法计算TCID50。
2 结果
2.1 PEDV YL112株细胞毒M基因的扩增
PCR扩增产物经2%琼脂糖凝胶电泳检测,结果出现长度约850 bp的特异性条带,与预期结果一致(图1)。

图1 PEDV YL112株M基因PCR扩增结果
2.2 PEDV YL112株M基因的遗传进化分析
测序结果显示,PEDV YL112株M基因序列长度为854 bp,无插入或缺失。运用DNAStar软件将该序列与GenBank登录的PEDV不同毒株的M基因进行核苷酸同源性分析,结果发现 PEDV YL112株与各参考株的 M基因核苷酸同源性在97.9%~99.8%之间。用Mega5.0绘制M基因系统进化树如图2所示。
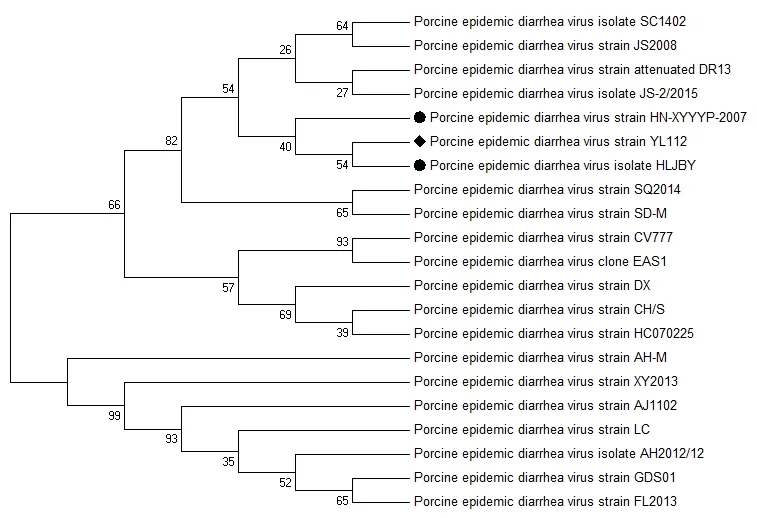
图2 PEDV YL112株M基因系统进化树
分析发现,包括PEDV YL112株在内的21株PEDV毒株明显分成了两个群,其中一群是以经典毒株CV777为代表的早期流行毒株,2010年前分离的所有参考毒株均属于该群;另外一群均为2010年以后出现的中国地方流行毒株。从进化树中可以看出,PEDV YL112株是早期流行毒株群成员之一,但其在群内与经典毒株CV777的亲缘关系较远,而与我国地方流行毒株 HLJBY以及HN-XYYYP-2007的亲缘关系较近(图2)。
2.3 Vero细胞染色体特征及数目
仔细观察吉姆萨染色后的Vero细胞染色体标本,发现本试验所用的Vero细胞染色体数目众多,且大小差异较大(图3)。在显微镜下记录一个完整细胞的染色体数目,约为 59~60条,即 2n=59~60,与预期结果一致。

图3 Vero细胞核型分析(100×)
2.4 PEDV YL112株的体外细胞传代适应性
由毒价测定结果可知(表2),随着 PEDV YL112株连续传代次数增加,病毒滴度也逐渐提高,从第5代的 104.8TCID50/0.1mL 提高至第35代的107.6TCID50/0.1mL。继续传代至40代,病毒滴度基本稳定在较高水平(107.6TCID50/0.1mL),没有进一步的显著提升。

表2 PEDV YL112株各代次毒价测定情况
3 讨论
PEDV疫苗很早就应用于猪流行性腹泻的防控,但该病依旧在免疫猪群发生。尤其是2010年以来,我国多个省份相继出现PED的爆发,导致大量新生仔猪发病死亡,严重影响了我国养猪业的发展。该病的再次流行引起了人们的广泛关注。
2009年11月至2010年3月期间,广西玉林市某猪场疑似感染PEDV。本研究首先对分离于该地区的PEDV YL112株进行了M基因的核苷酸同源性分析,发现该毒株与各参考毒株M基因之间的核苷酸同源性在97.9%~99.8%之间,显示出M基因在PEDV毒株进化过程中具有高度的保守性。系统进化树分析表明,PEDV YL112株与经典疫苗株CV777的亲缘关系较远,而与我国地方流行毒株HLJBY及HN-XYYYP-2007的亲缘关系较近。从时间维度来看,2010年以前中国流行的PEDV毒株大都与经典毒株CV777相似性较高,而2010年以来,PEDV中国流行毒株开始出现变异现象[15],PEDV YL112株正好处于过渡阶段,与系统进化树分析结果一致(图2)。该结果表明广西地区当时出现的流行株与早期使用的疫苗株相比已发生变异,这与临床上常规疫苗免疫预防效果差的现象相符[16]。这也提示要进一步加强对PEDV的分子流行病学调查和病原生态学研究,为制定合理的免疫预防策略提供及时有效的数据参考。
PEDV的体外细胞适应一直是制约病原研究及疫苗开发的瓶颈。目前,普遍认为添加了胰酶的Vero细胞可以用于PEDV的分离培养[17-18]。为进一步了解PEDV YL112株的复制特征,本研究采用Vero 细胞对该毒株进行体外适应性传代。试验用于培养病毒的Vero细胞形态正常,生长状况良好,细胞核型正确,符合病毒培养的需要。通过对病毒连续传代,发现随着代次的增加,病毒的滴度也逐渐提高,最后达到了107.6TCID50/0.1mL,并且维持在较高水平,表明该毒株高度适应了Vero细胞培养。这对于进一步了解该毒株的致病性、免疫原性及后续的疫苗研究均具有重要的现实意义。
本研究对PEDV YL112株进行了M基因的扩增和序列分析,对该毒株在PEDV国内流行毒株遗传进化上的地位有了初步的认识。同时,将PEDV YL112株在Vero细胞上进行传代培养,使毒株高度适应了 Vero细胞,成功获得高滴度的PEDV细胞毒株,为下一步进行 PEDV的致病性研究及疫苗开发提供了试验依据。
[1] Have P,Moving V,Svansson V,et al. Coronavirus infection in mink(Mustela vision). Serological evidence of infection with a coronavirus related to transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J]. Vet Microbiol,1992, 31(1):1-10.
[2] Gao Y Y,Kou Q W,Ge X N,et al. Phylogenetic analysis of porcine epidemic diarrhea virus field strains prevailing recently in China[J]. Arch Virol, 2013, 158(3):711-715.
[3] Sun R Q,Cai R J,Chen Y Q,et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China[J]. Emerg Infect Dis, 2012, 18(1):161-163.
[4] Li R F,Tian X Q,Liu Y,et al. Isolation and genetic analysis of a variant porcine epidemic diarrhea virus in China[J]. Pol J Vet Sci, 2016,19(1):65-73.
[5] Hofmann M,Wyler R. Quantitation, biological and physicochemical properties of cell culture-adapted porcine epidemic diarrhea coronavirus (PEDV)[J]. Vet Microbiol,1989, 20(2):131-142.
[6] Nguyen V P,Hogue B G. Protein interactions during coronavirus assembly[J]. J Virol, 1997,71(12):9278-9284.
[7] Opstelten D J,Raamsman M J,Wolfs K,et al. Envelope glycoprotein interactions in coronavirus assembly[J]. J Cell Biol, 1995,131(2):339-349.
[8] Narayanan K,Maeda A,Maeda J,et al. Characterization of the coronavirus M protein and nucleocapsid interaction in infected cells[J]. J Virol, 2000,74(17):8127-8134.
[9] Yang D Q,Ge F F,Ju H B,et al. Whole-genome analysis of porcine epidemic diarrhea virus(PEDV)from eastern China[J]. Arch Virol, 2014,159(10):2777-2785.
[10] Fan J H,Li Y J. Cloning and sequence analysis of the M gene of porcine epidemic diarrhea virus LJB/03[J]. Virus Genes, 2005,30(1):69-73.
[11] Siu K L,Kok K H,Ng M H,et al. Severe acute respiratory syndrome coronavirus M protein inhibits type I interferon production by impeding the formation of TRAF3-TANKTBK1/IKKepsilon complex[J]. J Biol Chem, 2009, 284(24):16202-16209.
[12] Fan J H,Zuo Y Z,Li J H,et al. Heterogeneity in membrane protein genes of porcine epidemic diarrhea viruses isolated in China[J]. Virus Genes, 2012, 45(1):113-117.
[13] Fan B,Jiao D,Zhao X,et al. Characterization of chinese porcine epidemic diarrhea virus with novel insertions and deletions in genome[J]. Sci Rep, 2017,7: 44209.
[14] Chen F,Zhu Y,Wu M,et al. Comparative genomic analysis of classical and variant virulent parental/attenuated strains of porcine epidemic diarrhea virus[J].Viruses, 2015, 7(10):5525-5538.
[15] 毕静. 猪流行性腹泻病毒AJ1102株的分离、鉴定及其分子进化特征[D]. 武汉:华中农业大学, 2013.
[16] 卢冰霞,秦毅斌,何颖,等. 2011年—2014年广西猪流行性腹泻病毒检测及其M基因的序列分析[J]. 中国畜牧兽医, 2015(03):549-557.
[17] 李树根,李力施,霍燕琼,等. 使用细胞培养单层分离猪流行性腹泻病毒[J]. 中国兽医科技, 1991, 21(10):26-27.
[18] Zhang W,Brown S C,Moran C. Alanyl aminopeptidase N(ANPEP)microsatellite: now a framework marker on porcine chromosome 7 map[J]. Anim Genet, 1996, 27(5):378-379.
责任编辑:宗淑萍
Sequence Analysis of the M gene of Porcine Epidemic Diarrhea VirusYL112 Strain and Its Adaptation to Vero Cells
LAN Ri-guo1, ZHANG Shu-qing1, ZHANG Jin-qiu2, MIAO Jin-feng1,CorrespondingAuthor
(1. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China; 2.National Research Center for Veterinary Vaccine Engineering and Technology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
To analyze the genetic variation between PEDV YL112 strain and other isolates, the M gene of PEDV YL112 strain was amplified and sequenced. The M gene of PEDV YL112 strain shared 97.9%-99.8% homology with PEDV reference strains.Phylogenetic analysis indicated that PEDV YL112 strain was genetically close to isolates HLJBY and HN-XYYYP-2007 rather than the classic strain CV777. Furthermore, adaptation of PEDV YL112 to Vero cells was conducted and its titer significantly increased from 104.8TCID50/0.1mL to 107.6TCID50/0.1mL by cellular adaptation. These results may contribute to further study on the genetic evolution, viral virulence and new vaccines of PEDV.
PEDV YL112; M gene; sequence analysis; Vero cells; adaptation
S858.28
:A
2017-03-29
国家自然科学基金项目“线粒体MAVS 蛋白在抗H3N2亚型猪流感病毒感染过程中的作用”(31201873);国家自然科学基金项目“肌醇磷脂-Ca2+-NFAT途径在牛磺酸缓解乳房链球菌感染中的作用”(31672515)
蓝日国(1993-),男,广西梧州人,本科在读,主要从事动物健康调控的研究。
苗晋锋(1976-),男,河南新乡人,副教授,博士,主要从事动物健康调控的研究。E-mail:mjf171647@126.com。
1008-5394(2017)02-0034-05

