血清中皮质醇成分分析标准物质的研制*
王孜一,戴新华,刘照,李红梅,王绍利
(1.中国计量科学研究院,北京 100013; 2.常州市计量测试技术研究所,江苏常州 213164)
血清中皮质醇成分分析标准物质的研制*
王孜一1,2,戴新华1,刘照1,李红梅1,王绍利2
(1.中国计量科学研究院,北京 100013; 2.常州市计量测试技术研究所,江苏常州 213164)
皮质醇是一种重要的肾上腺皮质激素,同时也是一种重要的临床诊断标志物,为保证检测结果具有溯源性、可比性和准确性,研制了血清中皮质醇成分分析标准物质。对血清样品进行分离、过滤、混匀、分装,进行均匀性检验、稳定性考察和定值分析。采用超高效液相色谱-同位素稀释串联质谱(UPLC-ID-MS/MS)法进行定值,混合健康男性血清和健康女性血清中皮质醇的定值结果分别为107.63 ng/g(U=1.44 ng/g,k=2), 92.24 ng/g (U=1.68 ng/g,k=2)。采用CCQM-K63a比对样品对定值方法进行验证,测量结果在该比对参考值的不确定度范围内。研制的皮质醇成分分析标准物质符合国家一级标准物质技术要求。
血清;皮质醇;标准物质;同位素稀释质谱法
AbstractHydrocortisone is an important kind of adrenocortical hormone,as well as an important kind of clinical diagnosis marker. For the purpose of the traceability,comparability and accuracy of detection results,hydrocortisone reference material was developed. Serum was filtrated, mingled and packed, and the value determination, homogeneity examination and stability investigation were conducted. The certi fied value of reference material was determined by ultra high performance liquid chromatography-isotope dilution tandem mass spectrometry (HPLC-ID-MS/MS). The content of hydrocortisone in healthy male and health female serum determined by this method were 107.63 ng/g (U=1.44 ng/g,k=2) and 92.24 ng/g (U=1.68 ng/g,k=2),respectively. Meanwhile, the method was veri fied by the comparison sample of CCQM-K63a and the measured value was within the range of uncertainty of this comparison’s reference value. Experimental results showed that, serum hydrocortisone component analysis reference material met the requirements of technical norm of national primary reference material.
Keywordsserum; hydrocortisone; reference material; isotope dilution mass spectrometry
皮质醇是一种重要的肾上腺皮质激素[1],在体液循环中大部分与蛋白质键合。皮质醇不仅对调节人体中脂肪和蛋白质的代谢发挥重要作用,而且对免疫系统和其它内分泌系统亦发挥重要作用[2]。在当前临床医学和药物学的研究中,皮质醇是一种非常重要的临床诊断标志物,临床上常以血清中皮质醇浓度作为筛选肾上腺皮质功能异常的首选指标。如果血清中皮质醇水平升高,则反映出常见疾病有肾上腺皮质功能亢进、双测肾上腺皮质增生或肿瘤等,另外非肾上腺疾病,如慢性肝病、妊娠及雌激素治疗等也会引起血清中皮质醇的增高;如果血清中皮质醇降低则反映出肾上腺皮质功能减退、垂体功能减退等。因此准确测定血清中皮质醇的含量,对于临床正确诊断肾上腺功能尤为重要。血清中皮质醇的常规检测方法有免疫分析法[3-4]、液相色谱法[5-7]、气相色谱 - 质谱联用法[8-9]、液相色谱 - 质谱联用法[10-12]。不同检测方法得到的测量结果有较大的差异,为了实现测量结果的准确性和可比性,需要建立完善的临床检验量值溯源体系,其中标准物质的研制就是量值溯源体系建立过程中的重要环节。
目前国内尚无血清中皮质醇成分分析标准物质。为了满足临床检测需求,笔者研制了血清中皮质醇成分分析标准物质(以下简称血清中皮质醇标准物质)。采用超高液相色谱-同位素稀释质谱法(UPLC-ID-MS/MS)[10,12-13]结合单点校正法[14],按照ISO Guide35[15]和JJG 1006-1994 《国家一级标准物质技术规范》[16]的要求对血清中皮质醇标准物质样品进行均匀性检验和稳定性考察,然后定值并对定值结果的不确定度进行了评定。
1 实验部分
1.1 主要仪器与试剂
超高效液相色谱-三重四极杆质谱联用仪:Xevo TQS型,美国Waters公司;
固相萃取柱:Sep-Pak C18Catridges (500 mg),美国Waters公司;
氮吹仪:美国Organomation公司;
电子天平:XP205型,最小分度值为0.01 mg,瑞士METTLER TOLEDO公司;
涡 旋 振 荡 器:Touch Mixer MT-51型,日 本Yamata公司;
超声波清洗机:Branson5510型,美国Branson公司;
纯 水 处 理 系 统:Mill-Q Academic型,法 国Millipore公司;
移液器:20,200,1 000,5 000 μL,德国 Eppendorf公司;
甲醇、乙腈、乙酸乙酯:色谱级,德国Merck公司;甲酸:质谱级,美国Sigma公司;
皮质醇纯品:采用质量平衡法进行定值,确定其纯度为(99.0±0.4)%,德国Dr公司;
皮质醇同位素标记物 ([9,11,12,12-D4]皮质醇):标示纯度大于98%,美国剑桥实验室;
血清样品:-70℃冰冻保存,北京安贞医院和军事医学科学院提供。
1.2 皮质醇纯度的确定
采用质量平衡法对皮质醇纯品进行纯度测定,并采用定量核磁法进行了验证,经过均匀性检验和稳定性考察,最终得到其纯度值。
1.3 标准溶液和内标溶液的配制
标准溶液和内标溶液为皮质醇和[9,11,12,12-D4]皮质醇的无水甲醇溶液,均为重量法配制。配制成质量分数为1.0 mg/g的标准储备溶液,于-20℃下密封保存。
1.4 血清皮质醇标准物质制备
1.4.1 血液的采集与检验
血清原料由安贞医院和军事医学科学院提供,分为健康男性血清和健康女性血清。对献血者进行血型及5项指标(艾滋、梅毒、乙肝、丙肝、转氨酶)检测,均合格。
1.4.2 血清的分离
血液采集后在室温放置2 h,再在4℃下放置4~6 h以保证血液充分凝固,剔除溶血或乳糜血。血清分离采用低温大容量血液离心机以3 500 r/min离心2次,每次10 min。小心将血清移入另一不含任何添加剂或抗凝剂的采血袋中,于-20℃保存,以备血清混合和后续工艺。
1.4.3 血清的混合
将预定数量符合要求的血清融化混合,放入相应体积容器(如5 L大立瓶,此容器应按照严格程序进行清洗和灭菌除热原),混合时间不少于30 min,以保证充分混匀。
1.4.4 去除蛋白质
将混匀后的血清无菌转入已处理的离心瓶,采用高速冷冻离心机,以6 000 r/min,于4℃下离心30 min,以去除纤维蛋白等固形物质。小心收集离心上清液,必要时可进行再离心以保证完全清除纤维蛋白等固形物质。
1.4.5 除菌过滤分装
除菌过滤和分装在百级分装间进行,严格按血液生物制品的除菌分装程序操作。混合后的血清先后经0.45μm和0.22 μm滤膜过滤至大立瓶,大立瓶放在搅拌器上进行搅拌,以防止血清上下分层造成不均匀。血清经过滤后采用5 mL冻存管分装,每支装2.5 mL血清,分装完毕2 h内冻存于-70℃冰箱中。
1.5 仪器条件
1.5.1 液相色谱条件
色谱柱:ACQUIT UPLC BEH C18柱(50 mm×2.1 mm,1.7 µm,美国 Waters公司);流动相:甲醇 -为含0.1%的甲酸水溶液(体积比60∶40),等度洗脱,流量为0.4 mL/min;进样体积:5 µL ;运行时间:3.5 min。
1.5.2 质谱条件
采用电喷雾离子源(ESI)对样品进行离子化;在正离子模式下进行扫描;毛细管电压:2.90 kV;锥孔电压:16 V;脱溶剂气体:N2,温度为400℃,流速为1 000 L/h;锥孔气流量:150 L/h;喷雾器压力:7.0×105Pa;采用多反应离子监测(MRM)方式,皮质醇和皮质醇同位素的母离子分别为m/z363.22,367.29;选择相应的子离子m/z121.06,121.14作为定量离子对血清中皮质醇含量进行测定。
2 均匀性检验
根据JJG 1006-1994[16]和JJG 1343-2012[17]对研制的标准物质进行均匀性检验。抽样检验方法:从血清中随机抽取11个包装,进行瓶间均匀性检验;每一瓶分别取3个子样,每个子样测量3次,进行瓶内均匀性检验。两种血清的均匀性检验结果见表1。
男性血清中皮质醇含量总平均值=107.632,F=1.13 ;F0.05(10,22)=2.75,F<F0.05(10,22)。
女性血清中皮质醇含量总平均值=92.234,F=0.58 ;F0.05(10,22)=2.75,F<F0.05(10,22)。
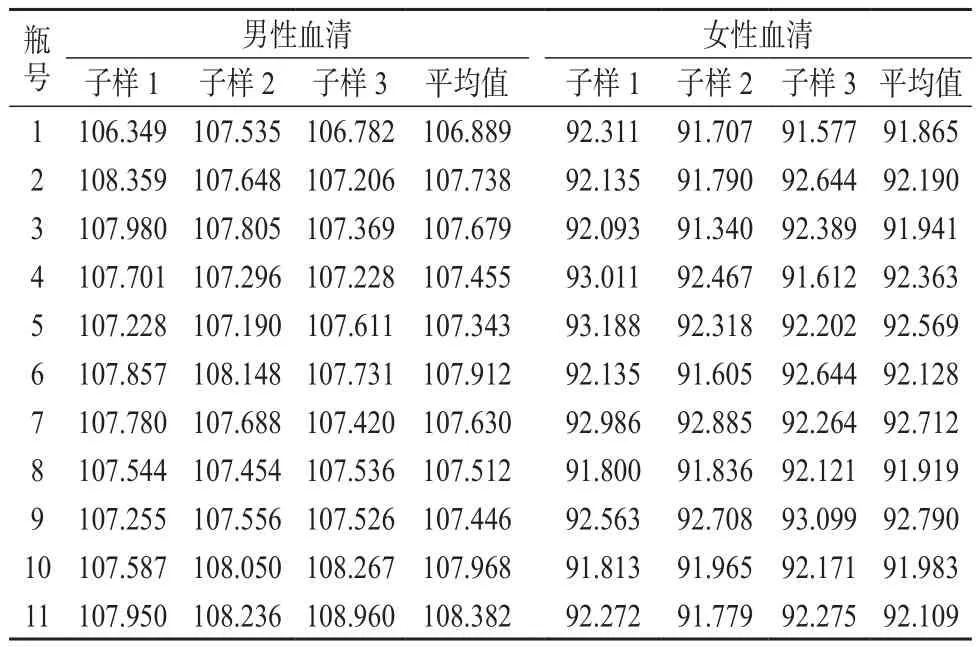
表1 血清中皮质醇标准物质均匀性检验结果 μg/g
根据JJG 1006-1994[16]和JJG 1343-2012[17]中的要求,采用F检验法对研制的标准物质进行均匀性检验,通过比较组间方差和组内方差,二者的比值小于统计检验的临界值,故两种血清中的皮质醇含量是均匀的。
3 稳定性考察
根据标准物质研制技术规范的要求,考察样品在-70℃下的长期稳定性。一级标准物质的稳定性应在12个月以上。长期稳定性是样品在规定的保存条件下,按先密后疏的原则,用UPLC-ID-MS/MS同位素稀释质谱法采取同步稳定性评估的方法对在 -70℃储存 1,3,6,12 个月的样品进行抽样,检测其含量的变化。短期稳定性是在(-20±5)℃及(4±5)℃温度范围内,采取同步稳定性评估的方法,用HPLC-ID-MS/MS法分别对储存4周和7天的样品进行稳定性监测。冻融性试验是采取同步稳定性评估的方法,用HPLC-ID-MS/MS法分别对冻融1次和2次的样品进行稳定性监测。一般每次取2包装,每个包装取3个子样,测3次,取平均值。两种血清的稳定性考察结果见表2。
血清中皮质醇样品经过12个月的稳定性考察,在不同时间的测量结果采用趋势分析,即线性拟合。对表3数据进行分析计算。利用稳定性评估基本模型公式Y=β0-β1X,经过计算得各参数值见表3。
由表3数据可知,对于男性血清和女性血清,均有|β1|<ts(β1),可见研制的标准物质在 12 个月内稳定性良好。
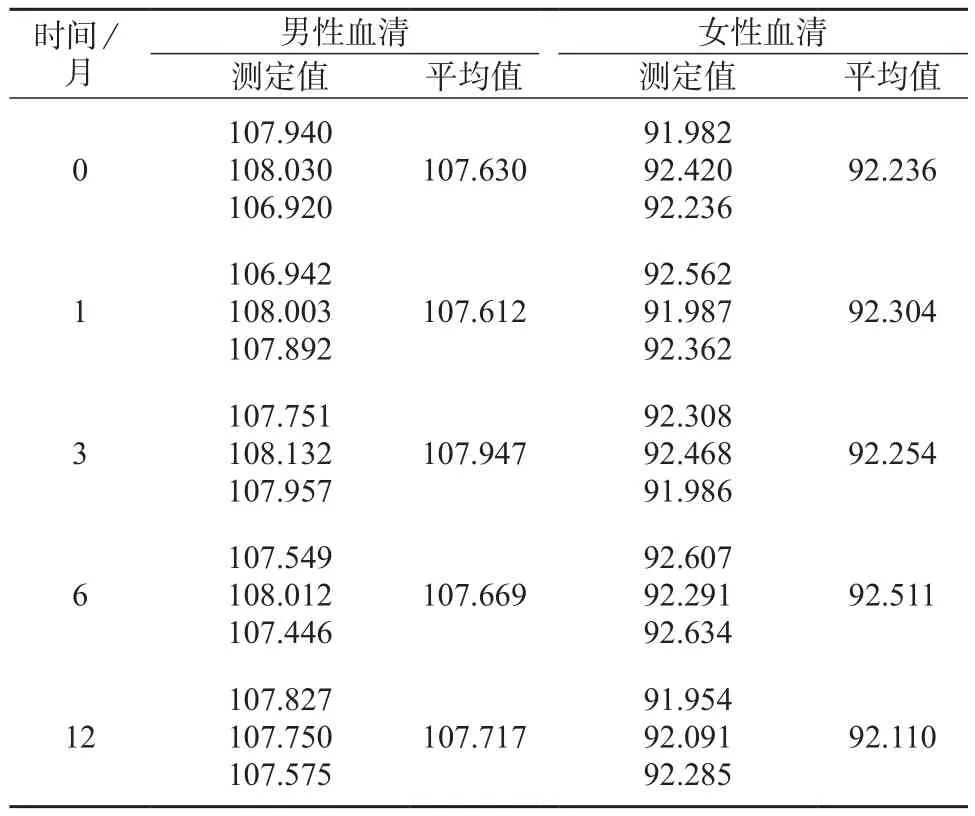
表2 血清中皮质醇的稳定性考察结果 μg/g
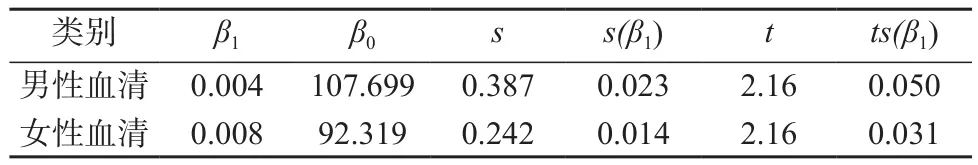
表3 血清中皮质醇的长期稳定性考察结果
4 定值
采用UPLC-ID-MS/MS方法测量血清中皮质醇的浓度,分别随机抽取研制2种不同血清标准物质样品各11支,每支样品分别取3个子样,进行样品前处理。测定时采用单点校准法[12],每个样品与其标准同一批测定,分析时以标准、样品、标准、样品的顺序进样,每个样品用前一个标准校准,每个标准及样品重复进样测定3次,以所得结果的均值作为该样品的测量结果,血清中皮质醇浓度的标准值为11支样品测量值的平均值。
4.1 样品前处理
将血清样品从-70℃冰箱中取出,放置于室温平衡2 h,轻微振荡混合均匀,避免产生气泡。用取样器取下层无气泡的血清0.5 mL加入10 mL离心管中称量,根据血清样品中皮质醇的浓度,向样品中加入皮质醇内标溶液,使其中皮质醇与内标物的比接近1∶1,称量质量。血清样品中加入6 mL 0.5 mol/L的磷酸调节pH值至1.5,静置,在室温下平衡1 h。平衡后,用固相萃取(SPE)柱分离血清中的皮质醇。SPE柱先用5 mL甲醇和5 mL水活化,然后以3~4 mL/min的速度上样,用12 mL水和5 mL水-乙腈(体积比80∶20)淋洗,最后用2 mL甲醇洗脱,洗脱液在40℃下氮气吹干,用0.5 mL水复溶后,以1 mL乙酸乙酯萃取2次,将两次萃取液合并,在40℃下用氮气吹干。然后用2.5 mL流动相复溶,充分涡旋以保证完全溶解。用0.22 μm有机膜过滤,移至色谱分析瓶中,将样品进行HPLC-MS/MS分析,色谱图见如图1。
图1 血清样品的MRM色谱图
4.2 方法确认
采用定值方法对CCQM-K63a比对样品(其比对结果的参考值为100.46 ng/g,扩展不确定度为1.83 ng/g)进行测定,测定结果为100.28 ng/g,相对偏差为0.42%,测量结果在比对参考值的不确定度范围内,证明定值方法的准确性良好。
4.3 方法检出限和定量限
采用仪器自带数据处理软件计算出不同浓度血清中皮质醇样品的信噪比,逐渐稀释样品至信噪比S/N=10时,根据稀释倍数计算出血清中皮质醇的质量分数,计算得该方法的定量限为LOQ=0.05 ng/g;当稀释至S/N=3时,计算得检出限为LOD=0.014 ng/g。
4.4 定值结果
男性血清和女性血清中皮质醇含量不同,经过测量和计算,两种不同血清中皮质醇定值结果见表4。

表4 血清中皮质醇标准物质定值结果
5 定值结果的不确定度评定
根据ISO,EURACHEM导则和测量不确定度评定与表示,对血清中皮质醇测量结果的不确定度进行评定。
5.1 不确定度来源
血清中皮质醇标准物质定值结果的不确定度由3部分组成:标准物质的不均匀性引入的不确定度ubb;标准物质的不稳定性引入的不确定度uls;标准物质定值过程引入的不确定度uchar。
5.2 不确定度分量
(1) 标准物质定值的不确定度由仪器测量重复性引入的A类不确定度uA和样品称量、标准配制、纯品标准物质引入的B类不确定度uB合成得到,
(2) 均匀性引入的不确定度,用方差分析法进行计算,得到标准物质均匀性引入的不确定度ubb。
(3) 稳定性引入的不确定度,血清中皮质醇的稳定性考察结果表明血清中皮质醇在考察期间是稳定的。采用趋势分析进行计算,得到标准物质稳定性引入的不确定度uls。
各不确定度分量评定结果见表5。
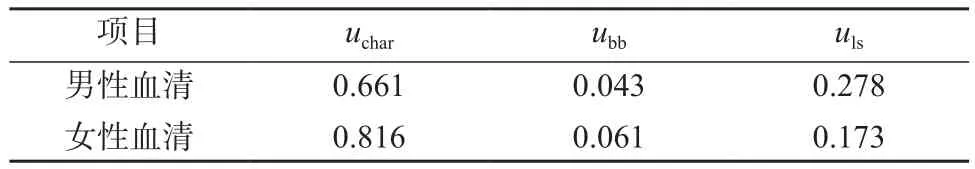
表5 定值不确定度分量评定结果 ng/g
5.3 不确定度合成

表6 血清中皮质醇标准物质的标准值和不确定度 ng/g
6 结论
(1)研制血清皮质醇标准物质,采用超高效液相色谱-同位素稀释质谱法对该标准物质进行定值。该标准物质研制技术路线、样品制备及定值方法的选择充分考虑了目前国内外相关限量要求和检测方法特点,均匀性和稳定性良好,符合国家一级标准物质技术规范要求。
(2)该标准物质可用于临床检验、卫生检验检疫等分析测试领域中分析仪器的校准、分析方法的确认评价以及实验室测量质量控制等。
[1] Petuku M M,McLauchlin M,Vuppu A K,et al. Detection of FITC-cortisol via Modulated Supraparticle Lighthouses[J]. AnalyticalChemistry,2006,78(5): 1 405-1 411.
[2] 王孜一,戴新华,张伟,等. 皮质醇纯物质中杂质分析与定值[J].质谱学报,2014,35(5): 413-419.
[3] Rowe L,Deo S,Shofner J,et al. Aequorin-based homogeneous cortisol immunoassay for analysis of saliva samples[J].Bioconjugate Chemistry,2007,18(6): 1 772-1 777.
[4] Gray G,Shakerdi L,Wallace A M. Poor speci ficity and recovery of urinary free cortisol as determined by the Bayer ADVIA Centaur extraction method[J]. Annals Clinical biochemistry,2003,40(5):563-565.
[5] Schoneshofer M,Kage A,Weber B,et al. Determination of urinary free cortisol by “on-line”liquid chromatography[J]. Clinical Chemistry,1985,31(4): 564-568.
[6] Kabra P M,Tsai L L,Manon L J. Improved liquid-chromatographic method for determination of serum cortisol[J]. Clinical Chemistry,1979,25(7): 1 293-1 296.
[7] Schoneshofer M,Fenner A,Altinok G,et al. Specific and practicable assessment of urinary free cortisol by combination of automatic high-pressure liquid chromatography and radioimmunoassay[J]. Clinica Chimica Acta,1980,106(1):63-73.
[8] Kasuya Y,Yokokawa A,Shibasaki H,et al. Measurement of cortisol secretion rate by stable isotope methodology following oral administration of3C-labeled cortisol to a human subject[J].Steroids,2002,67(9): 783-788.
[9] Thienpont L,Siekmann L,Lawson A. Development,validation,and certification by isotope dilution gas chromatography-mass spectrometry of lyophilized human serum reference materials for cortisol (CRM 192 and 193) and progesterone (CRM 347 and 348)[J]. Clinical Chemistry,1991,37(4): 540-546.
[10] Tai S S,Welch M J. Development and evaluation of a candidate reference method for the determination of total cortisol in human serum using isotope dilution liquid chromatography/mass spectrometry and liquid chromatography/tandem mass spectrometry[J]. Analytical Chemistry,2004,76(4):1 008-1 014.
[11] Taylor R L,Machacek D,Singh R J. Validation of a highthroughput liquid chromatography-tandem mass spectrometry method for urinary cortisol and cortisone[J]. Clinical Chemistry,2002,48(9): 1 511-1 519.
[12] Tai S S,Xu B,Welch M J. Development and evaluation of a candidate reference measurement procedure for the determination of progesterone in human serum using isotope-dilution liquid chromatography/tandem mass spectrometry[J]. Analytical Chemistry,2004,78(18): 6 628-6 633.
[13] 周剑,王敏,汤晓艳,等. 超声萃取-同位素稀释液相色谱-质谱法检测血清中氢化可的松[J].分析化学,2013,41(9):1 439-1 443.
[14] Thienpont L M,Van Nieuwenhove B,Stöckl D,et al. Calibration for isotope dilution mass spectrometry-description of an alternative to the bracketing procedure[J]. Journal of mass spectrometry,1996,31(10): 1 119-1 125.
[15] ISO Guide 35 Reference Materials—General and Statistical Principles for Certi fication[S].
[16] JJG 1006-1994 一级标准物质技术规范[S].
[17] JJF 1343-2012 标准物质定值的通用原则及统计学原理[S].
团簇质谱、光谱为合成氨催化剂提供新思路
许多能源相关的化学过程中,化学反应是在具有催化功能的界面或者团簇分子表面上发生的。要弄清团簇和催化表面的反应机理,在原子分子层次上研究团簇以及表面相关的化学反应过程是非常必要的。不久前,中国科学院大连化学物理研究所复合氢化物材料化学研究组研究员陈萍团队和分子反应动力学国家重点实验室团簇光谱与动力学研究组研究员江凌团队合作在合成氨反应机理研究中取得新进展,相关结果发表在《德国应用化学》(Angew Chem Int Ed,DOI:10.1002/ange.201703864)上,并被选为“热点文章”。
实现温和条件下氨的高效合成一直是催化领域的重要研究课题。陈萍团队首次报道了具有优异低温活性的LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理:LiH作为第二催化中心,可以转移过渡金属表面的氮物种形成Li2NH/LiNH2,继而加氢放氨。这种双中心的催化机制打破了单一过渡金属上反应物种的活化能垒和吸附能之间的限制关系,使得氨的低温低压合成成为可能(Nature Chemistry,2017,9,64)。而该催化剂上氮的活化和转移转化的微观机制尚有待深入研究。
在该工作中,大连化物所研究团队以LiH-Fe复合催化剂为研究对象,发现Fe与LiH在界面处存在强的相互作用。利用自主研制的团簇质谱与光谱联用实验装置,并与密度泛函理论计算紧密结合,成功探测到该催化剂表(界)面存在Li-Fe-H三元氢化物物种(如Li4FeH6,Li5FeH6等)。更为有趣的是这些氢化物物种可与N2反应直接转化为含有Fe-(NH2)-Li和LiNH2的物质,实现了N2的解离、向Li的转移和加氢;同时,三元氢化物中与Fe结合带负电荷的氢则转化为与N结合带正电荷的氢,完成了两电子转移。这些基于团簇反应的研究结果暗示了在Fe-LiH表(界)面形成的Li4FeH6很可能是催化活性中心,而N2的活化则有可能从传统Fe基催化剂C7位上的均裂过程转变为“氢助解离”机制。这项研究加深了对LiH-3d过渡金属催化剂上合成氨反应机理的认识,为新型高效合成氨催化剂的设计开发提供了思路。
上述工作得到国家杰出青年基金、基金委重点项目、教育部能源材料化学协同创新中心(iChEM)和大连化物所甲醇转化与煤代油新技术基础研究专项(DICPDMTO)的资助。
(中国化工仪器网)
Development of Serum Hydrocortisone Component Analysis Reference Material
Wang Ziyi1,2, Dai Xinhua1, Liu Zhao1, Li Hongmei1, Wang Shaoli2
(1. National Institute of Metrology, Beijing 100013, China;2. Changzhou Institute of Measurement & Testing Technology, Changzhou 213164, China)
O657
A
1008-6145(2017)04-0004-04
10.3969/j.issn.1008-6145.2017.04.001
*国家科技基础专项(2011FY130100)
联系人:戴新华;E-mail: daixh@nim.ac.cn
2017-05-18

