不同精子来源辅助生殖子代情况观察
刘 帅 王雪莹 黄海燕 郭 薇 刘效群 王树松 高章圈
河北省计划生育科学技术研究院,国家卫生计生委计划生育与优生重点实验室(石家庄, 050071)
不同精子来源辅助生殖子代情况观察
刘 帅 王雪莹 黄海燕 郭 薇 刘效群*王树松 高章圈
河北省计划生育科学技术研究院,国家卫生计生委计划生育与优生重点实验室(石家庄, 050071)
目的:观察不同来源精子(供精/夫精)辅助生殖技术(ART)子代出生缺陷及性别比情况。方法:回顾性分析2013年1月-2015年10月于本院接受IVF/ICSI治疗并成功分娩的246例新生儿一般情况和疾病分布,依据精子来源不同分为:夫精-体外受精(H-IVF)组,供精-体外受精(D-IVF)组,夫精-卵胞浆内单精子注射(H-ICSI)组,供精-卵胞浆内单精子注射(D-ICSI)组,比较新生儿性别比及出生缺陷率差异。结果:246名ART新生儿中夫精组和供精组性别比无差异(133:100/92:100,P>0.05),其中H-IVF组与D-IVF组性别比差异无统计学意义(P>0.05),H-ICSI组男婴比例高于D-ICSI组(143:100/50:100,P<0.05);ART新生儿异常体重主要表现为低体重,异常体重儿娩出率(26.0%/29.9%)及出生缺陷率(2.5%/3.2%),夫精组与供精组间差异无统计学意义(P>0.05);夫精ART新生儿疾病构成为循环系统1例(男)、神经系统1例(男)和唇腭裂1例(女),供精ART新生儿疾病构成为神经系统1例(男)、泌尿系统1例(女)、生殖系统1例(女)和唇腭裂1例(男)。结论:不同供精方式ART新生儿出生缺陷和IVF出生婴儿性别未见差异。
不孕症;辅助生殖技术;出生缺陷;性别比
目前不孕症夫妇中大约30%为男性因素所致,其中无精子症约占男性不育患者的10%~15%,由于病因复杂,给治疗带来很大困难[1-2]。随着生殖医学技术的飞速发展,供精已经逐渐被无精子症不孕夫妇所接受。由于供精精液需要经过精子库低温冷冻保存,另外,采用卵胞浆内单精子注射(ICSI)治疗患者中有很大一部分为少、弱、畸精症患者,这是否会造成供精与夫精辅助生殖技术(ART)分娩新生儿之间有所差异,目前不得而知。本研究观察不同精液来源ART子代情况。
1 对象与方法
1.1研究对象
本研究纳入2013年1月-2015年10月于河北省计划生育科研院生殖医学中心接受IVF/ICSI治疗并顺利分娩246例新生儿资料。其中IVF新生儿169例,ICSI新生儿77例。依据精子来源不同分为:夫精-体外受精(H-IVF)组,供精-体外受精(D-IVF)组,夫精-卵胞浆内单精子注射(H-ICSI)组,供精-卵胞浆内单精子注射(D-ICSI)组。本研究纳入获得成功分娩新生儿的患者资料及其分娩的新生儿的临床资料,并排除死胎、异位妊娠、行补救ICSI(R-ICSI)授精者及附睾、睾丸取精者的临床资料。
1.2 方法
1.2.1 供精精液来源 供精精液来源于河北省计划生育科研院人类精子库冻存精液,采用匿名精子,遵守供者与医务人员、供者与后代、供者与受者夫妇之间互盲原则,遵守供精相关法规和伦理原则。按照受者丈夫血型与供精者血型一致原则,并结合供受者体貌、学历相似情况提供精液,同时保证每1位供精者的精液标本不得使5名以上妇女妊娠并分娩。
1.2.2 常规超排卵 卵泡监测、超排卵和取卵等临床技术按本中心操作常规进行。月经第19~21天使用促性腺激素激动剂(GnRHa)进行降调节,降调14~16d后用卵泡刺激素(FSH)或人绒毛膜促性腺激素(hMG)启动促排卵,≥2个卵泡径线≥18 mm或≥3个达17 mm时肌注5000~10 000 U hCG,36~38 h行阴道超声引导下取卵术。
1.2.3 精液处理、授精及胚胎移植 精液37℃水浴锅液化,洗精液洗涤后,上游法处理;供精精液密度梯度离心后,上游法优选精子,处理后精液置于37℃、6% CO2培养箱中待用。IVF/ICSI按本实验室操作常规进行,取卵后3~4 h授精,授精后16~18 h观察双原核以确定是否正常授精,第3天根据胞质碎片比例和卵裂球数目进行胚胎评分,根据患者年龄和周期数选择评分高的胚胎进行移植。
1.2.4 临床妊娠判定及随访 移植后14 d检测血、尿β-hCG确定生化妊娠;移植后30 d行阴道B超检查,宫腔内见孕囊确诊为临床妊娠。妊娠中晚期、分娩时及新生儿1周岁时进行电话随访。随访内容包括:分娩孕周、新生儿体重及新生儿健康状况。
1.3 统计学方法
所有数据均采用SPSS 17. 0 统计软件进行数据处理和统计学分析,两组间计数资料比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同精子来源出生婴儿性别比比较
本研究共246名新生儿,男婴129名,女婴117名。性别比供精组与夫精组比较差异无统计学意义。IVF夫精组与供精组比较无统计学差异。D-ICSI组出生男婴比例低于H-ICSI组(P<0.05)。见表1。
2.2 不同精子来源新生儿体重分布情况
供精组共127名新生儿,异常体重儿娩出率与夫精组间差异无统计学意义(P>0.05)。H-IVF组与D-IVF组,H-ICSI组与D-ICSI组间异常体重儿娩出率差异无统计学意义。见表2。
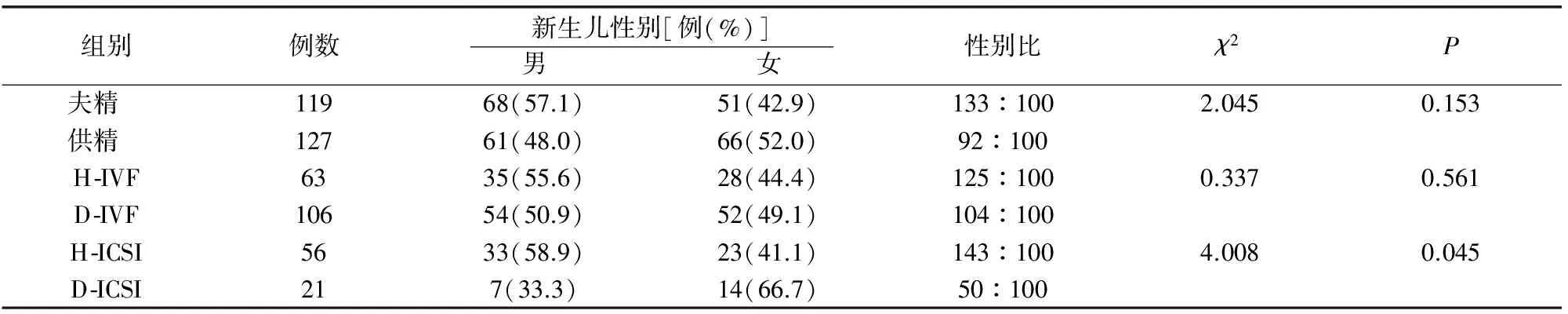
表1 不同精子辅助生殖子代出生婴儿性别比
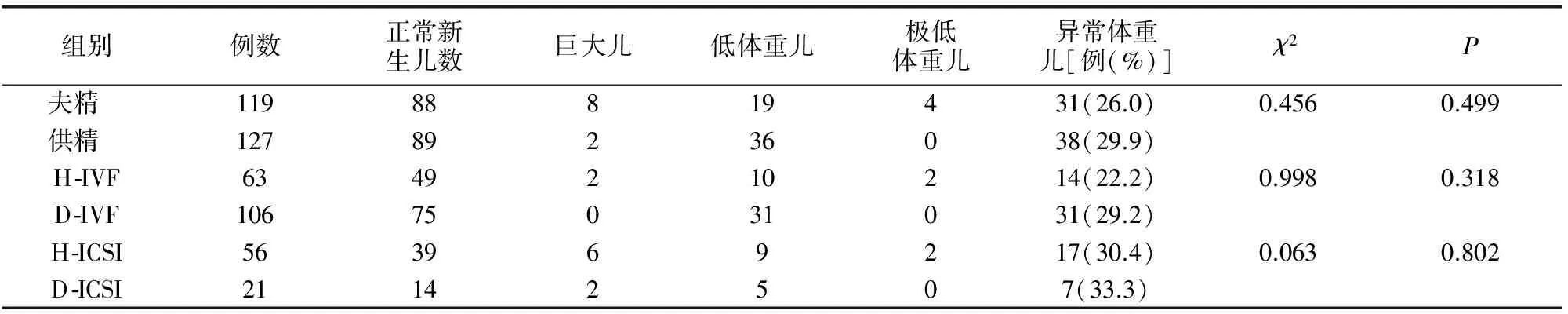
表2 不同精子来源辅助生殖子代新生儿体重情况(例)
2.3 不同精子来源新生儿出生缺陷情况
供精组出生缺陷率与夫精组无差异(P>0.05)。H-IVF组与D-IVF组、H-ICSI组与D-ICSI组间出生缺陷率差异均无统计学意义。见表3。
2.4 不同精子来源新生儿期疾病构成
各组新生儿期疾病构成见表4。
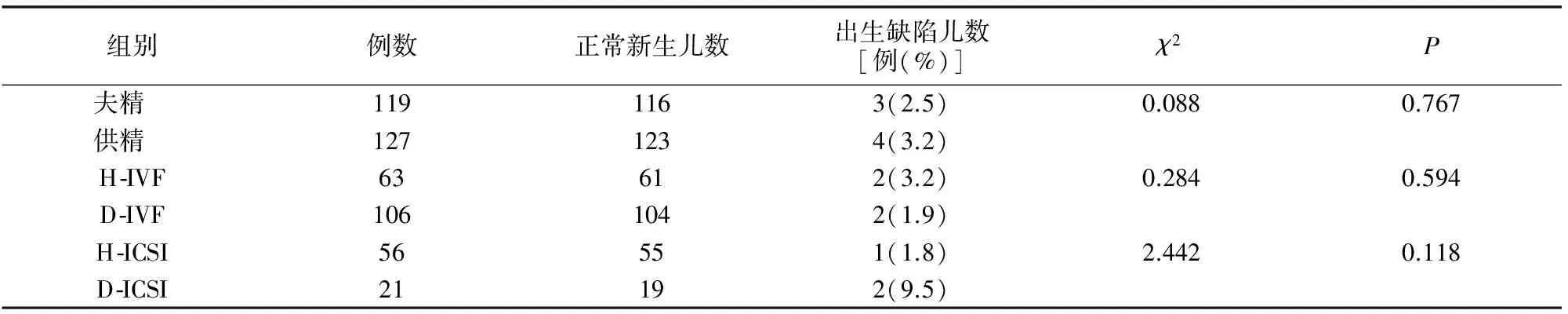
表3 不同精子来源辅助生殖子代新生儿出生缺陷情况(例)
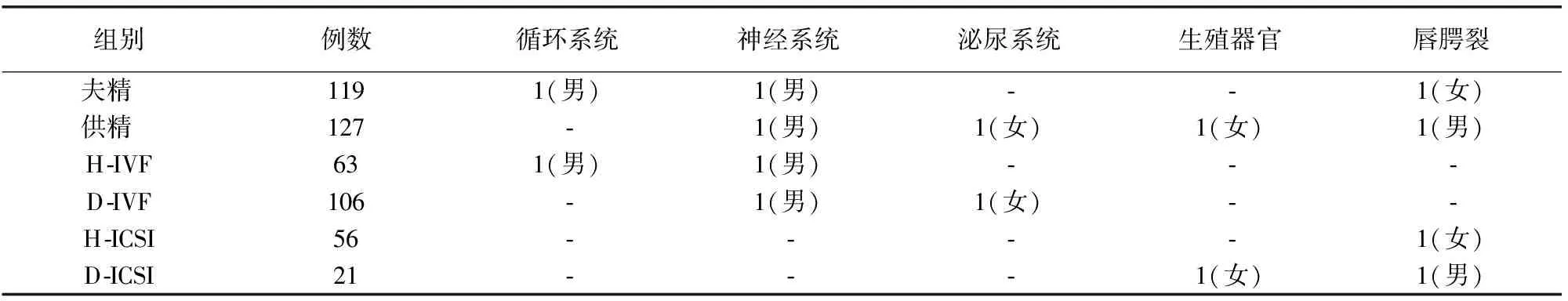
表4 不同精子来源辅助生殖子代新生儿期疾病构成(例)
3 讨论
供精人工授精或供精体外受精能够有效解决不可逆的无精子症和存在不宜生育的严重遗传性疾病患者的生育问题。随着精子冷冻技术的日益成熟和人类精子库的不断完善,供精辅助生殖技术得到广泛的推广。有研究结果显示,相较于夫精辅助生殖技术,供精辅助生殖技术更具安全性[3]。本研究显示,127名供精新生儿的出生缺陷率为3.2%,夫精新生儿的出生缺陷率为2.5%,两者间差异无统计学意义。根据国家卫计委(原卫生部)发布的《中国出生缺陷防治报告(2012)》结果,我国围产期出生缺陷总发生率逐年上升,全国出生缺陷总发生率约为1%~3%,这说明供精ART未增加新生儿出生缺陷率,但与夫精精液相比,也没有表现出明显优势。报告还显示2000~2011年期间,先天性心脏病、多指(趾)、唇裂伴或不伴腭裂、神经管缺陷、先天性脑积水等10类疾病是我国围产儿前10位高发出生缺陷[4]。本研究ART新生儿出生缺陷分布与上述报道一致。
本研究中ART新生儿异常体重率较高:供精为29.9%,夫精为26.0%,此结果低于吉玲等[5]研究结果(74.8%),这可能与分娩孕周有关。ART新生儿异常体重主要由于药物刺激及配子胚胎体外操作造成。Kalra 等[6]研究发现,超排卵组新生儿体重显著低于未超排卵组,文章认为ART常规超排卵刺激过程会造成母体内环境的改变,而这些变化会对胚胎种植和胎盘的形成产生影响,进而引起胚胎发育的滞后。另外,在ART过程中,由于取卵、ICSI等侵入性操作过程和体外培养环境与体内环境的差异,会造成胚胎发育基因印迹剖面的改变,在甲基化转移酶的作用下,通过选择性表达等位基因,造成父本的促生长基因的表达缺失,或父本等位基因中生长限制基因活化,从而造成新生儿出生体重偏低。同时,ART新生儿多胎妊娠和早产比例较自然妊娠高,也是造成新生儿体重偏低主要原因。
自然妊娠状态下,不同时期和地区的出生性别比保持相对稳定,约为105:100[7]。多个中心研究显示,ART出生婴儿性别比为107~116:100[6-9,13]。本研究中性别比为110:100,与上述结果相同。有研究结果表明ICSI会增加女婴出生比例[9-12]。Bu等[13]研究发现,ICSI胚胎卵裂期移植会造成男婴出生比例下降,囊胚期移植两者间差异无统计学意义。研究发现,不育男性精液Y染色体精子会发生形态学的改变,并且数量少于正常精液[14],因此在人工挑选精子时会造成选择偏倚,从而造成医源性男婴出生比例下降[14-16]。本研究结果显示,供精ICSI组性别比为50:100,而夫精ICSI组性别比为143:100。分析原因可能与以下几点有关,本研究中常规精液采用洗涤后上游法,供精采用密度梯度后上游法,有研究表明,密度梯度离心法会造成单一染色体精子的富集[17-19];商品化培养基会加入人血清白蛋白(HSA),此成分会使精子获能,一定程度上会造成X和Y精子的分离[18]。另外,本研究样本量较小,可能造成结果的偏差。
需要注意的是,由于供精治疗中会出现抚养孩子的社会学父亲和给予孩子遗传物质的生物学父亲,这其中涉及诸多的伦理和社会问题。鉴于此,结合本文研究结果,夫精仍然是ART治疗的首选,当无法避免应用供精时,应于术前由专门医生对接受供精的患者夫妇单独谈话,向其说明治疗中出现的诸如社会学父亲享受的权利及承担的责任、主动配合随访和婚前排查等问题,保证供精出生子代的安全性。同时需要指出的是,由于本研究病例数较少,更准确的评估仍需更大样本量的研究支持。
[1] Practice committee of american society for reproductive medicine in collaboration with society for male eproduction and urology. Evaluation of the azoosperm icmale [J]. Fertil Steril, 2008, 90(5Suppl): S74-77.
[2] 郑炜炜, 宋革, 钟小英, 等. 供精精液冻存时间对人工受精结局及子代出生缺陷的影响 [J]. 中国计划生育学杂志, 2014, 22(11): 755-758.
[3] 梁明, 张斌, 孙伟, 等. 供精精液行辅助生殖技术出生子代安全性评估 [J]. 中华男科学杂志, 2011, (3): 237-241.
[4] 凌寒. 卫生部发布《中国出生缺陷防治报告(2012)》 [J]. 中国当代医药, 2012, 28: 1.
[5] 吉玲, 杨赟, 马莉雅, 等. 辅助生殖技术受孕儿疾病构成 [J]. 中国妇幼保健, 2016, (3): 544-546.
[6] Kalra SK, Ratcliffe SJ, Coutifaris C, et al. Ovarian stimulation and low birth weight in newborns conceived through in vitro fertilization [J]. Obstet Gynecol, 2011, 118(4): 863-871.
[7] Qin J, Liu X, Sheng X, et al. Assisted reproductive technology and the risk of pregnancy-related complications and adverse pregnancy outcomes in singleton pregnancies: a meta-analysis of cohort studies [J]. Fertility and sterility, 2016, 105(1): 73-85.
[8] 马海兰, 罗克莉, 龚斐, 等. 辅助生殖技术助孕出生婴儿性别比例的初步调查 [J]. 生殖医学杂志, 2013,(3): 203-204.
[9] Maalouf W, Mincheva M, Campbell B, et al. Effects of assisted eproductive technologies on human sex ratio at birth [J]. Fertil Steril, 2014, 101(5): 1321-1325.
[10] Hentemann M, Briskemyr S, Bertheussen K. Blastocyst transfer and gender: IVF versus ICSI [J]. J Assist Reprod Genet, 2009, 26(8): 433-436.
[11] Scott J, Ryan J. Sex ratio of infants born following blastocyst culture [J]. Hum Reprod, 2006, 21(1): i16.
[12] Bonduelle M, Liebaers I, Deketelaere V. Neonatal data on a cohort of 2889 infants born after ICSI (1991-1999) and of 2995 infants born after IVF (1983- 1999) [J]. Hum Reprod, 2002, 17(3): 671-694.
[13] Bu Z , Chen Z, Huang G, et al. Live birth sex ratio after in vitrofertilization and embryo transfer in China-an analysis of 121, 247babies from 18 centers [J]. PLoS One, 2014, 9(11): e113522.
[14] Menezo Y. Paternal and maternal factors in preimplantation embryogenesis: interaction with the biochemical environmen [J]. Reprod Biomed Online, 2006, 12(5): 616-621.
[15] Setti A, Figueira R, Braga D. Gender incidence of intracytoplasmic morphologically selected sperm injection-derived embryos: a prospective randomized study [J]. Reprod Biomed Online, 2012, 24(4): 420-423.
[16] Luke B, Brown M, Grainger D. The sex ratio of singleton offspring in assisted-conception pregnancies [J]. Fertil Steril, 2009, 92(5): 1579-1585.
[17] Dineen T, Nolan A, Harrington J. Fluorescence in situ hybridization studies on the sex chromosome constitution of human sperm [J]. Arch Androl, 1998, 39(3): 217-222.
[18] Claassens O, Oosthuizen C, Brusnicky J. Fluorescent in situ hybridization evaluation of human Y- bearing spermatozoa separated by albumin density gradients [J]. Fertil Steril, 1995, 63(2): 417-418.
[19] Ericsson R, Langevin C, Nishino M. Isolation of fractions rich in human Y sperm [J]. Nature, 1973, 246(5433): 421-424.
[责任编辑:王丽娜]
Effect of sperm source on birth defects and live birth sex ratio of newborns by assisted reproductive technology
LIU Shuai, WANG Wueying, HUANG Haiyan, GUO Wei, LIU Xiaoqun, WANG Shusong, GAO Zhangquan
KeyLaboratoryofFamilyPlanningandHealthBirth,NationalHealthandFamilyPlanningCommission,HebeiFamilyPlanningScienceandTechnologyResearchInstitute,Hebei, 050071
Objective: To study the effect of different sources of sperm on birth defects and sex ratio of newborns by assisted reproductive technology (ART). Method: A retrospective study was conducted. From Jan 2013 to Oct 2015, the general condition and disease distribution of 246 newborns by IVF/ICSI were analyzed. Based on the sperm source, the newborns were divided into in vitro fertilization with husband's sperm group (H-IVF group), and in vitro fertilization with donor sperm group (D-IVF group), intracytoplasmic sperm injectioin with husband's sperm group (H-CSI group), and acytoplasmic sperm injectioin with donor sperm group (D-SI group). The birth defects and sex ratio of the newborns was compared among the four groups. Result: In the 246 newborns, the sex ratio of husband's sperm group and donor sperm group had no statistically significant difference (133:100 VS. 92:100,P> 0.05), there was no significant difference between H-IVF group and D-IVF group, but male baby percentage of H-ICSI group was significantly lower than that of H-ICSI group (143:100 VS. 50:100,P< 0.05). Low birth weight was the mainly proportion for abnormal weight newborns, and there was no statistically significant difference of abnormal birth weight rate (26.05% VS. 29.92%) and birth defects rate (2.52% VS. 3.15%) between husband's sperm group and donor semen group (P> 0.05). The birth defects of husband's sperm group had one defected newborn with circulatory system (male), one with abnormal nervous system (male) and one with cleft lip and palate (Female), The birth defects of donor sperm group had one newborn with abnormal nervous system (male), one with abnormal urinary system (female), one with abnormal reproductive system (female) and one with cleft lip and palate (Male). Conclusion: Donor semen has no significant impact on ART birth defects and IVF live birth sex ratio.
Infertility; Assisted reproductive technology; Birth defect; Sex ratio
河北省自然科学基金(H2016314002);河北省卫生厅科研基金项目(20160439)
2016-09-23
2016-10-15
10.3969/j.issn.1004-8189. 2017.01
*通讯作者:wyq_601@126.com

