一株产α-淀粉酶芽孢杆菌的分离及产酶条件的优化
依妮皮姑丽·麦麦提依明 ,艾麦尔江·麦提库尔班 ,阿依安·布胡达西 ,迪力木拉提·木合塔尔 ,迪丽拜尔·托乎提
(新疆师范大学生命科学学院极端环境微生物多样性实验室,新疆 乌鲁木齐 830054)
一株产α-淀粉酶芽孢杆菌的分离及产酶条件的优化
依妮皮姑丽·麦麦提依明 ,艾麦尔江·麦提库尔班 ,阿依安·布胡达西 ,迪力木拉提·木合塔尔 ,迪丽拜尔·托乎提
(新疆师范大学生命科学学院极端环境微生物多样性实验室,新疆 乌鲁木齐 830054)
以筛选与鉴定尉犁县黑湖产淀粉酶细菌,并对筛选出的细菌进行产酶条件优化为研究目的,从43株细菌中筛选出淀粉酶高产菌株 HM-22,并对其进行了菌株形态学鉴定、16S r DNA 分子鉴定以及产酶条件优化。从尉犁县黑湖采样的30个水、土和泥样样品中分离筛选43株细菌,从中筛选出14株产淀粉酶的菌株,采用Yoo改良法对产透明圈较大的菌株进行酶活力测定,从中筛选出了一株产酶活性较高的菌株HM-22。经革兰氏染色、菌落形态观察、生理生化检测和16S r DNA 序列比对鉴定该菌与Bacillustequilensis的相似性为99.8%,属于芽孢杆菌属。对菌株HM-22产酶条件进行初步优化确定其产酶的最佳条件是:该菌产淀粉酶最适温度为40 ℃,最适碳源为可溶性淀粉,最适氮源为牛肉膏,最适反应pH为6.0,最适产酶培养时间为24 h。优化后菌株HM-22的酶活力从最初的的酶活力122.45 U/mL达到147.53 U/mL,酶活力提高了17%。该研究为从新疆盐湖细菌中筛选淀粉酶活力较高的菌种资源及应用提供了理论依据和参考。
尉犁县黑湖;芽孢杆菌;α-淀粉酶;酶活力测定;产酶条件优化
α-淀粉酶能分解淀粉为糊精、低聚糖和单糖类[1]。α-淀粉酶广泛存在于动物、植物和微生物中[2],在工业生产中的应用很广泛[3],是最早用于工业生产并且迄今仍用途最广、产量最大的酶制剂之一[4],在洗涤剂工业、医药卫生、粮食加工、食品工业、酿造、发酵和纺织品工业等行业中都有非常重要的应用[5-6]。1894年,从真菌中鉴定和分离出淀粉酶,并用于酶制剂和添加剂中。之后,淀粉酶得到了广泛的应用,并吸引了研究人员的关注[7]。微生物优选为淀粉酶的生产者,原因是与其他生产者植物和动物相比,其有易处理、易培养和成本少的优点[8-9]。自然界有许多微生物都能够产淀粉酶,如根霉、曲霉、芽孢杆菌等[10]。目前,已报道的能够产生淀粉酶的微生物种属有不动杆菌属Acinetobacter、微球菌属Micrococcus、黄隐球酵母Cryptococcusflavus、盐单胞菌属Halomonasmeridiana、青霉菌属Penicillum、类芽孢杆菌属Paenibacillus、链霉菌属Streptomyces、假单胞菌属Pseudoalteromonas和杆菌属Bacillus等[11-13]。淀粉酶的生产主要依靠微生物发酵,国外的研究已经达到了产α-淀粉酶的调控基因的水平,还研究了与这些相关的基因克隆及转导,转化等技术。把芽孢杆菌重组体的基因引入生产用的菌株体内,使α-淀粉酶的产量提高了几十倍到几百倍,为选育高产α-淀粉酶菌株奠定了很好的基础。目前投入商业化生产的α-淀粉酶生产菌株几乎都是从自然界分离得到的野生型菌株,因此不断从自然界中分离淀粉酶产生菌,探索并优化其最佳产酶条件有重要意义[14]。为从新疆盐湖细菌中筛选并获得淀粉酶活力较高的菌种资源,并为其应用提供理论依据和参考,我们从新疆尉犁县黑湖采集的水、土和泥样中分离产淀粉酶的菌株,通过酶活力测定,筛选出较高活性的菌株,并进行分类鉴定,利用液体发酵法对产α-淀粉酶培养基发酵条件进行优化研究,对其酶学特性进行了初步探讨。
1 材料与方法
1.1 样品来源
采样地点为新疆尉犁县黑湖(86°47′40″E、41°14′09″N至86°52′10.7″E、41°13′11.7″N)。以湖心为出发点,围绕湖心按不同距离东、南、西、北方向不同深层取表层下10、20、40、60 cm深度水样、土样和泥样,水样pH为5.26~6.90, 湖心周边土样pH为6.5~6.9,泥样pH为6.0~6.9,盐度为25%~28%,样品点海拔高度为853~855 m。样品装入无菌试样袋密封,保存温度4 ℃。
1. 2 培养基
分离和保藏培养基:可溶性淀粉2 g、酵母膏5 g、蛋白胨10 g、氯化钠 10 g、蒸馏水1 000 m L,pH 7.0~7.2,固体加入15~20 g琼脂,1×105Pa灭菌30 min。
发酵培养基:可溶性淀粉2 g、酵母膏5 g、蛋白胨10 g、氯化钠10 g、蒸馏水1 000 m L,pH 7.0~7.2,1×105Pa灭菌30 min。
1.3 实验方法
1.3.1 产淀粉酶菌株的筛选 将活化的菌株点样于分离和保藏培养基平板上,4 ℃恒温培养 24 h左右,加入 Lugol 氏碘液,菌落周围出现水解透明圈的为淀粉酶阳性。牛津杯法进行复筛,即取适量菌株上清液于牛津杯淀粉酶筛选平板上,加入Lugol 氏碘液,用游标卡尺测定透明圈大小。
1.3.2 菌株培养和淀粉酶的提取 以5%的接种量接种到50 mL发酵培养基中,转速180 r/min,温度37 ℃,摇床培养20 h,8 000 r/min,离心15 min,取上清液为淀粉酶粗提液。
1.3.3 淀粉酶活性的测定 发酵液于4 ℃、8 000 r/min冷冻离心20 min,取上清液即为粗酶液。采用Yoo改良法[15]测定α-淀粉酶酶活力:取1 mg/mL可溶性淀粉溶液5 mL,在37 ℃水浴中预热10 min,加入1 mL磷酸氢二钾-柠檬酸缓冲液(pH 7.0),加入经适当稀释的粗酶液1 mL,37 ℃水浴振荡,精确反应5 min后,用0.1 mol/L 硫酸5 mL终止反应。取1 mL反应液与5 mL稀碘液显色,在620 nm处测定光密度。以1 mL水替1 mL反应液为空白,以不加酶液(加同体积的缓冲液)的管为对照。酶活力根据以下公式计算:
酶活力(U)=(R0-R)× 50×D/R0
式中R0,R分别表示对照液和反应液的吸光度,D为酶的稀释倍数。酶活定义为在37 ℃,pH值7.0条件下,5 min内水解l mg淀粉的酶量为一个活力单位。
1.3.4 形态学鉴定 通过光学显微镜对菌体形态进行观察。将菌株划线接种于分离和保藏培养基平板上,37 ℃培养1 d,观察单菌落的形状、大小、透明度、颜色、边缘和表面特征。
1.3.5 菌株生理生化鉴定 参照《伯杰细菌鉴定手册》[16]和《常见细菌系统鉴定手册》[17]对筛选出的淀粉酶活力高的菌株进行形态学描述和生理生化鉴定。生理生化鉴定中,分别对目的菌株进行硝酸盐还原试验,淀粉水解试验,酪蛋白水解试验,酯酶水解试验,过氧化氢酶水解实验,耐高温实验,产H2S实验,营养型测定实验,明胶液化,触酶实验,柠檬酸盐实验,运动性检测等实验,每个实验重复3 次。
1.3.6 16S r DNA的鉴定和构建系统发育树 利用传统的CTAB法[18]提取DNA。提取分离出的菌株基因组DNA为模板,使用细菌通用引物27F(5′- AGAGTTTGATCCTGGCTCAG-3′),1492R(5′- GGTTACCTTGTTACGACTT-3′),以目的菌株的基因组DNA为模板,对该菌株16S r DNA进行PCR扩增,PCR反应条件为50 μL反应体系,其中,预变性 94 ℃ 45 s,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min 15 s,30个循环,延伸72 ℃ 10 min。PCR产物由上海生工生物工程技术服务有限公司纯化和测序。将获得的序列提交至EzTaxon-e数据库进行相似度比较(http://www.ezbiocloud.net/eztaxon)(Kim et al.,2012)。通过ClustalW1.6软件包进行多序列匹配排列(http://www.ebi.ac.uk/Tools/ clustalw1.6/)。采用MEGA 6.06软件构建系统发育树。根据相关软件删除序列匹配排列中的插入和缺失,根据“Kimura双参数”方式,通过序列数据计算进化距离。选择邻近连接法(Neighbour-Joining)对系统进化树进行估算,通过1 000次取样确定。
1.3.7 液体发酵培养基的优化
1) 最适培养时间。菌株活化后,以5%的接种量接种在发酵培养基中,转速180 r/min,温度为37 ℃,恒温摇床培养12、16、20、24、28、32、36 h后,制备粗酶液,然后用Yoo改良法测定每个时间段的α-淀粉酶活力,研究培养时间对酶活力的影响并确定最适的培养时间。
2)最适pH值。菌株活化后,以5%的接种量分别接种到发酵培养基中,转速180 r/min,温度为37 ℃,恒温摇床培养24 h,在pH为5.0、6.0、7.0、8.0、9.0的条件下用Yoo改良法测定不同反应系统pH的α-淀粉酶活力,研究反应系统pH对酶活力的影响并确定最适pH。
3) 最适温度。菌株活化后,以5%的接种量分别接种到发酵培养基中,转速180 r/min,温度为37 ℃,恒温摇床培养24 h,在温度30、35、40、45、50 ℃的条件下用Yoo改良法测定不同反应系统温度的α-淀粉酶活力,研究反应系统温度对酶活力的影响并确定最适温度。
4)最佳碳源。菌株活化后,以5%的接种量接种到碳源分别为可溶性淀粉、糊精、葡萄糖和蔗糖的发酵培养基中,转速180 r/min,温度37 ℃,恒温摇床培养24 h后,制备粗酶液,用Yoo改良法测定每个不同碳源培养的菌株的α-淀粉酶活力,测定培养基碳源对酶活力的影响并确定最佳碳源。
5)最佳氮源。菌株活化后,以5%的接种量接种到碳源分别为牛肉膏、明胶、尿素和硫酸铵的发酵培养基中,转速180 r/min,温度为37 ℃,恒温摇床培养24 h后,制备粗酶液,用Yoo改良法测定每个不同氮源培养的菌株的α-淀粉酶活力,测定培养基氮源对酶活力的影响并确定最佳氮源。
2 结果与分析
2.1 产淀粉酶菌株的筛选
通过菌株产透明圈初筛,从43株细菌中筛选获得14株产淀粉酶菌株。其中HM-2、HM-22、HM-31的水解圈直径大于2 cm,确定为复筛菌株。通过3次测酶活力,HM-2、HM-22和HM-31的平均酶活力分别为119.32、122.45和106.49 U·mL-1,可见,菌株HM-22 的α-淀粉酶酶活力最高。
2.2 菌株的形态学观察及生理生化鉴定
光学显微镜下,菌株 HM-22 呈短杆状,端圆,单个排列。平板划线培养1 d后,菌落呈扁形、直径0.2 ~0.3 cm、表面干、边缘不完整、稍有隆起、颜色为乳白色、不透明、革兰氏阳性菌。菌株HM-22形态学观察和生理生化鉴定,见表1和表2。

表1 菌株HM-22的形态特征Table 1 Morphological characteristics of HM-22
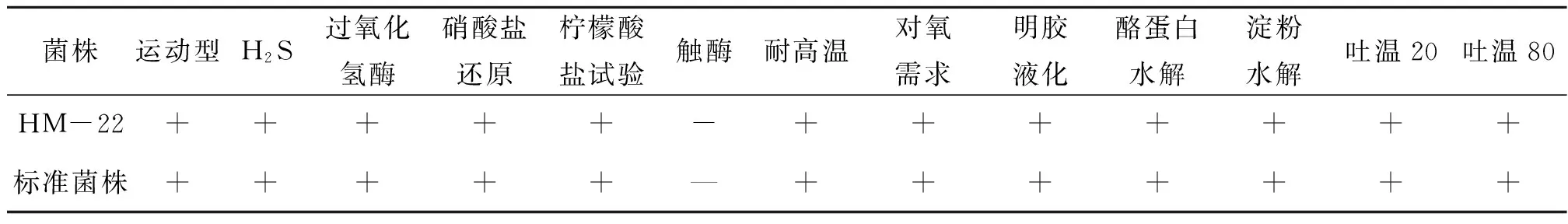
表2 菌株HM-22的生理生化实验结果Table 2 Physiological and biochemical tests of HM-22
2.3 16S r DNA序列测定
使用细菌通用引物对HM-22的16S r DNA 序列进行测序,PCR扩增得到约1.5 kb的16S r DNA片段,将获得的序列提交至EzTaxon-e 数据库(http://www.ezbiocloud.net/eztaxon)(Kim et al., 2012),调出相似性最高相关菌株的16S rDNA 序列,与芽孢杆菌的同源性为99.8%,其中与菌株Bacillustequilensis(AYTO01000043)的相似性最高。将菌株HM-22的16S r DNA 序列与 GenBank 数据库中部分细菌 16S r DNA 序列,通过ClustalW1.6软件包进行多序列匹配排列,应用 MAGA6.06 软件构建系统发育树( 图 1) 。结果显示,菌株 HM-22(KX866452)与芽孢杆菌属中的细菌有较近的亲缘关系,结合形态学、生理生化及分子鉴定结果初步确定该菌为芽孢杆菌Bacillustequilensis。
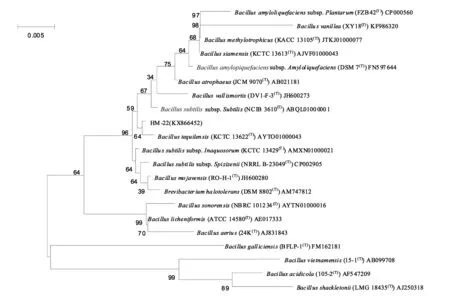
图1 菌株HM-22的系统发育树Fig.1 Phylogenetic tree of strain HM-22
2.4 培养条件的优化
2.4.1 最佳产酶时间的确定 菌株 HM-22在发酵培养基中培养后,用Yoo改良法分别在12、16、20、24、28、32、36 h时测定α-淀粉酶活力,结果见图2。由图2可以看出,培养时间为24 h时酶活力最高,为147.53 U/mL,菌株HM-22的最佳培养时间为24 h。
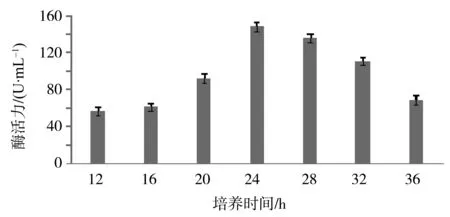
图2 菌株HM-22淀粉酶最佳产酶时间的确定结果Fig.2 The determination of optimal time in producing amylase by Bacterium HM-22
2.4.2 最适PH值 把反应系统的缓冲液pH分别调为5.0、6.0、7.0、8.0、9.0接种菌株HM-22后,用Yoo改良法分别测定α-淀粉酶活力,结果见图3。由图3可看出, pH为6.0时,株菌HM-22的酶活力达到最高值,为147.53 U/mL。当pH>6 时,酶活力明显降低。可见,该菌株对pH值有一定的耐受范围,但较强的碱性环境不利于菌株产淀粉酶,酶活力的最适pH为6.0。

图3 培养基初始pH值对菌株HM-22产酶能力的影响Fig.3 The impact of initial pH on Bacterium HM-22 in producing amylase
2.4.3 最适温度 将测定酶活力反应系统的温度分别调到30、35、40、45、50 ℃用Yoo改良法分别测定α-淀粉酶活力,结果见图4。由图4可看出,温度为40 ℃时株菌HM-22 α-淀粉酶活力达到最高值,为147.53 U/mL。随着温度的升高酶活力逐渐降低,50 ℃时淀粉酶活性基本上失活,酶活力非常低,由此可以确定菌株HM-22 α-淀粉酶活力的最适温度为40 ℃。
2.4.4 最适碳源 改变菌株的碳源,分别把可溶性淀粉、糊精、葡萄糖和蔗糖作为碳源培养菌株24 h后用Yoo改良法测定α-淀粉酶活力,结果见图5。由图5可看出,以可溶性淀粉为碳源时菌株HM-22的α-淀粉酶活力最高,为135.35 U/mL;以糊精作碳源时,菌株HM-22的α-淀粉酶活力下降为109.24 U/mL;以葡萄糖为碳源时,菌株HM-22的酶活力为65.1 U/mL;以蔗糖为碳源时,菌株HM-22的α-淀粉酶活力为121.82 U/mL。实验结果显示,可能是由于可溶性淀粉是淀粉酶的底物,能够诱导淀粉酶的合成,导致菌株HM-22的最佳碳源是可溶性淀粉。

图4 培养温度对菌株HM-22产酶活力的影响Fig.4 The impact of culture temperature on Bacterium HM-22 inproducing amylase
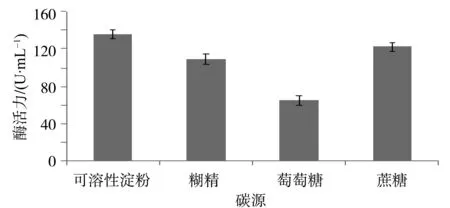
图5 碳源对菌株HM-22产酶能力的影响Fig.5 The impact of carbon source on Bacterium HM-22 in producing amylase
2.4.5 最适氮源 改变菌株的氮源,分别把牛肉膏、明胶、尿素和硫酸铵作为氮源培养菌株24 h后用Yoo改良法测定α-淀粉酶活力,结果见图6。由图6可看出,以牛肉膏为氮源时菌株HM-22的α-淀粉酶活力最高,为132.54 U/mL,以明胶作氮源时菌株HM-22的α-淀粉酶活力下降为96.39 U/mL,以尿素为氮源时菌株HM-22的α-淀粉酶活力为39.92 U/mL,以硫酸铵为氮源时菌株HM-22的酶活力为46.18 U/mL。牛肉膏为氮源时酶活性最强,究其原因,是牛肉膏中含有生长因子,有利于菌体的生长,故菌株HM-22的最佳氮源是牛肉膏。
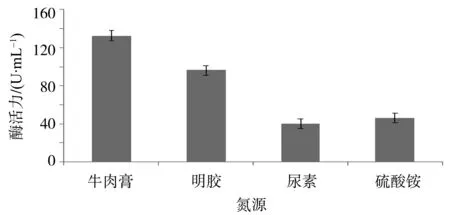
图6 氮源对菌株HM-22产酶能力的影响Fig.6 The impact of nitrogen source on Bacterium HM-22 in producing amylase
3 结果与讨论
本研究从新疆尉犁县黑湖采样的30个土样、水样和泥样样品中分离筛选出43株细菌,通过产淀粉酶透明圈大小初筛和牛津杯复筛从中筛选出14株产淀粉酶的菌株,采用Yoo改良法对产透明圈较大的菌株进行酶活力测定,并筛选出了一株产酶活性较高的菌株HM-22。经形态学、生理生化和16S r DNA 分子鉴定HM-22(KX866452)与Bacillustequilensis的相似性为99.8%,初步鉴定为芽孢杆菌属。对菌株HM-22产酶条件进行优化后得到最佳产酶条件:产淀粉酶最适温度为40 ℃,最适碳源为可溶性淀粉,最适氮源为牛肉膏,最适反应pH为6.0,最适产酶培养时间为24 h。优化后HM-22菌株的酶活力达147.53 U/mL,提高了17%。该菌株如果再进一步进行诱变处理和重组表达[24],酶活力还有提升的空间。
目前,不少芽孢杆菌应用到工业、农业、医学、环境修复等各个领域,对人类与社会做出了巨大的贡献[19-20]。据文献报道,芽孢杆菌在抗癌试验中具有转化产生多个转化产物的特性,其中有些转化产物可以抑制人恶性胶质瘤细胞和人乳腺细胞[21],有些芽孢杆菌在生防功能方面也突显重要的功能[22]。水解淀粉芽孢杆菌在自然界中分布十分广泛[23]。虽然很多研究者从芽孢杆菌中分离出产淀粉酶菌株并进行了性质研究,但远远不能满足工业生产对产酶菌株需求和酶性质的要求。产淀粉酶菌种资源探索备受瞩目,有更多的具有高活性的具应用价值的产淀粉酶微生物被不断分离,其各类功能和活性物质必定会进一步阐明,其应用前景更加广阔。为从新疆盐湖细菌中筛选获得淀粉酶活力较高的菌种资源,并为其应用提供理论依据和参考,本研究从新疆尉犁县黑湖采集的水、土和泥样中分离出产淀粉酶的菌株,通过酶活力测定,筛选出较高活性的菌株,进行分类鉴定,利用液体发酵法对产α-淀粉酶培养基发酵条件进行优化研究,并对其酶学特性进行了初步探讨。从该地区芽孢杆菌中分离的淀粉酶优化的最佳条件在氮源、碳源、pH、酶的反应温度以及产酶最佳时间等方面,和已报到的产酶条件相比,有一定的相似性和个别差异[14,24],该研究为淀粉酶产生的不同优化最佳条件提供重要参数。
[1] RAMESHKUMAR A,SIVASUDHA T. Optimization of nutritional constitute for enhanced α-amylase production by solid state fermentation technology[J]. International Journal of Microbiological Research,2011,2 (2):143-148.
[2] SETHI BIJAY K, JANA ARIJIT, NANDA PRATIVA K, et al. Production of α-amylase by aspergillus terreus NCFT 4269.10 using pearl millet and its structural characterization[J]. Frontiers in Plant Science, 2016, 7:1-13.
[3] 岳寿松, 边斐, 代运章,等. 产蛋白酶和淀粉酶芽孢杆菌SDYB-1的分子鉴定及酶学性能研究[J]. 山东农业科学,2015,11:54-59. YUE Shousong,BIAN Fei,DAI Yunzhang, et al. Molecular identification of protease and amylase secretingBacillussubtilisSDYB-1andcharacterizationsofenzymes[J].ShandongAgriculturalSciences, 2015, 11:54-59.
[4] 陈约慧, 陈颖聪, 刘冬冬,等. 一株高产淀粉酶的解淀粉芽胞杆菌的分离鉴定及其产酶条件优化[J]. 中国微生态学杂志, 2011, 23(6):505-510.CHENYuehui,CHENYingcong,LIUDongdong,etal.Isolationandidentificationofawildamylase-producingbacteriumandoptimizationofitsfermentableconditions[J].ChineseJournalofMicroecology, 2011, 23(6):505-510.
[5] 陈相达, 戴慧慧, 刘燕,等. 一株高产淀粉酶枯草芽孢杆菌的筛选、鉴定及产酶条件的优化[J]. 温州医科大学学报, 2011, 41(1):40-43.CHENXiangda,DAIHuihui,LIUYan,etal.ScreeningandidentificationofawildBacillussubtiliswith high amylase activity and optimization of its enzyme-producing conditions[J]. Journal of Wenzhou Medical College, 2011, 41(1):40-43.
[6] POHL S, HARWOOD C R. Heterologous protein secretion bybacillusspeciesfrom the cradle to the grave.[J]. Advances in Applied Microbiology, 2010, 73(10):1-25.
[7] RAUL D, BISWAS T, MUKHOPADHYAY S, et al. Production and partial purification of alpha amylase fromBacillussubtilis(MTCC 121) using solid state fermentation[J]. Biochemistry Research International, 2014(2): 1-5.
[8] RAJAGOPALAN G, KRISHNAN C. α-Amylase production from catabolite derepressedBacillussubtilis, KCC103 utilizing sugarcane bagasse hydrolysate[J]. Bioresource Technology, 2008, 99(8):3044-3050.
[9] REDDY N S, NIMMAGADDA A, RAO K R S S. An overview of the microbial α-amylase family[J]. African Journal of Biotechnology, 2004, 2(12):645-648.
[10] 库米拉·马吉提, 王伟, 张晓燕,等. 响应面法优化枯草芽孢杆菌发酵产低温淀粉酶的工艺条件[J]. 新疆农业大学学报, 2012, 35(6):478-483. KUMILA Majiti, WANG Wei, ZHANG Xiaoyan,et al. Optimization of cold temperature amylase ofBacillussubtilisby response surfas [J]. Journal of Xinjiang Agricultural University, 2012, 35(6):478-483.
[11] 陈吉刚, 张蓉蓉, 杨季芳,等. 北冰洋产淀粉酶海洋细菌的筛选与鉴定及其产酶条件的优化[J]. 安徽农业科学, 2011, 39(1):53-55. CHEN J G, ZHANG R R,YANG J F, et al. Screening and identification of amylase producing strain from Arctic Sea[J] . Journal of Anhui Agri, 2011, 39(1):53-55.
[12] PLOSS T N, REILMAN E, MONTEFERRANTE C G, et al. Homogeneity and heterogeneity in amylase production byBacillussubtilisunder different growth conditions[J]. Microbial Cell Factories, 2016, 15(1):1-16.
[13] CHAI K P, OTHMAN N F B, TEH A H, et al. Crystal structure ofAnoxybacillusα-amylase provides insights into maltose binding of a new glycosyl hydrolase subclass[J]. Scientific Reports, 2016, 6: 1-10
[14] 阙祖俊, 刘赵玲, 李文婷,等. 一株α-淀粉酶生产菌的分离鉴定及其产酶条件优化[J]. 浙江万里学院学报, 2010, 23(5):83-89. QUE Zujun, LI Wenting, LIU Zhaoling,et al. Isolation and identification of an α-amylase-producing bacteria strain and optimization of its fermentation conditions[J]. Journal of Zhejiang Wanli University, 2010, 23(5):83-89.
[15] 李力. 高淀粉酶蛋白酶活力枯草芽孢杆菌的选育及酶基因阳性克隆的筛选[D].乌鲁木齐:新疆农业大学,2009. LI Li. Breeding ofBacillussubtiliswithhigh-activityofamylase,proteaseandscreeningofpositiveclonesofenzymegenes[D].Urumqi:XinjiangAgriculturalUniversity, 2009.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.DONGXZ,CAIMY.Theidentificationmanualofsystematicbacteriology[M].Beijing:SciencePress, 2001.
[17] 布坎南,吉本斯.伯杰氏细菌鉴定手册 [M]. 8版.北京:科学出版社, 1984.BUCHANANRE,GIBBONSNE.Bergey′smanualofdeterminativebacteriology[M]. 8thed.Beijing:SciencePress, 1984.
[18]delSALG,MANFIOLETTIG,SCHNEIDERC.Aone-tubeplasmidDNAmini-preparationsuitableforsequencing[J].NucleicAcidsRes, 1988,16(20):9878.
[19] 王晓阁. 枯草芽孢杆菌研究进展与展望[J]. 中山大学研究生学刊(自然科学), 2012(3):14-23.WANGXiaoge.ResearchprogressandprospectofBacillussubtilis[J].SunYat-SenUniversity:JournalofTheGraduates(NaturalSciences、Medicine), 2012(3):14-23.
[20] 刘国红, 林乃铨, 林营志,等. 芽孢杆菌分类与应用研究进展[C]∥兰州: 第三届全国微生物资源学术暨国家微生物资源平台运行服务研讨会,2011:238.LIUGuohong,LINNaiquan,LINYingzhi,etal.AdvancesintaxonomyandapplicationofgenusBacillus[C]∥Lanzhou:The3rdNationalConferenceofMicrobialResources-PlatformServices,2011:238.
[21] 黄捷, 杨国新, 金东伟,等.巨大芽孢杆菌转化雷帕霉素的研究 [C]∥ 兰州: 第三届全国微生物资源学术暨国家微生物资源平台运行服务研讨会, 2011:268.HUANGJie,YANGGuoxin,JINDongwei,etal.RapamycinbyBacillusmegaterium[C]∥ Lanzhou:The 3rd National Conference of Microbial Resources-Platform Services, 2011:268.
[22] 刘贯锋, 朱育菁, 刘国红,等. 芽孢杆菌分类学特征及其生防功能菌株的筛选[C]∥ 兰州: 第三届全国微生物资源学术暨国家微生物资源平台运行服务研讨会,2011:242. LIU Guanfeng, ZHOU Yujing, LIU Guowei, et al. Taxonoimic characteristics ofBacillusgenusandscreeningofbiocontrolstrains[C].Lanzhou:The3rdNationalConferenceofMicrobialResources-PlatformServices, 2011:242.
[23] 马晓梅, 赵辉. 淀粉酶产生菌MSP13筛选及其产酶条件初步优化[J]. 食品科学, 2015, 36(11):177-181.MAXiaomei,ZHAOHui.Screeningofamylase-producingstrainMSP13andoptimizationoffermentationconditions.[J]FoodScience, 2015, 36(11):177-181.
[24] 胡博, 刘逸寒, 路福平,等. 枯草芽孢杆菌工程菌产耐酸性高温α-淀粉酶发酵条件的优化[J].天津科技大学学报,2012,6(27) :1-6.HUBo,LIUYihan,LUFuping,etal.Optimizationoffermentationconditionsforacid-resistantandheat-stableα-amylaseproductionwithengineeredstrainBacillussubtilis[J]. Journal of Tianjin University of Science and Technology, 2012, 6(27) :1-6.
Isolation of an α-amylase producing Bacillus and optimization of its fermentation conditions
MEMETIMIN Henipigul, METQURBAN Emerjan, BUGHDASH Ayan, MUHTAR Dilmurat, TOHTY Dilbar
(School of Life Science, Xinjing Normal University, Urumqi 830054, China)
The purpose of the study is to screen and identify amylase producing bacteria in the Black Lake in Yuli county, and to optimize the conditions of enzyme production. A high amylase producing strain HM-22 was screened from 43 strains of bacteria, has carried out morphological identification, molecular identification of 16S rDNA and optimization of enzyme production conditions were carried out. 43 strains of bacteria were isolated from 30 water, soil and mud samples in the Black Lake in Yuli County, and 14 strains producing amylase were screened out. The enzyme activity was determined by Yoo method, a strain with high enzyme activity was obtained and named as HM-22. By gram staining, colony morphology observation, physiological and biochemical tests, 16S rDNA sequence alignment and the similarity ofBacillustequilensiswas 99.8%, belonging to the genusBacillus. The optimization of enzyme production conditions of strain HM-22 was determined and the best condition for producing the enzyme is: the optimum temperature of amylase production was 40 ℃, the optimal carbon source is soluble starch, the optimal nitrogen source was beef extract, the optimum reaction pH was 6.0, the optimum culture time was 24 h. After optimization, the enzyme activity of strain HM-22 reached 147.53 U/mL from the initial activity of 122.45 U/mL, enzyme activity increased by 17%. The study provides a theoretical basis and reference for the screening of strains with high amylase activity in Xinjiang salt lake bacteria
Black Lake in Yuli County;Bacillus; alpha-amylase; enzyme activity determination; optimization of enzyme production conditions
10.13471/j.cnki.acta.snus.2017.04.020
2016-09-09 基金项目:国家自然科学基金(31260002)
依妮皮姑丽·麦麦提依明(1988年生),女;研究方向:极端环境微生物; E-mial:13669958015@163.com
迪丽拜尔·托乎提(1960年生),女;研究方向:极端环境微生物; E-mial:dilbar.th@163.com
Q939.9
A
0529-6579(2017)04-0126-07

