丹酚酸B对缺氧复氧诱导H9c2心肌细胞损伤的保护作用机制研究
刘莎莎,张 赛,汤 智,李玉冰,冯 凯,刘 湘*
(1.湘潭市中心医院,湖南 湘潭 411100;2.湘潭市中医院,湖南 湘潭 411100;3.大连市友谊医院,辽宁 大连 116100;4.大连市口腔医院,辽宁 大连 116021)
丹酚酸B对缺氧复氧诱导H9c2心肌细胞损伤的保护作用机制研究
刘莎莎1,张 赛2,汤 智2,李玉冰3,冯 凯4,刘 湘1*
(1.湘潭市中心医院,湖南 湘潭 411100;2.湘潭市中医院,湖南 湘潭 411100;3.大连市友谊医院,辽宁 大连 116100;4.大连市口腔医院,辽宁 大连 116021)
目的 观察丹酚酸B(Sal B)对H9c2心肌细胞缺氧复氧(hypoxia-reoxygenation,H/R)损伤的保护作用,并探讨其可能的作用机制。方法 首先构建H9c2心肌细胞缺氧复氧模型,采用噻唑蓝(MTT)法研究丹酚酸B与H9c2心肌细胞活力的量效关系,确定丹酚酸B的保护作用,给药方式为预给药。实验分为正常对照组、丹酚酸B组、模型组(H/R组)、H/R+丹酚酸B组,分别检测各组乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、活性氧簇(ROS)以及半胱氨酸天冬氨酸特异性蛋白酶-3(Caspase-3)的含量变化。Western印迹检测添加丹酚酸B对Akt磷酸化的影响,添加Akt抑制剂LY294002加以比较。结果 与正常对照组相比较,模型组LDH、MDA、ROS以及Caspase-3含量水平显著升高(P<0.05),SOD、GSH-Px以及CAT含量水平显著降低(P<0.05);与模型组相比,丹酚酸B能够显著提高SOD、GSH-Px以及CAT含量水平(P<0.05),显著降低LDH、MDA、ROS以及Caspase-3含量水平(P<0.05)。Western印迹结果显示与正常对照组相比较,模型组Akt磷酸化水平显著降低(P<0.001),相对于模型组丹酚酸B能够显著提高Akt的磷酸化水平(P<0.01),而这种保护作用能被LY294002所阻断(P<0.01)。结论 丹酚酸B对H9c2心肌细胞缺氧复氧损伤具有保护作用,其机制可能与磷脂酰肌醇 3-激酶(PI3K/Akt)通路相关。
丹酚酸B;H9c2心肌细胞;缺氧复氧;抗氧化;抗凋亡;磷脂酰肌醇3-激酶
缺血性心脏病(冠心病)是全世界范围内发病率及致死率最高的疾病之一,严重威胁人类的健康[1]。冠心病的治疗过程中常常伴随着心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI),其中氧自由基的大量生成及其后续的凋亡是MIRI损伤的重要机制之一[2-4]。丹参作为一种传统的活血化瘀中药,常用于冠心病的治疗[5-7]。丹酚酸B(Sal B)作为丹参中含量最多的成分同时也是最主要的活性成分,具有广泛的临床应用前景[8]。本研究采用心肌细胞缺氧复氧 (hypoxia-reoxygenation,H/R)损伤模型,从抗氧化及抗凋亡等方面探讨丹酚酸B对H/R损伤的作用机制,旨在为其临床应用提供基础理论依据。
1 材料
1.1 细胞
大鼠心肌细胞H9c2,购于中国科学院细胞库。
1.2 受试药物
丹酚酸B,购于上海融禾医药科技发展有限公司,质量分数>98%。以二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,加DMEM 稀释至所需浓度。
1.3 主要仪器及试剂
二氧化碳细胞培养箱购自美国Thermo Scientific公司;超净工作台购自上海智成分析仪器制造有限公司;超纯水仪购自美国Merck Millipore公司;恒温磁力搅拌器购自上海司乐仪器有限公司;台式离心机购自上海安亭科学化学仪器厂;低温冰箱购自青岛海尔股份有限公司;酶标仪购自奥地利Tecan公司;电子天平购自梅特勒-托利多仪器(上海)有限公司;厌氧手套箱购自美国COY Laboratory公司;SDS PAGE微型凝胶电泳及转膜设备购自美国BioRad公司;高糖DMEM培养基、无糖DMEM培养基和胎牛血清购自美国Gibco公司;噻唑蓝(MTT)及活性氧簇(ROS)试剂盒购自美国ENZO公司;胰酶(Trypsin)及DMSO购自美国Sigma公司;乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)和考马斯亮蓝蛋白定量试剂盒购自南京建成科技有限公司;半胱氨酸天冬氨酸特异性蛋白酶3(Caspase-3)活性检测试剂盒购自美国Biovision公司。哺乳动物蛋白提取试剂盒、BCA蛋白定量试剂盒、增强型免疫化学发光免疫印迹检测试剂盒和兔抗鼠二抗购自北京康为世纪有限公司;抑制剂LY294002(CID:3973)购自美国CA公司;鼠源一抗 p-Akt 1/2/3(B-5)、Akt 1/2/3(H-136)和 β-actin(C-2)购自美国Santa Cruz公司。
2 方法
2.1 心肌细胞H/R模型的构建
H9c2心肌细胞复苏后转移至培养瓶中,加入含有10%胎牛血清的培养液,置于37℃含5%CO2的细胞培养箱中培养。H9c2心肌细胞在含10%血清和1%双抗的高糖DMEM培养基中铺板生长24 h后达到生长对数期。缺氧处理前去除培养板中高糖DMEM培养基,加入无糖DMEM培养基,放入COY厌氧手套箱37℃恒温培养。复氧处理时,从厌氧手套箱中取出细胞培养板,用新鲜的高糖DMEM培养基替换无糖培养基,放入正常细胞培养箱中培养。H9c2心肌细胞缺氧时间固定为 6 h, 分别复氧 0、3、6、9、12、18、24 h,MTT法检测复氧不同时间对H9c2心肌细胞活力的影响,最终确定造模时间为缺氧6 h和复氧24 h。
2.2 分组与干预
实验分为正常对照组、丹酚酸B组、模型组(H/R组)和H/R+丹酚酸B组,其中H/R组和H/R+丹酚酸B组细胞进行H/R损伤处理,对照组和丹酚酸B组细胞不做处理。
2.3 指标检测
2.3.1 MTT法检测丹酚酸B预处理对H/R诱导H9c2心肌细胞的影响 首先在正常条件下1.563、3.125和6.25 μg/mL三个浓度丹酚酸B预孵育细胞24 h,考察药物的增殖作用和毒性作用,随后在缺氧6 h和复氧24 h条件下筛选最佳药物作用浓度,本部分实验分为正常对照组,H/R组和低、中、高浓度丹酚酸B给药组。
2.3.2 乳酸脱氢酶(LDH)活性测定 正常对照组和丹酚酸B组不做处理,H/R组和H/R+丹酚酸B组细胞缺氧6 h和复氧24 h,处理结束后收集细胞培养液,参考南京建成试剂盒操作步骤进行测定。
2.3.3 超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)含量变化测定 正常对照组和丹酚酸B组不做处理,H/R组和H/R+丹酚酸B组细胞缺氧6 h和复氧24 h,处理结束后收集细胞培养液,按照南京建成试剂盒说明书进行操作。
2.3.4 活性氧簇(ROS)含量变化测定 正常对照组和丹酚酸B组不做处理,H/R组和H/R+丹酚酸B组细胞缺氧6 h和复氧24 h,处理结束后取足量细胞移至离心管中,按照试剂盒说明书进行操作。
2.3.5 半胱氨酸天冬氨酸特异性蛋白酶3(Caspase-3)的含量变化测定 正常对照组和丹酚酸B组不做处理,H/R组和H/R+丹酚酸B组细胞缺氧6 h和复氧24 h,处理结束后取足量细胞移至离心管中,按照试剂盒说明书进行操作。
2.3.6 Western印迹检测 采用哺乳动物蛋白提取试剂盒提取细胞蛋白,BCA蛋白定量试剂盒进行蛋白定量,10%SDS-聚丙烯酰胺凝胶进行电泳分离,转NC膜。5%脱脂奶粉TBST溶液室温封闭3 h后,分别加入 p-Akt、Akt和 β-actin 鼠源一抗 (1∶200),4℃孵育过夜,1×TBST洗3次,加入兔抗鼠二抗(1∶2 000),室温孵育 2 h,1×TBST 洗 3 次,用 ECL显色并曝光,凝胶系统拍片,采用Image J软件进行条带灰度扫描。加入Akt抑制剂LY294002组进行验证,给药前预处理1 h,浓度为50 mol/L。
2.4 统计学处理方法
3 结果
3.1 心肌细胞H/R模型的构建
结果显示随着复氧时间的增加,心肌细胞活力逐渐下降,表明复氧在MIRI中发挥着重要作用。最佳的造模条件为缺氧6 h和复氧24 h(P<0.01)。结果见图1A。
3.2 不同浓度丹酚酸B对H/R诱导的H9c2心肌细胞的影响
结果显示细胞的活力没有发生变化(图1B)。排除了丹酚酸B的增殖作用和毒性作用后,寻找最佳的给药浓度,最终发现最佳的给药浓度为6.25 μg/mL。见图1B-1C。
3.3 丹酚酸B对H/R诱导的H9c2心肌细胞LDH的影响
LDH在细胞膜损伤时会从细胞中漏出,其可作为细胞死亡的标志。图1D显示相对于正常对照组,H/R组能够显著增加LDH的释放,相对于H/R组H/R+SalB能够显著减少LDH的释放(P<0.01)。见图1D。
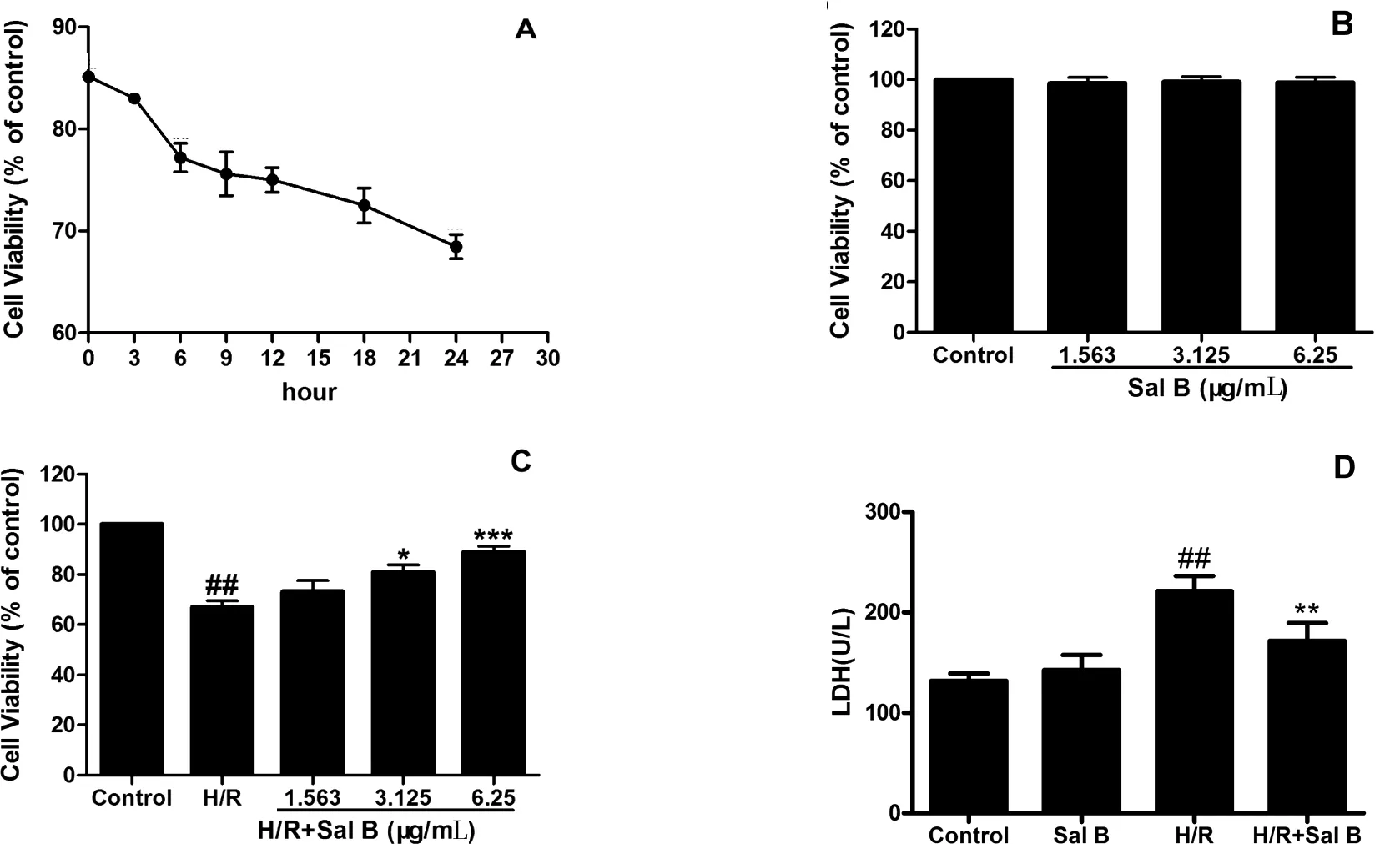
图1心肌细胞H/R模型构建及丹酚酸B对其影响
3.4 丹酚酸B对H/R诱导的H9c2心肌细胞SOD、MDA、GSH-Px和CAT的影响
相对于对照组,H/R能够对H9c2心肌细胞造成氧化应激损伤,它能够降低SOD、CAT和GSH-Px的活力(P<0.05)并且提高 MDA 的含量(P<0.01)。丹酚酸B的预处理能显著抑制抗氧化物酶活性的降低(P<0.05)和 MDA 量的增加(P<0.01)。 见图2A-2D。
3.5 丹酚酸B对H/R诱导的H9c2心肌细胞ROS的影响
ROS的大量生成在细胞凋亡的过程中发挥重要作用[9]。图2E显示相对于正常对照组,H/R 组的细胞内 ROS水平显著提高(P<0.001),而丹酚酸B的预处理能显著降低细胞内ROS的水平 (P<0.05)。结果表明丹酚酸B对H/R诱导的H9c2心肌细胞损伤的保护作用与其抑制氧化应激反应有关。
3.6 丹酚酸B对H/R诱导的H9c2心肌细胞Caspase-3的影响
Caspase-3活力的升高显示H/R组的凋亡损伤增加(P<0.001),相对于H/R组,丹酚酸B的预处理可以减轻凋亡损伤(P<0.05)。见图2F。
3.7 丹酚酸B对H/R诱导的H9c2心肌细胞Akt磷酸化水平的影响
Western印迹结果显示与正常对照组相比较,模型组Akt磷酸化水平显著降低(P<0.001),相对于模型组,丹酚酸B能够显著提高Akt的磷酸化水平(P<0.01),而这种保护作用能被LY294002所阻断(P<0.01)。见图3。
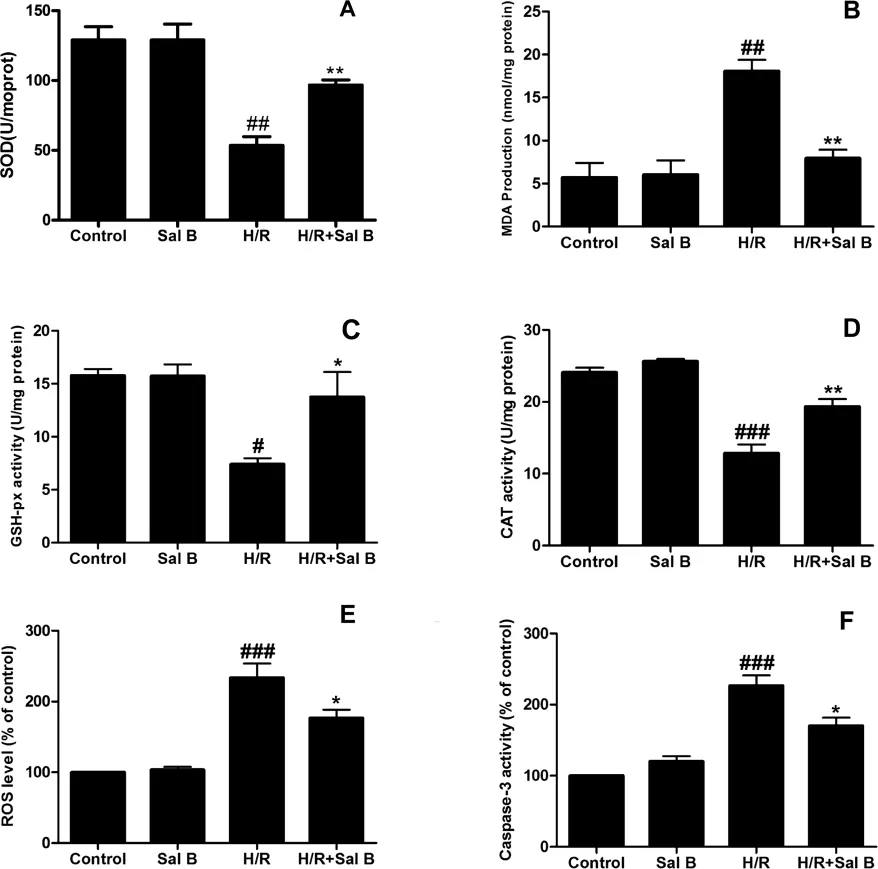
图2丹酚酸B对H/R损伤H9c2心肌细胞活力指标的影响
4 讨论
H9c2心肌细胞株是一种从大鼠胚胎心脏中分离出的永生化的心肌细胞系,不但具有类似于胚胎大鼠心肌细胞的形态学特征,而且具有成年大鼠心肌细胞电生理学和信号转导方面的生理特征,且性质稳定,因而被广泛应用于心肌细胞生理和病理方面的实验研究[10]。本研究利用体外H/R模型诱导H9c2心肌细胞凋亡,接近于体内心肌组织细胞MIRI的病理生理本质,是探讨丹酚酸B对MIRI过程中心肌细胞损伤的影响和机制研究的合适模型。
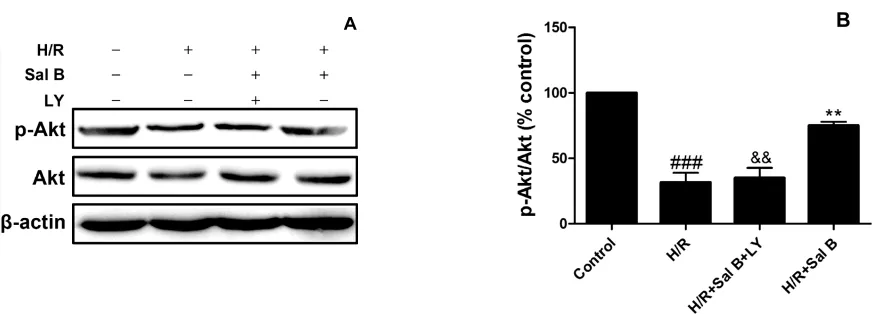
图3 Western blot检测丹酚酸B对H/R损伤H9c2心肌细胞Akt磷酸化水平的影响
目前研究报道的MIRI的发生机制主要有氧化应激、细胞凋亡、钙超载、炎症反应和能量代谢障碍等[11-12]。尽管MIRI发生的机制目前仍不完全清楚,但是越来越多的研究认为,氧化应激介导的心肌细胞凋亡与MIRI的发生发展关系密切,可能是其发病机制中的重要环节之一。氧化应激是指活性氧簇(ROS)的产生超过了机体内的清除能力导致活性氧自由基及其相关代谢产物在体内过量积聚造成失衡,从而对机体造成多种损害作用的病理状态。在机体正常情况下ROS可以被体内的抗氧化酶清除从而使细胞免受ROS的氧化损伤。当机体处于非正常情况比如组织细胞缺血缺氧时,ROS的清除系统功能降低或丧失从而造成细胞急性或慢性损伤[2,4,13]。氧化应激在心血管疾病的发生发展过程发挥着重要作用,既可直接损伤细胞DNA诱导凋亡,还可以通过激活线粒体途径等间接方式介导细胞凋亡。细胞凋亡(Apoptosis)是受一系列基因调控的、自发性的程序性死亡,它对维持机体细胞生长与消亡的平衡起着重要的调节作用,细胞凋亡并不是病理条件下自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。大量的研究证实缺血性心脏病、MIRI损伤、心衰以及神经退行性疾病等多种病理生理状态的过程中均伴有细胞凋亡的发生[14-18]。因此抗氧化应激从而抑制凋亡成为探索这些疾病的发病机制及研制相关药物的一个重要的方向。
细胞凋亡的诱导因子能够通过激活蛋白磷酸化依赖的信号传导级联反应抑制或促进凋亡程序。研究表明磷脂酰肌醇3-激酶(PI3K/Akt)信号转导通路在MIRI诱导的心肌细胞凋亡信号传导中具有重要的作用[19]。PI3K/Akt信号传导通路抗细胞凋亡作用可能与下面几种机制有关:(1)调节Bcl-2家族成员的活性[19];(2)抑制 Caspase 导致的细胞凋亡;(3)抑制促凋亡基因的表达[20];(4)活化转录因子NF-κB,抑制细胞凋亡;(5)活化的Akt能够抑制线粒体释放细胞色素c从而抑制细胞凋亡[21]。此外PI3K/Akt信号转导通路还可以调控细胞的生长与存活,血管新生,细胞迁移以及细胞周期等多种细胞活动与生物学效应[22-23]。
H/R诱导的H9c2心肌细胞氧化损伤模型被广泛用于模拟氧化应激[24]。在本研究中,H/R诱导的H9c2心肌细胞凋亡表现出了LDH释放的显著增加以及细胞存活率的显著降低。H/R造模的MTT结果显示复氧的0~24 h过程中细胞存活率呈时间依赖性地降低,说明了缺氧能够使H9c2心肌细胞的存活率降低,而复氧能使其进一步地降低。最终选择缺氧6 h加复氧24 h作为造模条件。
在观察完丹酚酸B的增殖作用和毒性作用以后,发现采用6.25 μg/mL丹酚酸B预处理24 h后能显著提高H/R损伤后的H9c2心肌细胞的存活率。丹酚酸B预处理对心肌细胞的保护作用体现在细胞存活率的增高和LDH漏出的降低。
大量ROS的存在能够通过脂质过氧化作用,蛋白质和DNA的氧化损伤多种生物分子,最终导致线粒体功能失常,Caspase-3的激活以及细胞的凋亡[25]。Caspases(半胱氨酸-天门冬氨酸特异性蛋白酶)家族是一类独特的半胱氨酸蛋白酶,它们可特异性水解目标蛋白中天门冬氨酸残基的羧基端。至今在哺乳动物中已发现的Caspase超过13种,其中起最为关键作用的是Caspases-3,一种凋亡关键效应酶。Caspase-3主要作用是对底物蛋白质进行酶解从而直接介导凋亡实施。MIRI导致氧化应激等因素可诱导内源性和外源性凋亡通路的激活,并最终激活Caspases-3。活化的Caspases-3可以降解多种胞内蛋白,使胞膜、细胞骨架及染色体结构遭到破坏,导致胞体固缩,染色体崩解,凋亡小体形成等。因此许多研究中将Caspase-3作为凋亡损伤的标志性指标[26]。许多研究表明MIRI能够引起Caspase-3活性的增高和心肌凋亡细胞数量的增加[27]。在本研究中H/R诱导的损伤能够提高H9c2心肌细胞胞内ROS浓度,并且也能增高氧化应激标志物比如脂质过氧化产物MDA的含量。丹酚酸B的预处理能够降低它们的含量并且能有效地增加SOD、GSH-px和CAT的活力。
PI3K/Akt信号通路在调控心肌细胞的生存和凋亡过程中发挥着重要作用。Western印迹检测结果显示丹酚酸B的预处理可以显著升高H/R损伤造成的Akt磷酸化水平降低,而这种保护作用可以被LY294002所阻断。因此我们推测丹酚酸B预处理可能通过激活PI3K/Akt通路抑制H/R诱导的H9c2心肌细胞凋亡。
综上所述,丹酚酸B对H/R诱导H9c2心肌细胞损伤具有保护作用,其作用机制可能与PI3K/Akt通路相关,但其确切的作用机制尚需进一步研究。
[1]Damiani G,Salvatori E,Silvestrini G.et al.Influence of socioeconomic factors on hospital readmissions for heart failure and acute myocardial infarction in patients 65 years and older:evidence from a systematic review[J].ClinintervAging,2015,10:237-245.
[2]Meng X,Sun G,YeJ.etal.NotoginsenosideR1-medi ated neuroprotection involves estrogen receptor-dependentcrosstalk between Akt and ERK1/2 pathways:a novel mechanism of Nrf2/ARE signaling activation[J].Free Radic Res,2014,48(4):445-460.
[3]Ray PD,Huang BW,Tsuji Y.Reactive oxygen species(ROS)homeostasis and redox regulation in cellular signaling[J].Cell Signal,2012,24(5):981-990.
[4]Wilkinson-Berka JL,Rana I,Armani Ret al.Reactive oxygen species,Nox and angiotensin II in angiogenesis:implications for retinopathy[J].Clin Sci(Lond),2013,124(10):597-615.
[5]杨志霞,林 谦,马 利.丹参对心血管疾病药理作用的文献研究[J].世界中西医结合杂志,2012(2):93-96.
[6]杜冠华,张均田.丹参现代研究概况与进展(续一)[J].医药导报,2004(6):355-360.
[7]张 照,朱伟君,阮鸿刚,等.丹参注射液对心脏微循环的影响[J].生理科学,1984(4):36.
[8]罗娟敏,苏加坤,田耀伟,等.HPLC法同时测定丹参药材中丹酚酸B、丹参酮ⅡA含量[J].亚太传统医药,2014(2):25-27.
[9]Sinha K,Das J,Pal PB,et al.Oxidative stress:the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J].Arch Toxicol,2013,87(7):1157-1180.
[10]Hescheler J,Meyer R,Plant S,et al.Morphological,biochemical,and electrophysiological characterization of a clonal cell(H9c2)line from rat heart[J].Circ Res,1991,69(6):1476-1486.
[11]Jennings RB,Sommers HM,Smyth GA,et al.Myocardial necrosis induced by temporary occlusion of a coronary artery in the dog[J].Arch Pathol,1960,70:68-78.
[12]Frohlich GM,Meier P,White SK,et al.Myocardial reperfusion injury:looking beyond primary PCI[J].Eur Heart J,2013,34(23):1714-1722.
[13]Chen XL,Kunsch C.Induction of cytoprotective genes through Nrf2/antioxidant response element pathway:a new therapeutic approach for the treatment of inflammatory diseases[J].Curr Pharm Des,2004,10(8):879-891.
[14]Nicholson DW.From bench to clinic with apoptosis-based therapeutic agents[J].Nature,2000,407(6805):810-816.
[15]Gottlieb RA.Cell death pathways in acute ischemia/reperfusion injury[J].J Cardiovasc Pharmacol Ther,2011,16(3-4):233-238.
[16]Zhao ZQ,Nakamura M,Wang NP,et al.Reperfusion induces myocardial apoptotic cell death[J].Cardiovasc Res,2000,45(3):651-660.
[17]Sun Y,Yi W,Yuan Y,et al.C1q/tumor necrosis factor-related protein-9,a novel adipocyte-derived cytokine, attenuates adverse remodeling in the ischemic mouse heart via protein kinase A activation[J].Circulation,2013,128(11 Suppl 1):S113-120.
[18]Wu N,Zhang X,Jia P,et al.Hypercholesterolemia abrogates the protective effect of ischemic postconditioning by induction of apoptosis and impairment of activation of reperfusion injury salvage kinase pathway[J].Biochem Biophys Res Commun,2015,458(1):148-153.
[19]Deng C,Sun Z,Tong G,et al.alpha-Lipoic acid reduces infarct size and preserves cardiac function in rat myocardial ischemia/reperfusion injury through activation of PI3K/Akt/Nrf2 pathway[J].Plos ONE,2013,8(3):e58371.
[20]Xin M,Deng X.Nicotine inactivation of the proapoptotic function of Bax through phosphorylation[J].J Biol Chem,2005,280(11):10781-10789.
[21]Bartling B,Tostlebe H,Darmer D,et al.Shear stress-dependent expression of apoptosis-regulating genes in endothelial cells[J].Biochem Biophys Res Commun,2000,278(3):740-746.
[22]Gibson EM,Henson ES,Haney N,et al.Epidermal growth factor protects epithelial-derived cells from tumor necrosis factorrelated apoptosis-inducing ligand-induced apoptosis by inhibiting cytochrome c release[J].Cancer Res,2002,62(2):488-496.
[23]Rommel C,Camps M,Ji H.PI3K delta and PI3K gamma:partners in crime in inflammation in rheumatoid arthritis and beyond?[J].Nat Rev Immunol,2007,7(3):191-201.
[24]Sun L,Zang WJ,Wang H,et al.Acetylcholine promotes ROS det oxification against hypoxia/reoxygenation-induced oxidative stress through FoxO3a/PGC-1alpha dependent superoxide dismutase[J].Cell Physiol Biochem,2014,34(5):1614-1625.
[25]Radak Z,Zhao Z,Goto S,et al.Age-associated neurodegeneration and oxidative damage to lipids,proteins and DNA[J].Mol Aspects Med,2011,32(4-6):305-315.
[26]Smith MA,Schnellmann RG.Calpains,mitochondria,and apoptosis[J].Cardiovasc Res,2012,96(1):32-37.
[27]Bae S,Yalamarti B,Kang PM.Role of caspase-independent apopto sis in cardiovascular diseases[J].Front Biosci,2008(13):2495-2503.
(本文编辑 杨 瑛)
Protective Effect of Salvianolic Acid B on Hypoxia-Reoxygenation Induced Injury in H9c2 Cardiomyocytes
LIU Shasha1,ZHANG Sai2,TANG Zhi2,LI Yubing3,FENG Kai4,LIU Xiang1*
(1.Xiangtan Central Hospital,Xiangtan,Hunan 411100,China;2.Xiangtan Chinese Medicine Hospital,Xiangtan,Hunan 411100,China;3.Dalian(Municipal)Friendship Hospital,Dalian,Liaoning 116001,China;4.Dalian Stomatological Hospital,Dalian,Liaoning 116021,China)
ObjectiveTo investigate the protective effect of salvianolic acid B (Sal B)on hypoxia-reoxygenation(H/R)induced injury in H9c2 cardiomyocytes.MethodsThe hypoxia-reoxygenation model of H9c2 cardiomyocytes was constructed.The relationship between the activity of Sal B and H9c2 was measured by MTT assay,and the protective effect of Sal B was determined.The following sets of experiments were performed:control group,Sal B group,model group(H/R group),H/R+Sal B group.The contents of lactic dehydrogenase(LDH),superoxide dismutase(SOD),malonaldehyde(MDA),glutathione peroxidase(GSH-Px),catalase(CAT),reactive oxygen species(ROS)and Caspase-3 in all groups were determined.The effect of Sal B on Akt phosphorylation was tested with Western blotting,and LY294002 added as the control.ResultsCompared with the control group,LDH,MDA,ROS,and Caspase-3 levels in H/R group significantly increased(P<0.05)and SOD,GSH-Px,and CAT levels in H/R group significantly decreased (P<0.05).Compared with H/R group,Sal B significantly increased SOD,GSH-Px,and CAT levels and decreased LDH,MDA,ROS,and Caspase-3 levels.Western blotting results showed that:compared with the controlgroup,Aktphosphorylation levelin modelgroup decreased significantly (P<0.01);comparedwith model group,Akt phosphorylation level in Sal B group increased significantly (P<0.01),while this effect could be blocked by LY294002(P<0.01).Conclusion Sal B shows protective effect on H9c2 cadiomyocytes injury induced by H/R,which mechanism may be related with the PI3K/Akt signaling pathway.
salvianolic acid B;H9c2 cadiomyocytes;hypoxia-reoxygenation;antioxidant;anti-apoptosis;PI3K/Akt
R285.5;R541.4
A
doi:10.3969/j.issn.1674-070X.2017.08.005
2016-12-10
刘莎莎,女,硕士,研究方向:心血管药理。
*刘 湘,女,主任药师,E-mail:liuxiangtougao@163.com。
本文引用:刘莎莎,张 赛,汤 智,李玉冰,冯 凯,刘 湘.丹酚酸B对缺氧复氧诱导H9c2心肌细胞损伤的保护作用机制研究[J].湖南中医药大学学报,2017,37(8):832-837.

