硒对氟致大鼠肾小管上皮细胞线粒体膜电位改变的拮抗作用
常 凯, 王 裕, 庞文彪, 高继萍, 陈朝阳, 宋国华
(山西医科大学实验动物中心, 实验动物与人类疾病动物模型山西省重点实验室, 太原 030001)
硒对氟致大鼠肾小管上皮细胞线粒体膜电位改变的拮抗作用
常 凯, 王 裕, 庞文彪, 高继萍, 陈朝阳, 宋国华
(山西医科大学实验动物中心, 实验动物与人类疾病动物模型山西省重点实验室, 太原 030001)
目的 探究硒对氟致大鼠肾小管上皮细胞(NRK-52E细胞)线粒体膜电位改变的拮抗作用。方法 实验共设4组: 染氟组(5 mg/L和20 mg/L的氟化钠)、染硒组(0.0171 mg/L和0.0342 mg/L的亚硒酸钠)、硒干预组(氟化钠和亚硒酸钠联合干预)和对照组,按照分组干预NRK-52E细胞48 h。流式细胞仪检测其线粒体膜电位,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)和总抗氧化力(T-AOC)测试盒测定酶的活性。结果 与对照组比,随着氟化钠浓度的升高,染氟组NRK-52E细胞线粒体膜电位下降(P<0.05或P<0.01)且SOD、T-AOC、GSH-PX和CAT酶活性均降低(P<0.05或P<0.01)。与染氟组相比,相对应的硒干预组线粒体膜电位升高(P<0.01)。与20 mg/L的染氟组比较,相对应硒干预组的SOD、T-AOC、GSH-PX和CAT酶活性均升高(P<0.05)。与0.0171 mg/L染硒组相比,相对应的硒干预组线粒体膜电位降低(P<0.01)且T-AOC、GSH-PX和CAT酶活性均降低(P<0.01或P<0.05)。5 mg/L加氟组与加硒组相比,线粒体膜电位显著变化(P<0.01), 但SOD、GSH-PX、CAT、T-AOC酶活性均无显著变化。20 mg/L加氟组与加硒组相比,线粒体膜电位具有显著性差异(P<0.01)且SOD、GSH-PX、CAT、T-AOC酶活性均有显著性差异(P<0.01)。结论 一定浓度的硒可以拮抗氟诱导大鼠肾小管上皮细胞线粒体膜电位下降,可能通过恢复抗氧化酶活性实现。
氟; 硒; 肾小管上皮细胞; 线粒体膜电位; 抗氧化酶
我国是地方性氟病较严重的国家之一,长期暴露于高氟可引起机体慢性氟中毒[1]。对慢性氟中毒的大鼠体内自由基含量检测,结果表明损伤的主要原因是氟中毒时自由基含量上升[2-4]。自由基攻击生物膜系统,会导致线粒体受损和生物膜脂质的过氧化[5]。线粒体的氧化损伤与慢性氟中毒关系密切[5]。线粒体结构和功能异常改变可能是因为慢性氟中毒而引起的氧化应激水平升高[3,6-9]。微量元素硒是维持生命活动所必须的,杨克敌等[10]早在1998年的研究已表明一定剂量的硒可拮抗氟中毒,这一结论被许多学者所支持[11-14]。Miao等[15]用不同浓度的含硒水饲喂大鼠表明,氟化钠+硒组较氟化钠组的谷胱甘肽过氧化物酶(GSH-PX)活性高。本文将探究硒对氟致NRK-52E细胞线粒体膜电位改变是否具有拮抗作用。
本实验以大鼠肾小管上皮细胞为载体, 以不同浓度的氟化钠(NaF)(5 mg/L、20 mg/L)和亚硒酸钠(Na2SeO3)(0.0 171 mg/L、0.0 342 mg/L)处理大鼠肾小管上皮细胞48 h, 然后对其线粒体膜电位和一类抗氧化酶系统包括: 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、GSH-PX和总抗氧化力(T-AOC)[16,17]进行检测,旨在探究硒对氟致NRK-52E细胞线粒体膜电位改变的作用,为抗氟药物的开发和应用提供参考数据。
1 材料与方法
1.1 细胞系来源及培养
本实验所用的大鼠肾小管上皮细胞(NRK-52E细胞)购自于中国科学院上海细胞库[12]。将大鼠肾小管上皮细胞置于37 ℃、体积分数5% CO2的培养箱中培养,使用含体积分数10%灭活胎牛血清,体积分数1%青链霉素的DMEM高糖培养基。
1.2 主要试剂
胎牛血清(杭州四季青公司),NaF分析纯(天津市博迪化工有限责任公司),Na2SeO3分析纯(购自天津市化学试剂厂),线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司),冰醋酸、SOD、GSH-PX、CAT和T-AOC测定试剂盒(均购于南京建成生物工程研究所)。
1.3 细胞的分组及处理
NRK-52E细胞的具体分组情况见表1。大鼠肾小管上皮细胞细胞按1 × 105/mL的密度接种于6孔培养板,每孔培养液3 mL。待细胞全部贴壁后,再用PBS洗涤2次,按照表1的分组方法进行给药,处理48 h。
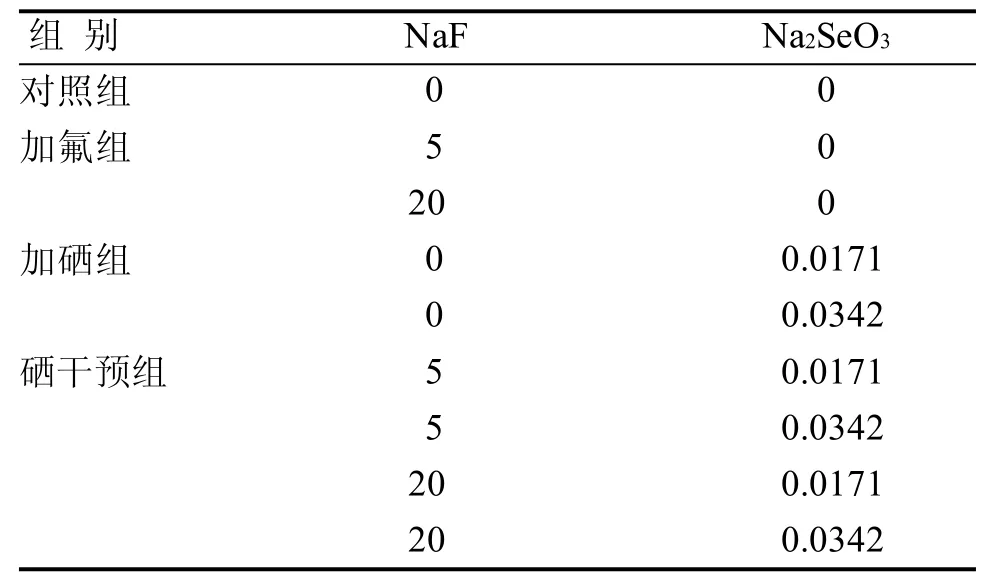
表1 实验分组情况Table 1 Experimental group mg/L
1.4 线粒体膜电位的测定
NRK-52E细胞给药处理48 h后, 用PBS洗涤2次(2 000 ×g、离心5 min), 收集细胞; 加入500 mL培养液和JC-1染色工作液, 颠倒混匀, 然后置于37 ℃、体积分数5% CO2的培养箱中孵育20 min; 孵育结束后, 600 ×g 4 ℃离心3~4 min, 沉淀细胞; 弃上清用JC-1染色缓冲液(1×)洗涤2次,600×g 4 ℃离心3~4 min; 250 mL JC-1染色缓冲液(1×)重悬细胞,用流式细胞仪分析,记录好实验结果。
1.5 氧化应激指标的测定
按照表1的分组方法对NRK-52E细胞进行给药,测定大鼠肾小管上皮细胞的应激指标,包括: SOD值、GSH-PX值、CAT值和T-AOC值。具体操作方法参见SOD测试盒、GSH-PX测试盒、CAT测试盒和T-AOC测定试剂盒说明书进行。
1.6 统计学分析
实验数据采用SPSS19.0软件进行分析处理,以均数±标准差()表示。方差齐的多组比较采用单因素方差分析(one-way ANOVA)和LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 线粒体膜电位
硒对氟诱导的NRK-52E细胞的线粒体膜电位的测定结果见表2和图1。线粒体膜电位较高时,JC-1以聚合物形式存在于线粒体基质中, 发红色荧光; 当线粒体膜电位较低时, 发出绿色荧光。5 mg/L加氟组与加硒组相比、20 mg/L加氟组与加硒组相比都具有显著性差异(P<0.01)。与对照组相比,随着NaF浓度的升高(从5 mg/L到20 mg/L),JC-1绿色荧光比值上升,线粒体膜电位降低(P<0.05或P<0.01)。0.0171mg/L的加硒组与对照组相比, 其线粒体膜电位无显著变化。硒干预组与对照组相比, 具有显著性差异(P<0.01); 0.0171 mg/L的硒干预组与同剂量加硒组相比,具有显著性差异(P<0.01);硒干预组与等剂量加氟组相比, 线粒体膜电位显著升高(P<0.01)。这说明硒对氟致NRK-52E细胞线粒体膜电位的变化具有拮抗作用。
2.2 氧化应激指标
如表3所示,5 mg/L加氟组与加硒组相比, SOD、GSH-PX(除0.0171mg/L的加硒组)、CAT、T-AOC酶活性均无显著变化; 20 mg/L加氟组与加硒组相比, 具有显著性差异(P<0.01)。与对照组相比, 染氟组SOD、GSH-PX、CAT、T-AOC酶活性均降低(P<0.05或P<0.01)。与0.0171 mg/L加硒组相比, 相对应的硒干预组T-AOC、GSH-PX和CAT酶活性均降低(P<0.01或P<0.05)。与20 mg/L染氟组比较, 相对应的硒干预组SOD、T-AOC、GSH-PX和CAT酶活性均升高(P<0.05)。
表2 硒干预对氟化钠诱导的肾小管上皮细胞线粒体膜电位的影响(± s, n=3)Table 2 Effect of selenium intervention on mitochondrial membrane potential of NRK-52E cells induced by sodium fluoride (± s, n=3)
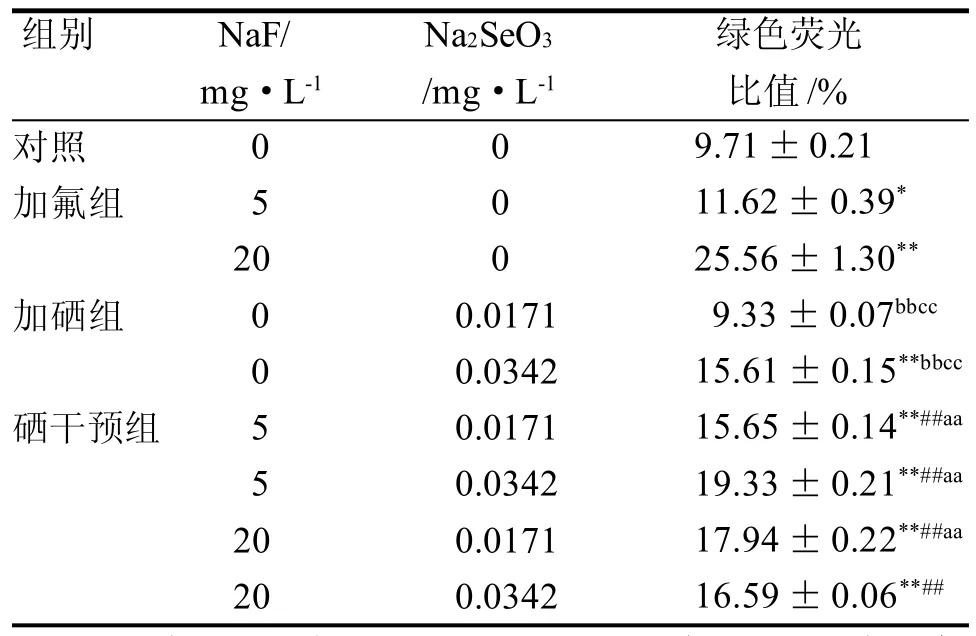
表2 硒干预对氟化钠诱导的肾小管上皮细胞线粒体膜电位的影响(± s, n=3)Table 2 Effect of selenium intervention on mitochondrial membrane potential of NRK-52E cells induced by sodium fluoride (± s, n=3)
注: 与对照组相比,*P<0.05,**P<0.01; 各硒干预组与同剂量加氟组相比,##P<0.01; 各硒干预组与同剂量加硒组相比,aaP <0.01; 20 mg/L加氟组与加硒组相比,bbP<0.01; 5 mg/L加氟组与加硒组相比,ccP<0.01
组别 NaF/ Na2SeO3绿色荧光mg·L-1/mg·L-1比值/%对照加氟组加硒组硒干预组0 5 2 0 0 0 5 5 2 0 20 0 0 0 0.0171 0.0342 0.0171 0.0342 0.0171 0.0342 9.71±0.21 11.62±0.39*25.56±1.30**9.33±0.07bbcc15.61±0.15**bbcc15.65±0.14**##aa19.33±0.21**##aa17.94±0.22**##aa16.59±0.06**##
3 讨论
线粒体是机体产生能量与储存能量的主要场所, 由内外两层膜包被[18],线粒体的内膜存在跨膜的质子梯度电位差,跨膜电位外室为正电位, 内室为负电位, 内膜上的ATP合成酶利用跨膜电势能可合成维持细胞正常功能所需的ATP[19]。线粒体膜电位对维持线粒体正常功能极为重要[20,21],甚至影响细胞乃至整个机体的基本生理功能。膜电位改变可反映出多种与线粒体功能相关的变化,如: 线粒体蛋白复合体的结构变化、细胞色素C释放和ATP的合成等。过量氟可致氧化代谢紊乱,从而引起细胞病理损伤甚至细胞的凋亡[22]。另外膜电位的下降被认为是细胞早期凋亡的标志性事件,更是细胞早期凋亡的不可逆事件[23]。本研究表明,随着NaF浓度的升高,染氟组NRK-52E细胞线粒体膜电位下降(P<0.05或P<0.01)。与加硒组相比,同剂量的硒干预组线粒体膜电位降低(P<0.01), T-AOC、GSH-PX和CAT酶活性均降低(P<0.01或P<0.05)。这提示了氟可诱导NRK-52E细胞线粒体膜电位的改变。另外本研究还显示,染氟组细胞内的SOD、T-AOC、GSH-PX和CAT酶活性均降低(P<0.05)。由此本文作者推测过量氟的摄入致细胞内氧化系统和抗氧化系统失衡,导致脂质过氧化作用增强,从而使机体有害的自由基不能及时清除,而线粒体膜由磷脂双分子层构成,膜上的钠钾ATP酶易受自由基攻击,这使得线粒体膜结构、功能受损和离子平衡紊乱,导致其膜电位发生改变。
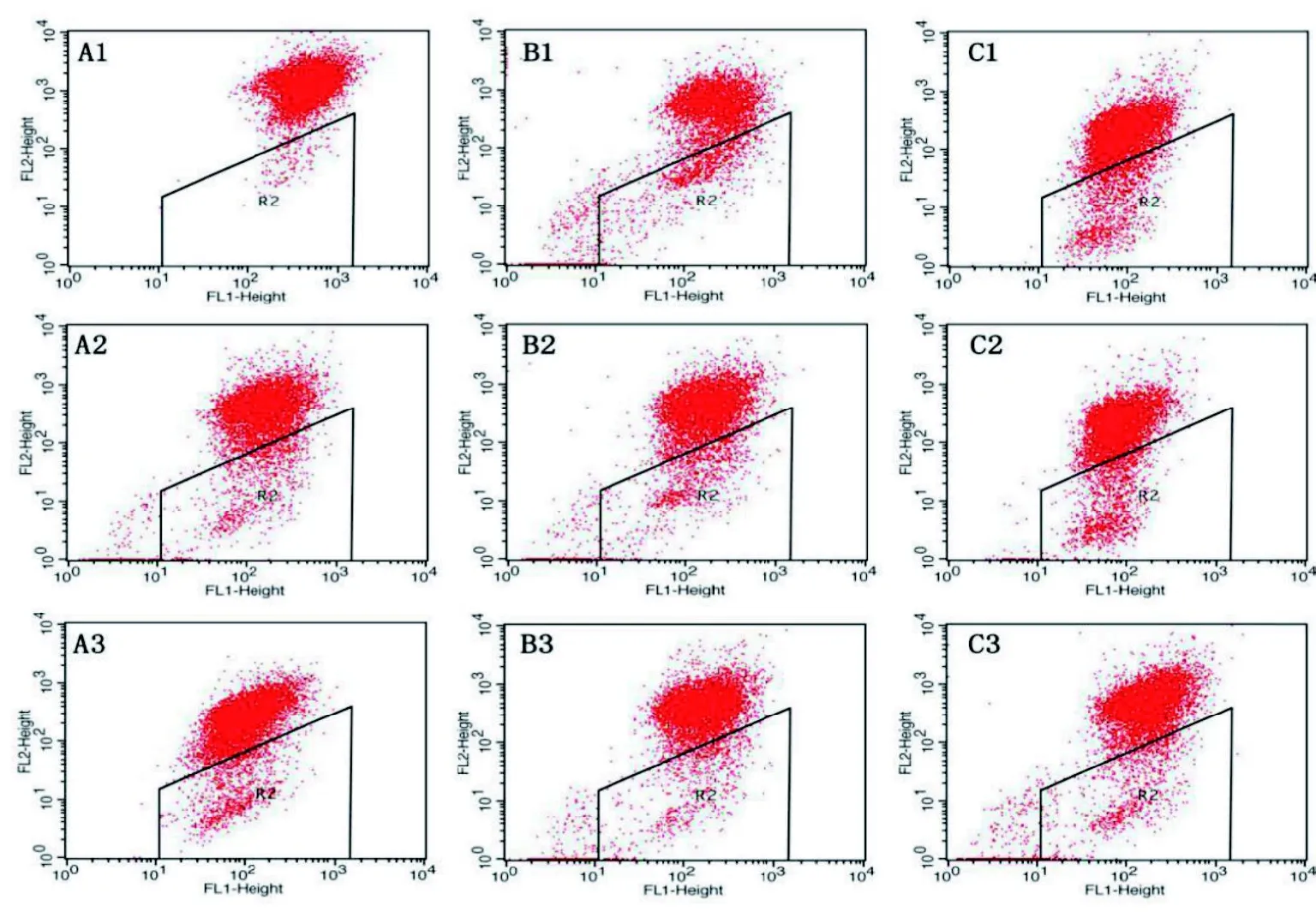
图1 硒干预对氟化钠诱导肾小管上皮细胞线粒体膜电位的流式图Figure 1 The mitochondrial membrane potential flow pattern of selenium intervention of NRK-52E cells induced by sodium fluoride
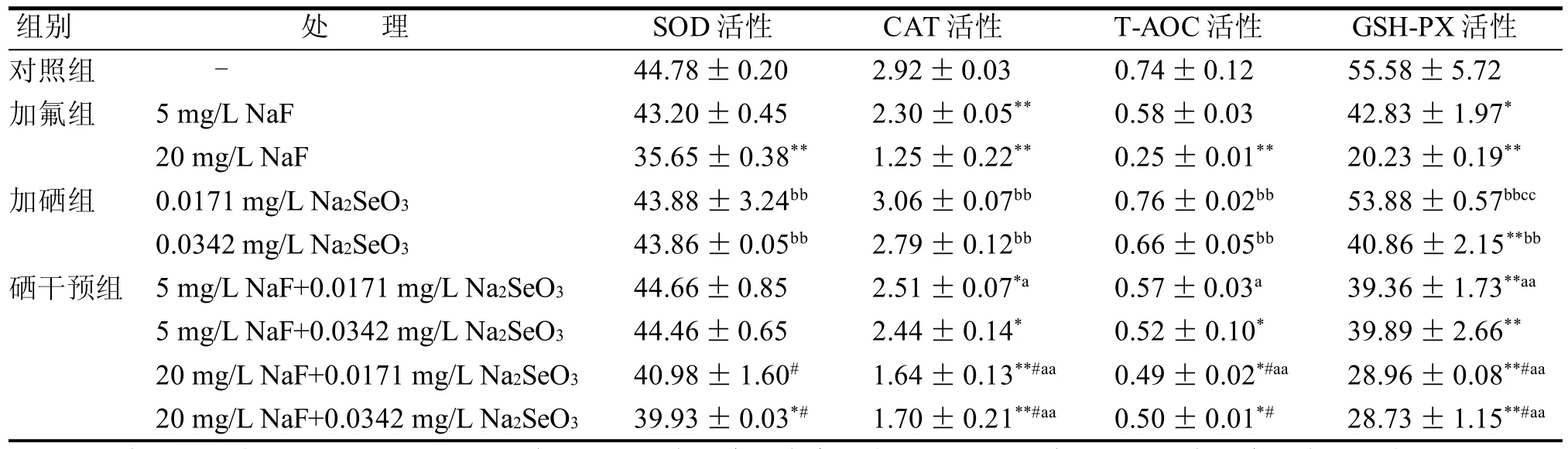
表3 硒对氟诱导大鼠肾小管上皮细胞培养液中氧化应激指标的影响(x-± s, n=6)Table 3 Effect of selenium on oxidative stress in NRK-52E cells induced by fluoride (x-± s, n=6) U/mL
5 mg/L加氟组与加硒组相比线粒体膜电位具有显著性差异(P<0.01)但SOD、GSH-PX、CAT、T-AOC酶活性均无显著性差异。20 mg/L加氟组与对照组、加硒组相比, 线粒体膜电位具有显著性差异(P<0.01)且SOD、GSH-PX、CAT、T-AOC酶活性均有显著性差异(P<0.01),表明20 mg/L的NaF已足够对NRK-52E细胞造成损伤, 但氟对NRK-52E细胞造成损伤的最小剂量还需进一步研究。
硒元素具有抗氧化性[24,25],是维持机体的正常生命活动所必需的元素。本研究显示,与染氟组相比, 硒干预组线粒体膜电位升高(P<0.01), SOD、T-AOC、GSH-PX和CAT酶活性均升高,推测硒拮抗氟致线粒体膜电位变化的机理:硒可以拮抗NRK-52E细胞内的高浓度氟,促进尿氟的排泄,清除自由基,使抗氧化酶活性恢复并明显抑制脂代谢紊乱和氟诱导的脂质过氧化,从而提高机体的抗氧化能力,对线粒体膜电位起到保护修复作用, 这一点在其它文献中也有提及[26-30]。
综上所述, 氟可以诱导NRK-52E细胞线粒体膜电位下降,抗氧化酶(SOD、T-AOC、GSH-PX和CAT酶)活性降低,一定浓度的硒对氟致NRK-52E细胞线粒体膜电位改变具有拮抗作用,可能是通过恢复抗氧化酶活性来实现的。
[1] 马士成. 铝对茶树氟吸收、累积、分布特性的影响及其机理研究[D]. 杭州: 浙江大学, 2012.
[2] 吴延莉, 徐小东, 曾贝贝, 等. 过量氟摄入对大鼠骨组织氧化应激的影响[J]. 中华地方病学杂志, 2015, 34(10):729-732.
[3] 秦双立. Fis1和Mfn1表达及氧化应激在慢性氟中毒大鼠肾小管上皮细胞线粒体损伤中的作用[D]. 贵阳: 贵阳医学院, 2013:1-46.
[4] 苗可可. 氟暴露致体外培养PC12细胞损伤机理的研究[D]. 金华: 浙江师范大学, 2014:1-53.
[5] 秦双立, 官志忠.线粒体损伤和氧化应激的关系[J]. 国外医学: 医学地理分册, 2013, 34(3):197-201.
[6] 楼迪栋, 刘燕斐, 张凯琳, 等. 慢性氟中毒对大鼠大脑皮质神经细胞活性氧水平和线粒体融合的影响[J]. 中国地方病学杂志, 2011, 30(3):256-260.
[7] Suzuki M, Bandoski C, Bartlett JD. Fluoride induced oxidative damage and SIRT1/autophagy through ROS-mediated JNK signaling[J]. Free Radic Biol Med, 2015, 89:369-378.
[8] Mahaboob BP, Saumya SM. Suppression of mitochondrial oxidative phosphorylation and TCA enzymes in discrete brain regions of mice exposed to high fluoride: amelioration by Panax ginseng (Ginseng) and Lagerstroemia speciosa (Banaba) extracts [J]. Cell Mol Neurobiol, 2013, 33(3):453-464.
[9] Qin SL, Deng J, Lou DD, et al. The decreased expression of mitofusin-1 and increased fission-1 together with alterationsin mitochondrial morphology in the kidney of rats with chronic fluorosis may involve elevated oxidative stress [J]. J Trace Elem Med Biol, 2015, 29:263-268.
[10] 杨克敌, 陈军, 王桂珍, 等. 不同浓度硒拮抗氟致肾脂质过氧化和微量元素影响的研究[J]. 卫生研究, 1998, 27(3): 201-204.
[11] 段鹏, 陈晋, 杨波, 等. 硒拮抗氟致大鼠肝细胞氧化应激和DNA损伤作用[J]. 中国公共卫生, 2013, 29(11):1626-1629.
[12] 冯佩. 硒对慢性氟中毒致血液抗氧化能力损伤影响机理的研究[D]. 金华: 浙江师范大学, 2012.
[13] 王桂芹. 硒和VitC对高氟所致氧化应激、DNA损伤及Bcl-2蛋白表达影响研究[D]. 广州: 广东药学院, 2011.
[14] Qian W, Miao K, Li T, et al. Effect of selenium on fluorideinduced changes in synaptic plasticity in rat hippocampus. [J]. Biol Trace Elem Res, 2013, 155(2):253-260.
[15] Miao K, Zhang L, Yang S, et al. Intervention of selenium on apoptosis and Fas/FasL expressions in the liver of fluorideexposed rats.[J].Environ Toxicol Pharmacol, 2013, 36(3): 913-920.
[16] 田洪艳, 李质馨, 徐冶, 等. 蒺藜提取物对小鼠损伤睾丸氧化/抗氧化系统的影响[J].中国妇幼保健, 2015 (26):4551-4554.
[17] 王裕. 氟对大鼠肾小管上皮细胞的毒性作用及硒干预机制的研究[D]. 太原: 山西医科大学, 2015.
[18] 范颖, 才丽平, 于彩娜, 等. 参附汤、芪附汤、姜附汤对阿霉素心脏毒性损伤大鼠线粒体途径细胞凋亡的影响[J].中国实验方剂学杂志, 2010, 16(8):135-138.
[19] 房晓祎. 二氮嗪对窒息新生大鼠心肌线粒体保护作用机制研究[D]. 汕头: 汕头大学, 2011:1-78.
[20] 吴伟, 徐蔚. 线粒体通透性转换孔结构和功能的研究进展[J]. 医学信息, 2011, 24(3):1753-1754.
[21] 苏米雅, 张家新. 哺乳动物细胞凋亡分子机理的研究进展[J].中国农学通报, 2011, 27(17):1-5.
[22] Wang Z, Yang X, Yang S, et al. Sodium fluoride suppress proliferation and induce apoptosis through decreased insulin-like growth factor-I expression and oxidative stress in primary cultured mouse osteohlasts [J]. Arch Toxicol, 2011, 85(11):1407-1417.
[23] 朱启伟, 王浩, 叶平, 等. 吡格列酮对缺氧/复氧后新生大鼠心肌细胞线粒体膜电位的影响[J]. 四川大学学报: 医学版, 2011, 42(6):784-788.
[24] 陈剑杰, 曹谨玲, 罗永巨, 等. 纳米硒对氟胁迫下鲤鱼肝抗氧化功能及组织结构的影响[J]. 应用生态学报, 2013, 24 (10):2970-2976.
[25] 尉俊仁, 冯佩, 章子贵. 硒对慢性氟中毒致雄性大鼠生殖毒性的拮抗作用[J].浙江师范大学学报: 自然科学版, 2011, 34(1):86-90.
[26] 张兵, 张爱君. 硒与氟中毒[J]. 中国地方病防治杂志, 2008, 23(4):263-267.
[27] 祝文静, 章子贵, 申秀英, 等. 氟中毒发病机制及硒的抗氟作用[J]. 中国地方病学杂志, 2009, 28(6):704-706.
[28] Feng P, Wei JR, Zhang ZG. Influence of selenium and fluoride on blood antioxidant capacity of rats[J]. Exp Toxicol Pathol, 2012, 64(6):565-568.
[29] 孙岩. 饮水型氟中毒致肾脏损伤的分子机制及硒的影响[D]. 金华: 浙江师范大学, 2016.
[30] 杜俊文, 吴韬, 张坤, 等. 氟中毒致血管损伤及动脉硬化的临床研究[J]. 中国地方病防治杂志, 2016(3):289.
Antagonistic Effect of Selenium on Change of Mitochondrial Membrane Potential of NRK-52E Cells Induced by Sodium Fluoride
CHANG Kai, WANG Yu, PANG Wen-biao, GAO Ji-ping, CHEN Zhao-yang, SONG Guo-hua
(Shanxi Medical University, Laboratory Animal Center, Shanxi Key Laboratory of Experimental Animal Science and Human Disease Animal Model, Taiyuan 030001, China)
ObjectiveTo study effects of fluoride on the change of mitochondrial membrane potential in rat renal tubular epithelial cells (NRK-52E cells) .MethodsThe experiments were divided into 4 groups: the control group, the fluoride group, the selenium group and the selenium intervention group. NRK-52E cells were cultured with fluoride and selenium respectively in various concentration, and fluoride and selenium combination for 48 h. (5 mg/L or 20 mg/L NaF、0.0171 mg/L or 0.0342 mg/L Na2SeO3). The mitochondrial membrane potential were detected by flow cytometry. The activity of enzymes and the content of free radicals were examined by relevant reagent kit, such as superoxide dismutase (SOD) reagent kit .ResultsCompared with the control group, the mitochondrial membrane potential decreased (P<0.05 or P<0.01) and SOD, total antioxidant capacity (T-AOC), glutathione peroxidase (GSH-PX) and catalase (CAT) enzyme activities decreased (P<0.05) with the increase of the concentration of sodium fluoride.The mitochondrial membrane potential of the selenium intervention group was increased (P<0.01) compared with that of the fluoride exposed group.Compared with the fluoride group of 20 mg/L, the relative selenium intervention group SOD, T-AOC, GSH-PX and CAT activities were increased (P<0.01). Compared with the selenium group of 0.0171 mg/L, the relative selenium intervention group the mitochondrial membrane potential decreased (P<0.01) and SOD, T-AOC, GSH-PX and CAT enzyme activities decreased (P<0.05 or P<0.01). 5 mg/L the fluoride group compared with the selenium group, the mitochondrial membrane potential changed significantly (P<0.01). But for SOD, T-AOC, GSH-PX and CAT activities ,there were no significant changed. 20 mg/L the fluoride group compared with the selenium group, the mitochondrial membrane potential changed significantly (P<0.01). SOD, T-AOC, GSH-PX and CAT activities also changed significantly (P<0.01) .ConclusionThe certain concentration of selenium could induce the decrease of mitochondrial membrane potential in NRK-52E cells induced by fluoride, that may be achieved by restoring the activities of activities.
Sodium fluoride; Selenium; Rat renal tubular epithelial cells; Mitochondrial membrane potential; Antioxidant enzymes
Q95-33
A
1674-5817(2017)03-0179-06
10.3969/j.issn.1674-5817.2017.03.002
2016-10-30
山西省实验动物专项(2012k02); 山西医科大学青年资金项目(02201429)
常 凯(1993-), 女, 硕士研究生, 主要研究方向: 人类疾病动物模型。E-mail: 932719380@qq.com
宋国华, 女, 教授。E-mail: ghsongg@hotmail.com

