ICR小鼠感染呼肠孤病毒III型的实验研究
罗银珠, 张 钰, 何丽芳, 黄碧洪, 吴瑞可, 闵凡贵, 潘金春, 袁 文, 王 静, 郭鹏举, 黄 韧
(广东省实验动物监测所, 广东省实验动物重点实验室, 广州 510663)
ICR小鼠感染呼肠孤病毒III型的实验研究
罗银珠, 张 钰, 何丽芳, 黄碧洪, 吴瑞可, 闵凡贵, 潘金春, 袁 文, 王 静, 郭鹏举, 黄 韧
(广东省实验动物监测所, 广东省实验动物重点实验室, 广州 510663)
目的 利用呼肠孤病毒Ⅲ型(Reo-3)感染ICR小鼠,分析小鼠的临床体征、靶器官病毒载量及血清抗体水平的动态变化。方法 通过动物体内适应试验增强病毒毒力,利用尾静脉注射与腹腔注射途径建立系统性感染ICR小鼠模型,观察动物临床体征,于感染0 d、4 d、7 d、18 d、25 d、35 d、72 d、129 d分别采集小鼠(2~3只小鼠)血液并剖检。47 d、81 d、103 d随机对3只小鼠进行血液采集跟踪。采用实时 qPCR方法检测靶器官病毒核酸量,ELISA方法检测血清抗体水平。结果 病毒经过4次小鼠体内适应其毒力明显增强。小鼠攻毒后6 d、7 d、9 d、10 d、11 d、16 d出现死亡,实时qPCR结果显示,肝脏病毒载量最高,其次是心、脾、肺。多数器官病毒载量峰值出现在6~11 d, 129 d后,多数靶器官检测阴性。血清抗体最早在18 d达到阳性,25 d达到峰值,并维持高抗体水平至试验结束。结论 小鼠体内适应方法可以明显增强Reo-3毒力,该病毒感染可引起小鼠多器官炎症反应,并导致小鼠死亡。本研究为该病毒模型建立及致病机理研究提供了参考数据。
呼肠孤病毒Ⅲ型(Reo-3); 感染; 临床研究; 呼吸道肠道病
呼肠孤病毒(Reovirus, Reo)是人兽共患病毒[1],能从人及多种动物如貂、河虾、蟹、禽、鸭、猪、羊、牛等分离到。该病毒由编码10个片段的双股RNA组成, 属于呼肠病毒科, 正呼肠病毒属[2]。呼肠孤病毒Ⅲ型(Reo-3)是该病毒属的代表株。该病毒可感染所有哺乳动物,包括小鼠、仓鼠、豚鼠、猫和犬等[3]。Reo-3 感染人,能引起幼年儿童腹泻、呼吸道感染及脑膜炎等疾病[4,5]。感染动物能引起动物急性的呼吸窘迫综合征和肺组织纤维化,脑炎,也可隐性感染动物并在体内产生抗体,给血液制品、单克隆抗体、细胞培养等外来致病因子的检定及动物试验带来一定的困难[1]。Reo-3在实验动物微生物学等级及监测(GB14922.2-2011)中被列为 SPF 等级实验动物必须排除的病原微生物。目前对哺乳动物呼肠孤病毒的结构、功能及分子生物学方面研究较多,而针对小鼠系统性感染模型的临床及相关报道不多,本实验经尾静脉和腹腔注射Reo-3感染ICR小鼠,并进行长达18周的血清学及组织核酸监测,为防控与研究Reo-3及呼吸道肠道病毒疾病提供数据。
1 材料与方法
1.1 病毒和细胞株
Reo-3购自美国典型菌种保藏中心(ATCC VR-824),BHK-ATCC细胞由本实验室保存。
1.2 实验动物
3周龄SPF级雄性ICR小鼠24只,体质量15~18 g,购自北京维通利华[SCXK(京)2016-0011],饲养于广东省实验动物监测所负压感染动物实验室内[SYXK(粤)2012-0122],自由饮食,动物实验开展经广东省实验动物监测所动物使用和管理委员会批准(IACUC2015003)。实验前,随机剖杀2只动物经酶联免疫吸附试验(ELISA)和QPCR检测确定为Reo-3抗原抗体阴性。
1.3 主要试剂和仪器
ELISA抗体检测试剂盒购自美国Express Bio公司, 酶标仪购自美国Thermo 公司。荧光定量PCR仪ABI 7500购自美国ABI公司, DMEM培养液购自美国Gibco公司, RNA提取试剂TRizol购自美国Invitrogen公司, DNA聚合酶购自中国大连宝生物公司, 其余试剂均为进口或国产分析纯。
1.4 QPCR引物合成
所用Reo-3引物参照参考文献[6]。引物由上海英潍捷基生物技术有限公司合成。
1.5 病毒滴度测定
将Reo-3接种BHK细胞,吸附作用1 h后加入含体积分数2%血清的维持液,放入37 ℃、体积分数5%CO2细胞培养箱中培养,倒置生物显微镜观察细胞形态,70%细胞产生细胞病变(CPE)后收获病毒液,反复冻融3次,离心取上清液作为感染病毒,并用qPCR对病毒拷贝数进行定量。

表1 Reo-3引物序列Table 1 Primer sequences of Reo-3
1.6 动物回归试验
取浓度约为3.1×106拷贝/mL的Reo-3细胞培养病毒液尾静脉和腹腔注射病毒液各0.2 mL/只,感染后3 d剖杀,取感染鼠的肝和肺进行研磨,离心后获得病毒液上清,重复感染小鼠,反复4次。最后一次获得的组织研磨上清液, 放-80 ℃, 备用。
1.7 感染动物试验
取经过体内适应增毒后的Reo-3病毒液,浓度为1.5×107拷贝/mL,尾静脉和腹腔注射病毒液各0.2 mL/只。动物接种病毒后,观察129 d。每日记录动物的被毛、行为活动、饮食和精神状态。并在小鼠感染后4 d、7 d、18 d、25 d、35 d、72 d和129 d对2~3只小鼠进行眼眶采血后脱颈椎处死并采集心、肝、脾、肺、肾、脑、胃、盲肠内容物置-20℃保存备用。在感染实验进行过程中的47 d、81 d、103 d, 随机抽取3只小鼠进行眼眶采血分离血清置-20 ℃保存待测血清抗体。
1.8 QPCR检测各组织病毒核酸含量
称量适量组织, 加入600 mL的PBS缓冲液于组织研磨机上研磨3~5 min,将组织匀浆。研磨后,10 000 r/min离心10 min, 取200 mL上清抽提核酸,具体步骤参照核酸提取试剂盒(TIANamp Genomic DNA Kit)说明书。最后应用ABI 7500 Real-Time PCR System,Taqman RT-PCR两步法试剂盒(Takara)即95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s, 进行40个循坏,荧光信号采集设于60 ℃,溶解曲线设置为: 95 ℃ 5 s,65 ℃ 1 min, 50 ℃ 30 s,进行荧光定量PCR检测鉴定。
1.9 小鼠血清抗体检测
根据试剂盒说明进行操作与读数判定: 样本稀释及加样, 将血清样本从1∶50稀释, 再向ELISA 微孔板各加100 mL稀释好的样本; 37 ℃孵育后洗板, 每孔加100 mL酶标二抗, 37 ℃孵育后洗板, 加显色液;反应完毕, 立即用酶标仪读数, 测试波长为405 nm。
1.10 统计分析
实验结束, 所有数据采用GraphPad Prism 5.01进行数据处理及分析。
2 结果
2.1 病毒动物回归试验
为提高病毒在小鼠体内适应能力,本实验进行了4次小鼠体内适应试验,结果显示,病毒初次接毒后体征不明显、不死亡、而适应毒接毒后小鼠体征加重。初次感染小鼠,病毒在体内增殖慢并且含量减低 (图1A),多次体内适应后,体内主要脏器肝、脾、肺病毒载量升高(图1B),表明病毒适应后感染能力及毒力增强。
2.2 临床观察
采用经过小鼠回归试验后含有Reo-3的组织研磨上清感染ICR小鼠,潜伏期(0~5 d)小鼠出现立毛、扎堆,个别小鼠精神差,运动减少; 发病期(6~18 d),感染鼠立毛明显,并出现腹式呼吸,感染后6 d,7 d,9 d,10 d,11 d,16 d,小鼠出现死亡,剖检见肺有出血,肝有白色坏死点,胃胀气,脾缩小; 恢复期(19~129~d),小鼠状态逐渐良好,精神好转。

图1 Reo-3病毒小鼠体内适应结果Figure 1 Reo-3 virus adaption to mice
2.3 血清抗体滴度变化
感染小鼠体内抗体滴度随着感染时间迁移而升高,接种后18 d抗体阳性,之后抗体效价逐渐升高,在25 d抗体稀释度达到128倍并维持至129 d (抗体稀释度达512倍)(表2)。
2.4 组织病毒含量变化
2.4.1 靶器官核酸含量变化 感染早期小鼠以肝病毒载量最高(图2A), 其次是心、脾、肺(图2B,C,D)。肝以6 d (3.3×106拷贝/mL)含量最高(图2A),心在11 d(4.5×105拷贝/mL)(图2B),肺在18 d(2.9×104拷贝/mL)(图2C),脑在4 d(4.3×105拷贝/mL) (图2D), 脾在6 d(8.7×103拷贝/mL)(图2E),肾在18 d(1.9×104拷贝/mL)(图2F), 并随着时间推移小鼠各组织内病毒核酸含量总体呈现下降趋势,到129 d除心和脾外检测到少量核酸外,其他组织均检测不到病毒核酸。
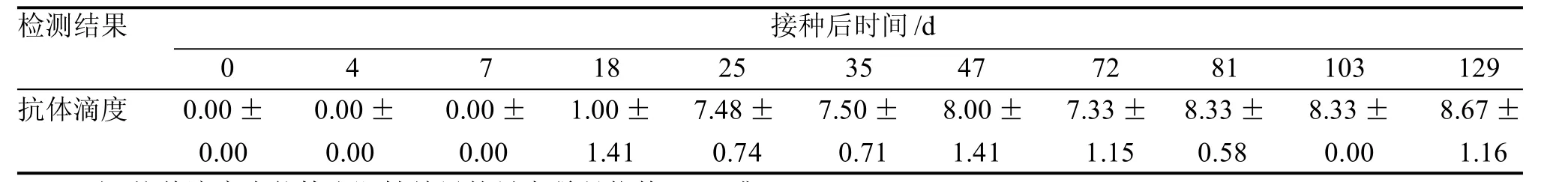
表2 感染小鼠抗Reo-3血清抗体的测定Table 2 Determination of serum antibody against Reo-3 of infected mice
2.4.2 胃肠消化道核酸含量变化 感染后的小鼠取胃及盲肠内容物进行核酸检测,结果显示病毒可以在胃中缓慢增殖,但到感染4个月后检测不到(图3A)。盲肠内容核酸检测除1只能检测到外,其余的均不能检测出来(图3B),该结果暗示该病毒在本实验中基本不经粪便排毒和传播。
2.4.3 死亡鼠主要脏器及组织核酸 感染实验后6 d, 7 d, 9 d, 10 d, 11 d, 16 d分别死亡1只(图5)。脏器核酸结果显示早期死亡小鼠(6 d, 7 d)肝和脑病毒载量高于其他组织,暗示两个器官为病毒早期增殖和损伤的主要器官。肝的核酸含量在不同时间死亡小鼠中均呈现高载毒量,显示病毒在小鼠肝脏大量复制,是致死的重要因素。肝、脾、肺、肾、胃病毒载量以7 d死亡鼠核酸含量最高,并呈现随着时间推移逐步减低。
3 讨论

图2 感染小鼠各内脏组织核酸测定(n=1~3)Figure 2 Content of Reo-3 nucleic acids in organs of infected mice (n=1~3)
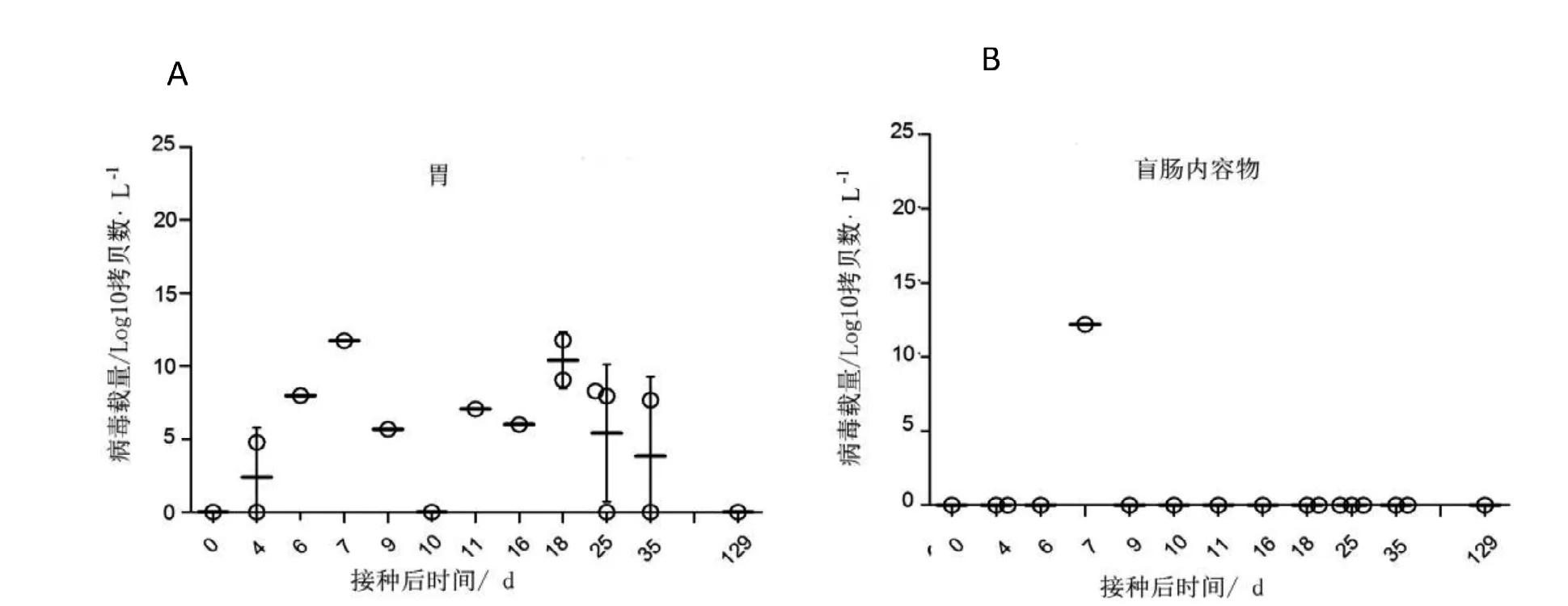
图3 感染小鼠胃肠道核酸含量变化 (n=1~3)Figure 3 Content of Reo-3 nucleic acids in gastrointestinal tract of infected mice (n=1~3)
呼肠孤病毒具有宿主谱广泛的特点, 除人外, 从自然感染的小鼠、禽、犬、猫、牛、猪、猕猴、黑猩猩、昆虫、鱼,蝙蝠等体内都分离到呼肠孤病毒[7-11]。根据国际病毒分类委员会第七次报告, 正呼肠孤病毒属分3个亚群。非融合基因哺乳动物正呼肠孤病毒(MRV)属于第一个亚群。该亚群目前有4个血清型(Reo-1, Reo-2, Reo-3, R4)[2,12]。Reo-3 病毒在鼠群中常呈隐性感染,威胁实验动物的健康, 进而影响动物实验的可靠性和准确性[13-14]。据报道[14],1980年代上海地区普通级鼠群感染率达35%,血清阳性率5.8%,屏障小鼠血清阳性率1.9%, 感染呈间发性流行, 时隐时现。近年报告[15]显示该病毒在SPF级实验鼠中流行率低。本实验室2015年对野鼠Reo-3抗体阳性率抽检阳性率30% (24/80)。2007年英国研究者[16]曾对野外捕获小鼠进行病原血清调查表明 Reo-3阳性率10%。目前,该病毒在实验动物病原微生物质量检测中被列为必须检测项目,要求阴性。

图4 死亡小鼠核酸含量变化 (n=1)Figure 4 Content of Reo-3 nucleic acids in dead mice (n=1)
本实验通过人工攻毒方式模拟感染小鼠后,出现了急性死亡及慢性带毒感染。死亡病例集中于感染后2周内,之后至18周小鼠均呈现隐性感染。肺是呼肠孤死亡小鼠的主要靶器官,小鼠死前均表现出腹式呼吸,呼吸困难,精神差等的呼吸综合症候,此与人感染Reo体征[17]有相近之处且实验操作简单, 是研究人感染Reo或药效评价的良好模型。
本实验从体内组织肝, 肺,心,脑,脾,肾等多脏器分离到病毒,且病毒携带时间大于4周,心与脑携带病毒时间长达18周仍然能检测到病毒核酸。这结果与研究报道[13]病毒污染鼠群的可引起多种系统性疾病,包括坏死性肝炎、心肌炎、胰腺炎以及脑膜炎结果一致。本实验证实了该病毒可穿透血脑屏障,在脑内定殖从而损伤脑组织,需引起重视。心在本实验中直到实验结束129 d仍能检测到,暗示着该病毒有可长时间存在于血液循环而引起病毒血症,该结果也显示在一些血制品卫生安全方面需引起重视。
小鼠经人工病毒感染后呈现全身性多组织多器官感染,感染早期病毒在各脏器定殖扩增并能引起动物死亡,随着时间推移小鼠各组织内病毒核酸含量总体呈现下降趋势,部分脏器内病毒逐渐被机体清除,此结果显示动物自身免疫系统在抗病毒中发挥重要作用, 在某些脏器内限制了病毒的复制及损伤, 表现在临床上动物死亡率减少, 动物状态恢复。
研究报道[18]Reo-3在动物群体中通过空气和粪-口途径传播,并且有人认为 Reo-3在环境中能稳定生存是造成病毒污染的主要原因,主要通过水平传播和垂直传播两种方式进行传播,其中以呼吸道和消化道传播为主要传播方式。本实验针对呼吸道(肺)及胃肠进行临床跟踪及核酸检测,结果发现感染早期肺病变明显,出血,充血,动物出现呼吸困难综合征,食欲下降,胃的核酸检测结果显示病毒呈低滴度复制。而盲肠内容检测结果除一只死亡鼠检测阳性外其余均为阴性。作者推测该毒株在经过多次动物全身性适应试验后可能改变了排毒途径,消化道传播方式减弱或消失,以呼吸道水平传播为主。
综上所述,小鼠感染Reo-3可作为研究Reo-3的良好模型。呼吸道传播方式对该病的防控提供有效指导方向。通过抗体来监测该病毒有效期可为18周或更长。以上对研究呼肠孤病毒及相关呼吸道肠道病提供了良好实验数据。
[1] 郎书惠, 贺争鸣, 吴惠英. 呼肠孤病毒感染不同免疫功能状态小鼠的病理组织学研究[J]. 实验动物科学与管理, 1998,15(3):54.
[2] 田克恭. 实验动物病毒性疾病[M]. 北京:中国农业出版社, 1992:41-45.
[3] 殷震, 刘景华. 动物病毒学[M]. 第2版. 北京: 科学出版社. 1997:329-330.
[4] Tyler KL, Barton ES, Ibach ML, et al. Isolation and molecular characterization of a novel type 3 reovirus from a child with meningitis[J]. J Infect Dis, 2004, 189:1664-1675.
[5] Ouattara LA, Barin F, Barthez MA,et al. Novel human reovirus isolated from children with acute necrotizing encephalopathy [J]. Emerg Infect Dis, 2011, 17:1436-1444.
[6] Bootz F, Sieber I, Popovic D, et al. Comparison of the sensitivity of in vivo antibody production tests with in vitro PCR-based methods to detect infectious contamination of biological materials[J]. Lab Anim, 2003, 37(4):341-351.
[7] Zhang Y W, Liu Y, Lian H, et al. A natural reassortant and mutant serotype 3 reovirus from mink in China[J]. Arch Virol, 2016, 161(2):495-498.
[8] Zhang S, Shu X, Zhou L, et al. Isolation and identification of a new reovirus associated with mortalities in farmed oriental river prawn, Macrobrachium nipponense (de Haan, 1849), in China[J]. J Fish Dis, 2016, 39(3):371-375.
[9] Mor SK, Verma H, Sharafeldin TA, et al. Survival of turkey arthritis reovirus in poultry litter and drinking water[J].Poultry Sci, 2015, 94(4):639-642.
[10] Kumar S, Dick EJ, Bommineni Y R, et al. Reovirus-associated meningoencephalomyelitis in baboons[J]. Vet Pathol, 2014, 51(3):641-650.
[11] Bai B, Shen H, Hu Y, et al. Serological survey of a new type of reovirus in humans in China[J]. Epidemiol Infect, 2014, 142 (10):2155-2158.
[12] Stanley N F, Dorman D C, Ponsford J. Studies on the pathogenesis of a hitherto undescribed virus (hepatoencephalomyelitis) producing unusual symptoms in suckling mice[J]. Aust J Exp Biol Med Sci, 1953, 31(2):147-159.
[13] Jacoby RO, Lindsey JR. Risks of infection among laboratory rats and mice at major biomedical research institutions[J]. ILAR J, 1998, 39(4):266-271.
[14] 徐蓓, 李建平, 屈霞琴, 等. 上海地区实验小鼠病毒性传染病的血清学调查[J]. 上海实验动物科学, 1989, 9(1):34-36.
[15] 王翠娥, 陈立超, 周倩, 等. 实验大鼠和小鼠多种病毒的血清学检测结果分析[J]. 实验动物科学, 2014, 31(2):20-24.
[16] Marty G D, Morrison D B, Bidulka J, et al. Piscine reovirus in wild and farmed salmonids in British Columbia, Canada: 1974-2013[J]. J Fish Dis, 2015, 38(8):713-728.
[17] Cheng P, et al. A novel reovirus isolated from a patient with acute respiratory disease[J]. J Clin Virol, 2009, 45:79-80.
[18] Waggie K,Kagiyama N,Allen AM. Manual of microbiologicmonitoring of laboratory animals [M]. Bethesda:MD: NIHPublication, 1994:99-100.
Research on Reovirus III (Reo-3) Infection in ICR Mice
LUO Yin-zhu, ZHANG Yu, HE Li-fang, HUANG Bi-hong, WU Rui-ke, Min Fan-gui, PAN Jin-chun, YUAN Wen, WANG Jing, Guo Peng-ju, HUANG Ren
(Guangdong Laboratory Animals Monitoring Institute, Guangdong Provincial Key Laboratory of Laboratory Animals, Guangzhou 510663, China)
ObjectiveTo establish reovirus type 3 ( Reo-3) infection model of ICR mice and observe clinical syndrome, investigate virus load in target organs and serology dynamic change in infected mice. Method Animal adaption method was used to increase the virus’s virulence. Systemic infection model was established with tail vein and intraperitoneally inoculation to ICR. The clinical sign was observed. The tissues and serums were harvested on 0 d before and 4 d、7 d、18 d、25 d、35 d、72 d、129 d after inoculation. Blood samples of three mice were randomly collected on 47 d、81 d、103 d. qPCR and ELISA were respectively used to detect the virus nucleic acid at target tissue and the antibody level .ResultsVirus virulence was increased after four times adaption trial. Mice death was observed at d7, d9, d10, d11, d16 post inoculation. The highest load of the virus was found in liver through qPCR, followed by heart, spleen, and lung. The peaks of viral load emerged from 6 to 11 d in all organs, negative results appeared at 129 d in the most organs. The earliest antibody detect time was on 18 d. The titer of antibody hit the peak on 25 d, then maintained a high level till to 129 d .Conclusionvirus virulence can be enhanced significantly through mouse in-vivo inoculation, multiple organs inflammation and early death in mice can be identified by the systemic infection way of Reo-3. This experiment provides an approach to establish Reo-3 infected mice animal model and provides good experimental data for further research on Reo-3 infection mechanism .
Reovirus type 3(Reo-3); Infection; Clinical research; Respiratory intestinal disease
Q95-33
A
1674-5817(2017)03-0198-06
10.3969/j.issn.1674-5817.2017.03.005
2016-12-30
广东省科技计划项目(2014B070706006)、(2013B060400028)
罗银珠(1983-), 女, 硕士, 兽医师, 研究方向: 病原学及实验动物模型研究。E-mail: agluo122@sina.com
黄 韧(1959-), 男, 博士, 研究员。E-mail: labking@sohu.com

