结核分枝杆菌蛋白酶体结构与功能研究进展
金 鑫,李传友,张林波
(1. 吉林农业大学,吉林长春 130118;2.北京市结核病胸部肿瘤研究所,北京 101149)
结核分枝杆菌蛋白酶体结构与功能研究进展
金 鑫1,李传友2,张林波1
(1. 吉林农业大学,吉林长春 130118;2.北京市结核病胸部肿瘤研究所,北京 101149)
结核病是由结核分枝杆菌(MTB)引起的一种慢性传染病,其发病机制比较复杂。本文介绍了MTB蛋白酶体结构及其激活因子的研究进展,阐述了MTB蛋白酶体生理功能,揭示了蛋白酶体在结核分枝杆菌的致病性、持留性、转录调控中发挥的重要作用。对结核分枝杆菌蛋白酶体结构和生理功能的深入研究,有助于进一步探索结核分枝杆菌持留致病新机制,也可为疫苗和抗结核新药的研发提供理论依据。
结核分枝杆菌;蛋白酶体;致病性;持留性
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)引起的一种人兽共患慢性传染性疾病。据世界卫生组织(WHO)2016年调查结果显示,2015年全球罹患结核病者有1 040万例,其中180万例患者死亡,48万人为耐多药结核病[1]。此病也会侵害多种动物而造成严重的经济损失,特别是近年来结核潜伏感染和耐多药结核病的不断涌现,使得结核病的防治愈发困难。而结核潜伏感染、耐药性等问题产生的根本原因是结核分枝杆菌的持留性。2003年,Darwin等[2]首先发现结核分枝杆菌蛋白酶体(Proteasome)能够帮助MTB抵抗宿主的杀伤作用,进而在宿主内持留、致病。MTB蛋白酶体是一类巨型蛋白质复合物,在相关激活因子的协助下能够调控错误折叠蛋白、调节蛋白、毒性蛋白等多种蛋白质的降解过程,进而影响MTB的致病性、病原性、细胞壁形成等[3]。最新研究发现MTB蛋白酶体与MTB的致病性存在紧密联系,并与结核病的潜伏感染相关。MTB蛋白酶体的结构和生理功能的研究已成为MTB致病机制研究的新热点。
1 MTB蛋白酶体结构及激活因子的研究进展
1.1 MTB蛋白酶体结构
Hu等[4]发现,MTB蛋白酶体由20S核心颗粒组成。20S核心颗粒是由2个外部的α环和2个内部的β环(α7β7β7α7)堆叠成的1个四环桶状结构,其中α环和β环分别由7个相同的α亚基和β亚基组成。MTB蛋白酶体组装是个有序的过程,首先是1个α环和1个β环组成半蛋白酶体(halfproteasome),之后2个半蛋白酶体聚合,2个β环同位并引起β亚基前肽裂解,蛋白酶体组装完成。Li等[5]通过冷冻电镜和X射线结晶学的手段发现β亚基前肽存在于半蛋白酶体的外侧,它的存在阻碍了2个半蛋白酶体同位,进一步证实了β亚基前肽不利于蛋白酶体的组装。2014年,Anandan等[6]研究发现蛋白酶体亚基可被PknA、PknB(调节分枝杆菌生理活性的关键信号分子)激酶磷酸化,其中PknA可影响MTB蛋白酶体的组装过程,并使对蛋白酶体未移除前肽的β亚基和α亚基磷酸化,阻碍聚合进而影响蛋白酶体核心颗粒的组装,与此同时可增强MTB对过氧化氢的抗性,影响MTB在氧化应激条件下的生存;PknB激酶能够调节蛋白酶体降解蛋白的活性,α亚基被PknB磷酸化后,其对Ino1蛋白(已知的蛋白酶体底物)的降解活性将会提升。
1.2 MTB蛋白酶体的2种激活因子
MTB蛋白酶体通常处于闭合状态,以避免其对细胞内蛋白质的任意水解。蛋白酶体对蛋白的降解过程首先需要激活因子打开蛋白酶体,之后在激活因子的协助下,待降解蛋白进入到蛋白酶体内部被降解。此过程包含2种途径:一种是Pearce等[7]发现的类泛素化途径,该途径包括Mpa激活因子识别被原核类泛素蛋白(Pup)标记的靶蛋白,并介导标记蛋白进入蛋白酶体,此途径需要ATP的参与;另一种是Jastrab等[8]发现的PafE激活因子,其可识别在应激条件下发生解折叠或损坏的蛋白质,并介导这类蛋白质进入蛋白酶体(图1)。
1.2.1 Mpa。Mpa由Rv2115c编码,是具有ATP水解功能的蛋白质。Wang等[10]发现Mpa对蛋白酶体的激活是通过将其C端嵌入到α亚基凹槽中,α亚基N端构象改变,蛋白酶体被打开,而待降解蛋白首先需要经过Pup标记,才能被Mpa识别。Striebel 等[11]发现,Mpa N端的卷曲螺旋区域识别Pup C端并与之结合,而无序状态的PupN端伸入到Mpa的活性中心中,与内部的迁移环接触,在ATP的驱使下迁移环上下移动,牵引Pup标记的靶蛋白定向进入活性中心,并导致靶蛋白解折叠,靶蛋白进入到蛋白酶体核心颗粒内部被降解成小分子肽[12-13](图1)。此外,Delley等[14]发现Mpa本身也可被Pup标记,被标记的Mpa不能与蛋白酶体结合,因此不能降解蛋白。但是去酰胺酶Dop可以对标记的Mpa去Pup化,而恢复其功能。
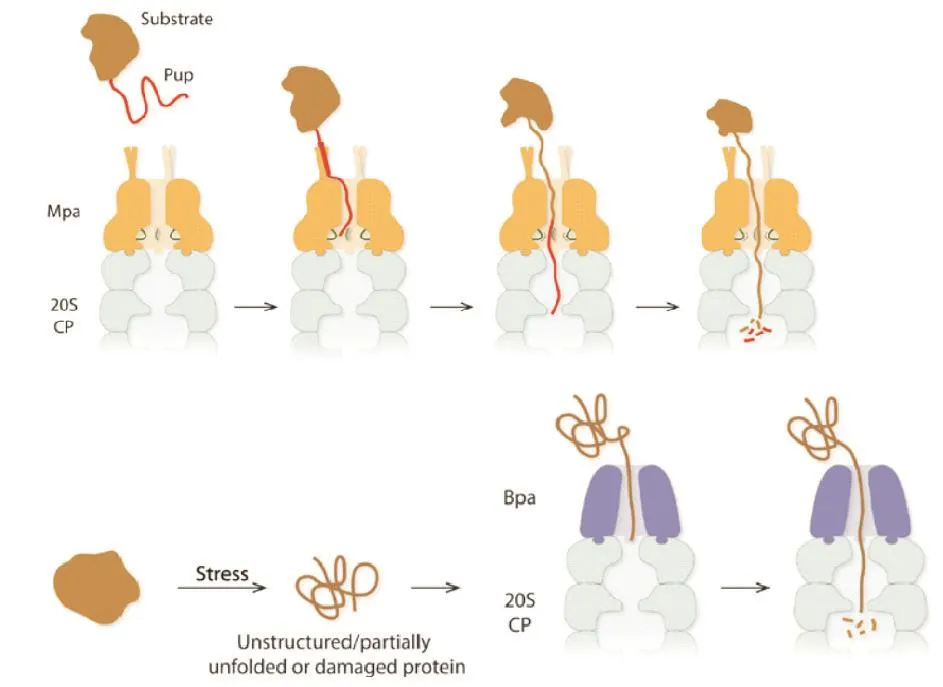
图1 结核分枝杆菌蛋白酶体降解蛋白的2种途径[9]
1.2.2 PafE。Jastrab等[8]在与蛋白酶体相互作用的蛋白中发现了另1个蛋白酶体激活因子,命名为PafE,又称Bpa[15]。在结构上,PafE是12重对称,而蛋白酶体核心颗粒中α亚基是7聚体,当PafE与α亚基结合时,PafE有5个C端处于未被结合的状态,这有可能增强了PafE与α亚基的亲和能力,亦或是未被结合的C端能够与有助于结合或降解功能的其他物质结合。Lin等[16]研究发现PafE与蛋白酶体的结合不紧密,会改变蛋白的降解过程。PafE的C端有一段突出的部分,使其与蛋白酶体的结合受阻,更易与蛋白酶体分离,待降解蛋白被释放。体外实验发现PafE有可能抑制Mpa-蛋白酶体对Pup标记蛋白的降解[8]。
2 MTB蛋白酶体生理功能的研究进展
2.1 与MTB持留性有关
MTB持留性和耐药性是现今关系到结核病临床治疗以及流行病学控制的两大课题,MTB持留性又是耐药性等问题产生的基本原因。当MTB进入宿主细胞内,宿主对MTB的杀伤作用主要包括巨噬细胞诱导NO合酶产生大量NO和其他活性氮中间产物(RNI),RNI通过破坏MTB的核酸、蛋白质、脂质体等物质来损伤MTB[17-18]。大部分MTB被杀死,少数MTB逃逸巨噬细胞免疫杀伤,而在宿主细胞内持留,且对抗结核药物不敏感[19]。研究发现MTB抵抗RNI杀伤的能力与蛋白酶体有关[20]。研究发现敲除MTB中编码核心颗粒的prcA和prcB后,MTB对RNI变得敏感,感染小鼠模型的致病性减弱。当对MTB ∆prcBA回补时发现,回补无降解活性的20S核心颗粒后,蛋白酶体对RNI的抵抗能力基本恢复到了野生型的水平,但在小鼠体内的持留能力没有恢复到野生型水平[21]。
Samanovic等[22]进一步研究发现,在MTB中敲除了蛋白酶体激活因子Mpa后,Rv1205编码的蛋白发生了积累,并导致结核分枝杆菌对RNI的抵抗能力减弱。在敲除核心颗粒prcBA的MTB中也发现Rv1205编码的蛋白发生了积累,比较发现该蛋白与植物酶LOG在结构上同源,因此命名为结核分枝杆菌Log。LOG具有磷酸核糖水解酶功能,在催化细胞分裂素合成的最后阶段,细胞分裂素前体在LOG催化下磷酸核糖基团被去除,成为有生物活性的细胞分裂素,在MTB中也发现细胞分裂素合成依赖Log。结核分枝杆菌Log是蛋白酶体的底物,在Mpa突变的MTB中Log无法被降解,其大量累积引起细胞分裂素大量积累,积累的细胞分裂素分解成对羟基苯甲醛(pHBA)等醛类物质,而pHBA等醛类物质,在NO存在的情况下杀死MTB。这有可能是醛类物质与MTB细胞膜上的蛋白或其他分子发生了反应,使得MTB对NO和其他RNI敏感。Jastrab等[8]研究发现,无降解活性的20S核心颗粒具有很强的捕获蛋白酶体底物的能力,如无活性的核心颗粒可以捕获Log使其失活,从有效避免醛类物质的累积。这也解释了为什么敲除prcBA的MTB回补无活性的核心颗粒后,蛋白酶体对RNI的抵抗能力能够基本恢复到野生型水平。蛋白酶体水解活性位点Thr突变后,MTB在宿主体内的持留能力减弱,这也就说明了蛋白酶体的水解活性对于MTB在宿主体内的持留至关重要[21]。
2.2 与MTB致病性有关
MTB可以在多种压力环境中存活并对人体致病。MTB这种能够适应多种应激条件的能力可能与蛋白酶体有关[23]。研究发现敲除20S核心颗粒的MTB在液体培养基中的生长仅发生微弱变化,而在更严格的环境,如固体培养下或是感染小鼠模型时,其生长会发生明显的变化,在pafE缺陷的MTB中也出现了类似现象。蛋白酶体对底物的降解在正常条件下可能是非必需的,相反,蛋白酶体有可能对应激条件下MTB的生长更为有利[24]。应激条件下蛋白质会发生错误折叠,PafE-蛋白酶体能够降解模式解折叠蛋白β-casein,错误折叠的蛋白也有可能被PafE-蛋白酶体降解。最新研究发现pafE突变的MTB对热激的敏感性增加,这与PafE-蛋白酶体底物热休克阻遏蛋白(HspR)的累积有关。pafE突变株中HspR无法被降解,HspR大量累积抑制了DnaK操纵子的表达,DnaK操纵子包含hspR和clpB,二者编码的基因对于MTB应对热激是必要的。当外界温度升高,突变pafE的MTB中错误折叠的蛋白数量增加,同时HspR不能被快速降解,HspR的累积又抑制了热激应答基因的表达,MTB无法应对错误折叠蛋白产生的毒性,最终导致细胞死亡[8]。
当MTB进入宿主,会面临硝酸化、氧化应激、营养物的限制等来自宿主体内的各种应激条件,这些应激条件对MTB的生存是不利的。但是蛋白酶体有可能通过循环利用氨基酸,维持细胞的基本代谢水平以及降解在应激条件下发生错误折叠的蛋白,使MTB具备应对宿主产生的不利环境的能力[25]。反之,敲除蛋白酶体后的MTB不能通过降解蛋白质来合理调控蛋白,无法应对宿主内产生的应激条件,错误折叠蛋白不能被降解而对细胞产生毒性,使得MTB的毒性减弱,对宿主的致病性也随之减弱。因此,MTB蛋白酶体的降解功能对MTB发挥毒性是必要的,对宿主的致病性方面起到关键作用。
2.3 与MTB转录调控有关
MTB蛋白酶体与转录调控有关,参与相关基因的表达调控。Festa等[26]对突变Mpa基因的MTB进行转录水平分析时,发现了铜响应调节子(RicR)的表达受到抑制。RicR能够增强MTB对铜(Cu)毒性的抵抗能力,从而有利于MTB在宿主体内的生存。MTB感染宿主后,宿主利用Cu来抑制MTB的生长,而RicR通过调控有关基因(lpqS、Rv2963、mymT、socAB、ricR)的表达来应对Cu的变化。当Cu含量低时,RicR抑制这5个基因的表达;当Cu含量高时,RicR诱导这5个基因的表达。在MTB中Mpa基因突变后,这5个基因的转录水平下降,这可能是由于RicR本身是蛋白酶体底物,在突变株中RicR不能被降解而累积,导致RicR调节子被抑制。另一种可能是一种或多种Cu结合蛋白发生了积累,这些Cu结合蛋白通常是蛋白酶体的底物,这将导致细胞内可被利用的Cu被结合,类似Cu含量低的情况最终导致RicR调节子被抑制。Shi等[27]研究发现,敲除RicR调控的5个基因中的任意1个,并不影响MTB对小鼠的致病性,只有抑制整个RicR调节子才会减弱对小鼠的致病性。
在MTB中突变Mpa后,锌(Zn)摄入调节子(Zur)调控的基因被上调。当Zn含量低时,Zur被释放出来,诱导相关基因表达,有利于MTB在Zn缺乏的环境中生存。Mpa突变的MTB中,Zur调控的基因异常上调,突变株丧失了对Zur合理的调控能力,而无法应对感染宿主后细胞内Zn含量的变化,因此在宿主体内的致病性减弱[26]。
3 结语
蛋白酶体的存在对感染宿主期间MTB的生存是有利的,MTB蛋白酶体可以抵抗宿主巨噬细胞产生的RNI而持留。蛋白酶体与MTB在宿主内的致病性有密切关系,缺少蛋白酶体的MTB无法应对感染宿主后宿主内产生的多种应激条件,且不能合理调节相关基因的表达从而导致致病性减弱。然而蛋白酶体的功能、持留和致病性之间的关系至今未能完全阐释。例如,是否仅因为醛类物质的累积导致敲除蛋白酶体的MTB对RNI敏感?MTB蛋白酶体与宿主内的哪些应激条件存在紧密关系?蛋白酶体又如何应对这些不同的应激条件对MTB的损伤?目前研究发现MTB蛋白酶体与金属的动态平衡有关系,但MTB蛋白酶体究竟如何影响转录水平等具体机制仍有待进一步研究。对于MTB蛋白酶体生理功能的研究表明,蛋白酶体对于MTB的致病性尤为重要,同时可作为抗结核新药研发的潜在靶点,但需要考虑的是蛋白酶体抑制剂是否会对人体自身的蛋白酶体产生影响[28-30]。对于MTB蛋白酶体结构和机制的深入研究,将为疫苗和抗结核新药的研发提供更充分的理论基础,为治疗结核病以及攻克潜伏感染和多重耐药这两大难题带来希望。
[1] WHO. Global tuberculosis report of 2016[M]. Geneva:World Health Organization,2016.
[2] DARWIN K H,EHRT S,GUTIERREZ-RAMOS J C,et al. The proteasome of Mycobacterium tuberculosis is required for resistance to nitric oxide [J]. Science,2003,302(12):. 1963-1966.
[3] JASTRAB J B,DARWIN K H. Bacterial Proteasomes[J]. Annual Review of Microbiology,2015,69:109-127.
[4] HU G,LIN G,WANG M,et a1. Structure of the Mycobacterium tuberculosis proteasome and mechanism of inhibition by a peptidyl boronate[J]. Mol Microbiol,2006,59:1417-1428.
[5] LI D,LI H,WANG T,et a1.Structural basis for the assembly and gate closure mechanisms of the Mycobacterium tuberculosis 20S proteasome[J]. EMBO J,2010,29:2037-2047.
[6] TRIPTI A,JAEIL H,HEATHER B,et al. Phosphorylation Regulates Mycobacterial Proteasome[J]. Journal of Microbiology,2014,52(9):743-754.
[7] PEARCE M J,MINTSERIS J,FERREYRA J,et al. Ubiquitin-like protein involved in the proteasome pathway of Mycobacterium tuberculosis[J]. Science,2008,322(5904):1104-1107.
[8] JASTRAB J B,WANG T,MURPHY J P,et al. An adenosine triphosphate-independent proteasome activator contributes to the virulence of Mycobacterium tuberculosis[J]. Proc Natl Acad Sci USA,2015,112(14):1763-1772.
[9] IMKAMP F,ZIEMSKI M,WEBER-BAN E. Pupylationdependent and -independent proteasomal degradation in mycobacteria[J]. BioMol Concepts,2015,6(4):285-301.
[10] WANG T,DARWIN K H,LI H. Binding-induced folding of prokaryotic ubiquitin-like protein on the Mycobacterium proteasomal ATPase targets substrates for degradation[J]. Nat Struct Mol Biol,2010,17:1352-1357.
[11] STRIEBEL F,IMKAMP F,OZCELIK D,et al. Pupylation as a signal for proteasomal degradation in bacteria[J]. Biochim Biophys Acta,2014(1):103-113.
[12] MAUPIN-FURLOW J A. Prokaryotic Ubiquitin-Like Protein Modification[J]. Annual Review of Microbiology,2014,68:155-175.
[13] STRIEBEL F,HUNKELER M,SUMMER H,et al. The mycobacterial Mpa-proteasome unfolds and degrades pupylated substrates by engaging Pup´s N-terminus[J]. EMBO J,2010,29:1262-1271.
[14] DELLEY C L,STRIEBEL F,HEYDENREICH F M,et al. Activity of the mycobacterial proteasomal ATPase Mpa is reversibly regulated by pupylation[J]. J Bio Chem,2012,287(11):7907-7914.
[15] DELLEY C L,LAEDERACH J,ZIEMSKI M,et al. Bacterial proteasome activator bpa (rv3780) is a novel ringshaped interactor of the mycobacterial proteasome[J]. PloS One,2014,9(12):10-18.
[16] LIN B,HU K,WANG T,et al. Structural analysis of the dodecameric proteasome activator PafE in Mycobacterium tuberculosis[J]. PNAS,2016,113(17):1983-1992.
[17] GENGENBACHER M,KAUFMANN S H. Mycobacterium tuberculosis:success through dormancy[J]. FEMS Microbiol Rev,2012,36:514-532.
[18] STERN A M,ZHU J. An introduction to nitric oxide sensing and response in bacteria[J]. Adv Appl Microbiol,2014,87:187-220.
[19] GANDOTRA S,SCHNAPPINGER D,MONTELEONE M,et al. In vivo gene silencing identif i es the Mycobacterium tuberculosis proteasome as essential for the bacteria to persist in mice[J]. Nat Med,2007,13:1515-1520.
[20] NATHAN C,SHILOH M U. Reactive oxygen and nitrogen intermediates in the relationship between mammalian hosts and microbial pathogens[J]. Proc Natl Acad Sci USA,2000,97:8841-8848.
[21] GANDOTRA S,LEBRON M B,EHRT S. The Mycobacterium tuberculosis proteasome active site threonine is essential for persistence yet dispensable for replication and resistance to nitric oxide[J]. PLoS Pathog,2010,6:152-157.
[22] SAMANOVIC M I,TU S,NOVAK O,et al. Proteasomal control of cytokinin synthesis protects Mycobacterium tuberculosis against nitric oxide[J]. Mol Cell, 2015,57:984-994.
[23] ALONSO S,PETHE K,RUSSELL D G,et al. Lysosomal killing of Mycobacterium mediated by ubiquitinderived peptides is enhanced by autophaty[J]. Proc Natl Acad Sci USA,2007,104:6031-6036.
[24] BOSEDASGUPTA S,PIETERS J. Striking the right balance determines TB or not TB[J]. Front Immunol,2014(5):455.
[25] CERDA-MAIRA F,DARWIN K H. The Mycobacterium tuberculosis proteasome:more than just a barrel-shaped protease[J]. Microbes infect,2009,11:1150-1155.
[26] FESTA R A,JONES M B,BUTLER W S,et al. A novel copper-responsive regulon in Mycobacterium tuberculosis[J]. Molecular Microbiology,2011,79(1):133-148.
[27] SHI X S,RICHARD A F,THOMAS R,et al. The Copper-Responsive RicR Regulon Contributes to Mycobacterium tuberculosis Virulence[J]. mBio,2014,5(1):876-889.
[28] LIN G,LI D Y,CARVALHO L P S,et al. Inhibitors selective for mycobacterial versus human proteasomes[J]. Nature,2009,461:621-626.
[29] LIN G,LI D Y,CHIDAWANYIKA,et al. Fellutamide B is a potent inhibitor of the Mycobacterium tuberculosis proteasome[J]. Arch Biochem Biophys,2010,501:214-220.
[30] LIN G,CHIDAWANYIKA T,TSU C,et al. N,C-capped dipeptides with selectivity for mycobacterial proteasome over human proteasomes:role of S3 and S1 binding pockets[J]. J Am Chem Soc,2013,135:9968-9971.
(责任编辑:杜宪)
Research Progress of the Structure and Function on Proteasome of Mycobacterium tuberculosis
Jin Xin1,Li Chuanyou2,Zhang Linbo1
(1. Jilin Agricultural University,Changchun,Jilin 130118;2. Beijing Tuberculosis & Thoracic Tumor Research Institute,Beijing 101149)
Tuberculosis is a chronic infectious disease caused byMycobacterium tuberculosis(MTB) and its pathogenesis is complex. MTB is confronted with a massive immune response from host immune system. Importantly,proteasome ofMycobacterium tuberculosisis able to evade elimination to favor persistence of bacterium. In recent years,researchers have a new understanding of structure and function on proteasome of MTB. The formation and protein degradation of proteasome are regulated by related factors. Proteasome plays an important role in pathogenicity,persistence and transcriptional regulation of MTB. Further study on the structure and physiological function of the proteasome of MTB is helpful to search the new mechanism of persistence and pathogenicity of MTB. At the same time,it will provide new evidences for development of vaccines and new anti-tuberculosis drugs.
Mycobacterium tuberculosis;proteasome;pathogenicity;persistence
Q71
:A
:1005-944X(2017)07-0075-05
10.3969/j.issn.1005-944X.2017.07.022

