羊种布鲁氏菌Rev.1突变株在BALB/c鼠中的免疫保护评价
叶 锋,马晓菁,刘丽娅,谷文喜,吐尔洪·努尔,易新萍,马俊杰,钟 旗
(新疆畜牧科学院兽医研究所,新疆乌鲁木齐 830000)
羊种布鲁氏菌Rev.1突变株在BALB/c鼠中的免疫保护评价
叶 锋,马晓菁,刘丽娅,谷文喜,吐尔洪·努尔,易新萍,马俊杰,钟 旗
(新疆畜牧科学院兽医研究所,新疆乌鲁木齐 830000)
为评价Rev.1-ΔKan-VirB12突变株在BALB/c鼠中的免疫保护力,以Rev.1为参照,用Rev.1-ΔKan-VirB12接种BALB/c小鼠,免疫45 d后用布鲁氏菌16M强毒株攻毒,15 d后取BALB/c鼠脾脏进行克脾指数测定和病理组织学检测。结果显示:BALB/c鼠免疫攻毒15 d后,Rev.1-ΔKan-VirB12免疫组和Rev.1免疫组的克脾指数与对照组之间有显著性差异(P<0.05),而Rev.1免疫组与Rev.1-ΔKan-VirB12免疫组之间的克脾指数差异不显著(P>0.05)。结果表明,羊布鲁氏菌Rev.1-ΔKan-VirB12突变株与其亲本Rev.1株的免疫保护性无明显差异,具备作为布鲁氏菌病标记疫苗的潜力。
羊种布鲁氏菌;Rev.1;突变株;免疫保护
布鲁氏菌病(以下简称布病)是由布鲁氏菌(Brucella)引起的一种人兽共患传染病[1]。近年来,国内外布鲁氏菌病疫情呈上升趋势,引起了广泛关注。人主要通过直接或间接接触患病动物而感染布病。研究表明目前感染人最多的是羊种布鲁氏菌[2-3]。在切断传染源的基础上,疫苗接种是公认的能够降低畜间布病发病率的有效方法之一[4]。因此,布病疫苗的研制一直是布病防控的主要研究热点。
布鲁氏菌为胞内寄生菌,抗生素对其效果甚微。机体的细胞免疫对抑制布病有至关重要的作用[5]。目前布病疫苗中弱毒活疫苗的应用最为广泛。用于羊布病免疫的疫苗主要包括Rev.1、M5和S2,其为过去几十年的布病防疫提供了重要保障,但也存在毒力较强,可引起负反应,且无法区分疫苗免疫和自然感染等问题。目前有国外研究机构使用Rev.1结膜免疫3~4个月后,通过检测抗体是否存在,来鉴别疫苗免疫和自然感染。但该方法的免疫过程较为繁琐,也存在将疫苗洒落到饲养环境中造成污染的风险,且因个体差异等因素,其鉴别诊断结果存在较大差异。为了解决当前疫苗使用中存在的这些问题,国内外多家研究机构,通过分子生物学技术对布鲁氏菌进行了遗传改造,从而获得具有分子标记的疫苗株[6-10]。研究表明,IV 型分泌系统中的VirB12蛋白可以作为一种布病血清学的检测抗原[11]。本研究应用同源重组的方法,将VirB12基因替换为Kana基因,获得了Rev.1-ΔKan-VirB12突变株,并在小动物模型上验证了其安全性和免疫效果,为布病防治提供了技术储备。
1 材料与方法
1.1 主要试剂
Brucella Broth培养基和Brucella Agar培养基,购自美国BD公司;布鲁氏菌抗原,购自中国疾病预防控制中心传染病研究所;氨苄青霉素、卡那霉素,购自Sigma公司。
1.2 菌株与实验动物
标准菌株16M、Rev.1,购自中国兽医药品监察所;Rev.1-ΔKan-VirB12突变株,由本室构建并保存;6周龄左右SPF级BALB/c小鼠,体重(18.5±1.5)g,购自新疆医科大学动物实验中心,许可证号SCXK(新)2003-0002。BALB/c鼠饲养及解剖场地为新疆天康畜牧生物技术股份有限公司P3动物房。
1.3 菌悬液制备及毒力测定
将羊种16M毒株划线接种于TS琼脂培养基上,37 ℃ 5% CO2恒温培养3 d;挑取单菌落接种于100 mL TS液体培养基中,37 ℃振荡培养2~3 d,观察菌的浓度;将菌液分别进行稀释,并根据不同梯度稀释后,将菌液涂布于布氏琼脂培养基平板上,37 ℃ 5% CO2培养3~5 d后计数备用。将16M菌株以1.0×109CFU腹股沟注射BALB/c鼠,15 d后取脾脏研磨分菌,并计算其克脾菌数。
1.4 16M毒株感染BALB/c鼠的剂量确定
将BALB/c鼠在隔离笼具中饲养3 d,使其适应环境。将16M标准毒株按照1.0×102~1.0×107CFU/只的剂量,对小鼠进行腹腔注射,对照组注射同等剂量PBS。15 d采血后剖检;脾脏加入1.0 mL TS液研磨成匀浆;将匀浆10倍稀释后取100 µL涂布于TSA平板上进行分菌计数;37 ℃ 5% CO2恒温培养箱放置3~5 d后进行计数,确定16M的感染剂量。
1.5 Rev.1、Rev.1-ΔKan-VirB12突变株抗体消长测定
取50只6周龄的雌性BALB/c小鼠,体重(18.5±1.5)g;随机将小鼠分成Rev.1组、Rev.1-ΔKan-VirB12组,每组各25只小鼠;分别腹腔注射免疫接种Rev.1疫苗株和Rev.1-ΔKan-VirB12株;免疫后每隔1周进行眼球采血,持续7周,每次每组3只BALB/c小鼠;采用SAT进行抗体检测,绘制抗体消长趋势图。
1.6 BALB/c小鼠免疫保护试验
取100只6周龄的雌性BALB/c小鼠,体重(18.5±1.5)g;随机分成Rev.1组、Rev.1-ΔKan-VirB12组,每组各40只,PBS对照组20只;分别以3.0×104CFU剂量经腹腔注射免疫接种Rev.1和Rev.1-ΔKan-VirB12株,空白组注射同等剂量PBS;免疫后每周每组取5只(PBS组取3只)采血,分离血清做后抗体检测;剖杀取脾脏称重,研磨成匀浆后分菌计数;免疫后45 d,用16M强毒株以3.0×104CFU剂量腹腔注射攻毒所有BALB/c小鼠;在攻毒15 d、30 d后采血,分离血清;剖杀小鼠,将脾脏称重后,研磨成匀浆进行分菌计数。对脾脏称重及菌落计数结果,应用SPSS 11.5软件进行方差检验统计学分析。
1.7 BALB/c鼠免疫攻毒组织器官病理变化
免疫攻毒后15 d剖杀BALB/c鼠,用多聚甲醛固定PBS对照组、Rev.1株组、Rev.1-ΔKan-VirB12突变株组BALB/c鼠的心脏、肝脏、脾脏、肺脏、肾脏组织,然后制成石蜡切片,HE染色后镜检,观察BALB/c鼠脏器组织病理变化。
2 结果
2.1 16M毒力测定
16M攻毒小鼠后,取脾脏研磨铺板培养计数,计算出的克脾菌数为2.3×106CFU/g,表明该16M株为强度株。
2.2 16M感染BALB/c鼠剂量测定
根据表1可知,将16M以1.0×104CFU剂量感染BALB/c鼠,15 d后血清中可检测到布病抗体,BALB/c鼠脾脏中也可分到布鲁氏菌,其克脾指数(log CFU/g)与1.0×105CFU剂量感染BALB/c鼠值接近,说明16M株攻毒BALB/c鼠的最小攻毒剂量为1.0×104CFU。因此,确定本研究中16M强毒株攻毒BALB/c鼠的攻毒剂量为3.0×104CFU。

表1 羊种16M强毒株感染BABL/c鼠剂量确定
2.3 Rev.1和Rev.1-ΔKan-VirB12抗体消长趋势
如图1所示,Rev.1和Rev.1-ΔKan-VirB12免疫BALB/c鼠均能诱导动物机体产生免疫应答,Rev.1与Rev.1-ΔKan-VirB12免疫抗体在BALB/c鼠内消长曲线趋向基本一致,并没有明显的差异;在第2周即可检测到血清学抗体,第3~4周抗体滴度维持在较高水平,此后抗体滴度开始下降,第6~7周抗体水平低于1:25或基本检测不到。

图1 布鲁氏菌Rev.1-ΔKan-VirB12免疫抗体消长曲线
2.4 BALB/c小鼠免疫保护试验结果
分析结果表明,Rev.1免疫攻毒组与Rev.1-ΔKan-VirB12免疫攻毒组之间的克脾指数差异不显著(P>0.05)。Rev.1免疫攻毒组、Rev.1-ΔKan-VirB12免疫攻毒组和PBS对照攻毒组之间的克脾指数差异显著(P<0.05)。Rev.1组(n=20)有4只BALB/c鼠的脾脏分离出布鲁氏菌;Rev.1-ΔVirB12组(n=20)有3只BALB/c鼠的脾脏分离出布鲁氏菌;PBS对照攻毒组(n=20)中的所有20只BALB/c鼠均分离出布鲁氏菌。攻毒后30 d,Rev.1和Rev.1-ΔKan-VirB12免疫攻毒组与PBS对照攻毒组的克脾指数趋于一致。该结果表明,Rev.1-ΔKan-VirB12与Rev.1株对布鲁氏菌16M毒株均有较好的保护抵抗力,Rev.1-ΔKan-VirB12株的免疫保护力与Rev.1株相当(表2)。
表2 BALB/c鼠免疫保护实验结果
2.5 BALB/c小鼠脾脏形态观察
小鼠体内评价布鲁氏菌的毒力残留已成为一种国际通用的评价标准[12]。本研究结果表明,在用Rev.1疫苗株、Rev.1-ΔKan-VirB12株免疫BALB/c鼠45 d后,用16M攻毒,小鼠脾脏炎症反应与疫苗免疫的保护力呈正相关性。由图2可以看出,免疫攻毒15 d后,PBS攻毒对照组的小鼠脾脏比Rev.1-ΔKan-VirB12组、Rev.1组和空白组的明显肿大。随着时间延长,在免疫攻毒30 d后,与PBS对照攻毒组相比,免疫Rev.1组和Rev.1-ΔKan-VirB12组的小鼠脾脏发生轻微肿大,其炎症反应基本与空白组趋于一致。

图2 BALB/c小鼠脾脏形态变化
2.6 组织病理变化
与PBS攻毒对照组相比较,病理组织学切片结果表明,Rev.1、Rev.1-ΔKan-VirB12免疫攻毒组BALB/c鼠的心脏、肺脏和肾脏组织中均未见明显病理变化,而非免疫攻毒组BALB/c鼠的心脏、肺脏、肝脏和脾脏却有明显的病理变化。Rev.1免疫攻毒组BALB/c鼠脾脏组织出现轻微的增宽现象,以及脾小梁延伸、红髓与白髓界限不清、肝细胞充血出血;Rev.1-ΔKan-VirB12免疫攻毒组BALB/c鼠脾脏出现轻微的增宽现象及脾小梁延伸,肝细胞出血、轻度水肿;PBS对照攻毒组脾窦扩张充血明显,白髓稍减少,部分区域肝细胞有炎性细胞浸润现象。(图3、图4)。
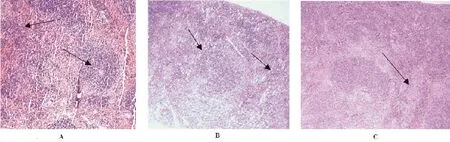
图3 16M毒株攻毒BALB/c鼠的脾脏病理组织切片(HE×100)
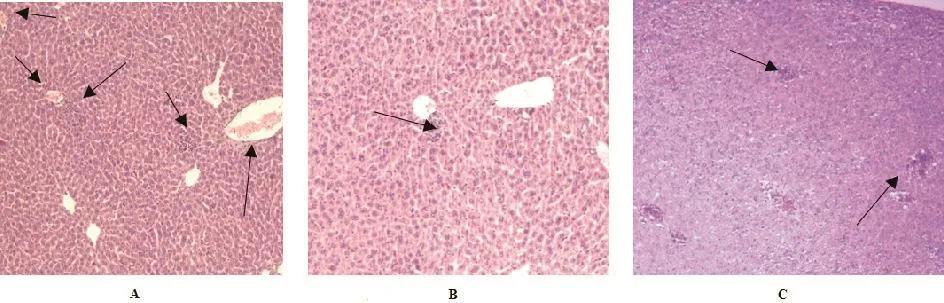
图4 16M毒株攻毒BALB/c鼠的肝脏病理组织切片(HE×100)
3 讨论
目前,畜间布病的防治主要依赖疫苗接种,M5、S2和Rev.1均可用于羊布病的免疫。本研究以Rev.1为亲本株,利用同源重组技术对其进行改造,以Kana基因替代了布鲁氏菌Ⅳ型分泌系统(T4SS)中VirB12基因,获得了具有布病诊断标记的Rev.1-ΔKan-VirB12标记疫苗株,为建立区分动物布病免疫和自然感染的鉴别诊断方法奠定了基础。
Ⅳ型分泌系统(T4SS) 是布鲁氏菌的关键致病力因子,由12个可跨膜蛋白的多蛋白复合物家族组成,与布鲁氏菌细胞内生存繁殖有关[13-14]。研究证明,VirB12在布鲁氏菌感染中是一种免疫原性蛋白,但却不是T4SS系统的必需蛋白[15]。根据文献记载,机体对抗布鲁氏菌的主要是细胞免疫[16-18]。本研究以Rev.1疫苗株为参照,用Rev.1-ΔKan-VirB12突变株免疫BALB/c鼠,检测结果表明,Rev.1-ΔKan-VirB12突变株和Rev.1株在BALB/c 鼠体内都可产生免疫应答,其抗体强度和持续时间保持一致,即免疫后的3~4周达到顶峰,6周后抗体滴度基本低于1:25。为了评价突变株的免疫保护力,本研究在免疫45 d后对小鼠进行16M攻毒试验,剖检后取脏器进行评价。从克脾指数上看,突变株与Rev.1株无显著差异(P>0.05),而PBS对照组则与以上两组有显著差异(P<0.05)。从脾脏和肝脏的病理组织切片也可以看出,Rev.1-ΔKan-VirB12突变株和Rev.1株对16M均具有较好的保护抵抗力,且其免疫保护力也基本保持一致。
综上所述,本研究对Rev.1-ΔKan-VirB12在BALB/c鼠体内的毒力、抗体水平、对脏器的影响及对强度株的免疫保护效力进行了测定。结果显示,与亲本株相比,Rev.1-ΔKan-VirB12突变株在BALB/c鼠体内毒力有所降低,但免疫保护效力无显著差异。本研究为布鲁氏菌标记疫苗的进一步研究提供了基础,但相关的鉴别诊断方法和突变株对靶动物的免疫效力还需进一步建立及验证。
[1] DEQIU S,DONGLOU X,JIMING Y. Epidemiology and control of Brucellosis in China. Veterinary Microbiology,2002,90(1/4):165-182.
[2] 马晓菁,库尔班·居麦,舒展,等. 2012-2014年新疆动物布鲁氏菌病流行病学调查与分析[J]. 畜牧与兽医,2016,48(5):111-114.
[3] GALINDO R C,MUNOZ P M,MIGUEL M J,et al. Genecxpression changes in spleens of wildlife reservoir species,Eurasian wild boar(Susscrofa),naturally infected with Brucella suisbiovar 2[J]. Journal of Genetics and Genomics,2010,37(11):725-736.
[4] 毛开荣. 布鲁氏菌病研究进展[J]. 动物保健,2006,109(9):28-30.
[5] WYCKOFF J H,POTTS R D. Killing of Brucellaantigen-sensitized macrophages by T lymphocytes in bovine brucellosis[J]. Veterinary Immunology and Immunopathology,2007,120(3/4):148-159.
[6] JACQUES I,VERGER J M,LAROUCAU K,et al. Immunological responses and protective efficacy against Brucella melitensis induced by bp26 and omp31 B.melitensis Rev.1 deletion mutants in sheep[J]. Vaccine,2007,25(5):794-805.
[7] CLOECKAET A,JACQUES I,GRILLOM J,et al. Development and evaluation as vaccines in mice of Brucella melitensis Rev.1 single and double deletion mutants of the BP26 and omp31 genes coding for antigens of diagnostic signif i cance in ovine brucellosis[J]. Vaccine,2004,22:2827-2835.
[8] 钟旗,何倩倪,范伟兴,等. 布鲁氏菌 VirB8 变异株的构建及其感染力和毒力的测定[J].畜牧兽医学报,2009,40(6):892-897.
[9] 易德武,张俊波,王远志,等. 羊种布鲁氏菌新疆流行株015株sodc基因缺失株的构建与初步评价[J]. 石河子大学学报(自然科学版),2016,34(1):24-29.
[10] CAMPOS E,CRAVERO S L,DELGUI L,et al. Brucella abortus INTA2,a novel strain 19 Δbp26:luc Δbmp18 double mutant lacking drug resistance markers[J]. Veterinary Microbiology,2002,87(1):1-13.
[11]ROLÁN H G,DEN HARTIGH A B,KAHLMCDONAGH M,et al. VirB12 is a serological marker of Brucella infection in experimental andnatural hosts[J]. Clinic Vaccine Immunology,2008,15 (2):208-214.
[12] STEVENS M G,OLSEN S C,PUGH G W,et al. Comparison of immune responses and resistance to Brucellosisin mice vacciuated with Brucella abortus 19 or RB51[J]. Infection Immunity,1995,63(1):264-270.
[13] 李默,易德武,王远志,等. 布鲁氏菌 Ⅳ 型分泌系统效应蛋白BspB的原核表达及布鲁氏菌免疫逃逸分析[J]. 中国病原生物学杂志,2015,10(9):778-781.
[14]O' CALLAGHAN D,CAZEVIEILLE C,ALLARDETSERVENT A,et al. A homologue of the Agrobacterium tumefaciens VirB and Bordetella pertussis Ptl type IV secretion systems is essentialfor intracellular survival of Brucellasuis[J]. Molecular Microbiology,1999,33(6):1210-1220.
[15]YAO H S,HORTENSIA G R,ANDREAS B,et al. Brucella abortus VirB12 is expressed during infection but is not an essential component of the type IV secretion system[J]. Infectionand Immunity,2005,73(9):6048-6054.
[16] 丁家波,王芳,杨宏军,等. 一株中等毒力牛种布鲁氏菌的鉴定和毒力测定[J]. 中国农业科学,2014,47(13):2652-2658.
[17] 易新萍,谷文喜,李金平,等. 评价牛型布鲁氏菌疫苗免疫保护力 BALB/c 鼠模型的建立[J]. 中国兽医杂志,2013,40(6):73-77.
[18] 郑孝辉,胡森,王加兰,等. 流产布氏杆菌 S19 突变株构建及在小鼠感染模型中的免疫保护评估[J]. 中国预防兽医学报,2009,31(11):887-891.
(责任编辑:朱迪国)
Evaluation of Protective Eff i cacy about Brucella melitensis Rev.1 Mutant in BALB/c Mice
Ye Feng,Ma Xiaojing,Liu Liya,Gu Wenxi,Tuerhong·Nuer,Yi Xinping,Ma Junjie,Zhong Qi
(Institute of Veterinary Research,Xinjiang Academy of Animal science,Urumuqi,Xinjiang 830000)
In order to evaluate protective efficacy of Rev.1-ΔKan-VirB12 mutant in BALB/c mice,BALB/c mice were vaccinated with both Rev.1 and Rev.1-ΔKan-VirB12,and then were challenged with 16M after vaccinated 45 d. Fifteen days post challenge,the spleens of BALB/c mice were taken for theBrucellaload of gram of spleen determination and histopathological examination. Results showed that there was signif i cant difference between Rev.1-ΔKan-VirB12 group and Rev.1 group and control group(P<0.05). The difference ofBrucellaload of gram of spleen between Rev.1 immune group andKan-VirB12 immune group was not signif i cant(P>0.05). The results showed that the protective eff i cacy of both was nearly same,holding the potential as a vaccine for Brucellosis.
Brucella.melitensis;Rev.1;mutant;protective eff i cacy
S851.3
:B
:1005-944X(2017)07-0100-05
10.3969/j.issn.1005-944X.2017.07.028
新疆高技术研究发展计划项目(201311102);新疆公益性科研院所基金(KYGY2016020)
钟 旗

