大孔吸附树脂纯化富集川芎总生物碱的工艺
蒲忠慧,王力,高宇,张潇,彭成,*,熊亮,*,李文兵
(1.成都中医药大学药学院,教育部中药材标准化重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;2.绵阳师范学院生命科学与技术学院,四川绵阳621006;3.四川新绿色药业科技发展股份有限公司,四川彭州610031)
大孔吸附树脂纯化富集川芎总生物碱的工艺
蒲忠慧1,2,王力1,高宇1,张潇1,彭成1,*,熊亮1,*,李文兵3
(1.成都中医药大学药学院,教育部中药材标准化重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137;2.绵阳师范学院生命科学与技术学院,四川绵阳621006;3.四川新绿色药业科技发展股份有限公司,四川彭州610031)
以盐酸川芎嗪为对照品,采用酸性染料比色法测定川芎总生物碱含量。以吸附率和解吸率为指标,比较7种不同型号大孔吸附树脂的静态吸附与解吸附能力,考察动态吸附与洗脱参数,筛选最佳大孔吸附树脂纯化富集川芎总生物碱的工艺条件。结果表明AB-8型大孔树脂对川芎总生物碱的吸附与解吸性能最好,静态吸附率为75.10%,解吸率为81.45%,静态吸附和解吸时间分别为12 h和8 h。其动态富集工艺条件为:最佳上样液pH为8.0,上样质量浓度为4.479 9 mg/mL,上样量为8 BV,用13 BV去离子水除杂后,再用14 BV体积分数85%的乙醇进行洗脱。经AB-8大孔树脂纯化富集后,川芎总生物碱纯度提高了2.38倍,回收率为75.15%(RSD=1.22%,n=3)。
川芎;总生物碱;大孔吸附树脂;纯化富集
川芎始载于《神农本草经》,为常用君药,是伞形科藁本属植物川芎(Ligusticum chuanxiong Hort.)的干燥根茎,主要分布于四川都江堰、彭州、新都等地,为川产道地药材[1-3]。其味辛、微苦、性温,归肝、胆、心包经,具有活血行气、祛风止痛的功效,可泡酒喝,也可泡茶喝,或者炖鸡煨肉食用。在饮食及人群方面,适宜于患有月经不调,经闭痛经,产后瘀痛等病症的人群[4];还可以用于风寒头痛、风热头痛、偏头痛、血管神经性头痛等症的人群[5];以及有着各种瘀血阻滞之病症的人群[6]。川芎总生物碱作为一个有效成分群,在治疗心脑血管疾病方面的疗效显著[7-9]。因此,分离纯化川芎总生物碱具有重要的意义。
大孔吸附树脂具有比表面积大、吸附容量大、选择性好、前处理简便、使用周期长、且不溶于酸碱及有机溶剂等优点[10-11],尤其在分离纯化生物碱类化合物的应用中取得了很好的效果[12-13]。但目前尚未见有大孔吸附树脂分离纯化川芎总生物碱的研究报道。本研究在前期提取工艺基础上,以富集川芎总生物碱量为目的,采用静态吸附分离法筛选最佳型号的大孔吸附树脂,动态吸附分离法优化纯化工艺条件,为进一步研究川芎总生物碱提取物的制备提供科学方法,也为川芎相关新药的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
川芎饮片:由四川新绿色药业科技发展股份有限公司提供,经成都中医药大学药学院李敏老师鉴定为伞形科多年生草本植物川芎Ligusticum chuanxiong Hort.的根茎。现存于成都中医药大学中药资源系统研究与开发利用省部共建国家重点实验室培育基地,标本号:LC-20150910。
盐酸川芎嗪对照品:中国食品药品检定研究院提供,批号110817-201006,含量为83.9%;所用其它试剂均为市售分析纯。
大孔吸附树脂:ADS-5、ADS-7(天津浩聚树脂科技有限公司);HPD-100、HPD-500、HPD-600(河北沧州宝恩化工有限公司);AB-8、D101(安徽三星树脂科技有限公司)。
1.2 仪器与设备
Analytikjena SPECORD/200型紫外可见分光光度计、石英比色皿:德国耶拿分析仪器股份公司;FA2004B型电子天平:上海越平科学仪器有限公司;AUW220D电子分析天平:SHIMADZU CORPORATION;HX-200型高速中药粉碎机:浙江省永康市溪岸五金药具厂;SHZC-4263型卧式恒温振荡器:成都瑞昌仪器制造有限公司;PHS-25酸度计:成都世纪方舟科技有限公司。
1.3 方法
1.3.1 标准曲线的绘制
采用酸性染料比色法测定川芎总生物碱含量[14]。精密称取盐酸川芎嗪对照品12.19 mg(含量83.9%),加氯仿溶解并定容至10 mL,制得对照品储备液(1.022 7 mg/mL)。分别精密吸取盐酸川芎嗪对照品储备液 0.1、0.2、0.4、0.6、0.8、1.0 mL,置于 6 个 60 mL 分液漏斗中,分别加入含4.0 mL pH 3.6的磷酸氢二钠-柠檬酸缓冲液和7.0 mL溴甲酚绿溶液。随后以10、7、6 mL氯仿萃取3次,收集合并氯仿层,用氯仿定容至25 mL,加入1.0 g无水硫酸钠,摇匀,除水30 min后,以不加盐酸川芎嗪同法萃取制得空白对照,在417 nm波长下测定吸光度。以吸光度为纵坐标,以盐酸川芎嗪的浓度(μg/mL)为横坐标绘制标准曲线。
1.3.2 总生物碱的含量测定
精密称取一定量的川芎粉末,按照前期研究优选的提取工艺:即加入15倍量80%乙醇100℃加热回流提取2.5 h,将所得药液过滤合并浓缩蒸干。残渣加1 mol/L的盐酸60 mL溶解,滤过,滤液用浓氨水调pH值为9~10后,用氯仿萃取至无色,合并氯仿萃取液,浓缩蒸干,得总生物碱粗品,加氯仿溶解定容。精密吸取1 mL生物碱粗品溶液,按照“1.3.1”项下方法操作,以不加样品同法萃取制得空白溶液。在417 nm波长下测定其吸光度,根据回归方程计算总生物碱含量。
1.3.3 大孔树脂静态吸附性能的考察
1.3.3.1 静态吸附与静态解吸
参照文献[15]对 7 种大孔树脂(ADS-5、ADS-7、D101、AB-8、HPD-100、HPD-500、HPD-600)进行预处理,采用静态吸附与解吸法[16]筛选纯化川芎生物碱的树脂类型。具体操作如下:
静态吸附与解吸:分别准确称取7种预处理好的大孔树脂3份,每份各1.0 g,置于50 mL的具塞磨口三角瓶中,然后分别加入总生物碱质量浓度为0.398 2 mg/mL的川芎水溶液35 mL,于恒温振荡器25℃振摇吸附24 h,充分吸附后抽滤,滤液浓缩干后氯仿定容至5 mL。取上述吸附已达饱和并冲洗滤干的树脂,加入35 mL 95%的乙醇溶液,然后于恒温振荡器上25℃振荡24 h,充分解吸后再抽滤,滤液浓缩干后氯仿定容至5 mL。分别吸取1.0 mL上述供试品溶液,按“1.3.1”项下方法测定吸光度,计算各种树脂对川芎生物碱的比吸附量与吸附率、比解吸量与解吸率,计算公式如下。
比吸附量=(C0V0-CMVM)/W;吸附率/%=(C0V0-CMVM)/C0V0×100;比解吸量=CEVE/W;解吸率/%=CEVE/(C0V0-CMVM)×100。
式中:C0为上样液中总生物碱的质量浓度,mg/mL;V0为上样液的体积,mL;CM为吸附残液中总生物碱的质量浓度,mg/mL;VM为吸附残液体积,mL;CE为乙醇洗脱液中总生物碱的质量浓度,mg/mL;VE为乙醇洗脱液体积,mL;W为树脂质量,g。
1.3.3.2 静态吸附动力学考察
精密称取预处理的AB-8型树脂2.5 g,置于50 mL磨口锥形瓶中,精密加入总生物碱质量浓度为1.221 3 mg/mL的川芎水溶液25 mL,于恒温振荡器25 ℃下振摇,平行 3 次,分别在 2、4、6、8、10、12、24 h时吸取上清液3.0 mL,浓缩蒸干。同时将吸附24 h后的树脂用蒸馏水冲洗后抽干,加入95%乙醇25 mL进行解吸,25 ℃下振摇,平行 3 次,分别在 2、4、6、8、10、12、24 h时吸取上清液3.0 mL,浓缩蒸干,上述残渣分别加氯仿溶解按“1.3.1”项下方法测定上清液中残留总生物碱含量。
1.3.4 AB-8大孔树脂动态吸附与洗脱条件的考察
1.3.4.1 上样液pH值对川芎总生物碱富集的影响
准确量取5份预处理好的AB-8型大孔树脂10 mL,湿法装于径高比为1∶20的玻璃柱中(直径 2.5 cm、高50 cm),平行3份,用1 mol/L NaOH和1 mol/L HCl酸度计调节pH值后,分别加入pH值为 3、5、7(原液)、9、11的川芎总生物碱水溶液 50 mL进行充分吸附12 h后将多余吸附残液放出,先用蒸馏水洗至流出液无色,水洗液与吸附残液合并,氯仿定容至5.0 mL容量瓶中,精密吸取0.2 mL测定吸光度,并计算吸附率。
1.3.4.2 上样液浓度对川芎总生物碱富集的影响
准确量取6份预处理好的AB-8型大孔树脂10mL,置于玻璃柱中,平行3份,分别精密加入pH 9的含川芎总生物碱质量浓度为 0.896 0、1.792 0、2.688 0、3.584 0、4.479 9、5.375 9 mg/mL水溶液,于充分吸附12 h后将多余吸附残液放出,用蒸馏水洗脱至流出液无色,水洗液与吸附残液合并,氯仿定容至5.0 mL容量瓶中,精密吸取0.2 mL测定吸光度,并计算吸附率。
1.3.4.3 上样量对川芎总生物碱富集的影响
准确量取预处理好的AB-8型大孔树脂10 mL,置于玻璃柱中,平行3份,精密吸取pH 9的川芎生物碱质量浓度为4.479 9 mg/mL水溶液,以2 BV/h的流速通过树脂进行动态吸附,用试管收集过柱液,每1 BV(10 mL)收集1份,每管分别精密吸取0.5 mL,测定川芎总生物碱的含量。
1.3.4.4 水洗用量对川芎总生物碱富集的影响
准确量取预处理好的AB-8型大孔树脂10 mL,置于玻璃柱中,平行3份,精密吸取pH 9的川芎生物碱质量浓度为4.479 9 mg/mL水溶液70 mL于树脂中进行吸附,待充分吸附后加入去离子水,以2 BV/h的流速洗脱,流出液每1 BV收集1份,测定川芎总生物碱的质量。
1.3.4.5 乙醇洗脱浓度对川芎总生物碱富集的影响
准确量取5份预处理好的AB-8型大孔树脂10mL,置于玻璃柱中,平行3份,分别加入pH 9的川芎生物碱提取液,按上样量与树脂体积比1∶30(g/mL)进行动态吸附,吸附完成后,用13 BV去离子水洗除去杂质,分别用体积分数35%、55%、75%、85%、95%的乙醇溶液进行动态解吸附,将洗脱液浓缩蒸干,氯仿定容至5.0 mL容量瓶中,精密吸取0.1 mL测定测定总生物碱的含量。
1.3.4.6 乙醇洗脱用量对川芎总生物碱富集的影响
准确量取预处理好的AB-8型大孔树脂10 mL,置于玻璃柱中,平行3份,精密吸取pH 9的川芎生物碱质量浓度为4.479 9 mg/mL水溶液70 mL于树脂中进行吸附,待充分吸附12 h后加入先用13 BV去离子去杂质,再加入75%乙醇,以2 BV/h的流速收集洗脱液,每1 BV收集1份,测定总生物碱的含量。
1.3.5 正交试验
结合单因素试验结果,选取上样液pH值(A)、上样液浓度(B)、乙醇洗脱浓度(C)、上样量(D)为影响因素,设计四因素三水平正交试验L9(34),如表1所示。根据正交设计方案(表2),以川芎总生物碱含量为考察指标,确定大孔树脂纯化川芎总生物碱的最佳工艺条件。
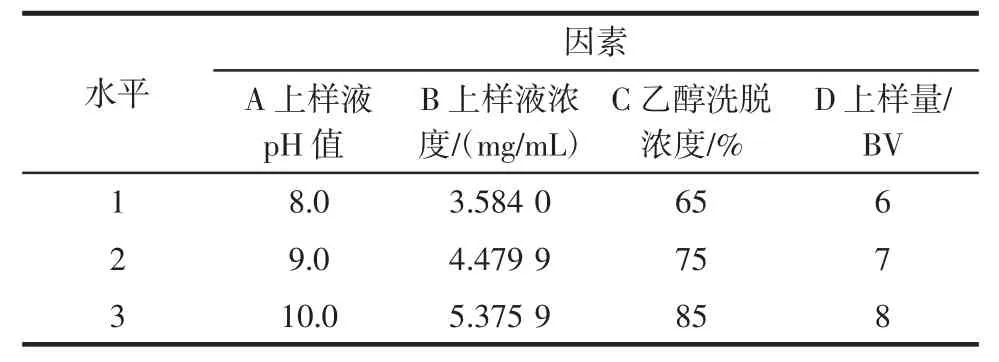
表1 正交试验因素水平表Table 1 The factors and levels of orthogonal experiment
1.3.6 验证试验
按照正交试验优选的最佳纯化工艺条件进行验证,试验平行3次。
2 结果与分析
2.1 川芎总生物碱的标准曲线
以盐酸川芎嗪的浓度(μg/mL)为横坐标,以吸光度为纵坐标,绘制标准曲线,得回归方程Y=0.017 82X-0.029 07,相关系数R2=0.998 4。结果表明,盐酸川芎嗪在浓度 4.09 μg/mL~40.90 μg/mL 范围内与吸光度呈良好的线性关系。
2.2 树脂极性对川芎总生物碱分离效果的影响
本试验选用非极性的ADS-5、D101、HPD-100型、弱极性的AB-8型以及极性的ADS-7、HPD-500、HPD-600型7种大孔吸附树脂,定性地考察树脂极性对川芎总生物碱分离效果的影响。结果见图1。

图1 树脂型号对川芎总生物碱富集的影响Fig.1 Effects of macroporous resin types on the purification of total alkaloids from L.chuanxiong Hort.
由图1可知,7种大孔吸附树脂的比吸附量按大小依次为 AB-8>HPD-500 >HPD-600>ADS-5>D101>ADS-7>HPD-100;解吸率依次为 AB-8>HPD-600>HPD-100>ADS-5>D101>HPD-500>ADS-7。由于弱极性的AB-8大孔树脂对川芎生物碱吸附解吸性能最好,因此选择AB-8型树脂纯化川芎总生物碱。
2.3 AB-8树脂静态吸附动力学考察结果
以比吸附量和比解吸量(mg/g)对时间t(h)作图,得到AB-8型大孔吸附树脂的静态吸附和解吸动力学曲线见图2。
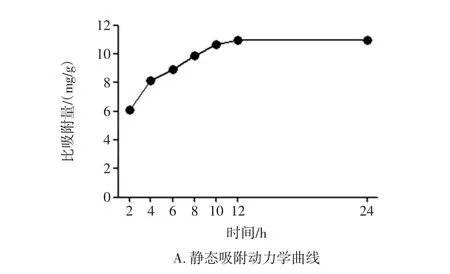

图2 AB-8型大孔吸附树脂的静态吸附和解吸动力学曲线Fig.2 Kinetic curve of static adsorption and desorption for AB-8 macroporous resin
由图2可知,AB-8型大孔吸附树脂静态吸附过程中的比吸附量在4 h后增加缓慢,12 h后基本达到平衡,而在静态解吸过程中的比解吸量在8 h后基本达到平衡。因此,选择静态吸附时间为12 h,解吸时间为8 h。
2.4 上样液pH值对川芎总生物碱富集的影响
上样液pH值对川芎总生物碱富集的影响见图3。
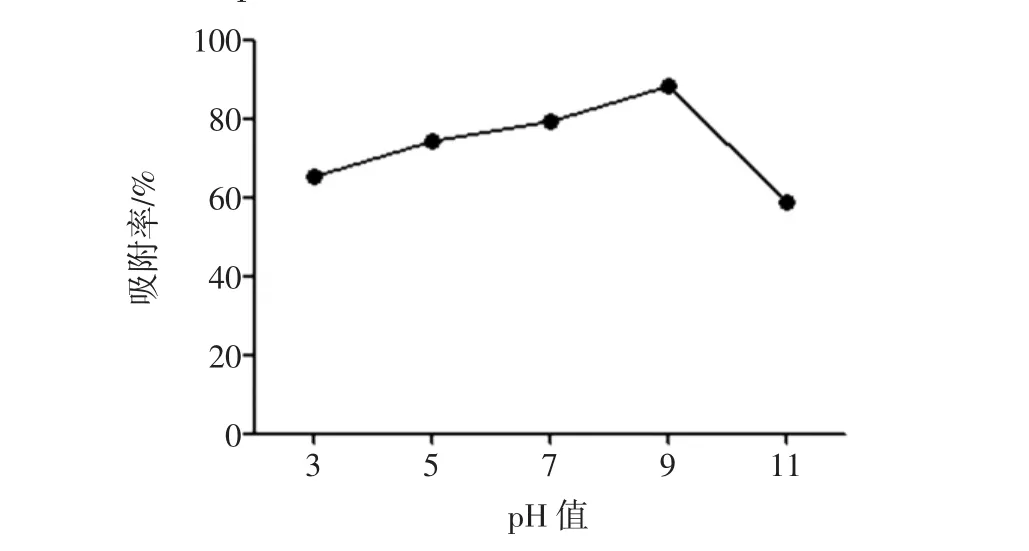
图3 上样液pH值对川芎总生物碱富集的影响Fig.3 Effects of sample pH on the purification of total alkaloids from L.chuanxiong Hort.
结果表明,pH 值为 3、5、7(原液)、9、11 时,吸附率分别为 65.13%、74.24%、79.41%、88.30、58.89%(n=3)。可见,上样液pH值在3~9之间时,随着pH值的升高,树脂对样品中总生物碱的吸附量增加;当pH值超过9时,树脂对总生物碱的吸附量降低。因此,选择pH值9为样液的最佳上样pH值。
2.5 上样液浓度对川芎总生物碱富集的影响
上样液浓度对川芎总生物碱富集的影响见图4。
由图4可得,当上样浓度为0.8960、1.7920、2.6880、3.584 0、4.479 9、5.375 9 mg/mL 时,吸附率分别为66.52%、74.26%、77.73%、79.36、80.68%、80.78%(n=3)。当上样液质量浓度低于3.584 0 mg/mL时,吸附率随上样浓度增大而上升,当上样液质量浓度达到4.479 9 mg/mL时,再增加浓度(5.375 9 mg/mL)对吸附率没有显著影响。综合考虑,最终选用质量浓度为4.479 9 mg/mL。
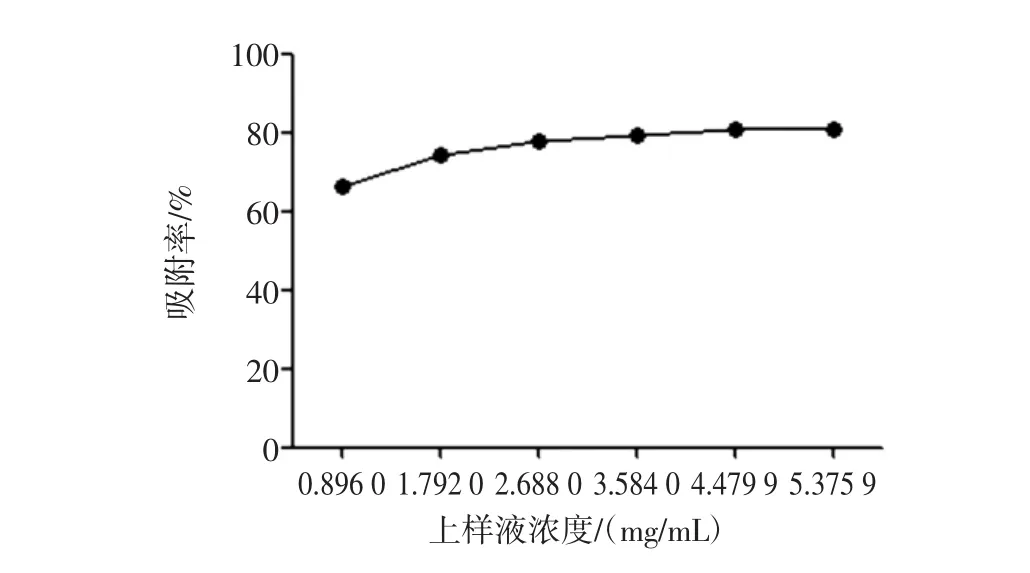
图4 上样液浓度对川芎总生物碱富集的影响Fig.4 Effects of sample concentration on the purification of total alkaloids from L.chuanxiong Hort.
2.6 上样量对川芎总生物碱富集的影响
上样量对川芎总生物碱富集的影响(泄露曲线)结果见图5。
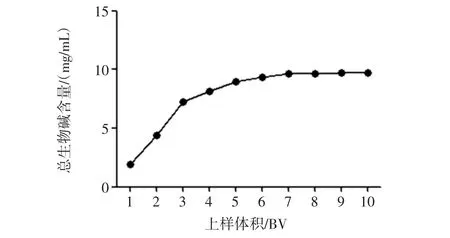
图5 上样量对川芎总生物碱富集的影响Fig.5 Effects of sample volume on the purification of total alkaloids from L.chuanxiong Hort.
由图5可见,当上样体积达到7 BV时,树脂柱中总生物碱成分呈现完全泄露,大孔树脂对样品液中总生物碱吸附饱和。故确定最佳上样量为7 BV,相当于10 mL树脂上样70 mL总生物碱质量浓度为4.479 9 mg/mL的川芎提取液,即最佳上样量与树脂体积比约为 1∶30(g/mL)。
2.7 水洗用量对川芎总生物碱富集的影响
水洗用量对川芎总生物碱富集的影响见图6。
由图6可知,随着水洗用量的增加,流出液中的总生物碱逐渐减少,当水洗用量为13 BV时,流出液中的总生物碱已经很少。因此,确定最佳的水洗用量为13BV。
2.8 乙醇洗脱浓度对川芎总生物碱富集的影响
乙醇洗脱浓度对川芎总生物碱富集的影响见图7。
由图7可见,当乙醇洗脱浓度低于75%时,随着乙醇浓度的增大,树脂上解吸附下来的总生物碱含量随之升高,当乙醇浓度达到85%时,树脂上解吸附下来的总生物碱含量反而降低,以洗脱浓度为75%的乙醇解吸效果最好。因此,确定乙醇最佳洗脱浓度为75%。
2.9 乙醇洗脱量对川芎总生物碱富集的影响
乙醇洗脱量对川芎总生物碱富集的影响见图8。

图6 水洗用量对川芎总生物碱富集的影响Fig.6 Effects of the quantity of elution water on the purification of total alkaloids from L.chuanxiong Hort.

图7 乙醇洗脱浓度对川芎总生物碱富集的影响Fig.7 Effects of the concentration of elution ethanol on the purification of total alkaloids from L.chuanxiong Hort.
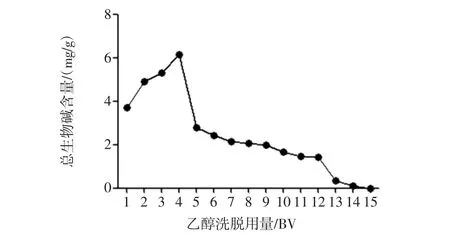
图8 乙醇洗脱用量对川芎总生物碱富集的影响Fig.8 Effects of the quantity of elution ethanolon the purification of total alkaloids from L.chuanxiong Hort.
结果表明,随着乙醇洗脱用量的增加,样品中总生物碱逐渐被洗脱下来,当洗脱剂用量为14 BV时,洗脱液中的总生物碱已基本洗脱完全。因此,确定乙醇最佳洗脱用量为14 BV。
2.10 正交试验结果与分析
根据正交设计方案,按“1.3.1”项下方法于417 nm处测定9份试验样品总生物碱含量。正交试验结果及方差分析见表2、表3。
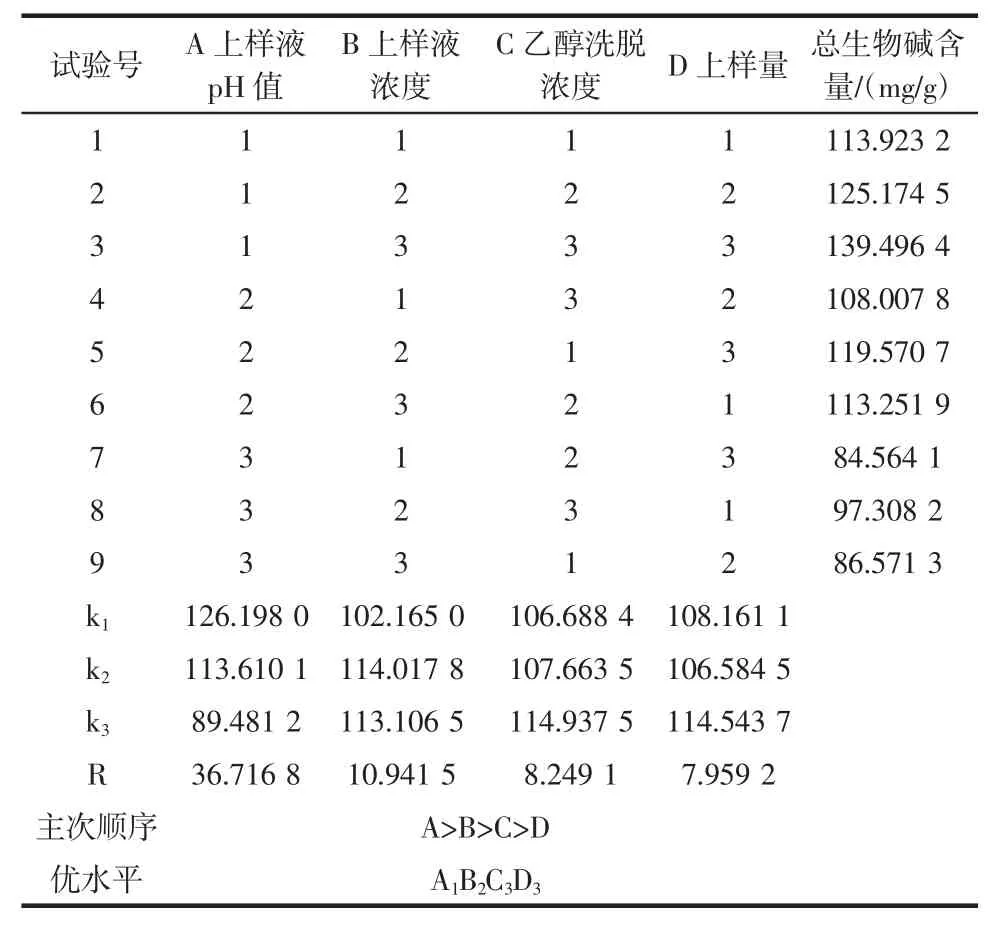
表2 正交试验L9(34)方案及结果Table 2The results and scheme of L9(34)orthogonal experiment
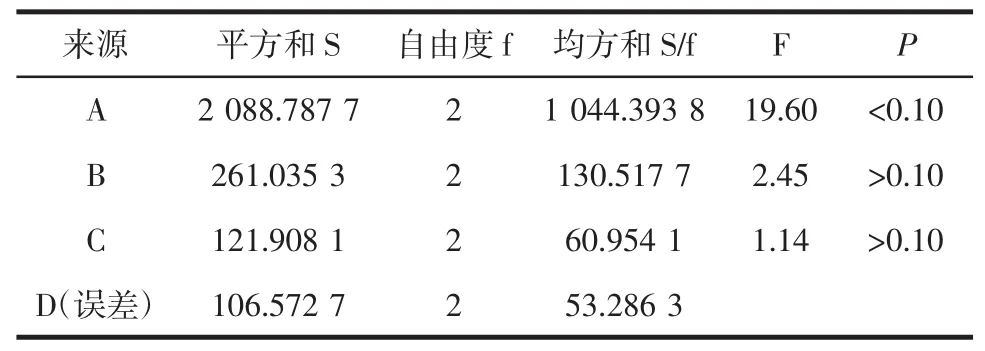
表3 正交试验方差分析表Table 3 The table of variance analysis of orthogonal experiment
由表2中R值可以看出,影响川芎总生物碱含量的的因素主次顺序依次为A>B>C>D,即上样液pH值对生物碱含量的影响最大,其次为上样液浓度,乙醇洗脱浓度和上样量。由表3方差分析可知,因素A的影响显著(P<0.1),因素B和C的影响均不显著(P>0.1),因素D因离均差平方和最小作为误差估计项,影响最小。因此,最终确定大孔树脂纯化川芎总生物碱最佳工艺条件为A1B2C3D3。即上样液pH 8,上样浓度4.479 9 mg/mL,乙醇洗脱浓度85%,上样量8 BV作为实施方案加以验证。
2.11 验证试验
按照优选的最佳纯化工艺条件进行验证:即量取已处理好的AB-8大孔树脂300 mL湿法装柱,精密吸取pH 8的总生物碱质量浓度为4.479 9 mg/mL的川芎水溶液8 BV上样,吸附12 h后,先用13 BV去离子水除杂后,再用14 BV体积分数85%的乙醇进行洗脱,收集洗脱液,蒸干,称取一定量氯仿定容至25 mL。分别精密吸取0.1 mL,按“1.3.1”项下方法于417nm处测定试验样品中川芎总生物碱的含量(mg/g)。另外,分别精密吸取未经AB-8大孔树脂纯化的原提取液25 mL,以及纯化后重新溶解的溶液25 mL,放置于蒸发皿烘干至恒重,称定重量,计算浸膏中总生物碱含有量(mg/g)。试验重复3次,结果见表4。
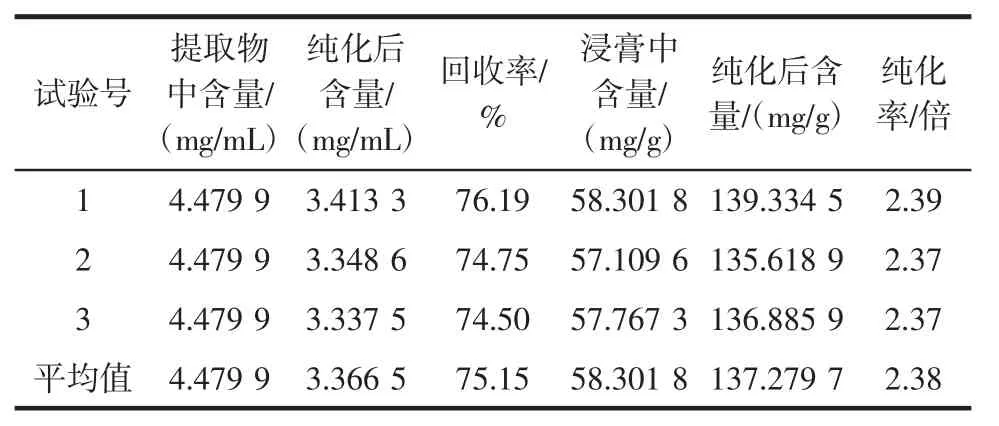
表4 AB-8大孔树脂纯化川芎总生物碱的验证试验(n=3)Table 4 Verification tests for the purification of total alkaloids from L.chuanxiong Hort.by macroporous resin(n=3)
由表4可知,经AB-8大孔树脂纯化川芎总生物碱后,所得浸膏中总生物碱的含有量由58.30 mg/g提高到137.28 mg/g,纯化后纯度提高了2.38倍,回收率为75.15%(RSD=1.22%,n=3)。可见AB-8大孔吸附树脂可作为一种良好的纯化川芎总生物碱的树脂使用。
3 结论
本试验首次采用静态吸附分离法优选了AB-8大孔吸附树脂为纯化川芎总生物碱的最佳型号树脂。正交试验优化了动态富集最佳工艺条件:上样液pH值为8.0,上样质量浓度为4.479 9 mg/mL,上样量为8 BV,用13 BV去离子水除杂后,再用14 BV体积分数85%的乙醇进行洗脱。川芎总生物碱经AB-8大孔树脂纯化后,所得浸膏中总生物碱的含量由58.30 mg/g提高到137.28 mg/g,纯化后纯度提高了2.38倍,回收率为75.15%(RSD=1.22%,n=3)。该工艺简单可行,纯化富集效果较好,对大生产有一定指导作用。
[1] 陈闽军,吴永江,范骁晖,等.色谱指纹图谱分析技术用于鉴别中药川芎产地[J].中国中药杂志,2003,28(7):606-610
[2] Yan R,Li S L,Chung H S,et al.Simultaneous quantification of 12 bioactive components of Ligusticum chuanxiong Hort.by high-performance liquid chromatography[J].J Pharm Biomed Anal,2005,37(1):87-95
[3] 孙立磊,王帅,包永睿,等.多波长覆盖融合指纹图谱评价不同产地川芎药材差异性[J].中国实验方剂学杂志,2016,22(5):75-79
[4] 张斯杰,郭建博,王晓莉,等.川芎-香附提取物对原发性痛经模型动物的作用[J].沈阳药科大学学报,2013,30(5):383-387
[5] 赵永烈,王谦,王良叶,等.川芎治疗头痛各家谈[J].中医药学报,2014(2):97-101
[6] 张晓琳,徐金娣,朱玲英,等.中药川芎研究新进展[J].中药材,2012,35(10):1706-1709
[7] 王立英,曲娴,刘絮,等.川芎生物碱对大鼠血清中SOD活性、NO、NOS、MDA含量的影响[J].中国老年学杂志,2008,28(20):1989-1990
[8] 高健,曲晓峰,刘洋.川芎生物碱对脑缺血再灌注大鼠SOD、MDA、神经功能及脑梗死容积的影响[J].中国老年学杂志,2009,29(1):22-24
[9] 崔新颖,刘惠民.川芎生物碱对抗异丙肾上腺素诱发的急性心肌缺血试验研究[J].中国地方病防治杂志,2008,24(1):61
[10]何伟,李伟.大孔树脂在中药成分分离中的应用[J].南京中医药大学学报,2005,21(2):134-136
[11]贾振宝,陈文伟,关荣发,等.大孔吸附树脂纯化红茶黄素的研究[J].中草药,2010,41(7):1106-1109
[12]徐东峰,李斌.大孔吸附树脂在分离纯化生物碱中的应用[J].江西中医药,2013,44(12):53-54
[13]孙越,曹喜红,潘艳丽.大孔吸附树脂在中药研究中的应用[J].中医药信息,2002,19(2):23
[14]李路扬,龙娓芳,万定荣,等.5种小檗属药用植物总生物碱及小檗碱的含量测定[J].中国实验方剂学杂志,2014,20(17):91
[15]王小芳,张喜民,邓月婷,等.大孔树脂分离纯化松潘乌头总生物碱研究[J].中成药,2014,36(4):860-864
[16]孙政华,郭玫,邵晶,等.大孔吸附树脂纯化富集五脉绿绒蒿总生物碱[J].中成药,2016,38(1):77-83
Purification and Enrichment of Total Alkaloids from Ligusticum chuanxiong Hort.by Macroporous Resin
PU Zhong-hui1,2,WANG Li1,GAO Yu1,ZHANG Xiao1,PENG Cheng1,*,XIONG Liang1,*,LI Wen-bing3
(1.Pharmacy College,Chengdu University of TCM,The Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine,State Key Laboratory Breeding Base of Systematic Research,Development and Utilization of Chinese Medicine Resources,Chengdu 611137,Sichuan,China;2.College of Life Science and Technology,Mianyang Normal University,Mianyang 621006,Sichuan,China;3.Sichuan Neo-Green Pharmaceutical Technology Development Co.,Ltd.,Pengzhou 610031,Sichuan,China)
The content of the total alkaloids was measured by acid dye colorimetry with ligustrazine hydrochloride as reference substance.Taking the adsorption and desorption rates as index,the best macroporous resin was screened out from seven resins by static adsorption method,elution parameters were optimized by dynamic adsorption method.Results showed that AB-8 was considered the best purification and enrichment potency for total alkaloids from L.chuanxiong Hort.The static absorbtion ratio was 75.10%and desorption ratio was 81.45%.Optimal purification process conditions were as follows:the concentration of sample solution 4.4799 mg/mL with pH as 8.0,maximum sample volume 8 BV,washed by 13 BV purified water and 14 BV 85%ethanol.The purity of total alkaloids was 2.38 times higher than before enrichment,the average recovery rate was 75.15%in 3 validation tests(RSD=1.22%,n=3).
Ligusticum chuanxiong Hort.;total alkaloids;macroporous resin;purification and enrichment
2016-08-26
10.3969/j.issn.1005-6521.2017.11.019
四川省科技支撑计划(2015SZ0031);科技基础性工作专项计划(2015FY111500-140)
蒲忠慧(1982—),女(汉),讲师,在读博士,从事中药药效物质基础研究。
*通信作者:彭成,研究员,博士生导师,从事中药药效与毒理研究;熊亮,副研究员,硕士生导师,从事天然药物化学成分及药效物质基础研究。

