星形胶质细胞活化后瞬时受体电位通道6在TBI中的作用*
张礼均,冯 华
(1.重庆市急救医疗中心神经外科 400014;2.第三军医大学西南医院神经外科,重庆 400038)
星形胶质细胞活化后瞬时受体电位通道6在TBI中的作用*
张礼均1,冯 华2△
(1.重庆市急救医疗中心神经外科 400014;2.第三军医大学西南医院神经外科,重庆 400038)
目的 探讨大鼠颅脑损伤(TBI)后星形胶质细胞(AST)瞬时受体电位通道(TRPC)6在TBI中扮演的角色。方法 将健康成年雄性SD大鼠39只分为假手术组、致伤组和去铁胺(DFX)组,每组13只。参照Feeney法建立大鼠大脑冲击伤模型,完成Morris水迷宫实验、大脑缺损体积,免疫荧光检测TRPC6与神经胶质原纤维酸性蛋白质(GFAP)共表达,以及Western blot定量检测TRPC6水平。结果 DFX组比致伤组大鼠大脑缺损体积明显减小[(115.35±13.70)mm3vs.(209.99±16.70)mm3,P<0.05],Morris水迷宫实验发现DFX组平台搜索策略[(3.13±0.35)分]和搜索时间[(36.15±26.63)s]均较致伤组[(2.13±0.64)分和(110±47.34)s]明显改善(P<0.05)。免疫荧光双标发现DFX组GFAP高表达,且与TRPC6共表达增多。Western blot定量检测发现DFX组TRPC6明显下调(P<0.01)。结论 大鼠TBI早期DFX治疗后AST活化,TRPC6高表达,进而起到神经保护作用。
颅脑损伤;神经胶质原纤维酸性蛋白质;瞬时受体电位通道;去铁胺
颅脑损伤(TBI)一直表现为高致残率和高死亡率,是神经外科救治重点难点,而神经外科医师关注的焦点依然是如何挽救损伤灶周围的“半暗带(penumbra)”,以挽救更多的神经细胞,保留更多神经功能,从而达到改善患者预后的目的。既往“半暗带”神经元的保护是实验研究的重点,然而,众所周知,中枢神经系统中,绝大多数是星形胶质细胞(AST),AST在TBI中扮演的作用知之甚少。体外实验研究发现胶质细胞活化可以预防铁离子进入突触间隙,从而避免铁超载造成神经元的毒性作用[1],与本课题前期研究结果一致[2],因此作者认为AST可能在TBI中扮演重要角色,现将实验结果报道如下。
1 材料与方法
1.1 材料 动物:健康成年雄性SD大鼠39只,由第三军医大学大坪医院野外战外科研究所实验动物中心提供。主要试剂:甲磺酸去铁胺(DFX,诺华制药,瑞士);兔抗Actin多克隆抗体(ABCAM公司,英国);神经胶质原纤维酸性蛋白质(GFAP)抗体(Sigma,美国);瞬时受体电位通道(TRPC)6抗体(Sigma,美国);荧光二抗(中杉公司,中国);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(5X),P0015(武汉碧云天,中国);TEMED,15524010(Invitrogen,美国);琼脂糖(TAKARA,日本)。主要设备:Leica TCS NT型激光共聚焦显微镜(德国);Morris水迷宫(江苏,中国)。
1.2 方法
1.2.1 模型的建立与分组 参照Feeney法建立大鼠大脑冲击伤模型,1%戊巴比妥钠腹腔注射进行麻醉,大鼠立体定向仪固定大鼠头部,正中切口开颅,钻孔位于冠状缝后2.00 mm和矢状缝右侧2.00 mm,扩大骨窗约6.00 mm,充分暴露脑组织,并保持硬膜完整,立体定向固定打击杆,打击杆重量30.00 g,高度15.00 cm,直径4.50 mm,垂直脑表面进行打击,制备大鼠大脑冲击伤模型。将39只SD大鼠分为假手术组、致伤组、DFX组,每组13只。致伤组和DFX组,于模型制备后2.00 h分别给予生理盐水、DFX 100 mg/kg(用等量生理盐水溶解稀释)腹腔注射,间隔12 h给药1次,直至28 d实验结束。假手术组只开颅,不打击,给药方法同致伤组。
1.2.2 Morris水迷宫 于模型制备后23 d,将各组动物进行Morris水迷宫实验训练,每天2次,于28 d动物处死前,完成Morris水迷宫实验,评估实验动物的空间学习记忆力。
1.2.3 大脑缺损体积 于28 d实验结束时处死各组动物,完整保留大脑组织,采用多田公式计算大鼠大脑缺损体积。
1.2.4 TRPC6与GFAP免疫荧光双标 取额部致伤灶周围脑组织,采用二甲苯Ⅰ、Ⅱ进行石蜡切片脱蜡,梯度乙醇(下行)入水,0.01 mol/L磷酸盐缓冲液(PBS)漂洗3次,加封闭血清,0.01 mol/L PBS漂洗1次,加TRPC6抗体(1∶100),孵育1.00 h,室温,过夜,0.01 mol/L PBS漂洗3次,加荧光二抗(羊抗小鼠/FITC,1∶50),37 ℃,1.00~1.50 h,0.01 mol/L PBS漂洗3次,封闭血清30 min;加GFAP抗体(1∶100),孵育1.00 h,室温,过夜,0.01 mol/L PBS漂洗3次,加GFAP荧光二抗(兔抗羊/CY3,1∶50),37 ℃,1.00~1.50 h,0.01 mol/L PBS漂洗3次,DAPI复染胞核,0.01 mol/L PBS漂洗3次,甘油封片。对照实验:不加一抗,用健康人或兔血清代替免疫血清,其余步骤同上,结果为阴性。
1.2.5 Western blot检测 蛋白裂解液裂解细胞提取细胞内蛋白,BCA法进行蛋白质定量,用SDS-PAGE进行电泳分离,转PVDF膜。转膜完以后用去离子水泡下膜,倒掉废液加适量5%脱脂奶粉,摇2.00 h,TBST洗膜3次,每次10 min,TRPC6孵育(1∶700),4 ℃摇床过夜,转至室温摇置约30 min,以恢复室温,TBST洗膜3次,每次10 min,加辣根过氧化物酶标记二抗(1∶500),摇床摇2.00 h,TBST洗膜3次,每次10 min,用ECL显色并曝光显影,保存图片。
2 结 果
2.1 Morris水迷宫实验 完成5 d的训练后,进行Morris水迷宫实验(图1)。假手术组动物能迅速搜索到平台,需时(18.77±5.99)s,搜索策略基本都是直线式或趋向式[(3.63±0.52)分];而致伤组动物搜索到平台的时间为(110.12±47.34)s,搜索策略基本为边缘式或随机式[(2.13±0.64)分];DFX组动物搜索到平台的时间为(36.15±26.13)s,搜索策略基本为趋向式[(3.13±0.35)分]。致伤组搜索时间明显延长,搜索策略以边缘式或随机式为主,与假手术组比较,致伤组无论是平台搜索时间还是搜索策略差异均有统计学意义(P<0.01);DFX组搜索时间明显缩短,搜索策略以趋向式为主,与致伤组比较,DFX组平台搜索时间和搜索策略差异均有统计学意义(P<0.05);DFX组与假手术组比较,差异均无统计学意义(P>0.05)。

A:假手术组;B:致伤组;C:DFX组。
图1 Morris水迷宫实验轨迹图
2.2 各组大鼠大脑缺损体积比较 28 d实验结束,致伤组和DFX组可见致伤侧半球缺损体积直径较打击杆直径显著增加,致伤组伤侧仅残留少量皮层和额叶、枕叶脑组织,而DFX组大脑缺损体积明显缩小(图2)。与致伤组[(209.99±16.70)mm3]比较,DFX组[(115.35±13.70)mm3]大脑缺损体积明显减轻(P<0.05)。
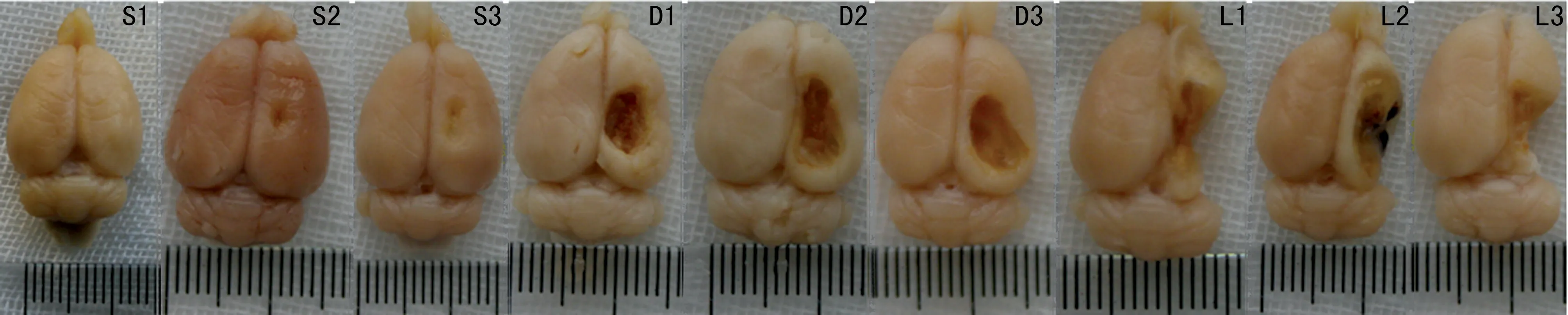
S1、S2、S3:假手术组;D1、D2、D3:DFX组;I1、I2、I3:致伤组。
图2 各组大鼠28 d实验结束时大脑大体标本
2.3 TRPC6+GFAP免疫荧光双标 检测TRPC6与GFAP共表达情况(图3),发现假手术组GFAP高表达,TRPC6低表达,TRPC6与GFAP共表达甚少,且密度低,共表达呈橙色;致伤组致伤灶周围TRPC6表达明显增强,但却偶见GFAP染色阳性的细胞,共表达也少见,但可见TRPC6表达强化的突起;DFX组可见TRPC6表达较致伤组下调,而GFAP染色阳性的细胞数量多,细胞体增大,与TRPC6共表达数量显著增加。
2.4 各组大鼠TRPC6表达水平比较 Western blot检测TRPC6表达情况(图4),发现假手术组TRPC6表达较弱,致伤组TRPC6表达显著增强,予以DFX治疗后,TRPC6表达显著下调。进一步采用Quantity One Version 4.4软件半定量分析,结果发现假手术组TRPC6表达较低(1.17±0.04);与假手术组比较,致伤组明显升高(1.50±0.09),差异有统计学意义(P<0.05);与致伤组比较,DFX组明显下降(1.16±0.04),差异有统计学意义(P<0.05)。

图3 GFAP+TRPC6免疫荧光双标

a:P<0.05,与致伤组比较。
图4 各组大鼠TRPC6表达水平比较
3 讨 论
AST是中枢神经系统最多的细胞[3],在铁转运方面扮演重要角色,而不是储存铁,然而其作用却往往被忽视。有研究发现,TBI后AST的功能状态会通过调控谷氨酸摄取和释放[4-5]、神经元能量物质的代谢[6-7]来影响神经元的存活。Lin等[8]发现,TBI后自噬和凋亡可导致AST损伤,运用白藜芦醇能抑制活性氧族累积,减少谷氨酸的毒性作用,起到保护AST的作用,进而保护神经元,改善神经功能。
课题组前期研究发现,TBI予以DFX能显著改善空间学习记忆力,但机制不清[2,9]。众所周知,中枢神经系统中AST的数量约占90%,且对铁离子等神经毒性物质的耐受性好于神经元。本课题进一步研究发现DFX组AST细胞体肥大,GFAP染色明显增强,同时TRPC6表达明显增强,予以DFX治疗能显著减少大鼠大脑缺损体积,并改善大鼠空间学习记忆力。推测其机制,予以DFX激活AST,上调TRPC6表达,摄取铁离子增加,达到神经保护的作用。
有研究发现,AST活化的特点之一就是中间丝(波形蛋白和GFAP)增加,导致细胞分裂增加和细胞肥大[10-11]。跟小胶质细胞类似,AST活化促使大量神经营养物质产生,受损细胞免于死亡[12-13],且减少谷氨酸对神经细胞的兴奋性毒性作用[14]。AST可以转运铁离子,而不是储存铁离子,有研究发现脱髓鞘大鼠表现出AST铁累积、铁蛋白和抗氧化的血红蛋白加氧酶都增加,提示AST通过铁离子相关的自身调节途径发生保护反应减少了铁离子介导的细胞毒性作用。本实验观察到DFX组AST细胞体显著增大,提示早期DFX治疗后可以引起AST活化。Pelizzoni等[1]发现,神经退行性疾病存在铁离子诱导AST活化,摄取更多铁,从而减少铁超载所致神经毒性作用,达到保护神经元的作用,与本实验结果一致,提示TBI后AST细胞肥大可能是一种神经保护作用[15],可能机制是AST活化后,TRPC6表达强化,摄取更多铁离子进入AST,减少铁超载所致神经毒性,达到神经保护作用。
综上所述,作者推测,TBI后大量铁离子早期即导致“半暗带”大量AST和神经元死亡,造成大脑缺损体积增加,动物空间学习记忆力下降,而早期予以DFX治疗有效可能是DFX螯合大量铁离子后,避免AST和神经元迅速死亡,存活下来的AST活化,通过TRPC6等将过量铁离子转运入活化AST,避免过量铁离子造成神经元损伤而起到神经保护的作用,为临床TBI救治开辟一条新思路。
[1]Pelizzoni I,Zacchetti D,Campanella A,et al.Iron uptake in quiescent and inflammation-activated astrocytes:a potentially neuroprotective control of iron burden[J].Biochim Biophys Acta,2013,1832(8):1326-1333.
[2]张礼均,胡荣,李飞,等.去铁胺对大鼠大脑打击伤的治疗作用[J].第三军医大学学报,2012,34(23):2349-2352.
[3]De Keyser J.Mostert JP.Koch MW.Dysfunctional astrocytes as key players in the pathogenesis of central nervous system disorders[J].J Neurol Sci,2008,267(1/2):3-16.
[4]Myer DJ,Gurkoff GG,Lee SM,et al.Essential protective roles of reactive astrocytes in traumatic brain injury[J].Brain,2006,129(10):2761-2772.
[5]Rosenberg PA.Accumulation of extracellu1ar glutamate and neuronal death in astrocyte-poor cultures exposed to glutamine[J].Glia,1991,4(1):91-100.
[6]Reiner DJ,Mietlicki-Baase EG,McGrath LE,et al.Astrocytes regulate GLP-1 receptor- mediated effects on energy balance[J].J Neurol,2016,36(12):3531-3540.
[7]Kiray H,Lindsay SL,Hosseinzadeh S,et al.The multifaceted role of astrocytes in regulating myelination[J].Exp Neurol,2016,283(Pt B):541-549.
[8]Lin C,Chen T,Yang L,et al.Resveratrol protects astrocytes against traumatic brain injury through inhibiting apoptotic and autophagic cell death[J].Cell Death Dis,2014,5(3):e1147.
[9]张礼均,胡荣,李飞,等.瞬时受体电位通道6在大鼠大脑冲击伤后铁代谢中的作用[J].第三军医大学学报,2012,34(23):2353-2356.
[10]Herrmann JE,Imura T,Song B,et al.STAT3 is a critical regulator of astrogliosis and scar formation after spinal cord injury[J].J Neurol,2008,28(28):7231-7243.
[11]Lee KM,Maclcan A.New advances on glial activation in health and disease[J].World J Virol,2015,4(2):42-55.
[12]Zhao Z,Alam S,Oppenheim RW,et al.Overexpression of glial cell line-derived neurotrophic factor in the CNS rescues motoneurons from programmed cell death and promotes their long-term survival following axotomy[J].Exp Neurol,2004,190(2):356-372.
[13]Matsui T,Moil T,Tateishi N,et al.Astrocytic activation and delayed infarct expansion after permanent focal iachemia in rats[J].J Cereb Blood Flow Metab,2002,22(6):711-722.
[14]Schousboe A,Sonnewald U,Civenni G,et al.Role of astrocytes in glutamate homeostasis:implications for excitotoxicity[J].Neurotox Res,2005,8(3):221-225.
[15]Pardo L,Schluter A,Valor LM,et al.Targeted activation of CREB in reactive astrocytes is neuroprotective in focal acute cortical injury[J].Glia,2016,64(5):853-874.
Effect of TRPC6 after astrocytes activation in traumatic brain injury*
ZhangLijun1,FengHua2△
(1DepartmentofNeurosurgery,ChongqingMunicipalEmergencyMedicalCenter,Chongqing400014China; 2DepartmentofNeurosurgery,SouthwestHospital,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
Objective To explore the role of astrocytes transient receptor potential channel 6(TRPC6) in rat brain injury(TBI).Methods Thirty-nine male Sprague-Dawley(SD) rats were divided into the sham operation group,injury group and deferoxamine(DFX) group(n=13).According to the previous model construction scheme established by our research group Feeney method,the rat brain impact injury model was established.The Morris water maze test was performed and the defected brain volume was measured.The immunofluorescence was adopted to detect the co-expression of TRPC6 and GFAP.Then Western blot was performed.Results The defected brain volume after TBI in the DFX group was significantly decreased compared with the injury group[(115.35±13.70)mm3vs.(209.99±16.70)mm3]](P<0.05).The Morris water maze test found that the platform search strategy and search time in the DFX group were(3.13±0.35) and(36.15±26.63)s,which were significantly improved compared with(2.13±0.64) and(110±47.34)s in the injury group(P<0.05).The immunofluorescence found that GFAP in the DFX group was highly expressed,moreover the co-expression with TRPC6 was increased.Western blot found that TRPC6 in the DFX group was significantly down-regulated(P<0.01).Conclusion In rat TBI early stage,strocytes are activated after DFX treatment and TRPC6 is highly expressed,playing a neuroprotective role.
traumatic brain injury;glial fibrillary acidic protein;transient receptor potential channels;deferoxamine
国家自然科学基金青年基金项目(30901545);重庆市自然科学基金项目(cstc2015jcyjA1051);重庆市卫计委临床重点专科项目(渝卫医函2015-517)。 作者简介:张礼均(1975-),主治医师,博士,主要从事颅脑创伤及神经外科重症监护的研究。△
,E-mail:fenghua8888@vip.163.com。
0.3969/j.issn.1671-8348.2017.18.003
R642;R651.1+5;R965
A
1671-8348(2017)18-2456-03
2017-01-12
2017-03-16)

