白腐真菌的分离及其固定化应用研究
张莉,汪志
武汉工程大学化学与环境工程学院,湖北 武汉 430205
白腐真菌的分离及其固定化应用研究
张莉,汪志
武汉工程大学化学与环境工程学院,湖北 武汉 430205
通过愈创木酚培养基和鞣酸培养基对白腐真菌所产漆酶的显色作用分离筛选出白腐真菌;采用“吸附-包埋-交联”的复合固定化方法,以改性稻壳作为吸附载体,聚乙烯醇、海藻酸钠为包埋剂,硼酸、CaCl2为交联剂,制备了白腐真菌固定化生物小球;将该生物小球应用于废水处理,分别研究了生物小球投加量、曝气量、处理时间、处理温度、pH值等因素对废水处理效果的影响.结果表明,在小球投加量为20%,曝气量为2 L/min,处理时间为8 h,处理温度为35℃,pH范围为4.5~5的实验条件下,处理后的废水化学需氧量(COD)值可由1 027 mg/L降至94.5 mg/L,COD去除率可达90.8%.
白腐真菌;分离;固定化
白腐真菌是一类能引起木质白色腐烂作用的丝状真菌的总称[1],其生物种类的多样性以及其特殊的降解机制[2],备受国内外学者关注.白腐真菌生物降解的广谱性,体现在其对生物难降解物质如农药、苯类化合物、卤化物等的降解[3-5],因此在工业废水处理中多有应用.
在实际工业应用中,离散型的白腐真菌在废水处理过程中,常出现丝状菌大量增殖引起的膨胀现象,导致运行不稳定.生物固定化技术作为现代生物过程领域的新型技术[6],可有效解决此类问题.微生物固定技术的机理主要有吸附、包埋、共价、结合作用[7],其中包埋法不仅操作简单,制作的固定化生物小球强度高,而且可防止生物外流[8],因此实际应用较为广泛.郑宇[9]、茆云汉[10]等人研究了“包埋-交联”的复合固定技术对微生物进行固定化处理,均取得了良好的处理效果.
本实验将分离筛选出的白腐真菌进行固定化处理,改进传统包埋固定的方法,采用“吸附-包埋-交联”制备出固定化微生物球,并将其应用于废水处理.实验所用废水为“萃取-生物”一体化装置[11]萃取处理后的含氯化工废水,废水中所含氯有机物经一体化装置的萃取处理,其质量浓度已降至白腐真菌耐受限度,对驯化过的白腐真菌已无毒害作用;测得废水的COD值约1 027 mg/L.
1 实验部分
1.1 仪器、试剂与材料
1.1.1 实验仪器与试剂
实验仪器:超净工作台、不锈钢手提式压力蒸汽灭菌器、生化培养箱、生物显微镜、数显恒温水浴锅、电子天平、精密pH计、微波炉等.
实验试剂:愈创木酚;鞣酸;聚乙烯醇(1799型,醇解度98.0%~99.0%);海藻酸钠(化学纯);重铬酸钾(优级纯);硫酸亚铁铵(分析纯);其余试剂均为分析纯.
实验材料:活性炭粉,购自国药集团化学试剂有限公司,研磨后过孔径为125 μm的筛;稻壳粉,购自仙桃市某粮食加工厂,研磨后过125 μm筛;改性稻壳粉,用2 mol/L硫酸浸渍8 h,过滤水洗后烘干.
1.1.2 培养基
1)PDA培养基[12]:马铃薯200 g,葡萄糖20 g,琼脂15 g,H2O 1 L,pH值6.0~7.0;
2)PDA-愈创木酚培养基:含有质量分数为0.1%愈创木酚的PDA培养基;
3)PDA-鞣酸培养基:含有质量分数为0.1%鞣酸的PDA培养基.
1.2 实验方法
1.2.1 菌种的分离、筛选
1)菌种的分离
实验选取的土壤、腐枝样品来自于武汉工程大学某落叶林,采用平板划线法接种在PDA培养基上,培养4 d~5 d后挑取白色絮状菌丝转接到新鲜相同的培养基上,反复转接直至得到纯的菌株.
2)菌种的筛选
愈创木酚和鞣酸对白腐真菌所产生的漆酶具有明显的显色作用,经过反复筛选可筛选出所需的白腐真菌[13].从PDA培养基中挑选长势优良的菌株,挑取其菌丝接种到PDA-愈创木酚培养基上,置于生化培养箱中培养4 d~6 d后,挑出显砖红色的菌株,在PDA-愈创木酚培养基上反复接种,直至出现稳定的变色现象.将筛出的菌株接种在PDA-鞣酸培养基上,挑出显紫色的菌株,在PDA-鞣酸培养基上反复转接,直至出现稳定的变色现象.
3)显微鉴别
本实验采用简单染色法对分离筛选出的菌株制片观察.取洁净载玻片一块,在其中央加一滴无菌水,用灼烧并冷却后的接种环挑取少量菌丝浸润在其中.用美蓝染液对其染色,盖上盖玻片,水洗去除多余染液,用吸水纸吸去载玻片上的水珠,自然干燥后镜检.
1.2.2 白腐真菌的固定化
1)固定化方法
将分离筛选出的白腐真菌在培养液中扩大培养,离心分离出菌体备用,采用“吸附-包埋-交联”的复合固定化法对其进行固定化.
实验中以聚乙烯醇、海藻酸钠为固定化载体,硼酸和氯化钙为交联剂,分别掺加活性炭粉、稻壳、改性稻壳作为吸附载体,制备出活性炭、稻壳和改性稻壳的固定化生物小球.
2)凝胶小球的制备
按照“质量分数为10%聚乙烯醇+质量分数为1.0%海藻酸钠+质量分数为1.0%外源掺加物”的比例制备固定化生物小球,其中外源掺加的吸附载体为活性炭粉、稻壳等.
向60 mL蒸馏水中加入聚乙烯醇6.0 g、海藻酸钠0.6 g,加热至95℃以上使其溶解,添加活性炭粉0.6 g,混匀;冷却后再投加离心分离的菌体6.0 g,混匀后备用.用滴管吸取上述胶状液体,逐滴滴入到质量分数为2%CaCl2、质量分数为3%硼酸交联溶液中,交联固化24 h;24 h后用生理盐水洗净,用COD值约400 mg/L的溶液进行活化.制备出活性炭固定化生物小球.
稻壳、改性稻壳固定化生物小球制备方法同上.
3)外源掺加吸附载体的筛选
按照上述方法制备空白固定化生物小球(仅不掺加吸附载体,其他均相同),并分别将制备的空白、活性炭、稻壳和改性稻壳四种固定化生物小球进行COD降解实验,以确定掺加的最佳吸附载体类型.
1.2.3 固定化凝胶小球应用研究确定最佳吸附载体类型后,制备该类型凝胶小球若干,将其应用于废水处理;分别研究小球投加量、时间、曝气量、温度及pH对废水处理效果的影响,以确定该固定化生物小球处理废水的最佳环境条件.
1.3 分析方法
为了检验实验效果,采用COD的去除率来表征.
COD的测定:采用快速消解滴定法[14].
2 结果与讨论
2.1 菌种的分离、筛选
2.1.1 菌种的分离经平板划线接种培养4 d后,每个培养皿约有5~7个菌落,各菌落能较清晰地分离.经过多次转接,菌落不断纯化,通过显微镜观察,菌落中再无杂菌,所分离的菌落可认为是纯的菌落.其中的两种菌种,外观形态如图1所示.

图1 菌种的分离Fig.1Separation of strains
由图1可以看出,接种到PDA培养基上的菌种,能快速生长,长出的菌丝能较快向四周伸展,从而能快速长出较大的菌落.
2.1.2 菌种的筛选将分离出的纯菌种分别接种到PDA-愈创木酚培养基中进行培养,挑出有砖红色变色现象的菌种继续接种,经过3次转接,出现了稳定的砖红色变色现象,如图2(a)所示;将PDA-愈创木酚培养基筛选出的菌种接种到PDA-鞣酸培养基上继续筛选,挑出有紫色变色现象的菌种继续转接,经过2次转接,出现了稳定的紫色变色现象,如图2(b)所示.

图2 (a)愈创木酚和(b)鞣酸复筛Fig.2Repeated screening by(a)guaiacol medium and(b)tannic acid medium
根据以上的特定显色反应,可以认为所筛选出的菌种为白腐真菌,引起变色反应的是其分泌的降解酶系的漆酶.
2.1.3 显微鉴别为进一步研究分离出的白腐真菌,对其显微观察以做进一步的鉴别.用接种环挑取少量菌丝,置于滴有水滴的载玻片上,轻轻剥离菌丝,使其松散分散;滴加美兰染液进行染色,盖上盖玻片,水洗去除多余染液,吸干水后放在显微镜下观察即可.如图3所示.
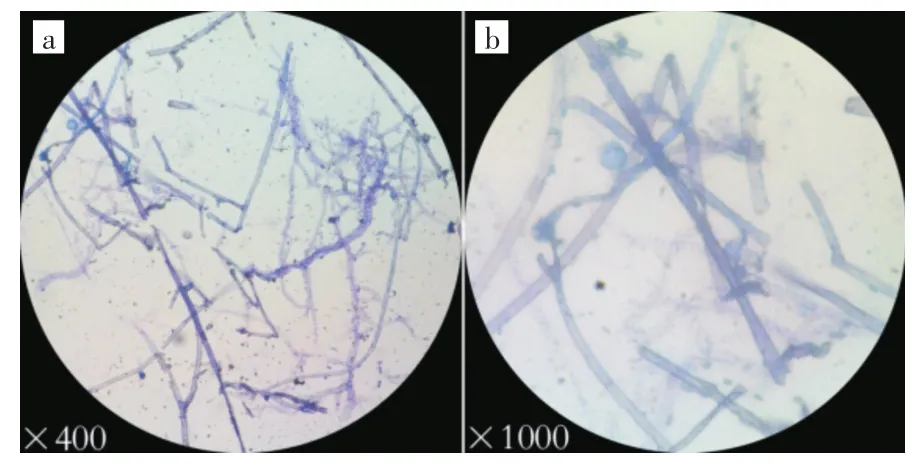
图3 白腐真菌显微放大图像Fig.3Microscopic images of white-rot fungi
图3为生物显微镜下拍摄,菌丝均用质量分数为1%的美蓝染色.图3(a)为放大400倍,图3(b)为放大1 000倍.菌丝结状分隔,纤维菌丝较多,菌丝大量分枝,无锁状联合.
2.2 白腐真菌的固定化
2.2.1 凝胶小球的制备实验中的固定化生物小球采用“吸附-包埋-交联”的复合固定化法,按“质量分数为10%聚乙烯醇+质量分数为1.0%海藻酸钠+质量分数为1.0%吸附载体”的质量比制备而成.制备出的小球呈白色、较规则的球形,颗粒饱满,大小均匀,粒径3 mm~4 mm,如图4(a)所示;制备的凝胶小球经交联24 h后,对其进行活化处理,活化后白色褪去,略显黄色,如图4(b)所示.

图4 固定化微生物小球外观效果图(a)活化前,(b)活化后Fig.4Appearance shape of immobilized microbial pellets(a)before the activation and(b)after the activation
2.2.2 掺加外源吸附载体的筛选将制备的空白、活性炭、稻壳和改性稻壳4种凝胶小球进行COD降解实验,以确定最佳外源掺加吸附载体类型.配置试验培养液,测得其COD值为986.3 mg/L;试验采用250 mL锥形瓶,加入200 mL培养液,按其体积分数20%的投加量加入凝胶小球,置于25℃恒温水浴锅中静置培养;8 h后测定各培养液剩余COD浓度.COD去除率的关系如图5所示.

图5 不同类型的固定化小球对COD去除率的影响Fig.5Effects of different types of immobilized pellets on removal rate of COD
由图5可以看出,与空白小球相比,掺加活性炭、稻壳和改性稻壳的小球对降解COD效果均有提高,以改性稻壳效果最为明显.这是因为在固定化过程中掺加吸附载体,对提高小球的结构稳定性、通透性以及生物稳定性具有明显效果.与活性炭、普通稻壳相比,在相同掺入量下,掺入改性稻壳有更好的效果.故本实验选择掺加的吸附载体为改性稻壳.
2.3 白腐真菌的固定化应用
选择改性稻壳为吸附载体后,制备出固定化生物小球,将其应用于废水处理,以确定其处理废水的最佳环境条件.
2.3.1 投加量对处理效果的影响设置固定化生物小球的投加量(按培养液的体积比)分别为2%、5%、8%、12%、15%、20%、25%、30%,在恒温25℃下静置培养8 h,测定废水COD降解情况,以判断不同投加量下的废水处理效果.实验结果投加量对处理效果的影响如图6所示.
由图6可知,投加量在2%~15%范围内时,COD去除率随投加量的增大显著提高;继续增大投加量,COD去除率仅小幅提升,继而基本保持平稳.当投加量增大到20%以后,COD去除率再难提高.基于经济成本及工业化应用等方面的考虑,继续增大固定化小球的投加量必将增加处理成本,故可确定最佳投加量为20%.

图6 投加量对处理效果的影响Fig.6Effects of dosage on treatment
2.3.2 时间对处理效果的影响设置生物小球投加量为20%,在恒温水浴25℃条件下静置培养,在培养0.25 h、0.5 h、1 h、1.5 h、2 h、3 h、4 h、6 h等时间后测定COD的去除效果,以判断不同时间下对废水处理效果的影响.实验结果见图7.

图7 时间对处理效果的影响Fig.7Effects of time on treatment
由图7可知,随着培养时间的增加,COD去除率逐渐提高,培养时间8 h为拐点,继续延长培养时间对COD的去除无明显影响,说明在8 h时微生物对COD再难降解.故最佳处理时间为8 h.
2.3.3 曝气量对处理效果的影响设置生物小球投加量为20%,培养温度为25℃,采用微型可调曝气机对其进行曝气培养,设置曝气量分别为0 L/min、1 L/min、2 L/min、4 L/min、6 L/min、8 L/min,8 h后测定COD的去除效果,以判断不同曝气量对废水处理效果的影响.实验结果如图8所示.

图8 曝气量对处理效果的影响Fig.8Effects of aeration rate on treatment
由图8可以看出,随着曝气量的增大,COD去除率逐渐提高,曝气量2 L/min为拐点,继续增大曝气量对COD的去除无明显影响,说明曝气量足够大时,曝气量不再对COD的去除造成影响.故最佳曝气量为2 L/min.
2.3.4 温度对处理效果的影响设置生物小球投加量为20%,曝气量为2 L/min,在设定的不同温度条件下进行曝气培养,8 h后测定COD的去除效果,以判断不同温度对废水处理效果的影响.实验结果如图9所示.

图9 温度对处理效果的影响Fig.9Effects of temperature on treatment
由图9可以看出,在10℃~35℃的温度范围内,废水的COD去除率随温度升高而增大;随着温度继续升高,COD去除率开始下降.故本实验固定化微生物小球处理废水最佳温度为35℃.
2.3.5 pH对处理效果的影响设置生物小球投加量为20%,曝气量为2 L/min,在设定的不同pH条件下进行曝气培养,8 h后测定COD的去除效果,以判断不同pH对废水处理效果的影响.实验结果如图10所示.
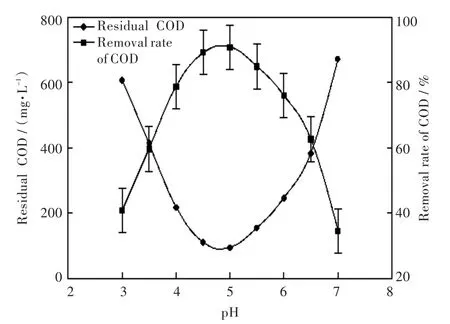
图10 pH对处理效果的影响Fig.10Effects of pH on treatment
由图10可知,pH值为4.5~5之间出现COD去除率的峰值,当pH低于4.5或高于5时,COD去除率明显降低.故本实验固定化生物小球处理废水最佳pH范围为4.5~5.
综上所述,制备的改性稻壳固定化微生物小球处理废水的最佳环境条件为:固定化微生物小球投加量为20%,处理时间为8 h,曝气量为2 L/min,处理温度为35℃,废水处理pH范围为4.5~5;最佳环境条件下废水的COD去除率可达90.8%,处理后的废水COD值由1027 mg/L降至94.5 mg/L,达到《污水综合排放标准》(GB 8978-1996)中一级排放标准[15].
3 结语
将分离筛选出的白腐真菌进行固定化处理,制备出固定化生物小球,并将其应用于废水处理,得出实验结论如下:
1)分离筛选出的菌株能与愈创木酚、鞣酸发生特征显色反应,其分泌的胞外酶属于白腐真菌的特征酶系,因此分离出的菌株是一种白腐真菌.
2)掺加吸附载体有利于白腐真菌的固定化,以改性稻壳作为外源吸附载体优于活性炭及普通稻壳.
3)在投加量为20%,曝气量为2 L/min,温度为35℃,pH范围为4.5~5,处理时间为8 h的条件下,固定化生物小球处理废水效果最佳,COD去除率可达90.8%.
后期实验工作将白腐真菌的固定化生物小球应用于“萃取-生物”一体化装置的生物部分,进一步研究其对含氯化工废水的处理,使其更加稳定化、系统化.
参考文献:
[1]谢静茹,廖戎,明株,等.白腐真菌的培养及其在染料污水脱色中的应用[J].西南民族大学学报,2016,42(1):72-75.
XIE J R,LIAO R,MING Z,et al.Culture of white rot fungus and its application in the decolorization of dye effluent[J].JournalofSouthwestUniversityfor Nationalities,2016,42(1):72-75.
[2]李慧蓉.白腐真菌的研究进展[J].环境科学进展,1996,4(6):69-77.
LI H R.White rot fungi——an ingenious army for environmental protection[J].Advances in Environmental Science,1996,4(6):69-77.
[3]李慧蓉.白腐真菌生物学与生物技术[M].北京:化学工业出版社,2005.
[4]范荣桂,董双双,王权程,等.白腐真菌生物反应器特性及其在“红水”处理中的应用研究[J].辽宁化工,2011,40(10):1070-1073.
FANRG,DONGSS,WANGQC,etal. Characteristics of white-rot fungi bioreactor and its applicationin“redwastewater”treatment[J]. Liaoning Chemical Industry,2011,40(10):1070-1073.
[5]潘忠成,赖娜,李琛,等.白腐菌在废水处理中的应用研究进展[J].化工技术与开发,2013,42(7):59-63.
PAN Z C,LAI N,LI C,et al.Research progress in wastewater treatment by white rot fungi[J].Technology &Development of Chemical Industry,2013,42(7):59-63.
[6]孙鸿,宋华,刘江红,等.微生物固定化降解含聚废水[J].环境化学,2013,32(3):419-424.
SUN H,SONG H,LIU J H,et al.Degradation of poly-containingwastewaterwithimmobilized microorganism[J].Environmental Chemistry,2013,32(3):419-424.
[7]杨玖坡,陈梅梅,张海涛,等.固定化微生物技术处理石油石化废水研究进展[J].环境工程,2013,31(5):25-29.
YANG J P,CHEN M M,ZHANG H T,et al.Research progress in treatment of petroleum and petrochemical wasterwater with immobilized microorganism technology[J].Environmental Engineering,2013,31(5):25-29.
[8]李婧,党志,郭楚玲,等.复合固定化法固定微生物去除芘[J].环境化学,2012,31(7):1036-1042.
LI J,DANG Z,GUO C L,et al.Removal of pyrene using immobilized microorganism[J].Environmental Chemistry,2012,31(7):1036-1042.
[9]郑宇,王晓琼,赵阳国,等.包埋法固定化对硫氧化微生物菌群结构和功能的影响[J].微生物学报,2016,56(9):1504-1512.
ZHENG Y,WANG X Q,ZHAO Y G,et al.Effects of immobilization on community structure and function of sulfide oxidizing microbiota[J].Acta Microbiologica Sinica,2016,56(9):1504-1512.
[10]茆云汉,王建龙.聚乙烯醇固定化微生物新方法的研究[J].环境科学学报,2013,33(2):370-376.
MAO Y H,WANG J L.Immobilization of activated sludge in PVA matrix using innovative methods[J]. ActaScientiaeCircumstantiae,2013,33(2):370-376.
[11]金焰,汪志,张莉,等.三氯甲烷废水处理中试装置的仿真软件设计[J].武汉工程大学学报,2016,38(4):410-414.
JIN Y,WANG Z,ZHANG L,et al.Exploration of simulation software design of pilot-plant of chloroform wastewater treatment[J].Journal of Wuhan Institute of Technology,2016,38(4):410-414.
[12]周群英,王士芬.环境工程微生物学[M].北京:高等教育出版社,2008.
[13]龚国利,陈志宣,陈松,等.高产漆酶白腐真菌的分离与鉴别[J].陕西科技大学学报,2012,30(6):79-83.
GONG G L,CHEN Z X,CHEN S,et al.The separationandidentificationofwhite-rotfungi producing laccase[J].Journal of Shanxi University of Science&Technology,2012,30(6):79-83.
[14]国家环境保护总局.水和废水监测分析方法[M].北京:中国环境科学出版社,2009.
[15]国家环境保护局.污水综合排放标准:GB 8978-1996[S].北京:中国环境科学出版社,1996.
本文编辑:张瑞
Separation,Immobilization and Application of White-Rot Fungi
ZHANG Li,WANG Zhi
School of Chemistry and Environmental Engineering,Wuhan Institute of Technology,Wuhan 430205,China
A kind of white-rot fungus was separated by the color reaction of its laccase on guaiacol medium and tannic acid medium.Then the white-rot fungus was made into immobilized biological pellets by adsorption,embedding and crosslinking,using modified rice husk as adsorption carrier,polyvinyl alcohols and sodium alginate as embedding medium,and boric acid and CaCl2as crosslinking medium.The effects of biological pellets'dosage,aeration rate,reaction temperature,reaction time and pH value on the treatment effect were investigated.Results indicate that the removal rate of chemical oxygen demand(COD)can reach 90.8%and the residual COD concentration reduces from 1 027 mg/L to 94.5 mg/L at the biological pellets'dosage of 20%,aeration rate of 2 L/min,reaction time of 8 h,reaction temperature of 35℃and pH values of 4.5-5.
white-rot fungi;separation;immobilization
X703.1
A
10.3969/j.issn.1674⁃2869.2017.03.001
1674-2869(2017)03-0205-06
2016-12-09
张莉,硕士,教授.E-mail:dygzhangli@163.com
张莉,汪志.白腐真菌的分离及其固定化应用研究[J].武汉工程大学学报,2017,39(3):205-210. ZHANG L,WANG Z.Separation and immobilization of white-rot fungi[J].Journal of Wuhan Institute of Technology,2017,39(3):205-210.

