哮喘患者支气管肺泡灌洗液的差异蛋白表达及分析
赵蕴伟 邹晓婷 李爽
·呼吸病研究·
哮喘患者支气管肺泡灌洗液的差异蛋白表达及分析
赵蕴伟 邹晓婷 李爽
目的 探讨支气管哮喘患者与健康人肺泡灌洗液(broncho alveolar lavage fluid,BALF)中蛋白质表达的差异性,选出目标上调蛋白。方法 选择30例支气管哮喘患者及30例健康志愿者,行支气管肺泡灌洗,将灌洗液回收后离心、留取上清液后保存,应用双向凝胶电泳技术与质谱技术对肺泡灌洗液行蛋白质表达差异性的鉴定及分析。结果 支气管哮喘组BALF的巨噬细胞移动抑制因子(macrophagemigrat ioninhibitory factor,MIF)和嗜酸性粒细胞阳离子蛋白(eosinophil cationic pro-tein,ECP)含量明显高于健康对照组(P<0.05),差异有统计学意义。结论 MIF与ECP在哮喘肺泡灌洗液中是表达上调的蛋白,对支气管哮喘的发生发展起到一定的促进作用。
支气管哮喘(bronchial asthma),多以反复发作的喘息、气促及胸闷为特点,是临床的多发病、常见病,因其发病机制及临床诊治一直是医学的重点和难点而受到广大研究者的关注。目前研究认为,哮喘跟许多炎症细胞及炎症因子有关,是一种以嗜酸性粒细胞为主的非特异性炎症性疾病,其中,有涉及到大量蛋白质的含量及种类变化,而支气管肺泡灌洗液中的蛋白成分主要来源于气道及肺泡上皮表层,在一定程度上,这些蛋白成分能反映哮喘发病的整个病理过程。本研究主要是以蛋白质组学[1]为基础,先用双向凝胶电泳技术[2]得到标本的电泳图谱,然后应用电泳图谱分析软件对其进行匹配分析,同时对差异蛋白质斑点的信息进行统计,最后用质谱技术对其进一步鉴定,选出新的生物学蛋白标志物,为哮喘发病的机制提供新的线索,为支气管哮喘的临床诊断提供新的依据,并能为哮喘获取新的治疗靶点研究提供参考依据,从而为研究及诊疗支气管哮喘带来新希望。
资料与方法
一、本次实验收集2015年9月至2016年9月我院收治的30例哮喘患者为研究对象为观察组,同时收集30例健康志愿者为对照组,两组研究对象在种族、年龄、性别等一般性资料没有显著差异。选取支气管哮喘患者的标准:根据中华医学会呼吸病学分会哮喘学组在2008年制订的支气管哮喘防治指南[3]中确诊为支气管哮喘的患者,诊断这些患者在慢性缓解期,做支气管镜检查之前,患者病情平稳,年龄在20岁到60岁。选取病例时,排除标准如下:① 在急性发作期的患者;② 凝血功能较差的患者;③ 有妊娠、恶性肿瘤及严重的心肝肾疾病的患者;④ 合并自身免疫性疾病患者。所有患者及志愿者均签署《经电子支气管镜操作知情同意书》和《实验研究知情同意书》。
本次研究所需要应用的主要试剂以及工具仪器主要有:购自Amersham Pharmaeia Bioteeh公司的三氯乙酸(TCA)、丙烯酰胺、琼脂(Agarose)、溴酚蓝,Bio-Rad公司的IPG缓冲液、TEMED、固相pH梯度预制胶条,80-1上海手术器械厂的离心机,美国的Bio-Rad laboratories凝胶成像仪,美国安发玛西亚公司的双向凝胶电泳仪,Amersham pharmcia Biotech公司的image Master TM 2D version:5.0图像分析软件,日本岛津公司的质谱仪。
二、方法
1 标本采集:所有参加实验研究者均完成了心电图、凝血功能,肝肾功能等常规检查,在禁食8小时以后,清晨给予2%利多卡因局部吸入麻醉,两小时后经电子支气管镜行肺泡灌洗,收集所有的灌洗液置冰浴,1500prm离心30min,留取上清液,用1.5mL EP管分装,标记后储存于-80℃冰箱中备用。
2 BALF中蛋白样品的提取:采用三氯乙酸(TCA)沉淀法提取蛋白样品。具体过程:分别取上述BALF样品1.5lm,加入TCA0.15g,使样品溶液的TCA终浓度为10%;充分混匀后冰浴20min,3500prm离心15min;弃除上清液,沉淀物以事先预冷的丙酮溶解,再次3500prm离心15min,将残留的TCA和丙酮去除;蛋白沉淀物风干几分钟后,加水化上样缓冲液充分溶解,使样品溶液中蛋白质浓度为0.6mg/mL;4℃下,100000g离心60min去除杂质,上清液即为实验所需的BALF蛋白样品, 置于-80℃冰箱中保存备用。
3 双向凝胶电泳及凝胶图像的分析: 此次实验研究将同组BALF样本进行等量混合,取300μL的BALF蛋白样品,先除去BALF中的高丰度蛋白,再将其充分地进行水化,将 ph 值为 3-10 的 17cm非线性胶条作为样品,进行第一向等电聚焦,等待其处于平衡之后,用硝酸银对其进行银染后,开始用双向凝胶电泳进行第二向的SDS-聚丙烯酰胺凝胶电泳[4],染色后的双向电泳凝胶用扫描仪透射扫描,将这些凝胶图像逐一进行点检测,将它们的背景进行削减与匹配,蛋白点丰度的比较在组间进行,如果测到的蛋白点丰度高于或者是低于正常值的3倍,就把这类蛋白视作是差异蛋白。
4 质谱检测与数据库检索:将以上重复性比较好、形态相对完整的差异蛋白胶点进行切取,萃取之后再用质谱仪开始质谱检测与分析,最终得到一个肽质量的指纹图谱,将强度在10个单位以上、有10个以上离子信号的谱图进行数据库检索,鉴定出相关的多肽和蛋白。
三、统计学分析
应用医学统计软件 SPSS 11.0对数据进行处理分析,实验中各种BALF蛋白质含量变化的数据资料采用百分比表示,两组数据间的样本均数的比较采用配对资料t检验,当P<0.05 时,组间数据比较具有很大的差异。
结 果
进行凝胶电泳技术和质谱技术分析后的BLAF,电泳图谱(见图1),共鉴定出相关9种差异表达的蛋白质,这些蛋白斑点相对集中,其染色深浅及大小差异性较大,其中protein2(MIF)跟protein3(ECP)是研究的目标蛋白,跟健康对照者相比,支气管哮喘患者的移动抑制因子和嗜酸性粒细胞阳离子蛋白丰度明显较高,具有较大差异,P<0.05。具体差异蛋白含量的比较(见表1)。
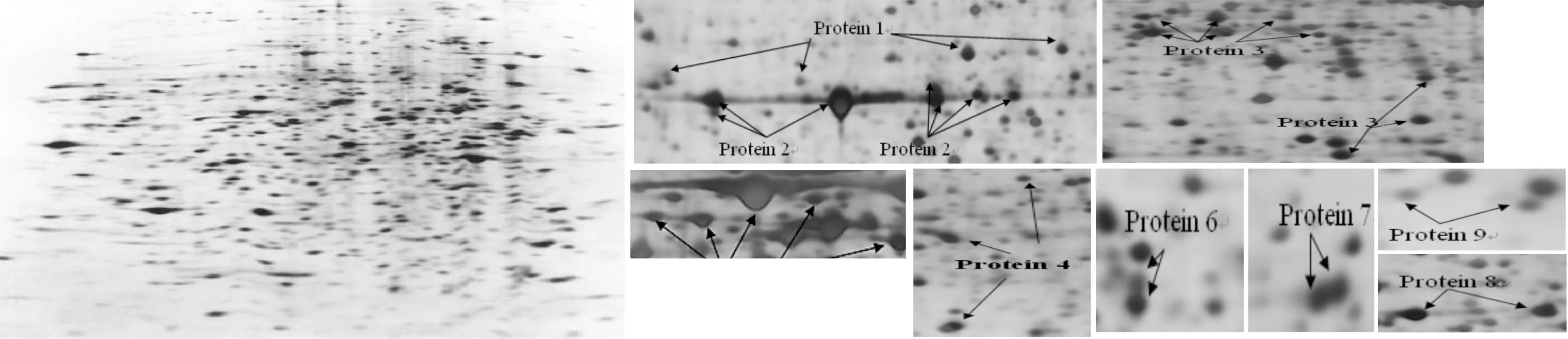
图1 聚丙烯酰胺凝胶电泳图谱

组别nBALF中MIF值(ng/mL)BALF中ECP值(ng/mL)哮喘组3010.57±4.5320.68±5.23对照组304.58±1.546.79±2.36
注:P<0.05,差异具有统计学意义。
讨 论
目前认为,哮喘的发病不仅受环境因素的影响,基因遗传因素也起到了重要作用,并且可能与多种基因遗传有关[5]。上个世纪以来,国际上将挑选哮喘候选基因一直视为重点,使得哮喘的分子遗传学研究得到广泛的关注,越来越多的临床实验得到开展。遗传信息的根本源头是基因, 而蛋白质才是生物体具体功能的执行者。研究表明,蛋白质的表达比基因序列在致病因素上更具有主导地位,跟其有关的疾病占所有疾病的98%,高出跟基因序列有关的疾病49倍。因此,在疾病的发病机制本质上,异常表达的蛋白质比基因更有揭示意义,本次实验正是在蛋白质组学的基础上,研究了哮喘患者与健康人的BALF中差异蛋白的表达,发现MIF和ECP的蛋白丰度在哮喘患者中显著升高。
哮喘是一种以多种炎症细胞及炎症因子为主的非特异性炎症性疾病[6],炎症细胞在气道内聚集,释放炎症因子,导致粘液分泌增加,血管通透性增加,支气管平滑肌收缩,引起哮喘的急性发病。MIF作为一种前炎症因子,主要来源于嗜酸性粒细胞,哮喘患者MIF的高表达,会引起嗜酸性粒细胞的产生增加,与嗜酸性粒细胞呈明显正相关关系,因此MIF作为一种细胞因子,能明显调节嗜酸性粒细胞的产生。MIF涉及到多方面的疾病,在免疫与炎症等方面都有了很多的研究,将MIF作为靶点可以为哮喘的治疗开辟新途径。Yamaguchi[7]等研究了哮喘患者与健康对照者痰液中MIF的蛋白丰度,实验结果显示在哮喘患者中,MIF的丰度明显高于健康者,且跟嗜酸性粒细胞阳离子蛋白呈正相关,该研究者还应用双重免疫荧光染色法进一步证实了在痰液嗜酸性粒细胞胞液中,MIF与嗜酸性粒细胞过氧化酶共同存在。MIF能正向调控哮喘的细胞因子及炎性介质,有学者[8]在基因敲除技术的基础上,对哮喘大鼠模型进行了相关研究,结果表明MIF基因敲除后的大鼠肺组织及肺泡灌洗液中IL-4、IL-5、IL-13等炎症因子的含量明显低于正常对照组,说明MIF有上调辅助性Th2优势性细胞因子的可能,在哮喘的发病过程中起到了促进作用。Yamaguchi等[9]对有明显喘息、气促及咳嗽等症状的哮喘患者与处于缓解期的哮喘患者进行了血清MIF的检测,结果显示,有症状哮喘患者的MIF含量明显高于无症状哮喘患者,因此说明,MIF与哮喘患者症状的发生有内在的密切联系。
ECP是一种碱性蛋白质,在嗜酸性粒细胞中合成并分泌到细胞外,能导致气道上皮的损伤及上皮细胞的脱落,抑制纤毛的异物清除作用,并释放大量炎性介质,ECP是哮喘发病过程的关键致病因子。Wever[10]等做了相关实验,研究显示嗜酸性粒细胞阳离子蛋白(ECP)水平可以作为气道炎症活动指标之一,ECP引起炎症的主要作用机制有:① 对气管上皮细胞和角质细胞有很强的毒性作用;② 诱导肥大细胞释放组胺、白三烯、前列腺素、血栓烷素A2等炎性介质,导致气道粘液分泌增多,微血管及黏膜的通透性增加,黏膜充血水肿,并使感觉神经纤维暴露,导致气道高反应性。
综上所述,巨噬细胞移动抑制因子和嗜酸性粒细胞阳离子蛋白作为嗜酸性粒细胞合成并分泌的蛋白质,都可作为嗜酸细胞活性标志物,能在支气管哮喘的发生发展过程都起到重要的促进及调节作用,因此,MIF和ECP的水平可反映哮喘气道炎症的活动情况及疾病严重程度,可以为支气管哮喘的临床诊断及获取新的治疗靶点研究提供参考依据,具有较高的临床应用价值。
[1] Park CS,Rhim T.Application of proteomics in asthma research[J].Expert Rev Proteomics, 2011,8(2):221-230.
[2] Amano T,Nishihira J,Miki I.Blockade of macrophage migration inhibitory factor (MIF) prevents the antigen-induced response in a murine model of allergic airway inflammation[J].Inflamm Res,2007,56(1): 24-31.
[3] 中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案)[J/CD].中华哮喘杂志(电子版),2008,2(1):3-13.
[4] Siroux V,Basagana X,Boudier A,et al.Identifying adult asthma phenotyoes using a clustering approach[J].Eur Respir J,2011,38(2):310-317.
[5] L?tvall J,Akdis CA,Bacharier LB,et al.Asthma endotypes:a new approachto classification of disease entities within the asthma syndrome[J].J Allergy Clin Immunol,2011,127(2):355-360.
[6] Brasier AR,Victor S,Ju H,et al.Predicting intermediate phenotypes in asthma using bronchoalveolar lavage-derived cytokines[J].Clin Transl Sci,2010,3(4):147-157.
[7] Yamaguchi E,Nishihira J,Shimizu T,et al.Macrophage migration inhibitory factor (MIF) in bronchial asthma[J].Clin Exp Allergy,2000,30(9):1244-1249.
[8] Mizue Y,Ghani S,Leng L,et al.Role for macrophage migration inhibitory factor in asthma[J].Proc Natl Acad Sci USA,2005,102(40):14410-14415.
[9] Magalhaes ES,Mourao‐Sa DS,Vieira‐de‐Abreu A,et al.Macrophage migration inhibitory factor is essential for allergic asthma but not for Th2 differentiation[J].Eur J Immunol,2007,37(4):1097-1106.
[10] Wever AM,Wever-Hess J,Hensgens H,et al.Serum eosinophil cationic protein (ECP) in chronic asthma. Relationship to spirometry, flow-volume curves, PC20, and exacerbations[J].Respir Med,1994,88(8):613-621.
10.3969/j.issn.1009-6663.2017.08.044
黑龙江省科学技术研究面上项目(教育厅、校级),基金(No JMSUJCMS2016-041) 黑龙江省卫生计生委科研课题(No 2016-299)
154007 黑龙江 佳木斯,佳木斯大学附属第一医院
李爽,E-mail:vivianlee1981@163.com
2017-02-15]

