株洲地区北京基因型结核分枝杆菌感染与利福平耐药的相关研究
谭英征 陈双华 肖鹏程 李丹 傅京力 龙云铸
株洲地区北京基因型结核分枝杆菌感染与利福平耐药的相关研究
谭英征1陈双华2肖鹏程1李丹1傅京力1龙云铸1
目的 研究北京基因型结核分枝杆菌(MTB)感染的易感因素及其与利福平耐药的相关性。 方法 收集株洲市2014年5月至2016年8月痰抗酸染色阳性肺结核患者156例痰标本,对MTB进行分离培养与菌种鉴定。培养阳性菌株行DNA提取,运用RD105缺失基因检测法鉴定北京基因型MTB、Xpert MTB/RIF检测法鉴定耐利福平MTB,分析性别、年龄、糖尿病、复治患者以及利福平耐药与北京基因型的关系。结果 156例痰标本中培养出分枝杆菌150株,其中MTB菌株142株,非MTB菌株8株。女性患者的北京基因型MTB(38/68,55.8%)的比例明显高于男性患者 (13/74,17.5%),复治患者北京基因型MTB(26/55,47.2%)比例明显高于初治患者(18/87,20.6%),糖尿病患者北京基因型MTB(32/61,52.4%)比例明显高于非糖尿病患者北京基因型MTB(19/81,23.4%),年龄≥55岁的患者北京基因型MTB(31/60,51.6%)明显高于年龄≤30岁的患者 (4/30,13.3%),差异均有统计学意义(P<0.05)。在耐利福平菌株中北京基因型MTB(40/48,83.3%)明显高于非耐利福平菌株中北京基因型MTB(11/94,11.7%),差异有统计学意义(P<0.05)。结论 女性、高龄、并发糖尿病、复治,可能是感染北京基因型MTB的危险因素。北京基因型MTB与利福平耐药有明显相关性。
分枝杆菌,结核;RD105;利福平耐药;Xpert MTB/RIF
结核病是严重危害人类健康的传染病,是全球关注的公共卫生和社会问题,是我国重点控制的重大疾病之一。中国是全球结核病第二大高负担国家[1],年新发结核病患者例数约130万[2],患病人数仅次于印度,居全球第二,给社会造成严重的负担。全世界有三分之一的结核病由北京基因型MTB引起。北京基因型菌株是一类具有相似遗传背景的结核分枝杆菌,根据不同的基因特征,可将北京基因型家族成员进一步分为许多亚型,依次区分不同的北京家族株成员。这类菌株分布广泛,在世界各地都发现有北京基因型菌株的流行,其致病性强、传播迅速以及耐药形成更容易[3-4],多次造成爆发流行。但在世界不同地区北京基因型菌株的比列差距大,在中东、西欧、拉丁美洲等地区较低,在亚洲的东亚地区较高[5]。中国是一个结核病高发病率的国家,也是北京基因型菌株高比例的地区。在我国北方,北京基因型菌株占绝对优势,可以达到70%-80%,在中国香港、中国台湾所占比例分别为70%和44.5%[6-7]。它具有高毒力特点,引起抑制和逃逸宿主免疫,易致耐药、结核复发。既往研究表明北京基因型菌株与结核耐药有密切关系,但各地区研究结果不尽相同,本研究采用RD105缺失基因检测法鉴定北京基因型MTB、Xpert MTB/RIF检测法鉴定耐利福平结核分枝杆菌,探讨株洲北京基因型MTB的流行情况、易感因素及与耐利福平结核分枝杆菌菌株的相关性。
资料与方法
一、对象
收集株洲市2014年5月至2016年8月到中南大学湘雅医学院附属株洲医院结核门诊就诊患者为研究对象。该研究经中南大学湘雅医学院附属株洲医院医学伦理委员会批准,所有参与研究者均签署知情同意书。入选患者156例,其中男82例,女74例,初治93例,复治63例,并发糖尿病61例,≤30岁33例,30-55岁54例,≥55岁69例。
1 入选标准:至少具有以下三项:① 有午后低热、咳嗽、咯血、盗汗、乏力等典型肺结核感染临床表现,症状超过2周;② 有肺结核典型影像学改变;③ 痰涂片抗酸染色阳性;④ 支气管或肺部组织病检支持结核性改变;⑤ 痰培养为结核分枝杆菌[8]。
2 排除标准:① 在外院已行菌种培养鉴定明确为耐多药结核感染者;② 标本不合格者。
二、方法
1 痰抗酸染色法:收集患者清晨痰液,依据《中国结核病防治规划实施工作指南(2008年版)》进行抗酸染色[9],抗酸染色阳性痰液送罗氏培养。
2 罗氏固体培养:痰培养采用4%氢氧化钠处理分离培养。吸取痰标本到前处理管中,加入4%氢氧化钠前处理液充分混匀,静置15min后取吸管吸取前处理液均匀接种在培养基斜面上,观察培养情况,记录生长结果[10-11]。
3 菌株DNA制备:将生长形态良好的菌体溶于500ulTE缓冲液(PH值为8.0)中,80℃、30min灭活,煮沸10min,1200r/min离心2min,取上清备用(-20℃冷冻保存)。
4 北京基因型MTB鉴定:北京家族菌株的鉴定采用RD105缺失基因检测法。上游引物序列为RD105-P1 GGAGTCGTTGAGGGTGTTCATCAGCTCAGTCCGGT,下游引物序列为RD105-P2 CGCCAAGGCCGCATAGTCACGGTCG和RD105-P3 GGTTGCCCACTGGTCGATATGGTGGACTT。扩增条件:预变性94℃ 30s,57℃ 30s,72℃ 30s,25个循环后,72℃延伸7min。在1.5%琼脂糖凝胶电泳下阅读结果,扩增产物片段为786bp,该菌株为北京基因型;若扩增产物片段为1495bp,该菌株为非北京基因型[12]。
5 Xpert MTB/RIF检测:取菌株标本与含氢氧化钠及异丙醇的处理液混合,在涡旋震荡器上震荡15-30s,室温静置15min。取混合液2mL转移至一次性多室塑料反应盒中,然后将反应盒放置到检测模块,仪器进行自动化分析[13]。
三、统计分析
采用SPSS18.0软件进行统计分析,两组间率的比较采用χ2检验分析,P<0.05为差异有统计学意义。
结 果
一、菌株培养分型结果
从158例痰标本中培养出150株阳性菌株,MTB菌株142株,非MTB菌株8株。在142株MTB菌株中,北京基因型MTB 51例,非北京基因型91例。其中男74例,女68例,初治87例,复治55例,并发糖尿病61例,≤30岁30例,30-55岁52例,≥55岁60例(见表1)。
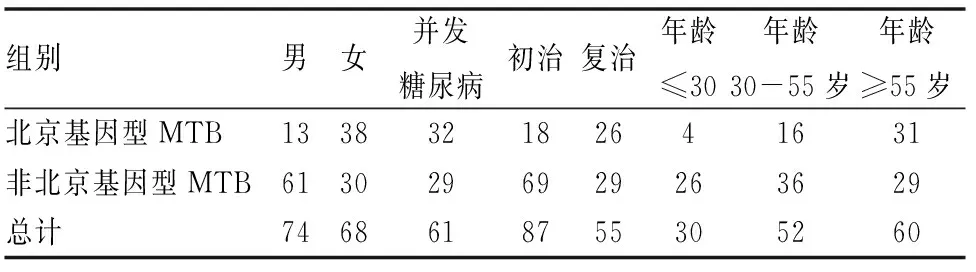
表1 142例MTB菌株分型结果(例)
二、北京基因型MTB的易感因素
女性患者的北京基因型MTB(38/68,55.8%)明显高于男性患者的北京基因型MTB(13/74,17.5%),复治患者北京基因型MTB(26/55,47.2%)明显高于初治北京基因型MTB(18/87,20.6%),糖尿病患者北京基因型MTB(32/61,52.4%)明显高于非糖尿病患者北京基因型MTB(19/81,23.4%),年龄≥55岁的患者北京基因型MTB(31/60,51.6%)明显高于年龄≤30岁的患者北京基因型MTB(4/30,13.3%),差异均有统计学意义(P<0.05)。
三、北京基因型MTB与耐利福平的关系
通过Xpert MTB/RIF检测结果发现,耐利福平菌株48例,其中北京基因型MTB40例,非北京基因型8例。耐利福平患者北京基因型MTB(40/48,83.3%)明显高于非耐利福平患者北京基因型MTB(11/94,11.7%),差异均有统计学意义,P<0.05。(见表2)。
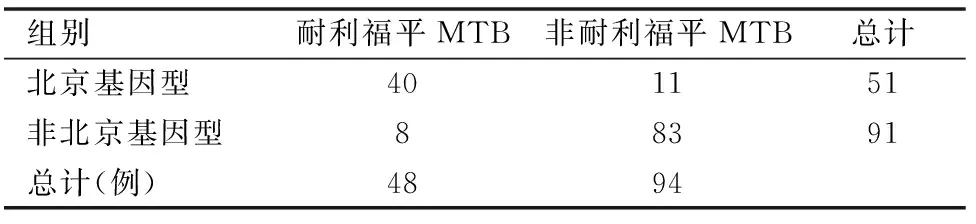
表2 142例MTB菌株Xpert MTB/RIF检测结果分析(例)
讨 论
北京基因型MTB在世界各地流行广泛,不同地域差别明显,在亚洲较为流行。它与多耐药密切相关,被怀疑是获得耐药性优势的进化谱系。一旦有一株耐多药,治疗就变得困难、复杂,且更易造成结核传染播散[14]。因此,研究北京基因型菌株的分布和传播规律,探讨其与耐药的相关性,对结核病的控制具有重要意义。
RD105缺失基因检测法是一种基于结核分枝杆菌复合群长片段序列多态性(large sequence polymorphisms,LSPs)分析对北京家族菌株进行鉴定的新方法[15-16]。该方法操作简便、快速、费用低廉,且准确可靠,为北京基因型进行鉴定的筛选方法[17]。本研究釆用RD105缺失基因检测法鉴定北京家族菌株,在142株MTB菌株中,北京基因型MTB 51例,非北京基因型61例。北京基因型MTB所占比例为35.9%,低于我国北方、香港、台湾,提示北京基因型MTB在地区发布有一定的差异性,但样本量较少,不能进行有效统计学分析。本次研究中女性患者的北京基因型MTB(38/68,55.8%)明显高于男性患者的北京基因型MTB(13/74,17.5%),复治患者北京基因型MTB(26/55,47.2%)明显高于初治北京基因型MTB(18/87,20.6%),糖尿病患者北京基因型MTB(32/61,52.4%)明显高于非糖尿病患者北京基因型MTB(19/81,23.4%),年龄≥55岁的患者北京基因型MTB(31/60,51.6%)明显高于年龄≤30岁的患者北京基因型MTB(4/30,13.3%),差异均有统计学意义(P<0.05)。提示女性、高龄、复治患者、并发糖尿病患者可能是感染北京基因型MTB的易感因素,可能为宿主免疫反应低下,不足以刺激Th1细胞及阻止细菌的大量繁殖,导致宿主易感。
Xpert MTB/RIF检测法是世界卫生组织为遏制结核病推荐的检验方法[18],是以半巢式实时定量PCR技术为基础,以rpob基因为靶基因,自动提取DNA后扩增rpob基因的81bp片段进行检测,2小时内可检测出MTB是否对利福平耐药[19-22]。由于大部分利福平耐药菌株同时对异烟肼耐药,故利福平耐药情况可以在一定程度上可作为耐多药结核病的监测指标。通过Xpert MTB/RIF检测结果发现,耐利福平菌株48例,其中北京基因型MTB 40例,非北京基因型8例。耐利福平患者北京基因型MTB(40/48,83.3%)明显高于非耐利福平患者北京基因型MTB(11/94,11.7%),差异均有统计学意义(P<0.05)。北京基因型MTB被认为是获得耐药性优势的进化谱系,与耐药相关密切,但不同国家和地区各不同。本次研究中,耐利福平患者北京基因型MTB(40/48,83.3%)明显高于非耐利福平患者北京基因型MTB(11/94,11.7%),差异均有统计学意义。而耐利福平患者大多数情况下伴随耐异烟肼,很少有单独耐利福平的报道。研究北京基因型MTB对耐药结核病传播有重要的意义,本研究提示北京基因型MTB对株洲地区耐药结核的流行有着重要的意义,可能是耐药结核病传播的优势菌群,应重视并做好流行病学追踪。本次研究运用现场流行病学和分子生物学方法分析了株洲北京基因型结核分枝杆菌菌株的流行情况和与耐利福平结核分枝杆菌菌株的相关性,为株洲耐药结核病的防治提供参考依据,并对耐药结核病人群的监测具有重要意义。但由于结核病具有潜伏感染的特点,其发病和传播具有复杂性,北京基因型MTB的耐药机理、体内感染机制、流行病学特点等问题目前仍尚不清楚,需要进一步的大样本研究。
[1] 文艳苹,刘伟,吴琍敏,等.杭州地区结核分枝杆菌氧氟沙星耐药株的MIRU-VNTR基因分型研究[J].浙江预防医学,2014,26(10):986-989,997.
[2] Yousef N,Hasan RA,Abuhammour W.Pulmonary tuberculosis outbreak in a pediatric population[J].Clin Pediatr (Phila),2013,52(7):589-592.
[3] Faksri K,Drobniewski F,Nikolayevskyy V,et al.Genetic diversity of the Mycobacterium tuberculosis Beijing family based on IS6110, SNP, LSP and VNTR profiles from Thailand[J].Infect Genet Evol,2011,11(5):1142-1149.
[4] Yang C,Luo T,Sun G,et al.Mycobacterium tuberculosis Beijing strains favor transmission but not drug resistance in China[J].Clin Infect Dis,2012,55(9):1179-1187.
[5] Centers for Disease Control and Prevention. European concerted action on new generation genetic markers and techniques for the epidemiology and control of tuberculosis.Beijing/W genotype Mycobacterium tuberculosis and drug resistance[J].Emerg Infect Dis,2006,12(5):736-743.
[6] Chan MY,Borgdorff M,Yip CW,et al.Seventy percent of the Mycobacterium tuberculosis isolates in Hung Kong represent the Beijing genotype[J].Epidemiol Infect,2001,127(1):169-171.
[7] Jou R,Chiang CY,Huang WL.Distribution of the Beijing family genotypes of Mycobacterium tuberculosis in Taiwan[J].J Clin Microbiol,2005,43(1):95-100.
[8] 葛均波,徐永健,梅长林,等.内科学[M].第8版.北京:人民卫生出版社,2013:61-65.
[9] 中华人民共和国卫生部疾病预防控制局,中华人民共和国卫生部医政司,中国疾病预防控制中心.中国结核病防治规划实施工作指南(2008年版)[M].北京:中国协和医科大学出版社,2009:15-25.
[10] 中国防痨协会基础专业委员会.结核病诊断实验室检验规程[S].北京:中国教育文化出版社,2006:49-64.
[11] 赵雁林,王黎霞,成诗明.结核分枝杆菌药物敏感性实验标准化操作程序及质量保证手册[M].北京:人民卫生出版社,2013:3-12.
[12] Tsolaki AG,Gagneux S,Pym AS,et al.Genomic deletions classify the Beijing/W strains as a distinct genetic lineage of Mycobacterium tuberculosis[J].J Clin Microbiol,2005,43(7):3185-3191.
[13] 张治国,欧喜超,孙倩,等.利福平耐药实时荧光定量核酸扩增技术检测痰标本中结核分枝杆菌及其耐药性的研究[J].中国防痨杂志,2013,35(1):13-16.
[14] Nakajima C,Tamaru A,Rahim Z,et al.Simple multiplex PCR assay for identification of Beijing family Mycobacterium tuberculosis isolates with a lineage-specific mutation in Rv0679c[J].J Clin Microbiol,2013,51(7):2025-2032.
[15] Liu M,Jiang W,Liu Y,et al.Increased genetic diversity of the Mycobacterium tuberculosis W-Beijing genotype that predominates in eastern China[J].Infect Genet Evol,2014,22:23-29.
[16] Kanji A,Hasan Z,Tanveer M,et al.Occurrence of RD149 and RD152 deletions in Mycobacterium tuberculosis strains from Pakistan[J].J Infect Dev Ctries,2011,5(2):106-113.
[17] 刘敬华,赵秀芹,刘志广,等.一种鉴定结核分枝杆菌 “北京家族” 菌株的新方法[J].中华微生物学和免疫学杂志,2008,28(2):172-175.
[18] 宋世森.利福平耐药实时荧光定量核酸扩增检测技术检测菌株和痰标本的结果分析[J].结核病与肺部健康杂志,2014,3(2):110-111.
[19] 赵冰,欧喜超,夏辉,等. Xpert Mtb/RIF检测技术在结核病诊断中的应用评价[J].中国防痨杂志,2014,36(6):462-463.
[20] Blakemore R,Story E,Helb D,et al.Evaluation of the ana1ytical performance of the Xpert Mtb/RIF assay[J].J Clin Microbiol,2010,48(7):2495-2501.
[21] Helb D,Jones M,Story E,et al.Rapid detection of Mycobacterium tuberculosis and rifampin resistance by use of on_demand,near patient technology[J].J Clin Microbiol,2010,48(1):229-237.
[22] Boehme CC,Nabeta P,Hillemann D,et al.Rapid molecular detection of tuberculosis and rifampin resistance[J].N Engl J Med,2010,363(11):1005-1015.
Correlative research between Beijing genotypes MTB infection in Zhuzhou and rifampin resistance
TAN Ying-zheng, CHEN Shuang-hua, XIAO Peng-cheng, LI Dan, FU Jing-li, LONG Yun-zhu
Department of Infections Diseases, Zhuzhou Affiliated Hospital of Xiangya Medical College of Central South University, Zhuzhou, Hunan 412007, China
Objective To explore the correlation between Beijing genotypes MTB infection in Zhuzhou and rifampin resistance. Methods 156 sputum specimens of tuberculosis with positive sputum anti-acid stain were collected from May 2014 to August 2016 in Zhuzhou, and they were given isolated culture and strain identification. The positive strains were given DNA extract, and Beijing genotypes MTB was identified by RD105 missing genetic test and rifampin resistance of MTB by Xpert MTB/test so as to analyze the association of Beijing genotypes with gender, age, diabetes, retreatment patients and rifampin resistance. Results 150 mycobacterium were cultivated among 156 sputum specimens, wherein there were 142 MTB strains and 8 non-MTB strains. The proportion of Beijing genotypes MTB of female patients (38/68, 55.8%) was apparently higher than that of male patients (13/74, 17.5%), and the proportion of Beijing genotypes MTB of retreated patients (26/55, 47.2%) was apparently higher than that of untreated patients (18/87, 20.6%), and the proportion of Beijing genotypes MTB of diabetes patients (32/61, 52.4%) was apparently higher than that of non-diabetes patients (19/81, 23.4%), and the proportion of Beijing genotypes MTB of patients over 55 years old (31/60, 51.6%) was apparently higher than that of patients below 30 (4/30, 13.3%) (P<0.05). Beijing genotypes MTB in rifampin-resistance strains (40/48, 83.3%) was obviously higher than that in non-rifampin resistance strains (11/94, 11.7%) (P<0.05). Conclusion Female, advanced age, diabetes and retreatment might be the risk factors of Beijing genotypes MTB infection. Beijing genotypes MTB is obviously associated with rifampin resistance.
Mycobacterium; tuberculosis; Rd105; rifampin resistance; Xpert MTB/RIF
10.3969/j.issn.1009-6663.2017.08.040
1. 412007 湖南 株洲,中南大学湘雅医学院附属株洲医院,感染内科 2. 412012 湖南 株洲,湖南中医药高等专科学校
龙云铸,E-mail:346370009@qq.com
2016-11-24]

