TRALI大鼠肺泡活化巨噬细胞及共刺激分子CD40、ICAM-1的表达变化分析
饶群 朱宇芳 黄华
TRALI大鼠肺泡活化巨噬细胞及共刺激分子CD40、ICAM-1的表达变化分析
饶群1朱宇芳1黄华2
目的 探讨输血相关急性肺损伤(TRALI)大鼠肺泡活化巨噬细胞及共刺激分子CD40、血浆及肺组织中细胞间粘附分子-1(ICAM-1)的表达变化及其意义。方法 选取60只SPF级、6-7周龄的雄性SD大鼠,采用随机数字表法分为假手术组(腹腔注射等量生理盐水)、对照组(腹腔注射2mg/kg脂多糖)、模型组(静脉输注脂多糖5mg/kg)和TRALI组(腹腔注射2mg/kg脂多糖+静脉输注血浆1mL/只)各15只,采用RT-PCR技术检测活化巨噬细胞中Toll样受体4(TLR4)mRNA的表达,采用Northern bolt 检测CD40 mRNA的表达,采用免疫组化染色检测ICAM-1蛋白的表达,采用酶联免疫吸附法(ELISA)检测血清中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-β)、ICAM-1的水平。结果 模型组和TRALI组的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA、ICAM-1蛋白表达水平显著高于假手术组和对照组(P<0.05),TRALI组的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA、ICAM-1蛋白表达水平显著的低于模型组(P<0.05);模型组和TRALI组的血清中TNF-ɑ、IL-β、ICAM-1的水平显著的高于假手术组和对照组(P<0.05),TRALI组的血清中TNF-ɑ、IL-β、ICAM-1的水平显著的低于模型组(P<0.05)。结论 TRALI大鼠肺TLR4 mRNA、CD40 mRNA、ICAM-1蛋白高表达,这可能与促进炎症因子释放,引起肺损伤有关。
输血相关急性肺损伤;巨噬细胞;细胞间粘附分子-1
输血相关性急性肺损伤(transfusion-related acute lung injury,TRALI)主要是指输入血液或血液制品后6 h内出现的以急性非心源性肺水肿和低氧血症为主要表现的临床综合征,其起病急、发展快,若救治不及时,则会导致患者死亡。[1-2]。TRALI的发病机制尚不完全清楚,多认为与炎症反应和细胞损伤有关,而巨噬细胞及共刺激分子CD40、血浆及肺组织中细胞间粘附分子-1(ICAM-1)在这一过程中发挥着重要作用[3-4]。为了进一步探讨TRALI大鼠肺泡活化巨噬细胞及共刺激分子CD40、血浆及肺组织中细胞间粘附分子-1(ICAM-1)的表达变化及其意义,本研究选取了60只雄性SD大鼠,并随机分为假手术组(腹腔注射等量生理盐水)、对照组(腹腔注射2mg/kg脂多糖)、模型组(静脉输注脂多糖5mg/kg)和TRALI组(腹腔注射2mg/kg脂多糖+静脉输注血浆1mL/只),检测了各组大鼠肺组织细胞TLR4 mRNA、 CD40 mRNA、ICAM-1蛋白以及血清中TNF-ɑ、IL-β、ICAM-1的水平,为临床上提供了一定的理论依据。
资料与方法
一、实验动物
选取60值SPF级、6-7周龄的雄性SD大鼠,体质量220±10g;购买自上海邦耀生物科技有限公司,动物许可证号:SCXK(沪)2015-0122。
二、实验仪器与药品
脂多糖、氯胺酮、PBS均购自美国Sigma公司,Trizol试剂盒、逆转录试剂盒以及RT-PCR检测试剂盒均购自美国Promeg公司, TNF-ɑ、IL-β、ICAM-A检测试剂盒购自北京中杉金桥生物公司。7900型荧光定量PCR仪为美国应用生物系统公司生产,880型酶标仪为德国拜发仪器公司生产,光学显微镜为日本奥林巴斯公司生产。
三、分组与建模
本研究参照Susannah等的建模方法进行建模[5],具体方法如下:将60只SD大鼠随机分作假手术组、对照组、模型组和TRALI组,其中TRALI组大鼠经腹腔注射2mg/kg脂多糖,注射2h后腹腔注射80mg/kg氯胺酮进行麻醉,分离大鼠股血管后进行插管,注入含50%肝素的生理盐水,10 min内移除约1mL血液,然后再输注等体积的血浆。对照组仅腹腔注射2mg/kg脂多糖,模型组仅静脉输注脂多糖5mg/kg,而假手术组仅腹腔注射等量生理盐水。血浆的制作方法参照Susannah等[5]的方法,即无菌条件下采集大鼠全血,以3000r/min离心10min后进行分离血浆,-80℃条件下进行储存。
四、标本采集及检测方法
1 标本采集:造模6h后将大鼠麻醉,摘取眼球后采集外周血约3mL,以3000r/min离心10min后收集上清液备用。将大鼠处死后用PBS灌洗双肺6次,收BALF约2.5mL/只,以2000 r/min离心10 min,弃去上清液,沉淀细胞备用。剪取大鼠右肺并作两份,一份以10%的中性甲醛溶液固定,另一份置于液氮中备用。
2 巨噬细胞中TLR4 mRNA的检测方法:将沉淀细胞以PBS洗涤2次后以1 000 r/min离心10 min,取下层细胞加入含2 mmol/L谷胺酰氨、10%胎牛血清、100 U/L青霉素、100 U/L链霉素的RPMI 1640培养液在37℃、5%CO2条件下培养2h,用含10%胎牛血清的RPMI 1640培养液重悬细胞。利用Trizol试剂盒提取细胞总mRNA,加入逆转录试剂盒逆转为为cDNA,利用RT-PCR试剂盒和荧光定量PCR仪检测巨噬细胞中TLR4 mRNA表达水平,具体检测步骤严格按照试剂盒说明书进行。
3 肺组织中CD40 mRNA的检测方法:采用Trizol试剂盒提取各组肺组织的mRNA,每孔加入约20ug提取mRNA,甲醛凝胶电泳完毕后转移至尼龙膜上,将膜置于杂交袋中以样品mRNA与探针在42℃杂交过夜。杂交完毕后压片,放射显影并测量条带的灰度值,以GAPDH作为内参照,两者灰度的比值即为表达水平。
4 肺组织中ICAM-1蛋白表达的检测方法:将肺组织作连续切片,采用免疫组化染色试剂盒进行染色,以山羊抗 Ps 多克隆抗体和兔抗 ICAM-1为一抗,以辣根酶标记山羊抗兔 Ig G为二抗,DAB显色后光镜下观察ICAM-1蛋白的表达。
5 血清中炎症因子的检测方法:采用酶联免疫吸附法测定血清中TNF-ɑ、IL-β、ICAM-1水平,具体检测步骤严格按照试剂盒说明书进行。
五、HE染色
将10%的中性甲醛溶液固定的肺组织作连续切片,厚度约4-6 um,常规石蜡包埋后苏木精-伊红(HE)染色封片,光学显微镜下观察肺病理组织学变化。
六、统计学方法
结 果
一、各组大鼠的肺组织HE染色
A为假手术组的肺泡组织结构清晰,肺泡壁薄、结构清楚,肺泡腔内无渗出液及细胞;B为对照组的肺泡壁略有增厚,肺泡结构基本完整,可见部分炎性细胞浸润;C为模型组可见肺泡组织结构严重过受损,破坏严重,肺泡腔及肺泡壁组织间充满炎性细胞,水肿明显;D为TRALI组,肺泡组织结构损坏程度低于模型组,说明腹腔注射脂多糖、静脉输注血浆较单纯腹腔注射脂多糖会进一步加重大鼠肺损伤,但较静脉注射脂多糖的损伤程度轻。(见图1)。

图1 A为假手术组、B为对照组、C为模型组、D为TRALI组(HE×400)
二、各组大鼠的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA表达
模型组组和TRALI组的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA表达水平显著的高于假手术组和对照组(P<0.05),TRALI组的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA表达水平显著的低于模型组,P<0.05;(见表1)。
三、各组大鼠肺组织中ICAM-1蛋白表达
模型组组和TRALI组的肺组织中ICAM-1蛋白表达水平显著的高于假手术组和对照组(P<0.05),TRALI组的肺组织中ICAM-1蛋白水平显著的低于模型组,P<0.05;(见表2)。
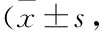
表1 TLR4 mRNA、CD40 mRNA表达比较相对表达量)
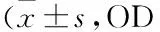
表2 各组大鼠肺组织中ICAM-1蛋白表达值)
四、各组大鼠血清中炎症因子水平变化
模型组组和TRALI组的血清中TNF-ɑ、IL-β、ICAM-1的水平显著的高于假手术组和对照组(P<0.05),TRALI组的血清中TNF-ɑ、IL-β、ICAM-1的水平显著的低于模型组,P<0.05;(见表3)。

表3 各组大鼠血清中炎症因子水平变化
讨 论
TRALI是一种常见的急性肺损伤类型,也是目前导致患者输血后死亡的主要原因,其临床症状与急性呼吸窘迫综合征(ARDS)相似,且起病急、发展快,患者的病死率非常高[5-6]。目前针对TRALI病理过程最为合理的学说为"二次打击假说",主要是指患者输血前已经存在炎症反应激活等病理状态,大量炎性细胞在肺内募集造成一次打击;而输血会激活肺内大量募集的炎性细胞,造成肺泡上皮以及毛细血管损伤形成第二次打击[7-8]。因此,本研究参照“二次打击假说”将雄性大鼠制作TRALI模型,TRALI组大鼠先腹腔注射脂多糖为第一次打击,输注存储后的血浆为第二次打击,进而诱导肺损伤;而对照组仅腹腔注射2mg/kg脂多糖,模型组仅静脉输注脂多糖5mg/kg,假手术组仅腹腔注射等量生理盐水。结果表明,TRALI组和模型组大鼠可见肺泡组织结构严重过受损,破坏严重,肺泡腔及肺泡壁组织间充满炎性细胞,水肿明显,提示肺损伤较为明显,造模成功;而假手术组的肺泡组织结构清晰,肺泡壁薄、结构清楚,肺泡腔内无渗出液及细胞;对照组的肺泡壁略有增厚,肺泡结构基本完整。
一、各组大鼠的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA表达比较
TRALI的具体发病机制目前尚不完全清楚,多认为与巨噬细胞的激活有关。巨噬细胞广泛分布在肺泡腔内,具有调节肺部炎症反应的作用,其在受到打击后会大量激活,进而促进炎症反应和氧化应激反应的发生和发展,造成肺泡上皮细胞损伤[9-10]。Toll样受体4(Toll like receptors 4,TLR4)是巨噬细胞表面重要的模式识别受体,而LPS能够通过TLR4激活NF-kB,进而促进多种炎症介质的表达[11]。研究表明[12],NF-kB能促进共刺激分子CD40的表达,并与其配体CD40L结合,进而增加蛋白酶分子和炎症介质的表达;而巨噬细胞表面TLR4和CD40过表达是也被认为是TRALI发病的重要因素。本研究通过对各组大鼠活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA表达水平检测分析发现,模型组和TRALI组的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA表达水平显著的高于假手术组和对照组,提示TRALI大鼠的活化巨噬细胞中TLR4 mRNA和肺组织中CD40 mRNA均高表达;而TRALI组的活化巨噬细胞中TLR4 mRNA、肺组织中CD40 mRNA表达水平显著的低于模型组(P<0.05),提示脂多糖可上调活化巨噬细胞中TLR4 mRNA和肺组织中CD40 mRNA 的表达,继而导致TRALI的发生,但静脉注射脂多糖较腹腔注射脂多糖和静脉输注血浆的效果更为明显。
二、各组大鼠肺组织中ICAM-1蛋白表达比较
ICAM-1是一种蛋白质,主要表达于内皮细胞表面,其也是白细胞CDll/CDl8系统的配体,可介导PMN的活化及血管壁的紧密黏附,进而在炎症反应的发生和发展过程中发挥着重要作用[13]。研究表明[14-15],ICAM-1在正常情况下基本不表达或低水平表达,而当其表达升高时可与PMN表面的整合素相互作用,促进PMN黏附于内皮细胞并移至炎性区域,引起过度炎症反应。本研究通过对各组大鼠肺组织中ICAM-1蛋白表达进行检测发现,模型组和TRALI组的肺组织中ICAM-1蛋白表达水平显著高于假手术组和对照组,提示TRALI大鼠肺组织中ICAM-1蛋白高表达;而TRALI组的肺组织中ICAM-1蛋白水平显著的低于模型组,提示脂多糖可上调大鼠肺组织中ICAM-1蛋白的表达,继而导致TRALI的发生,但静脉注射脂多糖较腹腔注射脂多糖和静脉输注血浆的效果更为明显。
三、各组大鼠血清中炎症因子水平变化
本研究同时发现,模型组组和TRALI组的血清中TNF-ɑ、IL-β、ICAM-1的水平显著的高于假手术组和对照组(P<0.05),TRALI组的血清中TNF-ɑ、IL-β、ICAM-1的水平显著的低于模型组,提示TNF-ɑ、IL-β等炎症因子的表达与TRALI的发生和发展也有密切的关系,其原因可能是TLR、 CD40以及ICAM-1的表达能激活炎症反应,进而促进各种炎症因子的分泌。但本研究限于研究样本的不足,对于TRALI发病的具体机制仍需作进一步的深入研究。
综上所述,TRALI大鼠肺TLR4 mRNA、CD40 mRNA、ICAM-1蛋白高表达,这可能与促进炎症因子释放,引起肺损伤有关。
[1] Goldman M,Webert KE,Arnold DM,et al.Proceedings of a consensus conference: towards an understanding of TRALI [J].Transfus Med Rev,2005,19(1):2-31.
[2] Toy P, Bacchetti P, Grimes B, et al. Recipient clinical risk factors predominate in possible transfusion-related acute lung injury[J]. Transfusion, 2015, 55(5):947-952.
[3] 魏明, 涂玲, 刘佳,等. 输血相关急性肺损伤对SD大鼠巨噬细胞活化和共刺激分子CD40表达的影响[J]. 中华急诊医学杂志, 2015, 24(8):845-850.
[4] 蔡光秀. 大鼠输血相关性急性肺损伤后活化巨噬细胞表面TLR4及CD40的表达情况[J]. 海南医学院学报, 2016, 22(6):521-523,527.
[5] Nicholson SE, Johnson RA, Craig T,et al.Transfusion—related acutelung injury in a rat model of trauma—hemorrhage[J].J Trauma,2011,70(2):466-471.
[6] Warkentin TE,Greinacher A,Bux J.The transfusion-related acute lung injury controversy: lessons from heparin-induced thrombocytopenia[J]. Transfusion, 2015, 55(5):1128-1134.
[7] Mckenzie CG,Kim M,Singh TK,et al.Peripheral blood monocyte-derived chemokine blockade prevents murine transfusion-related acute lung injury (TRALI)[J]. Blood,2014,123(22):3496-3503.
[8] 钟周琳,周燕,李丽兰,等.输血相关急性肺损伤及其预防与控制策略的研究进展[J].国际输血及血液学杂志,2016,39(1):81-84.
[9] 叶苑,李丽玮,李志强.雷帕霉素干预TRALI大鼠肺组织mTOR信号通路下游蛋白p70s6k/p-p70s6k表达与肺病理变化研究[J].中国输血杂志,2016, 29(3):251-254.
[10] 卓孝福.输血相关急性肺损伤的发病机制[J].中国输血杂志, 2014, 27(10):1075-1079.
[11] 王同显,马保凤.固有免疫在输血相关急性肺损伤发病机理中的作用[J].中国输血杂志,2014,27(5):546-549.
[12] 蔡炳冈,朱进,汪茂荣.Toll样受体4信号通路研究进展[J].医学研究生学报, 2015,23(11):1228-1232.
[14] 江龙,林时辉,高峰,等.黄芪多糖对脂多糖诱导的急性肺损伤大鼠的保护作用及肿瘤坏死因子-α、细胞间黏附分子-1、白细胞介素-6表达的影响[J].中国生物制品学杂志, 2014, 27(11):1416-1420.
[15] 林立,王丽,金尾静,等.支原体肺炎伴喘息患儿血清细胞间黏附分子-1与白细胞介素-17A的表达[J].中华医院感染学杂志, 2015,25(7):1472-1474.
[16] 王会中,王贻霞,王关嵩,等.细胞间黏附分子-1对肺癌进程和预后的影响[J/CD].中华肺部疾病杂志(电子版),2015, 8(1):77-80.
Expression changes of TRALI and CD40 in rat alveolar activated macrophages and co-stimulatory molecules ICAM-1
RAO Qun, ZHU Yu-fang, HUANG Hua.
Department of Clinical Laboratory, Xiangyang Central Hospital, Xiangyang, Hubei 441021, China
Objective To investigate the expression and significance of ICAM-1 in CD40, plasma and lung tissue of rat alveolar activated macrophages and co-stimulatory molecules TRALI. Methods The value of 60 SPF, 6 to 7 week old male SD rats were randomly divided into the sham operation group (intraperitoneal injection of normal saline), the control group (intraperitoneal injection of lipopolysaccharide 2mg/kg), the model group (intravenous infusion of lipopolysaccharide 5mg/kg) and the TRALI group (intraperitoneal injection of 2mg/kg lipopolysaccharide+intravenous infusion of plasma 1ml/only), 15 rats in every group. The expression of TLR4 mRNA in macrophage activation was detected by RT-PCR technology, CD40 mRNA expression by Northern bolt, ICAM-1 protein by immunohistochemical staining, and the serum TNF-ɑ,IL-β and ICAM-1 levels by ELISA. Results The activation of lung tissue macrophages in TLR4 mRNA, CD40 mRNA, ICAM-1 protein expression level was significantly higher in the model group and the TRALI group than in the sham operation group and the control group (P<0.05). The expression levels of CD40 mRNA and ICAM-1 protein in lung tissue and TLR4 mRNA in the TRALI group were significantly lower than those in the model group (P<0.05). The levels of TNF-α, ICAM-1 and IL-β level were significantly higher in the model group and the TRALI group than in the sham group and the control group (P<0.05). The levels of TNF-α, ICAM-1 and IL-β level in serum were significantly lower in the TRALI group than in the model group (P<0.05). Conclusion High expression of TLR4 mRNA, CD40 mRNA and ICAM-1 protein in the lung of TRALI rats may be related with the promotion of the release of inflammatory factors and cause lung injury.
blood transfusion related acute lung injury; macrophages; intercellular adhesion molecule-1
10.3969/j.issn.1009-6663.2017.08.014
1. 441021 湖北 襄阳,襄阳市中心医院检验科 2. 441003 湖北 襄阳,解放军477医院医务科
朱宇芳,E-mail:hanyuchenqiao@126.com
2016-12-14]

