间歇低氧大鼠脂肪因子chemerin的表达与糖脂代谢关系研究
赵宏 汪小亚 张秀丽 李娟芝 刘佳银 余勤
·论 著·
间歇低氧大鼠脂肪因子chemerin的表达与糖脂代谢关系研究
赵宏1汪小亚2张秀丽1李娟芝1刘佳银1余勤2
目的 通过检测间歇低氧大鼠血清chemerin的表达水平,探讨脂肪因子chemerin在OSAHS相关糖脂代谢紊乱中的作用。方法 选取健康雄性Wistar大鼠24只随机分4组:常氧+普通饮食组(NC+ND组)、常氧+高脂饮食组(NC+HFD组)、间歇低氧+普通饮食组(IH+ND组)、间歇低氧+高脂饮食组(IH+HFD组)。ND组给予基础饲料喂养,HFD组予以高脂饲料喂养。IH组暴露于8h/d的间歇低氧环境中,同时NC组给予间歇压缩空气。检测大鼠血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)、空腹胰岛素(FINS)水平,用稳态模型胰岛素抵抗指数(IRI)及胰岛素敏感指数(ISI)系统评价胰岛素抵抗,ELISA法检测大鼠血清chemerin的表达。结果 与NC+ND组比较,IH+ND组大鼠FPG、FINS、IRI、TC、TG、LDL-C升高有统计学意义(P<0.01);IH+HFD组大鼠血清FPG、TC、LDL-C水平高于IH+ND组,血清FINS、IRI水平高于NC+HFD组,差异均有统计学意义(P<0.05)。与NC+ND组比较,IH+ND组大鼠血清chemerin水平升高有统计学意义(P<0.01);IH+HFD组大鼠血清chemerin水平高于IH+ND组和NC+HFD组,差异均有统计学意义(P<0.01)。Pearson分析显示:IH组大鼠血清chemerin与FPG(r=0.751,P<0.01)、FINS(r=0.764,P<0.01)、IRI(r=0.765,P<0.01)、TC(r=0.791,P<0.01)、LDL-C(r=0.818,P<0.01)呈正相关,与ISI(r=-0.692,P<0.01)呈负相关。结论 间歇低氧大鼠存在血糖、血脂代谢紊乱,且间歇低氧合并高脂饮食时,大鼠糖脂代谢紊乱更为严重;间歇低氧大鼠血清chemerin水平有升高趋势,合并高脂饮食时这种趋势更为显著;血清chemerin水平变化与糖脂代谢紊乱相关,脂肪因子chemerin可作为OSAHS相关糖脂代谢紊乱的预测因子之一。
睡眠呼吸暂停;间歇低氧;Chemerin;胰岛素抵抗;糖脂代谢
阻塞性睡眠呼吸暂停低通气综合症(obstructive sleep apnea hypopnea syndrome,OSAHS)以间歇低氧(intermittent hypoxia,IH)为主要特点,是一种可累及全身多系统损害的睡眠呼吸障碍性疾病,可引起糖脂代谢异常。Chemerin作为一种新发现的脂肪因子[1],可通过促进脂肪分解、促进脂肪细胞分化、影响胰岛素敏感性、参与胰岛素抵抗等来调节糖脂代谢平衡。目前鲜有报道OSAHS相关糖脂代谢紊乱与脂肪因子chemerin的关系,本实验通过建立模拟人OSAHS的慢性间歇低氧动物模型,来探讨脂肪因子chemerin在间歇低氧相关糖脂代谢紊乱中的作用,为OSAHS相关代谢综合征发病的研究提供新的思路。
资料与方法
一、材料
1 实验动物:24只健康雄性Wistar大鼠,平均体重233.528±20.927g,鼠龄8周,由兰州大学实验动物中心提供,基础饲料及动物垫料由兰州大学实验动物中心提供,实验前于安静环境、自然光照、温度20℃-26℃、日温差≤4℃、湿度40%-60%条件下适应性喂养1周。
2.主要试剂:葡萄糖检测试剂盒(上海荣盛生物技术有限公司),胰岛素检测试剂盒(天津九鼎医学生物工程有限公司),大鼠chemerin ELISA检测试剂盒(武汉优尔生商贸有限公司)。
3.主要仪器设备:参照文献[2-3]设计间歇低氧大鼠模型,该模型由硬件设备与控制设备组成。硬件设备:IH环境模拟舱、动物饲养舱、电磁式空气压缩机、氧气钢瓶、氮气钢瓶、气体输送管道;控制设备:气体减压阀、电磁阀、气体流量控制计、数显时间继电器。间歇低氧组程序设定为每一循环周期120s,即40s低氧期和80s复氧期,每小时循环30次。首先为40s的低氧期,前30s向模拟舱内输入纯氮气,使模拟舱内氧浓度由21%逐渐降至6%-7%,后10s为静息期,无气体输入,维持舱内氧浓度稳定于6%-7%,形成低氧暴露;低氧期结束后进入80s复氧期,向模拟舱内输入纯氧气20s,待舱内氧浓度逐渐升高至21%,持续输入60s压缩空气,使舱内氧浓度维持在21%左右,形成常氧环境,如此循环。常氧组程序设定为向动物饲养舱内间歇输入正常空气,输入时间及流量同间歇低氧组。各舱内氧浓度由CY-12C测氧仪实时监控。医用氧气、高纯度氮气由甘肃省兰州方圆建化有限责任公司提供,CY-12C测氧仪由浙江省建德市梅城电化学分析仪器厂提供。
二、方法
1 动物分组及模型建立:24只健康雄性Wistar大鼠,按随机数字表法分4组:常氧+普通饮食组(NC+ND)、常氧+高脂饮食组(NC+HFD)、间歇低氧+普通饮食组(IH+ND)、间歇低氧+高脂饮食组(IH+HFD),每组6只。普通饮食组给予基础饲料喂养,高脂饮食组予以高脂饲料(猪油10%、胆固醇2%、蛋黄粉5%、丙基硫氧嘧啶0.2%、蔗糖10%、基础饲料72.8%)喂养,高脂饲料由北京博泰宏达公司提供。大鼠分笼饲养,自由饮食,每日9时至17时将IH组置于模拟舱内,NC组置于饲养舱内,暴露期间自然光照、自由饮水,建模时间6周,此过程中无实验动物死亡。本实验设计符合兰州大学第一医院动物实验伦理学标准。
2 标本采集:实验6周末将空腹12h的大鼠常规称重,腹腔注射10%水合氯醛麻醉后,固定于实验台上,沿腹部正中线切口依次打开腹腔各层组织,暴露腹主动脉,真空采血管采血后高速离心机(湘仪,中国湖南)在4℃下3000r/min离心15min,收集上清液分装,分别保存于4℃与-20℃冰箱用于血脂、血糖和胰岛素检测。取血样置于高速离心机(湘仪,中国湖南,参数:离心力=1000g/分钟,时间=5分钟,温度=4℃)离心,分离血样的上层清液并储存于-20℃行血清chemerin检测。
3 血脂、空腹血糖及空腹胰岛素检测:取血清样品送兰州大学第一医院检验科,使用全自动生化分析仪检测甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C),取血清样品送内分泌研究中心,葡萄糖氧化酶法检测空腹血糖(FPG)及放射免疫分析法检测空腹胰岛素(FINS)水平,计算IRI与ISI评价胰岛素抵抗及敏感性程度。
4 ELISA法测定血清chemerin表达:取血清样品,根据制造商说明书采用酶联免疫吸附法检测大鼠血清chemerin浓度。使用标准chemerin的稀释液(15.6pg/mL-1000pg/mL)绘制标准曲线。
三、统计学处理
结 果
一、各组大鼠糖脂代谢指标水平比较
IH+ND组大鼠FPG、FINS、IRI、TC、TG、LDL-C水平均高于NC+ND组,差异有统计学意义(P<0.01)。IH+HFD组大鼠血清FPG水平(15.078±2.824 mmol/L)高于 IH+ND组(12.651±1.314 mmol/L),血清TC水平(6.074±1.032 mmol/L)高于IH+ND组(4.134±0.582 mmol/L),差异均有统计学意义(P<0.05),血清LDL-C水平(3.710±0.527mmol/L)高于IH+ND组(2.182±0.413 mmol/L),差异有显著统计学意义(P<0.01)。余各项指标均无统计学意义。IH+HFD组大鼠血清FINS水平(32.999±10.470 mIU/L)高于NC+HFD组(20.163±3.412 mIU/L),IRI 水平(23.404±11.831)高于NC+HFD组(10.112±4.680),差异有统计学意义(P<0.05),其余各项指标均无统计学意义。(见表1)。
二、各组大鼠血清chemerin水平比较
IH+ND组大鼠血清chemerin水平(460.772±13.326 pg/mL)高于NC+ND组(412.840±25.201 pg/mL),差异有显著统计学意义(P<0.01)。IH+HFD组大鼠血清chemerin水平(479.301±8.826 pg/mL)高于NC+HFD组(453.552±11.131 pg/mL),亦高于IH+ND组(460.772±13.326 pg/mL),差异均有显著统计学意义(P<0.01)。其余各项指标均无统计学意义。(见表2)。

表1 各组大鼠检测指标水平
注:*P<0.01与NC+ND组相比,**P<0.05与IH+ND组相比,***P<0.01与IH+ND组相比,#P<0.05与NC+HFD组相比。

表2 各组大鼠chemerin水平比较
注:*P<0.01与NC+ND组相比,***P<0.01与IH+ND组相比,##P<0.01与NC+HFD组相比。
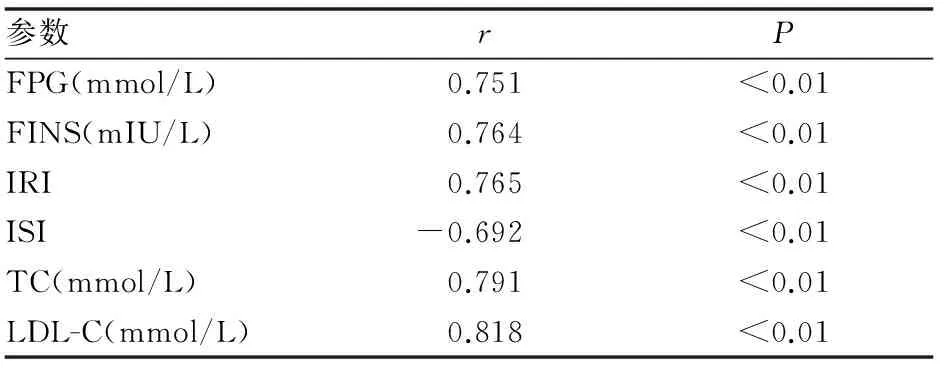
表3 血清chemerin与各参数的相关性分析
讨 论
阻塞性睡眠呼吸暂停低通气综合症(obstructive sleep apnea hypopnea syndrome,OSAHS)是一种临床常见的睡眠呼吸障碍性疾病,具有多系统损害的特点。OSAHS相关心血管疾病因其较高的发病率与致死率,广受研究者的重视,而近年来一些学者的研究显示,与睡眠呼吸障碍相关的糖脂代谢紊乱的发生率亦较高,是OSAHS相关代谢综合征(metabolic syndrome,MS)的重要危险因素,严重威胁人群健康,成为目前研究热点。
OSAHS引起的糖代谢异常,早期可表现为胰岛素抵抗,进而出现糖耐量减低及临床糖尿病。本研究中间歇低氧组大鼠血清FPG、FINS、IRI水平均高于常氧组,间歇低氧合并高脂组大鼠血清FINS、IRI水平高于常氧合并高脂组,差异均有统计学意义,说明OSAHS可引起较高的胰岛素水平和胰岛素抵抗。Polak与其研究团队发现[4],C57BL6/J小鼠暴露在IH环境14天可诱导IR的产生,并伴胰岛素敏感性下降、胰岛β细胞功能受损及胰腺氧化应激的增强,Lindberg等[5]研究发现,OSAHS患者胰岛素敏感性下降程度与睡眠呼吸暂停低通气指数(apnea hyponea index,AHI)显著相关,这与我们本实验结果相符。胰岛素具有促进脂肪合成,抑制脂肪分解和脂肪酸氧化,减少血浆游离脂肪酸水平等作用,高胰岛素血症在肥胖起始发病中具有重要的作用,而IR目前被认为可能是OSAHS相关并发症,如肥胖、糖尿病及脂质代谢紊乱等共同的发病机制之一。OSAHS可引起血脂代谢异常,Kono等[6]研究认为,OSAHS患者血脂异常发生率为48%,而对照组仅为25%,多元回归分析显示AHI是OSAHS患者发生高脂血症的预测因子。本研究结果显示,OSAHS可能具有上调血脂的作用,血脂代谢异常可表现为间歇低氧组大鼠总胆固醇、甘油三酯和低密度脂蛋白胆固醇的升高,而血脂代谢紊乱可参与代谢综合征的发生。一项临床荟萃分析[7]显示,OSAHS患者发生MS的危险性是非OSAHS患者的3.561倍,与未合并MS的患者相比,合并MS的患者TG、FPG均显著增高。本研究亦发现,间歇低氧合并高脂组大鼠空腹血糖、总胆固醇和低密度脂蛋白胆固醇水平均高于间歇低氧合并普食组大鼠,差异具有统计学意义(P<0.05),而一项针对正常体重OSAHS及OSAHS合并肥胖患者的临床研究[8]也得出相同的结论。同时,在我们的研究中,间歇低氧合并高脂组大鼠IRI、FINS水平高于常氧合并高脂组大鼠,差异具有统计学意义(P<0.05)。因此,OSAHS合并肥胖时,可加重糖脂代谢紊乱,可能增加MS的发生风险,肥胖合并OSAHS时,可进一步加重IR,同样增加MS的发生风险。
OSAHS可引起脂肪代谢紊乱,而由脂肪组织分泌的chemerin,是2007年Bozaoglu等[1]用信号序列捕获技术首次确定的一种脂肪因子,高度表达于白色脂肪组织、肝脏和肺,以旁分泌、自分泌或滋养血管分泌等多种方式作用于机体,不仅参与脂肪细胞的分化、成熟与代谢,亦可影响糖脂代谢、参与免疫应答、炎症反应等,在OSAHS的发生发展中起着重要作用。在本研究结果中,间歇低氧组大鼠血清chemerin水平明显高于常氧组,差异具有显著统计学意义(P<0.01),并且两组间FPG、FINS、IRI、TC、TG、LDL-C水平差异亦有显著统计学意义(P<0.01)。究其潜在机制,Chemerin在脂肪细胞分化过程中能对脂肪酸合成酶、葡萄糖转运蛋白-4、脂联素受体等进行调控[9],并降低糖原合成激酶3(GSK3)和蛋白激酶的磷酸化,影响外周组织对葡萄糖的吸收摄取,促进空腹血糖升高及肥胖发生,从而参与糖脂代谢平衡调节,与代谢综合征的发病相关[1]。
肥胖是一种慢性炎性疾病[10],是OSAHS最重要的危险因素之一。OSAHS可能通过增强炎性易感基因的表达和炎性细胞因子的合成[11],促进肥胖炎症反应的进展,导致肥胖的增加[12],而脂肪因子chemerin在肥胖和OSAHS相互影响的过程中发挥重要作用[13]。本文研究结果中,Chemerin水平的改变与肥胖有关,间歇低氧合并高脂组大鼠血清chemerin水平明显高于间歇低氧合并普食组,差异有显著统计学意义(P<0.01),与Ress等[14]报道一致。因此认为,chemerin系担任联系肥胖和OSAHS的角色,可被认为是OSAHS发生、发展的新生物标志物。此外,两组大鼠血清TC、LDL-C水平差异有统计学意义(P<0.05),行Pearson分析后发现,间歇低氧组大鼠血清chemerin水平与TC、LDL-C呈显著正相关,得出chemerin可加剧OSAHS并发的脂代谢紊乱,并进一步加剧OSAHS合并肥胖的脂代谢紊乱。因此认为,chemerin与OSAHS相关脂质代谢异常有密切联系,chemerin可通过血脂紊乱参与OSAHS的发生、发展。同时,本研究发现间歇低氧组大鼠血清chemerin水平与空腹血糖、空腹胰岛素、胰岛素抵抗性呈显著正相关,而与胰岛素敏感性呈显著负相关。该研究结果与临床研究[15]一致,脂肪因子chemerin可能通过TNF-κB途径介导的炎症反应诱导OSAHS相关IR的发生[16]。由此可见,血浆chemerin 水平与MS的主要组成部分具有明显相关性,chemerin可能参与了OSAHS相关MS的病理生理过程。
综上所述,脂肪因子chemerin在大鼠间歇低氧相关糖脂代谢紊乱中具有重要作用,chemerin可能通过肥胖、胰岛素抵抗和血脂代谢紊乱参与OSAHS的发生、发展,因此可作为早期预测OSAHS相关MS发生的脂肪因子,但chemerin 影响糖脂代谢的作用机制及具体信号转导途径尚不清楚。目前,关于脂肪细胞因子chemerin的研究还处于初始阶段,它在OSAHS相关MS中的作用有待于进一步研究和明确。对chemerin的深入研究,将为提前预防、临床诊断和治疗OSAHS相关代谢综合征疾病提供新的思路。
[1] Bozaoglu K,Bohon K,MeMillan J,et al.Chemerin is a novel adipo-kine associated with obesity and metabolic syndrome[J].Endocrinology,2007,148(10):4687-4694.
[2] 王忠弢,刘维英,郭春燕,等.髓鞘碱性蛋白、β-淀粉样前体蛋白和脑啡肽在间歇低氧大鼠脑内的变化及还原性谷胱甘肽的保护作用[J].中华结核和呼吸杂志,2014,37(2):129-131.
[3] Li C,Lu J,Zhang B.Development of a novel chronic intermittent hypoxia chamber[J].Sleep Breath,2012,16(1):177-179.
[4] Polak J,Shimoda LA,Drager LF,et al.Intermittent hypoxia impairs glucose homeostasis in C57BL6/J mice:partial improvement with cessation of the exposure[J].Sleep,2013,36(10):1483-1490.
[5] Lindberg E,Theorell-Hagl?w J,Svensson M,et al.Sleep Apnea and Glucose Metabolism:A Long-term Follow-up in a Community-Based Sample[J].Chest,2012,142(4):935-942.
[6] Kono M,Tatsumi K,Saibara T,et al. Obstructive sleep apnea is associated with some components of metabolic syndrome[J].Chest,2007,131(5):1387-1392.
[7] 王永滨,吴静,沈景昊,等.阻塞性睡眠呼吸暂停低通气综合征与代谢综合征关系荟萃分析[J].临床肺科杂志,2014,19(10):1758-1760.
[8] Feng X,Li P,Zhou C,et al.Elevated levels of serum chemerin in patients with obstructive sleep apnea syndrome[J].Biomarkers,2012,17(3):248-253.
[9] Ernst MC,Sinal CJ.Chemerin: at the crossroads of inflammation and obesity[J].Trends Endocrinol Metab,2010,21(11):660-667.
[10] Lee H,Lee IS,Choue R.Obesity,inflammation and diet[J].Pediatr Gastroenterol Hepatol Nutr,2013,16(3):143-152.
[11] Lurie A.Inflammation,oxidative stress,and procoagulant and thrombotic activity in adults with obstructive sleep apnea[J].Adv Cardiol,2011,46(11):43-66.
[12] McNicholas WT.Obstructive sleep apnea and inflammation[J].Prog Cardiovasc Dis,2009, 51(5):392-399.
[13] Calvin AD,Albuquerque FN,Lopez-Jimenez F,et al.Obstructive sleep apnea,inflammation,and the metabolic syndrome[J].Metab Syndr Relat Disord,2009,7(4):271-278.
[14] Ress C,Tschoner A,Engl J,et al.Effect of bariatric surgery on circulating chemerin levels[J].Eur J Clin Invest,2010,40(3):277-280.
[15] Quwens DM,Bekaert M,Lapauw B,et al.Chemerin as biomarker for insulin sensitivity in males without typical characteristics of metabolic syndrome[J].Arch Physiol Biochem,2012,118(3):135-138.
[16] Huang Z,Xie X.Chemerin induces insulin resistance in C2C12 cells through nuclear factor-κB pathway-mediated inflammatory reaction[J].Chin J Cell Mol Immunol,2015,31(6):725-729.
Relationship between the expression of adipokines chemerin and glucose and lipid metabolism in rats during intermittent hypoxia
ZHAO Hong, WANG Xiao-ya, ZHANG Xiu-li, LI Juan-zhi, LIU Jia-yin, YU Qin.
the First Clinical Medical College of Lanzhou University, Lanzhou, Gansu 730000, China
Objective To explore the role of adipokines chemerin in OSAHS-related glucose and lipid disorders by detecting the expression level of serum chemerin in rats during intermittent hypoxia. Methods A total of 24 healthy male Wistar rats were randomly divided into four groups: the NC+ND group (normoxic+normal diet), the NC+HFD group (normoxic+high fat diet), the IH+ND group (intermittent hypoxia+normal diet), and the IH+HFD group (intermittent hypoxia+high fat diet). The ND group was given basic diet, and the HFD group was given high-fat diet. The IH group was exposed to intermittent hypoxic environment of 8h/d, while the NC group
intermittent compressed air. The serum TC (total cholesterol), TG (triglyceride), LDL-C (low density lipoprotein cholesterol), FPG (fasting plasma glucose), and FINS (fasting insulin) were detected, and IR (insulin resistance) was evaluated systematically by the homeostasis model assessment of insulin resistance index (IRI) and insulin sensitive index (ISI). The expression of serum chemerin in rats were detected by ELISA. Results Compared with the NC+ND group, the serum FPG, FINS, IRI, TC, TG, and LDL-C levels increased significantly in the IH+ND group (P<0.01), the serum FPG, TC and LDL-C levels in the IH+HFD group were higher than in the IH+ND group, and the serum FINS and IRI were higher in the IH+HFD group than in the NC+HFD group (P<0.05). Compared with the NC+ND group, there was a significant rise in serum chemerin level (P<0.01). The serum chemerin level in the IH+HFD group were higher than the IH+ND group and the NC+HFD group (P<0.01). Pearson analysis showed that the serum chemerin in the IH group were positively correlated with FPG (r=0.751,P<0.01), FINS (r=0.764,P<0.01), IRI (r=0.765,P<0.01), TC (r=0.791,P<0.01), and LDL-C (r=0.818,P<0.01), and negatively correlated with ISI (r=-0.692,P<0.01). Conclusion There are glucose and lipid metabolism disorders in rats during intermittent hypoxia, and the phenomenon is more serious when fed with high fat diet. The serum chemerin level tends to increase in rats during intermittent hypoxia, and this trend is even more significant when fed with high fat diet. The serum chemerin is associated with glucose and lipid disorders. Adipokines chemerin could be one predictor of OSAHS related glucose and lipid metabolism disorders.
sleep apnea; intermittent hypoxia; insulin resistance; chemerin; glucose and lipid metabolism
10.3969/j.issn.1009-6663.2017.08.002
甘肃省自然科学基金项目(No 1506RJZA254)
1. 730000 甘肃 兰州,兰州大学第一临床医学院 2. 730000 甘肃 兰州,兰州大学第一医院呼吸科
余勤,E-mail:yuq701@163.com
2016-12-27]

