磁性Fe3O4/改性焦炭的制备及其降解性能
魏晓币,王光华,李文兵,万栋,刘阳,邵秋桐
磁性Fe3O4/改性焦炭的制备及其降解性能
魏晓币,王光华,李文兵,万栋,刘阳,邵秋桐
(武汉科技大学化学与化工学院,湖北武汉 430081)
以KOH为活化剂对焦炭进行活化制备改性焦炭,并采用原位氧化沉淀法制备出Fe3O4/改性焦炭,采用扫描电子显微镜(SEM)、N2吸附脱附(BET)、傅里叶交换红外光谱(FTIR)、X射线衍射(XRD)及振动样品磁强计(VSM)对样品进行表征,并且研究了其对罗丹明B的催化降解性能。结果表明,改性焦炭表面粗糙,孔结构发达,含氧官能团丰富,Fe3O4分散且牢固地负载于改性焦炭上,其粒径比纯Fe3O4小。Fe3O4/改性焦炭具有超顺磁性,对罗丹明B的降解为拟一级反应,其降解的最佳条件为:催化剂用量为0.8g/L,H2O2初始浓度为30mmol/L,pH为3.0,温度为35℃。Fe3O4与改性焦炭存在协同催化作用,罗丹明B的去除率可达98.85%。Fe3O4/改性焦炭是一种稳定、易磁分离回收利用的磁性催化剂。
改性焦炭;磁性催化剂;类Fenton;降解;稳定性
随着工业的发展,水作为人类赖以生存的资源,面临着日渐严重的污染,工业废水的处理刻不容缓。Fenton法因反应条件温和、设备简单、成本低廉、效率高,能产生氧化能力很强的羟基自由基(•OH),几乎无选择性地氧化降解有机物[1],广泛应用于处理造纸[2]、印染[3]、焦化废水[4]等有毒难降解的有机废水中。但均相Fenton法存在催化剂难以回收重复利用、易产生铁泥、H2O2利用率低等特 点[5],制约了其在水处理中的实际应用。鉴于均相Fenton法的这些缺点,如何对传统Fenton体系进行改进成了热门研究之一。
磁性纳米Fe3O4因其具有超顺磁性、热稳定性好、高反应活性、易于制备等特点[6-8],不仅保留了均相Fenton反应的优点,可以激发H2O2产生•OH,而且易于磁分离回收利用,铁离子流失少,在类Fenton催化剂研究中得到广泛关注。但纳米Fe3O4颗粒存在磁偶极之间相互作用,容易团聚[9],导致催化活性降低。在实际应用中常与活性炭[10]、膨润土[11]、碳纳米管[12]等材料复合,分散分布在载体表面上,避免其团聚。焦炭因价格低廉、取材方便等优点,对其表面进行处理,不仅获得优良的负载材料,也可以拓宽焦炭的利用途径,减缓其库存压力。
本实验对焦炭进行改性,并将磁性纳米Fe3O4负载于改性焦炭上,制备出集吸附、催化、磁性易回收于一体的Fe3O4/改性焦炭磁性催化剂,选择罗丹明B为目标污染物,通过对催化剂结构及性能的测试分析,研究其组成及催化剂投加量、H2O2用量、初始pH、温度等因素对罗丹明B催化氧化效果的影响,并初步探索其降解机理,为实际应用提供基础数据。
1 实验部分
1.1 试剂与仪器
(1)主要试剂 焦炭,购于武钢焦化厂;盐酸,购于信阳市化学试剂厂;罗丹明B,购于天津北联精细化学品开发有限公司;氢氧化钾、七水硫酸亚铁、硝酸钠、氢氧化钠、30%过氧化氢、无水乙醇,均购于国药集团化学试剂有限公司;以上试剂除焦炭外均为分析纯。
(2)实验仪器 SA3100比表面积和孔隙测定仪,美国Beckman Coulter公司;Nava 400 Nano型扫描电镜,德国FEI公司;Nicolet 6700型傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司;D8 ADVANCE and DAVINCI DESIGN–X射线衍射仪,日本理学公司;JDAW-2000D型号振动样品磁强计,美国麦克公司;752N型紫外可见分光光度计,上海佑科仪器仪表有限公司;DZF-200型真空干燥箱,上海圣欣科学仪器有限公司;DF-101S水浴锅,武汉科尔仪器设备有限公司。
1.2 改性焦炭的制备
称取24g KOH与6g焦炭充分研磨混匀,装入刚玉方舟并置于管式电阻炉。在N2保护下以5℃/min的升温速度升至500℃后保温60min。然后继续升温至850℃活化1.5h后,自然冷却至200℃后取出产物,用1mol/L盐酸浸泡1h后,再用蒸馏水充分水洗至中性。将洗涤后的产物于105℃干燥箱干燥4h得到改性焦炭。
1.3 Fe3O4/改性焦炭的制备
Fe3O4/改性焦炭采用原位氧化沉淀法制备[13]。将1.236g改性焦炭分散到装有100mL蒸馏水的多口烧瓶中搅拌均匀,通入高纯氮气并加热到95℃;然后将2.968g FeSO4∙7H2O溶解在100mL蒸馏水中并缓慢加入烧瓶中;再将0.848g NaOH和0.8g NaNO3溶于100mL蒸馏水,缓慢滴入烧瓶中,持续搅拌2.5h;磁分离出产物,用蒸馏水和无水乙醇交替洗涤至溶液呈中性,85℃真空干燥12h,冷却后研磨,即得到Fe3O4/改性焦炭磁性催化剂。
1.4 罗丹明B的降解实验
移取100mL浓度为100mg/L的RhB模拟废水于250mL锥形瓶中,溶液的初始pH用0.1mol/L HCl和NaOH调节,加入一定质量的催化剂,恒温磁力搅拌60min,使其达到吸附平衡,再加入一定浓度H2O2,以此开始记录降解时间,定时取样,磁分离,测定上清液RhB的浓度。
1.5 测试与表征
采用SA3100比表面积和孔隙测定仪测定77K时样品对氮气的吸附量,由此根据BET方程计算各样品的比表面积;Nava 400 Nano型扫描电镜观察样品的形貌;Nicolet 6700型傅里叶变换红外光谱仪对样品进行红外光谱分析;D8 ADVANCE and DAVINCI DESIGN-X射线衍射仪测试样品的晶型结构;JDAW-2000D型号的振动样品磁强计测试催化剂的磁滞回线;752N型紫外可见分光光度计测试样品的光学性能。
2 结果与讨论
2.1 SEM分析
从图1(a)中可以看出,焦炭呈块状,表面平整光滑,结构致密,基本没有孔隙结构。图1(b)中改性焦炭表面变得明显粗糙,微孔结构发达,呈蜂窝状,其比表面积达到298m2/g,远高于改性前的4m2/g,说明改性效果明显。图1(c)中纯Fe3O4粒径分布均匀(180nm),以多面体和圆球为主,团聚严重。图1(d)中Fe3O4相对分散地负载于改性焦炭上,且平均粒径(90nm)比负载前小,说明改性焦炭有利于Fe3O4分散,减小其颗粒大小,是很好的负载材料。
2.2 FTIR分析
各样品的FTIR谱图如图2所示。从改性焦炭的谱图中可以看出,在3400cm–1左右出现O—H伸缩振动峰,1645cm–1处出现C=O、C=C的伸缩振动峰[14],1000~1200cm–1处是C—O的伸缩振动峰和O—H弯曲振动峰[15],表明改性焦炭含有大量含氧官能团,易于吸附有机物,也有利于与其他物质结合,可作为较好的负载材料。Fe3O4谱图中在572cm–1处出现了比较强的吸收峰,这是 Fe—O—Fe弯曲振动峰。Fe3O4/改性焦炭谱图中出现C=O、C=C的伸缩振动峰等改性焦炭的特征峰及Fe—O—Fe弯曲振动峰,说明Fe3O4成功负载于改性焦炭上。
2.3 XRD分析
各样品的XRD谱图如图3所示。改性焦炭在2为25°和43°处出现宽的衍射峰,说明改性焦炭没有晶体结构,属于无定形炭。纯Fe3O4在2为18.1°、30.2°、35.6°、43.2°、53.6°、57.1°、62.7°处出现衍射峰,与JCPDS No.65-3107 Fe3O4标准谱峰吻合。Fe3O4/改性焦炭的XRD图中的Fe3O4特征峰位置与纯Fe3O4基本一致,说明Fe3O4负载于改性焦炭后结晶形态没有发生改变。
2.4 VSM分析
Fe3O4/改性焦炭的磁滞回线如图4所示,Fe3O4/改性焦炭的饱和磁化强度为40.85emu/g,磁滞回线中没有磁滞现象,剩余磁化强度和矫顽力均为零,表明其具有超顺磁性的特征。由于用一个磁块从溶液中进行磁性分离所需要的饱和磁化强度为16.3emu/g[16],因此,在外加磁场的作用下,Fe3O4/改性焦炭易于从溶液中磁分离回收,很好地解决了催化剂难以分离回收的问题。
2.5 催化剂投加量对RhB降解过程的影响
在初始H2O2浓度为50mmol/L,初始pH为3,温度为25℃的条件下,催化剂投加量对RhB降解过程的影响如图5所示。罗丹明B的降解过程为拟一级反应,根据相关研究得出的反应机理见式(1)~式(5)。随着催化剂投加量的增加,活性位点的增多,产生了大量的•OH自由基,RhB的降解速率逐渐增大;当催化剂投加量增加到0.8g/L之后,RhB的降解速率几乎不变,可能是由于过量的•OH与H2O2之间很快发生反应而淬灭,反而不利于RhB的降解,如式(5)[17]。综上分析,实验中最佳催化剂投加量为0.8g/L。
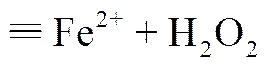
—→(2)
—→(3)
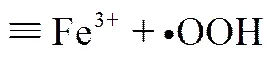
—→(5)
2.6 初始H2O2浓度对RhB降解过程的影响
在催化剂投加量为0.8g/L,初始pH为3,温度为25℃的条件下,初始H2O2浓度对RhB降解过程的影响如图6所示。随着H2O2浓度的增加,RhB的降解速率先增大,在30mmol/L时达到最大值,之后略有降低,可能是因为当H2O2的浓度高于临界值时,由于产生的•OH能被过量的H2O2捕获生成氧化还原电位更低的过氧自由基•O2H,如式(5)所示。综上所述,实验中最佳H2O2初始浓度为30mmol/L。
2.7 初始pH对RhB降解过程的影响
在催化剂投加量为0.8g/L,初始H2O2浓度为30mmol/L,温度为25℃的条件下,初始pH对RhB降解过程的影响如图7所示。从图7(a)中可以看出,RhB的降解过程受pH的影响较大,随着pH的降低,RhB降解速率先增大后减小。这是因为在pH高于4的情况下,纳米Fe3O4由于形成水合铁和水合亚铁配合物,抑制了•OH的产生,其催化能力明显减弱[18-19]。在pH较低时,催化剂表面的正电荷与带有阳离子的RhB发生了同性相斥的作用,这使得较低的pH下对RhB吸附量稍小,减少了活性位点接触导致降解速率降低。此外,图7(b)中随着pH降低,Fe溶出量逐渐增大,当pH过低时,Fe溶出量太高,从而引发副反应消耗了•OH导致降解速率降低,如式(3)所示。因此pH不宜过低,结合实验结果分析,实验中最佳pH为3.0。
图7 初始pH对RhB降解过程和Fe溶出量的影响
2.8 反应温度对RhB降解过程的影响
在催化剂投加量为0.8g/L,初始H2O2浓度为30mmol/L,初始pH为3.0的条件下,温度对RhB降解过程的影响如图8所示。随着温度的升高,RhB的降解速率逐渐加快,可见高温有利于RhB的降解,但温度过高,H2O2易被分解成水和氧气[20],且温度高,能耗高,因此温度不宜过高。综合经济效益分析,选择适宜温度为35℃。
2.9 不同条件下RhB的去除效果对比
不同条件下RhB的去除效果对比如图9所示,其中催化剂投加量为0.8g/L,初始H2O2浓度为30mmol/L,初始pH为3.0,温度为35℃。从图9中可以看出,单独加入H2O2或催化剂时,RhB的去除率均比较低。这是因为:缺少催化剂时,H2O2提供•OH的速度慢,且H2O2氧化能力比•OH弱很多;没有H2O2存在时,RhB的去除率主要源于催化剂的吸附作用。在催化剂+H2O2体系中,Fe3O4/改性焦炭相比纯Fe3O4催化降解RhB速率大幅提高,且前者在40min内对RhB的去除率达到96%以上,这是由于纳米Fe3O4与改性焦炭之间的协同效应使得RhB的降解速率更快[21]。纳米Fe3O4/改性焦炭降解RhB模拟有机废水的协同效应主要表现在以下两个方面:一方面将纳米Fe3O4负载于改性焦炭上,Fe3O4更加均匀地分散在改性焦炭表面,有效避免Fe3O4团聚现象,暴露在催化剂表面的活性位点增多,促进其催化H2O2产生更多•OH降解RhB;另一方面,利用改性焦炭的吸附作用,可先将有机物吸附在催化剂的表面,导致了较高浓度的目标污染物分子集中在催化剂活性中心附近微区内,因而目标污染物分子更易受到•OH的攻击,因此,催化剂对RhB模拟有机废水的降解是催化活性组分和催化剂载体协同作用的结果。
2.10 催化剂对RhB降解过程分析
用紫外可见光谱追踪测试此反应过程,不同时间下RhB溶液的紫外-可见光谱如图10所示。根据有机波谱分析理论,紫外区259nm和284nm处的吸收峰是苯环的特征吸收峰,可见光区554nm处的吸收峰是苯环与碳氮双键和碳碳双键大共轭体系的特征吸收峰,即可见光的生色团[22]。随着反应时间的进行,紫外区259nm、284nm和可见光区554nm处的吸收峰都迅速下降,200~220nm处的吸收峰先增大后减小,图10插图中RhB溶液的颜色逐渐变淡,表明苯环以及碳氮双键和碳碳双键都遭到了破坏,转化成小分子中间产物,直至完全矿化;90min时,紫外区259nm、284nm和可见光区554nm处的吸收峰完全消失,RhB溶液的颜色呈无色,则说明RhB已基本去除。
2.11 催化剂的稳定性
在催化剂投加量为0.8g/L,初始H2O2浓度为30mmol/L,初始pH为3.0,温度35℃的条件下,将催化剂重复使用4次,研究其重复降解性能,结果如图11所示。RhB去除率分别为98.85%、97.81%、92.27%、91.02%,可见催化剂使用4次后,RhB去除率均略有降低,且均在90%以上,重复使用性较好。降解效果降低可能是因为少量的Fe3O4在降解过程中流失,这也对应了图11中Fe溶出量的变化,随着使用次数的增加,Fe溶出量降低,由4.55mg/L降低到1.775mg/L,Fe溶出量比较低。综合分析,Fe3O4/改性焦炭催化剂的结构比较稳定,是一种稳定且易磁分离回收重复使用的催化剂。
3 结论
(1)焦炭改性后表面明显粗糙,微孔结构发达,呈蜂窝状,比表面积从4m2/g提高到298m2/g,含有大量含氧官能团,可作为优良的负载材料。纳米Fe3O4均匀且牢固地分散在改性焦炭上,平均粒径(90nm)比纯Fe3O4(180nm)小,Fe3O4/改性焦炭的饱和磁化强度为40.85emu/g,具有超顺磁性。
(2)通过实验得出Fe3O4/改性焦炭催化剂催化降解RhB的最佳条件为:催化剂投加量为0.8g/L,初始H2O2浓度为30mmol/L,初始pH为3.0,温度为35℃。Fe3O4/改性焦炭中Fe3O4与改性焦炭存在协同作用,相同条件下其催化活性远高于纯Fe3O4,90min内RhB完全矿化。
(3)Fe3O4/改性焦炭催化剂使用4次后,RhB去除率分别为98.85%、97.81%、92.27%、91.02%,重复使用性好。Fe溶出量较低,分别为4.55mg/L、2.93mg/L、1.98mg/L、1.775mg/L,说明其结构比较稳定,是一种稳定且易磁分离回收重复使用的催 化剂。
[1] DENG Y,ENGLEHARDT J D. Treatment of landfill leachate by the Fenton process[J]. Water Research,2006,40(20):3683-3694.
[2] 贾永强,李伟,贾立庄,等. Fenton氧化深度处理高浓度造纸废水的中试实验[J]. 环境工程学报,2014,8(1):215-221.
JIA Y Q,LI W,JIA L Z,et al. A pilot study on advanced treatment of high-concentration papermaking wastewater by Fenton oxidation process[J]. Chinese Journal of Environmental Engineering,2014,8(1):215-221.
[3] 马丽华,万金泉. Fe2+催化H2O2、S2O82–、S2O82–-H2O2降解橙黄G[J]. 化工进展,2012,31(10):2330-2334.
MA L H,WAN J Q. Degradation of orange G by H2O2、S2O82–、S2O82–-H2O2with ferrous ion[J]. Chemical Industry and Engineering Progress,2012,31(10):2330-2334.
[4] 吴丽雅,宋秀兰,林金华,等. Fenton试剂法深度处理焦化废水的研究及产物分析[J]. 科学技术与工程,2015,15(9):271-274.
WU L Y,SONG X L,LIN J H,et al. Advanced treatment of coking wastewater by Fenton reagent oxidation[J]. Science Technology and Engineering,2015,15(9):271-274.
[5] 赵晓亮,魏宏斌,陈良才,等. Fenton试剂氧化法深度处理焦化废水的研究[J]. 中国给水排水,2010,26(3):93-95.
ZHAO X L,WEI H B,CHEN L C,et al. Advanced treatment of coking wastewater by Fenton reagent oxidation process[J]. China Water & Wastewater,2010,26(3):93-95.
[6] ZHANG J B,ZHUANG J,GAO L Z,et al. Decomposing phenol by the hidden talent of ferromagnetic nanoparticles[J]. Chemosphere,2008,73(9):1524-1528.
[7] 何光裕,张艳,钱茂公,等. 磁性Fe3O4/石墨烯Photo-Fenton催化剂的制备及其催化活性[J]. 无机化学学报,2012,28(11):2306-2312.
HE G Y,ZHANG Y,QIAN M G,et al. Preparation and catalytic properties of Fe3O4/Graphene magnetically separable photo-Fenton catalyst[J]. Chinese Journal of Inorganic Chemistry,2012,28(11):2306-2312.
[8] XUE X F,HANNA K,ABDELMOULA M,et al. Adsorption and oxidation of PCP on the surface of magnetite:kinetic experiments and spectroscopic investigations[J]. Applied Catalysis B:Environmental,2009,89(3/4):432-440.
[9] ZHU M Y,DIAO G W. Synthesis of porous Fe3O4nanospheres and its application for the catalytic degradation of xylenol orange[J]. Journal of Physical Chemistry C,2011,115(39):18923-18934.
[10] 赵清华,全学军,谭怀琴,等. 焦化废水中有机污染物的光催化处理[J]. 化工进展,2009,28(5):894-898.
ZHAO Q H,QUAN X J,TAN H Q,et al. Photocatalytic degradation of organic pollutants in coking plant wastewater[J]. Chemical Industry and Engineering Progress,2009,28(5):894-898.
[11] MOCKOVCIAKOVA A,OROLINOVA Z,SKVARLA J. Enhancement of the bentonite sorption properties[J]. Journal of Hazardous Materials,2010,180(1/2/3):274-281.
[12] 侯翠岭,李铁虎,赵廷凯,等. 碳纳米管/四氧化三铁复合材料的电磁波吸收性能[J]. 新型炭材料,2013,28(3):184-190.
HOU C L,LI T H,ZHAO T K,et al. Electromagnetic wave absorbing properties of multi-wall carbon nanotube/Fe3O4hybrid materials[J]. New Carbon Materials,2013,28(3):184-190.
[13] XAVIER S,GANDHIMATHI R,NIDHEESH P V,et al. Comparison of homogeneous and heterogeneous Fenton processes for the removal of reactive dye Magenta MB from aqueous solution[J]. Desalination and Water Treatment,2015,53(1):109-118.
[14] LI Y,LENG T H,LIN H Q,et al. Preparation of Fe3O4@ZrO2core-shell microspheres as affinity probes for selective enrichment and direct determination of phosphopeptides using matrix-assisted laser desorption ionization mass spectrometry[J]. Journal of Proteome Research,2007,6(11):4498-4510.
[15] ZHANG S X,NIU H Y,HU Z J,et al. Preparation of carbon coated Fe3O4nanoparticles and their application for solid-phase extraction of polycyclic aromatic hydrocarbons from environmental water samples[J]. Journal of Chromatography A,2010,1217(29):4757-4764.
[16] 李涛,张援,唐明,等. 新型含羧基卟啉及其金属配合物的合成[J]. 化学试剂,2002,4:221-222.
LI T,ZHANG Y,TANG M,et al. Synthesis of a novel porphyrin with carboxyl group and its metal complexes[J]. Chemical Reagents,2002,4:221-222.
[17] GARRIDO-RAMIREZ E G,THENG B K G,MORA M L. Clays and oxide minerals as catalysts and nanocatalysts in Fenton-like reactions-a review[J]. Applied Clay Science,2010,47(3/4):182-192.
[18] 邓景衡,文湘华,李佳喜,等. 碳纳米管负载纳米四氧化三铁多相类芬顿降解亚甲基蓝[J]. 环境科学学报,2014,34(6):1436-1442.
DENG J H,WEN X H,LI J X,et al. Degradation of methylene blue by heterogeneous Fenton-like reaction using Fe3O4/carbon nanotube composites[J]. Acta Scientiae Circumstantiae,2014,34(6):1436-1442.
[19] SI Y B,FANG G D,ZHOU J,et al. Reductive transformation of 2,4-dichlorophenoxyacetic acid by nanoscale and microscale Fe3O4particles[J]. Journal of Environmental Science and Health,Part B,2010,45(3):233-241.
[20] WU Y Y,ZHOU S Q,QIN F H,et al. Modeling the oxidation kinetics of Fenton’s process on the degradation of humic acid[J]. Journal of Hazardous Materials,2010,179(1/2/3):533-539.
[21] 严平,占昌朝,曹小华,等. 原位合成H4SiW12O40@C协同UV/H2O2降解罗丹明B模拟废水[J]. 化工进展,2015,34(3):872- 878.
YAN P,ZHAN C C,CAO X H,et al. Synergetic degradation of Rhodamine B in simulated wastewater using ultraviolet and hydrogen peroxide catalyzed by H4SiW12O40@C synthesized[J]. Chemical Industry and Engineering Progress,2015,34(3): 872-878.
[22] 姜聚慧,陈华军,娄向东,等. 亚铁催化声化学降解罗丹明B[J]. 环境污染治理技术与设备,2006,7(8):99-103.
JIANG J H,CHEN H J,LOU X D,et al. Enhancement of degradation of Rhodamine B in aqueous solution by ultrasound/Fe2+process[J]. Techniques and Equipment for Environmental Pollution Control,2006,7(8):99-103.
Preparation and degradation properties of magnetic Fe3O4/modified coke
WEI Xiaobi,WANG Guanghua,LI Wenbing,WAN Dong,LIU Yang,SHAO Qiutong
(School of Chemistry and Chemical Engineering,Wuhan University of Science and Technology,Wuhan 430081,Hubei,China)
Modified coke was firstly prepared from coke by KOH activation and then Fe3O4/modified coke was prepared byoxidation precipitation method. The catalyst and samples were characterized by scanning electron microscopy(SEM),nitrogen adsorption isotherms(BET),Fourier transform infrared spectroscopy(FTIR),X-ray powder diffractometer(XRD)and vibrating sample magnetometer(VSM),and the catalytic degradation performance of Rhodamine B(RhB)was studied. The results show that the modified coke has rough surface and well-developed pore structure. Moreover,the oxygen-containing functional groups of modified coke are abundant. Fe3O4was dispersed and firmly loaded on the modified coke,making the latter is smaller than the pure Fe3O4. Fe3O4/modified coke possessed superparamagnetism,and its degradation of RhB could be regarded as pseudo first-order reaction. The best degradation conditions were as follow:[catalysts]=0.8g/L,initial [H2O2]=30mmol/L,pH=3.0 and=35℃. There is a synergistic effect between Fe3O4and modified coke,giving rise to the removal rate of RhB of 98.85%. Therefore,Fe3O4/modified coke is a magnetic catalyst with good stability and recyclability.
modified coke;magnetic catalyst;Fenton-like;degradation;stability
TQ426.8
A
1000–6613(2017)07–2577–07
10.16085/j.issn.1000-6613.2016-2176
2016-11-23;
2017-03-28。
湖北省自然科学基金项目(2014CFB810)。
魏晓币(1992—),男,硕士研究生,从事废水处理等研究工作。E-mail:571529489@qq.com。
联系人:王光华,教授,博士生导师,主要从事洁净煤技术及环境友好技术、低品质煤提质技术、精细化工与综合利用、废水废气治理等研究工作。E-mail:wghuah@ 163.com。

