数字PCR技术在布鲁菌病疗效判定中的应用价值
郭瑛 韩冰 王丽 孙华丽 刘贵明 蒋荣猛
数字PCR技术在布鲁菌病疗效判定中的应用价值
郭瑛 韩冰 王丽 孙华丽 刘贵明 蒋荣猛
目的 探讨数字PCR技术检测血清布鲁菌含量对疗效判定的应用价值。方法 选择2015年1月至2016年5月首都医科大学附属北京地坛医院收治的15例布鲁菌病恢复期患者,即布鲁菌病急性期患者经过规范抗生素治疗6周后仍有布鲁菌病相关临床症状的患者为研究对象,用数字PCR技术检测血清布鲁菌含量,并同时做血培养和布鲁菌凝集试验,比较三种试验结果。结果 15例患者布鲁菌病恢复期患者血清凝集试验结果均为阳性,14例患者未在血清中检测出布鲁菌DNA,仅有1例患者血清布鲁菌DNA定量检测结果为阳性,并且血培养阳性。剩余14例患者血培养阴性。结论 数字PCR技术为发现和确诊布鲁菌病现症感染病例提供了快速、快捷的方法,但仍需大样本进行验证。
布鲁菌病;数字PCR技术
布鲁菌病是一种古老的人畜共患性疾病,由布鲁菌感染引起,以长期发热、肝脾大、关节疼痛和慢性化为特征的人畜共患传染病,曾被命名为波状热和地中海热。在世界范围内均有分布。据统计,全世界每年新增约50万病例[1]。我国主要流行于内蒙古自治区、吉林省、黑龙江省、新疆维吾尔自治区、西藏自治区等。布鲁菌病有多种传播途径,临床表现多样,病程可长达数月至数年。部分布鲁菌病患者在治疗过程中或治疗后,仍有自觉布鲁菌病症状,如发热、乏力、盗汗和肌肉关节痛等。此时,早期正确鉴别诊断是治疗失败、复发还是重新感染是后续治疗成功的关键。目前,布鲁菌病实验室诊断技术缺乏快速、简便的方法,仍以分离培养和血清凝集试验、补体结合试验和酶联免疫吸附试验为主要检测手段。布鲁菌分离培养是实验室诊断的金标准。临床上主要采用血培养和骨髓培养。但是培养阳性率低,要求条件高,且存在生物安全性风险,临床因实验室条件限制不能常规开展。在我国,临床常规开展的血清凝集试验主要为虎红平板凝集试验(RBT)和试管凝集试验。RBT主要检测血清中总抗体,技术简单,价格便宜,被广泛作为初筛试验使用。阳性诊断价值较低,对于没有布鲁菌暴露危险因素患者诊断价值较高,对于反复暴露和既往感染患者诊断价值有限。试管凝集试验(SAT)常被用作布鲁菌病的诊断技术,主要检测IgG、IgM和IgA。但是各国具有诊断意义的抗体滴度标准不一致,未找到合适的抗体滴度诊断标准,且慢性期敏感性较低。补体结合试验(Coombs)主要检测血清中不完全和非凝集抗体,作为SAT的补充。Coombs在慢性期和复发患者中诊断价值优于血清凝集试验,敏感性和特异性较高。但该项检测方法操作复杂、耗时,需要一定的设备,难以在临床常规开展。ELISA能够检测血清中IgM和IgG抗体。单独检测IgM抗体可为急性期患者提供可靠的诊断,但是,当患者体内存在高滴度的IgG抗体时,干扰对IgM抗体的检出。不仅如此,类风湿因子也可导致假阴性结果。PCR技术自出现以来,被广泛应用于感染性疾病的诊断。美国指南推荐PCR技术作为布鲁菌病诊断初筛试验,以IS711为引物的PCR试验被广泛应用于检测血清中布鲁菌含量,应用前景广阔。但普通PCR技术检测敏感性低,且为相对定量,结果不够精确。布鲁菌血培养技术耗时、阳性率低,且存在生物安全风险。布鲁菌血清凝集试验、补体结合试验和酶联免疫吸附试验和普通PCR技术均存在一定的局限性。本文初步探讨利用数字PCR技术检测血清布鲁菌DNA含量对布鲁菌病恢复期的诊断价值。
1 资料与方法
1.1 一般资料 选择2015年1月至2016年5月首都医科大学附属北京地坛医院收治的15例布鲁菌病恢复期患者,即布鲁菌病急性期患者经过规范抗生素治疗6周后仍有布鲁菌病相关临床症状的患者。
1.2 入选标准
1.2.1 符合布鲁菌病急性期诊断标准:①流行病学史:发病前与家畜和畜产品、布鲁菌培养物等有密切接触史,或生活在布鲁菌病流行区的居民等。②有发热、乏力、多汗、肌肉和关节痛,或伴有肝、脾和淋巴结肿大等临床表现。③实验室分离出布鲁菌,试管凝集试验、补体结合试验或布鲁菌病抗人-球免疫球蛋白试验阳性。④病史≤6个月。
1.2.2 非急性期:符合布鲁菌病急性期诊断标准,并接受抗生素治疗6周后,仍有布鲁菌病相关临床症状的患者。
1.3 数字PCR试验方法
1.3.1 主要试剂:血液DNA提取试剂盒购自qiagen公司,QX200 ddPCR EvaGreen Supermix,微滴发生卡(DG8TM Cartridges),微滴发生油(QX200TM Droplet Generation Oil for EvaGreen)购自伯乐公司,引物在上海生工公司合成。
1.3.2 数字PCR:引物针对IS711基因设计[2],扩增产物长度252 bp,引物序列如下,BF:CATGCGCTATGTCTGGTTAC;BmR:AGTGTTTCGGCTCAGAATAAT。模板DNA提取按照试剂盒的说明书。布鲁菌基因组DNA由中国疾控中心布病室赠予。实验设计包括空白对照孔,阳性对照孔,阴性对照孔,样品孔。空白对照孔模板用无菌水替代,阳性对照孔模板是布鲁菌的基因组DNA,阴性对照孔模板是健康人基因组DNA,样品孔模板是15名患者血清提取的DNA。
1.3.3 配制数字PCR反应体系:Eva Green Supermix 12 μl,模板DNA 33 ng,上下游引物2 pmol,加水至24 μl。吸取20 μl转移至微滴发生卡的sample行(中间行),油滴行加入70 μl微滴发生油,盖上胶垫后,平稳放置在微滴生成仪中,开始生产微滴。将生成微滴转移至96孔PCR板,反应条件:95℃ 变性5 min,95℃30 s,57℃ 60 s,40个循环,4℃ 5 min,90℃ 5 min,4℃保存。将反应完成的96孔板平稳放入微滴读取仪中,打开quanta soft软件,输入样品信息后,点击run。
2 结果
2.1 一般情况 15例布鲁菌病恢复期患者中,男5例,女10例;年龄21~56岁。布鲁菌乳胶凝集试验由北京地坛医院完成,本组病例均为阳性。血培养阳性1例。
2.2 流行病学史 15例患者均来自疫区或从事畜牧业相关工作。
2.3 临床表现 15例患者有明显的布鲁菌病自觉症状,主要为发热、腰痛肌肉和关节痛、乏力等。见表1。
2.4 血清布鲁菌定量检测 有自觉症状的15例布鲁菌病恢复期患者中,1例血清布鲁菌DNA定量明显升高,2.34拷贝/μl,且血培养阳性。其余患者均未检测出布鲁菌DNA。
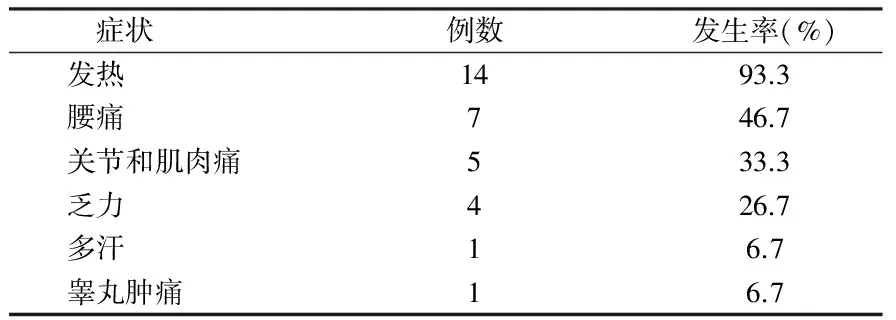
表1 15例布鲁菌病恢复期患者的临床症状
3 讨论
布鲁菌病经过规范6~8周抗生素治疗后,95%的患者病情有不同程度的好转,进入恢复期。然而,少部分患者仍自觉有布鲁菌病相关临床症状,如发热、乏力、盗汗、腰痛和关节痛等。此时,需要对布鲁菌病恢复期患者进行正确诊断,鉴别是治疗失败、复发还是重新感染,将决定临床医生的治疗决策。目前,诊断布鲁菌病主要依靠分离培养和凝集试验、补体结合试验、酶联免疫吸附试验和普通PCR技术。
布氏杆菌分离培养是诊断的金标准。临床上主要采用血培养和骨髓培养。据统计,急性期患者血培养敏感性为18.4%~90%,慢性期敏感性差,30%~70%[3-5]。骨髓培养比血培养灵敏度高,尤其是对已经应用抗生素患者[6]。培养阳性率主要取决于疾病分期、抗生素应用和培养方法等[7]。
布氏杆菌分离培养存在生物安全性问题。据不完全统计,在过去的25年中,实验室布氏杆菌感染率为18%~31%[8]。目前仅应用于科研,临床因实验室条件限制不能常规开展。
RBT主要检测血清中总抗体,技术简单,价格便宜,被广泛作为初筛试验使用。Skendros等[9]研究显示,在急性期,RBT敏感性接近100%,特异性87.5%,阴性预测值接近100%,而阳性预测值只有11.4%。然而,Arabaci等[10]对急性期患者研究发现,RBT敏感性48.1%,特异性96.1%,阳性预测值为1,阴性预测值低于0.5。由此可见,不同地区RBT急性期诊断价值存在差异。Al Dahouk等[11]认为,慢性期RBT敏感性差,约70%。总体而言,RBT对于没有布氏杆菌暴露危险因素患者诊断价值较高,对于反复暴露和既往感染患者诊断价值有限[12]。
SAT常被用作布鲁菌病的诊断技术,主要检测IgG、IgM和IgA。WHO指南推荐其为初筛试验,我国指南认定为确诊试验。但是,无论作为初筛试验,还是确诊试验,SAT均存在一定问题:(1)具有诊断学意义的抗体滴度尚未确定。WHO指南推荐SAT≥1∶160为布鲁菌病诊断标准。我国指南规定急性期诊断标准为SAT滴度≥1∶100,慢性期≥1∶50。(2)敏感性一般。据统计,SAT在急性期诊断敏感性从37.4%~90%[10,13]不等。慢性期敏感性差,为27.5%[14]。但恢复期SAT滴度较急性期升高4倍或以上,诊断价值较高[15]。
Coombs主要检测血清中不完全和非凝集抗体,作为SAT的补充。Coombs在慢性期和复发患者中诊断价值优于血清凝集试验,敏感性和特异性较高。不仅如此,Roushan等[6,10]研究认为,Coombs对于急性期诊断价值优于SAT、RBT和ELISA等。脑脊液Coombs对于合并脑膜炎患者诊断价值较大[14,16]。但该项检测方法操作复杂、耗时,需要一定的设备,难以在临床常规开展。
ELISA能够检测血清中IgM和IgG抗体。Roushan等[6,10]研究显示,单独检测IgM抗体可为急性期患者提供可靠的诊断,敏感性和特异性与SAT和Coombs相近。但是,单一检测血清中布氏杆菌抗体,可能会导致假阴性结果[16,17]。例如,当患者体内存在高滴度的IgG抗体时,干扰对IgM抗体的检出。不仅如此,类风湿因子也可导致假阴性结果,试验前应将其除去。ELISA对慢性期和复发患者的诊断价值优于SAT,与Coombs相似,但试验方法更为简单[15,18]。
当前,用编码BCSP31设计的B4/B5引物常被用于人布鲁菌病诊断。Casanova等[17,19]研究发现,诊断布鲁菌病急性期敏感性为98.3%,特异性为100%。对慢性期和复发患者也有一定诊断价值[20]。Fadeel等[18,21]报道了一个多重PCR实验(Bruce-ladder)用于从种水平上鉴定所有布氏杆菌,包括布氏杆菌的6个陆生种、海洋种和疫苗株S19、RB51、Revl。另有研究对比了分别以IS711、bcsp31、per设计的探针和引物的实时PCR,结果证明依据IS711设计引物和探针的PCR在鉴别布氏杆菌时表现最好的灵敏性、特异性、高效性和重复性[19,22]。Castano等[20,23]研究显示,在布鲁菌病流行地区,用以B4/B5为引物的传统PCR作为布鲁菌病初筛试验,以IS711为引物的实时PCR作为确证试验,不仅可用于布鲁菌病诊断,还可鉴定种型,具有广阔应用前景。
目前,我国布鲁菌病实验室诊断主要依靠RBT初筛,SAT进行确诊。但是,SAT试验作为确诊试验存在不足,表现在:(1)无论急性期还是慢性期,具有诊断价值的抗体滴度阈值尚未确定,缺乏大规模样本验证。(2)在疾病早期,由于抗体合成需要至少1周时间,SAT滴度可能<1∶160[3,4,23]。因此,对于急性期患者,一份SAT检测结果滴度<1∶160,不能除外布鲁菌病。临床高度怀疑布鲁菌病应在1~2周后复查。(3)SAT对于慢性期诊断特异性一般。32%的患者即使经过正规治疗,随访1年后,SAT滴度仍≥1∶80[12]。因此,布鲁菌诊断必须结合患者病史、临床表现和实验室检查进行综合判定。当前,开展新型实验室诊断技术迫在眉睫。
PCR技术作为病原学检测技术已经开始广泛应用于临床。第一代PCR技术通常采用电泳的方法对PCR产物进行分析,存在操作繁琐,容易出现交叉污染,只适用于定性研究等局限。为了克服传统PCR的不足,并满足生物学研究中对核酸定量分析的要求,1992年诞生了第二代PCR,即荧光定量PCR。荧光定量PCR在PCR扩增的同时对反应体系中引入的荧光信号进行实时检测分析,通过三个参数(荧光信号、-Cq值、DNA模板起始浓度)间的关系,确定靶标基因相对于外部参照(标准曲线或对照样本)的含量或表达水平。由于荧光定量PCR的结果曲线依赖-Cq值、PCR扩增效率和参照系,2009年由科学家们协商制订的定量PCR实验指南明确了定量PCR试验流程标准化和质量控制的必要性;更具意义的是指南还给出了规范定量PCR流程和质控环节的check-list,其核心目标旨在规范各实验室的数字PCR技术流程,统一试验技术思路、保证荧光定量PCR试验信息的透明度,以确保定量PCR试验结果的重复性、可靠性。然而对于-Cq值、PCR扩增效率和参照系的依赖仍是定量PCR技术的最大技术瓶颈,在这个意义上的定量也只能是相对的、间接的。而且在靶核酸分子风度低、样本间模板浓度差异细微的情况下,定量PCR的检测灵敏度和精确度都受到了限制,已不能满足临床实验室诊断的要求。
在这样的背景下,第三代PCR技术应运而生。QX200微滴式数字PCR系统属于第三代PCR技术。QX200微滴发生器可将含有核酸分子的荧光PCR反应体系分割成数万个纳升级的微滴,核酸分子在各微滴中随机分级,每个微滴或不含特检核酸靶分子,或者至少一个待检核酸靶分子,且每个微滴都是一个独立的PCR反应器。经PCR扩增后,QX200微滴分析仪逐个对每个微滴进行检测,有荧光信号的微滴判读为“1”,没有荧光信号的微滴判读为“0”,从而将荧光模拟信号数字化,因此该技术被称为数字PCR。最终根据泊松分布原理及阳光微滴的比例,分析软件可直接给出待检靶分子的拷贝数浓度,上述过程中荧光信号产生原理与定量PCR相同,可以采用具有序列特异性TapMan探针,也可以采用成本更低的新型核酸嵌入式染料-EvaGreen,因此,定量PCR与数字PCR的衔接是无缝的。
全新的数字化终点检测方式和分子技术的定量手段,赋予QX200微滴式数字PCR系统卓越的性能,即无需标准曲线和参照,对影响PCR效率的抑制物不敏感,大大提高了检测灵敏度、精确度、准确度和重复性,并实现了真正意义上的绝对定量。数字PCR技术较普通PCR技术而言,敏感性更高,且能够定量,是今后早期快速检测布鲁菌的发展方向。
本研究初步探讨分析15例布鲁菌恢复期病例的临床资料和数字PCR检测血清布鲁菌DNA定量检测结果。本研究结果显示,15例患者布鲁菌血清凝集试验结果均为阳性,说明凝集试验抗体可能为既往感染后产生的IgG抗体,并不能区分现症感染和既往感染。14例患者未在血清中检测出布鲁菌DNA,仅有1例患者血清布鲁菌DNA定量检测结果为阳性,说明部分布鲁菌病恢复期患者血清中布鲁菌含量很低或不存在。因此,对于规范治疗进入恢复期仍然有自觉症状的患者,可以利用数字PCR技术检测血清布鲁菌DNA的含量,为布鲁菌病的后续治疗提供依据。同时,数字PCR检测血清布鲁菌DNA阳性患者,血培养也是阳性,表明数字PCR可以取代血培养作为恢复期是否还有布鲁菌存在的一种方法,但只是初步探讨,尚需要扩大样本量验证。对于血清布鲁菌数字PCR检测阳性的患者,考虑存在现症布鲁菌感染,临床应继续给予抗布鲁菌治疗。
临床资料显示,血清布鲁菌DNA检测阳性病例较阴性病例有明显的高热症状(体温39.5℃),且布鲁菌血培养阳性,提示存在菌血症。14例血清布鲁菌DNA定量检测阴性患者有不同程度发热,但无高热,体温37.3~38℃,血培养阴性,提示可能不存在布鲁菌菌血症。14例患者都存在不同程度的腰痛、关节痛和睾丸肿痛等自觉布鲁菌病临床症状,分析靶器官损伤可能不是布鲁菌直接损伤所致,而是由迟发型免疫反应所致,与文献报道[9,10]相符。对于布鲁菌数字PCR检测阴性,但仍有自觉症状的患者,是否需要继续治疗,需综合患者临床表现,红细胞沉降率、C-反应蛋白、血清凝集试验结果综合考虑,评估是否需要继续治疗。
1 Al Dahouk S,Nockler K.Implication of laboratory diagnosis on brucellosis therapy.Expert Rev Anti Infect Ther,2011,9:833-845.
2 Kamal IH1,Al Gashgari B,Moselhy SS,et al.Two-stage PCR assay for detection of human brucellosis in endemic areas.BMC Infect Dis,2013,21:145.
3 Franco MP,Mulder M,Gilman RH,et al.Human brucellosis.Lancet Infect.Dis,2007,7:775-786.
4 Zai X,Yang Q,Liu K,et al.A comprehensive proteogenomic study of the human Brucellar vaccine strain 104M.BMC Genomics,2016,17:402.
5 Gomez MC,Nieto JA,Rosa C,et al.Evaluation of seven tests for diagnosis of human brucellosis in an area where the disease is endemic.Clin Vacc Immunol,2008,15:1031-1033.
6 Roushan MK,Amiri MJ,Larly A,et al.Follow-up standard agglutination and 2-mercaptoethanol tests in 175 clinical cured cases of human brucellosis.International Journal of Infectious Diseases,2010,14:e250-e253.
7 Mantur B,Parande A,Amarnath S,et al.ELISA versus conventional methods of diagnosing endemic brucellosis.Am J Trop Med Hyg,2010,83:314-318.
8 Ko J,Splitter GA.Molecular host-pathogen interaction in brucellosis: current understanding and future approaches to vaccine development for mice and humans.Clin Microbiol Rev,2003,16:65.
9 Skendros P,Pappas G,Boura P.Cell-mediated immunity in human brucellosis.Microbes Infect,2011,13:134.
10 Arabaci F,Oldacay M.Evaluation of serological diagnostic tests for human Brucellosis in an endemic area.Journal of Microbiology and Infectious Diseases,2012,2:50-56.
11 Al Dahouk S,Tomaso H,Nockler K,et al.Laboratory-based diagnosis of brucellosis-a review of the literature.Part Ⅰ: techniques for direct detection and identification of Brucella spp.Clin Lab,2003,49:487-505.
12 Andriopoulos P,Kaloqerakou A,Rebelou D,et al.Prevalence of Brucella antibodies on a previously acute brucellosis infected population: sensitivity,specificity and predictive values of Rose Bengal and Wright standard tube agglutination tests.Infection,2015,43:325-330.
13 Gomez MC,Nieto JA,Rosa C,et al.Evaluation of seven tests for diagnosis of human brucellosis in an area where the disease is endemic.Clin Vacc Immunol,2008,15:1031-1033.
14 Mantur B,Parande A,Amarnath S,et al.ELISA versus conventional methods of diagnosing endemic brucellosis.Am J Trop Med Hyg,2010,83:314-318.
15 Espinosa BJ,Chacaltana J,Mulder M,et al.Comparison of culture techniques at different stages of brucellosis.Am J Trop Med.Hyg,2009,80:625-627.
16 Karsen H,Tekin Koruk S,Duygu F,et al.Review of 17 Cases of Neurobrucellosis: Clinical Manifestations,Diagnosis,and Management.Arch Iran Med,2012,15:491-494.
17 Casanova A,Ariza J,Rubio M,et al.Brucellacapt versus classical tests inthe serological diagnosis and management of human brucellosis.Clin.Vaccine Immunol,2009,16:844-851.
18 Fadeel MA,Hoffmaster AR,Shi J,et al.Comparison of four commercial IgM and IgG ELISA kits for diagnosing brucellosis.J Med Microbiol,2011,60:1767-1773.
19 Queipo-Ortuno MI,Morata P,Ocon P,et al.Rapid diagnosis of human brucellosis by peripheral-blood PCR assay.J Clin Microbiol,1997,35:2927-2930.
20 Castano MJ,Solera J.Chronic brucellosis and persistence of Brucella melitensis DNA.J Clin Microbiol,2009,47:2084-2089.
21 Lopez-Goni I,Garcia-Yoldi D,Marin CM,et al.Evaluation of a multiplex PCR assay (Bruce-ladder) for molecular typing of all Brucella species,including the vaccine strains.J Clin Microbiol,2008,46:3484-3487.
22 Bounaadja L,Albert D,Chenais B,et al.Real-time PCR for identification of Brucella spp: a comparative study of IS711,bcsp31 and pertarget genes.Vet Microbiol,2009,137:156-164.
23 Memish Z,Mah MW,Al Mahmoud S,et al.Brucella bacteraemia: clinical and laboratory observations in 160 patients.J Infect,2000,40:59-63.
10.3969/j.issn.1002-7386.2017.15.013
项目来源:首都医科大学附属北京地坛医院院内科研基金(编号:DTQL201404)
010000 呼和浩特市,内蒙古医科大学附属医院药剂部(郭瑛);首都医科大学附属北京地坛医院感染性疾病诊疗与研究中心,感染病科国家临床重点专科(韩冰、孙华丽、蒋荣猛);中科院北京基因组研究所(王丽、刘贵明)
蒋荣猛,100015 首都医科大学附属北京地坛医院感染性疾病诊疗与研究中心,感染病科国家临床重点专科;
E-mail:13911900791@163.com
R 516.7
A
1002-7386(2017)15-2292-04
2017-02-14)

