HAG联合地西他滨治疗骨髓增生异常综合征临床效果及安全性分析
刘艳芬 冯志刚 訾建杰 刘欣 张成侠
HAG联合地西他滨治疗骨髓增生异常综合征临床效果及安全性分析
刘艳芬 冯志刚 訾建杰 刘欣 张成侠
目的 探讨高三尖杉酯碱+阿糖胞苷+粒细胞集落刺激因子(HAG)联合地西他滨治疗骨髓增生异常综合征临床效果并对安全性进行评价。方法 86例骨髓异常增生综合征患者随机分为HAG组和联合组,每组43例。HAG组采用高三尖杉酯碱静脉滴注,1 mg/d,1次/d,阿糖胞苷静脉滴注,2 mg/kg,1次/d,粒细胞集落刺激因子300 μg/d,静脉滴注,1次/d,3种药物均连续使用14 d。联合组在HAG组治疗基础上加用地西他滨,静脉滴注,15 mg/m2,连续输注3 h以上,每8 小时1次,连用3 d。观察2组患者治疗前后血管内皮生长因子、白细胞、血小板和血红蛋白水平;观察2组不良反应发生情况及复发率;随访至2016年1月,观察2组总体生存时间和无病生存时间,并绘制生存曲线。结果 2组治疗后血管内皮生长因子、白细胞、血小板和血红蛋白水平均显著高于治疗前,且联合组高于HAG组,差异均有统计学意义(P<0.05)。联合组疗效优于HAG组,差异有统计学意义(U=2.118,P<0.05)。联合组完全缓解率和总有效率明显高于HAG组,差异有统计学意义(P<0.05)。2组血小板减少、腹泻、肝功能损伤发生率比较,差异无统计学意义(P<0.05)。联合组肺部感染、恶心呕吐、发热的发生率明显高于HAG组,复发率明显低于HAG组,差异均有统计学意义(P<0.05)。随访至2016年1月,HAG组死亡14例,联合组死亡6例,联合组总体生存时间和无病生存时间显著高于HAG组,差异有统计学意义(P<0.05)。结论 HAG联合地西他滨治疗骨髓增生异常综合征可以显著改善患者血管内皮生长因子和相关血细胞水平,延长患者生存时间,降低病死率,临床效果显著。
骨髓增生异常综合征;地西他滨;治疗结果
骨髓增生异常综合征是一组异质性的造血系统的克隆性疾病,多由遗传、表观遗传或衰老造血干细胞微环境的改变而发病,一般分为低风险和高风险骨髓增生异常综合征,是中老年人最常见的血液系统恶性肿瘤[1,2]。骨髓增生异常综合征的病理生理包括正常的造血功能的抑制和减少髓系祖细胞分化,与外周血细胞减少的主要后果和增加风险进化在急性髓系白血病。虽然目前生物学的了解增加导致改善患者风险分层和预后、但临床治疗进展相对滞后[3]。异基因造血干细胞移植是唯一可能根治性治疗骨髓增生异常综合征的方法,但广泛应用后高淋巴增殖性疾病风险和高病死率成为其临床推广应用的阻碍[4]。研究发现,去甲基化制剂可以改变实体瘤患者的甲基化状态,提高临床疗效[5]。本研究通过高三尖杉酯碱+阿糖胞苷+粒细胞集落刺激因子(HAG)联合地西他滨治疗骨髓增生异常综合征,探讨其治疗效果并对安全性进行评价。
1 资料与方法
1.1 一般资料 选取2014年2月至2015年1月我院住院治疗的骨髓异常增生综合征患者86例,其中男49例,女37例;年龄25~72例,平均年龄(53.6±6.3)岁;病程1.5~7.2年,平均病程(4.3±1.2)年;分型:难治性贫血伴原始细胞增多-2 53例,难治性贫血伴原始细胞增多-1 23例,骨髓丧生异常综合征转化急性髓系白血病7例,慢性-单核细胞白血病3例;国际骨髓增生异常综合征预后积分系统(IPSS)评价:中危-1 28例,中危-2 47,高危11例;骨髓增生活跃程度:明显活跃28例,活跃35例,非活跃23例;合并疾病:冠心病23例,高血压21例,糖尿病14例。患者根据随机数字表分为HAG组和联合组,每组43例。HAG组中,男24例,女19例;年龄26~71例,平均年龄(54.3±6.5)岁;病程1.5~7.2年,平均病程(4.2±1.1)年;分型:难治性贫血伴原始细胞增多-2 27例,难治性贫血伴原始细胞增多-1 11例,骨髓丧生异常综合征转化急性髓系白血病4例,慢性-单核细胞白血病1例;IPSS评价:中危-1 15例,中危-2 22例,高危6例;骨髓增生活跃程度:明显活跃14例,活跃17例,非活跃12例;合并疾病:冠心病11例,高血压10例,糖尿病7例。联合组中,男25例,女18例;年龄25~72例,平均年龄(53.4±6.0)岁;病程1.5~7.1年,平均病程(4.4±1.3)年;分型:难治性贫血伴原始细胞增多-2 26例,难治性贫血伴原始细胞增多-1 12例,骨髓丧生异常综合征转化急性髓系白血病3例,慢性-单核细胞白血病2例;IPSS评价:中危-1 13例,中危-2 25,高危5例;骨髓增生活跃程度:明显活跃14例,活跃18例,非活跃11例;合并疾病:冠心病12例,高血压11例,糖尿病7例。2组患者性别比、平均年龄、病程、分型、IPSS评价、骨髓增生活跃程度、合并疾病等比较,差异无统计学意义(P>0.05)。
1.2 纳入与排除标准
1.2.1 纳入标准:①入选患者均符合“骨髓增生异常综合征诊断与治疗中国专家共识(2014年版)”[6]相关诊断标准;②患者意识清楚,能配合临床诊疗;③患者和(或)家属知情同意,并签署知情同意书;④经过医院临床试验伦理委员会审查批准。
1.2.2 排除标准:①伴发其他恶性肿瘤者;②肝肾功能异常者;③患者意识不清或有精神疾患不能配合诊疗者;④治疗前经过成分输血、造血生长因子、免疫调节治疗、去甲基化药物、化疗或造血干细胞移植等治疗;⑤对治疗药物成分过敏者;⑥妊娠期女性和哺乳期产妇;⑦患者和(或)家属不同意进行治疗或中途退出者。
1.3 治疗
1.3.1 HCG组:采用高三尖杉酯碱(辰欣药业股份有限公司,1 ml∶1 mg)+阿糖胞苷(海正辉瑞制药有限公司)+粒细胞集落刺激因子(协和发酵麒麟株式会社)进行治疗。高三尖杉酯碱采用静脉滴注,1 mg/d,1次/d,加入5%葡萄糖注射液250 ml缓慢滴注,连续使用14 d;阿糖胞苷采用静脉滴注,2 mg/kg,1次/d,连续使用14 d;粒细胞集落刺激因子300 μg/d静脉滴注,1次/d,连续使用14 d。
1.3.2 联合组:在HAG组治疗基础上加用地西他滨(正大天晴药业集团股份有限公司),静脉滴注,剂量为15 mg/m2,连续输注3 h以上,每8 小时1次,连用3 d。
1.4 观察指标 (1)观察2组患者治疗前后血管内皮生长因子、血小板和血红蛋白水平,白细胞计数;(2)观察2组不良反应发生情况及复发率;(3)随访至2016年1月,观察2组总体生存时间和无病生存时间,并绘制生存曲线。
1.5 疗效判定 参照骨髓增生异常综合征国际工作组制定的疗效标准[7]:完全缓解:骨髓中原始细胞所占比例≤5%,且所有细胞系均恢复正常,外周血象恢复正常且无原始细胞;部分缓解:经过治疗后患者骨髓中原始细胞比例较治疗前减少至少50%,但仍>5%;疾病稳定:患者经治疗后各项指标均有改善,但未达到部分缓解的标准,且至少8周无疾病进展证据;治疗失败:患者治疗期间出现死亡或疾病进展。总有效率=完全缓解率+部分缓解率。

2 结果
2.1 2组治疗前后血管内皮生长因子、白细胞、血小板和血红蛋白水平比较 2组治疗前血管内皮生长因子、白细胞、血小板和血红蛋白水平比较差异无统计学意义(P>0.05),2组治疗后血管内皮生长因子、白细胞、血小板和血红蛋白水平均显著高于治疗前,且联合组高于HAG组,差异均有统计学意义(P<0.05)。见表1。

表1 2组治疗前后血管内皮生长因子、白细胞、血小板和血红蛋白水平比较 ±s
注:与治疗前比较,*P<0.05;与HAG组比较,#P<0.05
2.2 2组疗效比较 联合组疗效优于HAG组,差异有统计学意义(u=2.118,P<0.05)。联合组完全缓解率和总有效率明显高于HAG组,差异有统计学意义(P<0.05)。见表2。

表2 2组疗效比较 n=43,例(%)
注:与HAG组比较,*P<0.05
2.3 2组不良反应及复发率比较 2组血小板减少、腹泻、肝功能损伤发生率比较,差异无统计学意义(P<0.05)。联合组肺部感染、恶心呕吐、发热发生率明显高于HAG组,复发率明显低于HAG组,差异均有统计学意义(P<0.05)。2组不良反应经对症治疗后均有好转。见表3。

表3 2组不良反应及复发率比较 n=43,例(%)
注:与HAG组比较,*P<0.05
2.4 2组随访情况 随访至2016年1月,HAG组死亡14例,联合组死亡6例,联合组总体生存时间和无病生存时间显著高于HAG组,差异有统计学意义(P<0.05)。见表4,图1。
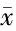
表4 2组总体生存时间和无病生存时间比较 n=43,月,±s
注:与HAG组比较,*P<0.05
3 讨论
骨髓增生异常综合征是一种以血细胞减少和衰弱倾向发展的急性髓系白血病[8]。其发病原因多于肿瘤家族史及增加肉类的摄入量有关,接触农药、杀虫剂、除草剂,肉类蛋类每周摄入增加,酒精摄入量增加均可增加其发病风险[9]。目前骨髓增生异常综合征的治疗仍存在一定争议,药物治疗缺乏大型多中心临床试验对生存影响的证据,而异基因造血干细胞移植尽管有一定优势,但其残留的细胞遗传学异常增加患者非复发死亡率[10,11]。本研究采用HAG联合地西他滨治疗骨髓增生异常综合征取得了良好的试验效果。
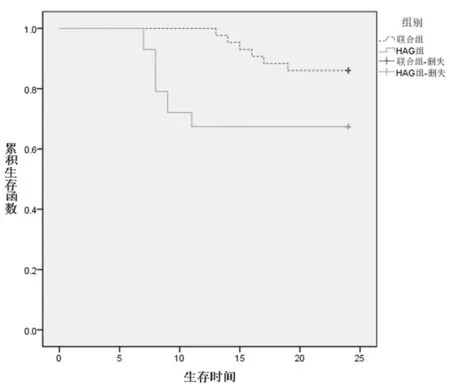
图1 2组生存曲线图
HAG治疗主要药物是高三尖杉酯碱、阿糖胞苷和粒细胞集落刺激因子。高三尖杉酯碱具有抗肿瘤特性的植物生物碱,具有防止蛋白质合成的初始伸长步独特的作用机制,已经广泛应用于治疗慢性粒细胞白血病,急性髓系白血病和骨髓增生异常综合征[12]。阿糖胞苷具有抑制细胞DNA合成,干扰细胞增殖的作用,其联合地西他滨对单用地西他滨治疗的老年急性髓系白血病效果不佳的患者,具有提高缓解率,减少并发症的作用[13]。粒细胞集落刺激因子的作用为动员骨髓中性粒细胞移行至外周血中,促进骨髓中粒细胞前体分化和增殖,增强中性粒细胞的作用[14]。HAG治疗骨髓增生异常综合征是一种临床常用的治疗手段。Xie等[15]对2 314例进行HAG治疗的骨髓增生异常综合征患者进行荟萃分析发现,HAG治疗完全缓解率高于密集化疗,早期病死率、骨髓抑制发生率也较低,说明HAG方案较化疗更有效,且有更好的耐受性。Xiao等[16]对24例骨髓增生异常综合征患者进行HAG治疗,发现整体回应率为79%,一个完全缓解率58.3%,部分缓解率20.7%,中位总生存期(OS)为36.2个月,估计的3年总生存率为45.8%,说明HAG治疗可显著提高骨髓增生异常综合征患者,尤其是具有良好和中间细胞遗传学的患者。本研究发现,2组治疗后血管内皮生长因子、白细胞、血小板和血红蛋白水平均显著高于治疗前,差异均有统计学意义(P<0.05)。
地西他滨为一种2’-脱氧胞苷类似物,作用于细胞增殖期,使临床应用广泛的DNA甲基化抑制剂,可以引发甲基化导致的表观遗传沉默的肿瘤抑制基因在体外和体内连续激活[17]。Wu等[18]对135例急性髓系白血病患者采用地西他滨联合HCG进行治疗发现,患者中位生存时间为23.8个月,24个月总生存率为48.9%。Finelli等[19]发现地西他滨可以提高骨髓异常增生综合征患者外周血细胞水平,改善生活质量,减少或消除输血的需要,延缓白血病的演变,延长总体生存时间。本研究发现,联合组治疗后血管内皮生长因子、白细胞、血小板和血红蛋白水平均显著高于HAG组,差异均有统计学意义(P<0.05)。联合组疗效优于HAG组,差异有统计学意义(u=2.118,P<0.05)。联合组完全缓解率和总有效率明显高于HAG组,差异有统计学意义(P<0.05)。联合组肺部感染、恶心呕吐、发热的发生率明显高于HAG组,复发率明显低于HAG组,差异均有统计学意义(P<0.05)。随访至2016年1月,HAG组死亡14例,联合组死亡6例,联合组总体生存时间和无病生存时间显著高于HAG组,差异有统计学意义(P<0.05)。
综上所述,HAG联合地西他滨治疗骨髓增生异常综合征可以显著改善患者血管内皮生长因子和相关血细胞水平,延长患者生存时间,降低病死率,临床效果显著。
1 Nomdedeu M,Pereira A,Ramos F,et al.Excess mortality in themyelodysplastic syndromes.Am J Hematol,2017,92:149-154.
2 Stankov K,Stankov S,Katanic J.Genetic and Epigenetic Drug Targets in Myelodysplastic Syndromes.Curr Pharm Des,2017,23:135-169.
3 Abel GA,Buckstein R.Integrating Frailty,Comorbidity,and Quality of Life in the Management ofMyelodysplastic Syndromes.Am Soc Clin Oncol Educ Book,2016,35:e337-344.
4 Saber W,Horowitz MM.Transplantation formyelodysplastic syndromes:who,when,and which conditioning regimens.Hematology Am Soc Hematol Educ Program,2016,27:478-484.
5 Linnekamp JF,Butter R,Spijker R,et al.Clinical and biological effects of demethylating agents on solid tumours - A systematic review.Cancer Treat Rev,2017,54:10-23.
6 中华医学会血液学分会.骨髓增生异常综合征诊断与治疗中国专家共识(2014年版).中华血液学杂志,2014,35:1042-1048.
7 Cheson BD,Greenberg PL,Bennett JM,et al.Clinical application and proposal for modification of the International Working Group (IWG) response criteria in myelodysplasia.Blood,2006,108:419-425.
8 Glenthoj A,Orskov AD,Hansen JW,et al.Immune Mechanisms inMyelodysplastic Syndrome.Int J Mol Sci,2016,17:E944.
9 Avgerinou C,Giannezi I,Theodoropoulou S,et al.Occupational,dietary,and otherrisk factorsformyelodysplastic syndromesin Western Greece.Hematology,2017,19:1-11.
10 Gangat N,Patnaik MM,Tefferi A,et al.Myelodysplastic syndromes:Contemporary review and how we treat.Am J Hematol,2016,91:76-89.
11 Trottier BJ,Sachs Z,DeFor TE,et al.Novel disease burden assessment predicts allogeneic transplantation outcomes in myelodysplastic syndrome.Bone Marrow Transplant,2016,51:199-204.
12 Lü S,Wang J.Homoharringtonineand omacetaxine for myeloid hematological malignancies.J Hematol Oncol,2014,7:2.
13 Bashir Y,Geelani S,Bashir N,et al.Role of low dosecytarabinein elderly patients with acute myeloid leukemia:An experience.South Asian J Cancer,2015,4:4-6.
14 Kiura K.Overviewof guidelines for proper use of theG-CSF(2013 edition).Gan To Kagaku Ryoho,2014,41:687-690.
15 Xie M,Jiang Q,Li L,et al.HAG (Homoharringtonine,Cytarabine,G-CSF) Regimen for the Treatment of Acute Myeloid Leukemia andMyelodysplastic Syndrome:A Meta-Analysis with 2,314 Participants.PLoS One,2016,11:e0164238.
16 Xiao F,Li Y,Xu W,et al.Efficacy and safety ofhomoharringtonineplus cytarabine and aclarubicin for patients withmyelodysplastic syndrome-RAEB.Oncol Lett,2016,11:355-359.
17 Hackanson B,Daskalakis M.Decitabine.Recent Results Cancer Res,2014,201:269-297.
18 Wu D,Du X,Jin J,et al.Decitabinefor Treatment of Myelodysplastic Syndromesin Chinese Patients:An Open-Label,Phase-3b Study.Adv Ther,2015,32:1140-1159.
19 Finelli C,Follo MY,Stanzani M,et al.Clinical Impact of Hypomethylating Agents in the Treatment of Myelodysplastic Syndromes.Curr Pharm Des,2016,22:1255-1257.
Therapeutic effects and safety of HAG combined with decitabine on myelodysplastic syndrome
LIUYanfen,FENGZhigang,ZIJianjie,etal.
DepartmentofHematology,TanshanMunicipalPeople’sHospital,Hebei,Tangshan063001,China
Objective To investigate the therapeutic effects of homoharringtonine+aracytidine+granulocyte colony-stimulating factor (HAG) combined with decitabine on myelodysplastic syndrome, and to evaluate its safety.Methods Eighty-six patients with myelodysplastic syndrome were randomly divided into HAG group and combination treatment group,with 43 patients in each group.The patients in HAG group were treated with homoharringtonine by intravenous drip, 1mg/d, 1 time/d, aracytidine by intravenous drip,2mg/kg,1 time/d,granulocyte colony-stimulating factor by intravenous drip,300g/d,1 time/d, for 14 days.However,the patients in combination treatment group,on the basis of HAG group,were treated with decitabine by intravenous infusion, 15mg/m2,continuous infusion for 3 hours or more,1 time/8 hours,for 3 days.The changes of vascular endothelial growth factor, white blood cell,platelet and hemoglobin levels were observed before and after treatment,moreover, the incidence rate of adverse reactions and relapse rate were observed and compared between two groups. The patients in both group were followed up until January 2016,and the overall survival time and disease free survival time were observed,besides, the survival curve was drawn.Results After treatment the levels of vascular endothelial growth factor,white blood cell,platelet and hemoglobin in both groups were significantly higher than that before treatment,moreover, which in combination treatment group were significantly higher than those in HAG group (P<0.05).The therapeutic effects in combination treatment group were superior to those of HAG group (U=2.118,P<0.05).The complete remission rate and total effective rate in combination treatment group were significantly higher than those in HAG group (P<0.05). However there were no significant differences in the incidence rates of thrombocytopenia,diarrhea,liver function injury between two groups (P>0.05). After follow-up till January 2016,14 patients died in HAG group, however,only 6 patients died in combination treatment group.Moreover the overall survival time and disease-free survival time in combination treatment group were significantly higher than those in HAG group (P<0.05).Conclusion The HAG combined with decitabine in treatment of myelodysplastic syndrome can significantly improve the levels of vascular endothelial growth factor and related blood cells,prolong the survival time of patients,reduce death rate,with obvious clinical effects.
myelodysplastic syndrome; decitabine; treatment outcome
10.3969/j.issn.1002-7386.2017.15.003
063001 河北省唐山市人民医院血液科
R 551.3
A
1002-7386(2017)15-2254-04
2017-02-18)

