非小细胞肺癌患者化疗后贫血状况分析及其对生活质量的影响
张春燕,黄晓利,杨 文
·临床医学· ·论著·
非小细胞肺癌患者化疗后贫血状况分析及其对生活质量的影响
张春燕,黄晓利,杨 文
目的 了解非小细胞肺癌患者化疗后的贫血状况,分析化疗过程中造成贫血的潜在因素,并调查贫血对非小细胞肺癌患者生活质量的影响。方法 于2014年6月至2015年12月纳入成都医学院第一附属医院医院肿瘤科的103例接受化疗的非小细胞肺癌患者,对其化疗后的贫血状况以及化疗过程中有可能影响贫血的潜在因素如个体基本情况、肿瘤疾病情况、营养状态及一般身体状况等进行调查,并对其化疗后生活质量进行评估,分析贫血与生活质量的相关性。结果 化疗前贫血发生率为32.0%,化疗后贫血发生率为57.3%,化疗前后贫血发生率明显升高;贫血的发生与加重、患者年龄、是否有系统合并症、肿瘤分期、白蛋白水平以及ZPS评分相关;与非贫血患者相比,贫血患者生活质量更差。结论 临床工作者应重视非小细胞肺癌患者化疗过程中贫血的发生及其对患者生活质量的影响,及时发现并积极干预,以改善非小细胞肺癌患者的生活质量和心理体验。
化疗;贫血;非小细胞肺癌;生活质量
肿瘤相关性贫血为肿瘤患者的常见并发症之一,可由肿瘤疾病本身对机体的破坏和消耗造成,以及由抗肿瘤治疗尤其是化疗引起。有报道显示肿瘤患者的贫血发生率较高,在被诊断出肿瘤时贫血发生率即为39%,13%的非贫血患者在诊断后的后续治疗中发展为贫血[1-2]。肺癌为我国常见的肿瘤类型,其中80%~85%为非小细胞肺癌(non small cell lung cancer,NSCLC)。化疗作为肺癌治疗的重要组成部分虽然能有效抑制肺癌进展,但同时亦可能引起或加重贫血,从而导致乏力、气促等症状,对患者的生活质量以及抗肿瘤治疗造成不利影响。肿瘤患者的贫血发生率与多种因素有关,至今仍未完全阐明。本研究分别对103例接受了化疗的肺癌患者进行调查,旨在研究化疗前后肺癌患者贫血发生率的差别,找出在化疗过程中有可能引起贫血的潜在危险因素,并分析贫血对肺癌患者生活质量的影响。
1 资料与方法
1.1 病例来源 所有病例均于2014年6月至2015年12月收治于我医院肿瘤科。纳入标准:(1)经细胞学或组织病理学检查被诊断为NSCLC;(2)既往无其他肿瘤性疾病或已无病生存5年以上;(3)接受至少3个周期的常规一线化疗;(4)签署化疗同意书。排除标准:(1)年龄<18或>80岁;(2)患有再生障碍性贫血、骨髓增生异常综合征或遗传性贫血等血液系统疾病;(3)明显的心、肝、肾功能损害或其他严重合并症;(4)化疗前3周内血红蛋白(Hb)<95 g/L;(5)化疗前2周内接受了输血治疗;(6)化疗前1年内或化疗期间接受了骨髓或干细胞移植。
选取符合上述条件的103例住院患者,其中男性患者84例,女性患者19例;中位年龄59岁(39~79岁);对全组患者按照国际肺癌研究协会(IASLC)公布的肺癌 TNM 分期系统进行划分,其中IB-II期17人,IIIA期32人,IIB期39人,IV期15人。
1.2 干预方法 采用以铂类药物为基础的一线联合化疗方案。其中吉西他滨+顺铂(GP)39例,培美曲塞+顺铂(PP)17例,紫杉醇+顺铂(TP)11例,多西他赛+顺铂(DP)36例。化疗前后患者均常规接受血常规和血生化检验并在化疗前对患者进行ZPS评分。
1.3 贫血评估 按照WHO 1999年标准,贫血按照以下分级:0级(正常):Hb≥110 g/L;I级(轻度):Hb 95~109 g/L;II级(中度):Hb 80~94 g/L;III级(重度):Hb 65~79 g/L;IV级(极重度):<65 g/L。对患者化疗前后的血红蛋白浓度进行分析以观察其是否发生了贫血。对于化疗前已经处于轻度贫血的患者,若其贫血程度上升一个等级则判定为贫血加重。
1.4 生活质量评估 采用欧洲癌症研究与治疗组织(EORTC)编制的用于评估肿瘤患者生活质量的问卷 EORTC QLQ-C30对化疗后患者的生活质量进行调查。该量表包括5个功能量表、1个总体健康状况和多个肿瘤相关症状量表,能较为全面地评估患者的总健康状况以及躯体、情绪、社会功能和一些肿瘤相关症状。将各个领域(子量表)所包括的条目得分相加并除以所包括的条目数即可得到该领域的粗分,进一步采用极差化方法将粗分化为在0~100内取值的标准化得分。功能量表领域得分越高,说明功能状况和生命质量越好,而症状领域得分越高则表明症状越多和生命质量越差。
1.5 统计学处理 通过统计学软件SPSS Statistics 20,采用χ2检验对不同组别的贫血发生/加重率进行分析;将患者的年龄、性别、肿瘤分期、肿瘤病理类型、白蛋白水平、有无其他系统合并症(冠心病、高血压、糖尿病等)以及KPS评分列为潜在影响因素,采用单因素以及多因素Logistic回归模型对化疗后患者贫血的潜在影响因素进行分析;采用χ2检验分析贫血状况与生活质量的相关性。P<0.05认为差异有统计学意义。
2 结果
2.1 化疗前后贫血发生率的比较 本组103列患者中,化疗前共有33例患者合并患有贫血,均为轻度,贫血发生率为32.0%;化疗后共59例患者患有贫血,贫血发生率为57.3%;化疗前后贫血发生率差异有统计学意义(P<0.01)。在原有33例贫血患者中,有20例患者贫血加重。
2.2 化疗后贫血的风险因素 103例NSCLC患者接受了以铂类为基础联合不同化疗药物进行辅助或者姑息化疗。接受不同化疗方案的NSCLC患者贫血新发或加重情况见表1。提示各组间贫血新发或加重情况差异无统计学意义(P=0.833)。
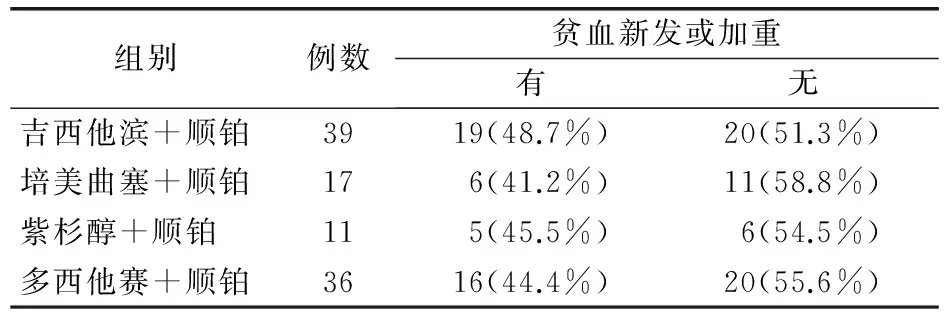
表1 接受不同含铂两药化疗方案的NSCLC患者的贫血发生情况(例)
注:NSCLC为非小细胞肺癌
显示在本组患者中不同联合用药对患者贫血状况没有明显影响。将所有患者统一纳入分析,以研究来自患者内部的个体因素对化疗后贫血状况的影响。结果显示,在60名≤65岁的患者里面,有21名患者(35.0%)出现新发贫血或贫血加重,而在43名>65岁的患者里面,却有25名患者(58.1%),2个年龄组之间贫血新发和加重率差异具有统计学意义(P=0.02)。而在84例男性患者、19例女性患者中分别有37例(44.0%)、9例(47.4%)患者出现新发贫血或者贫血加重,显示贫血新发和加重率在不同性别组之间没有明显差异(P=0.804)。
在不同肿瘤分期的患者当中,5例IB~II期患者(35.3%)、13例IIIA期患者(37.5%)、17例IIIB期患者(43.6%)、11例IV期患者(73.3%)出现了新发贫血或贫血加重,其中IV期组患者与IB~II期组患者的贫血新发和加重率差异具有统计学意义(P=0.032),IIIA期组、IIIB组患者与另外2个分期组相比差异不具有统计学意义。在59例腺癌患者中有27例患者(46.3%)新发贫血或贫血加重,而在44例鳞癌患者里面则有19例患者(43.2%),2组患者的贫血新发及加重率差异无统计学意义(P=0.683)。
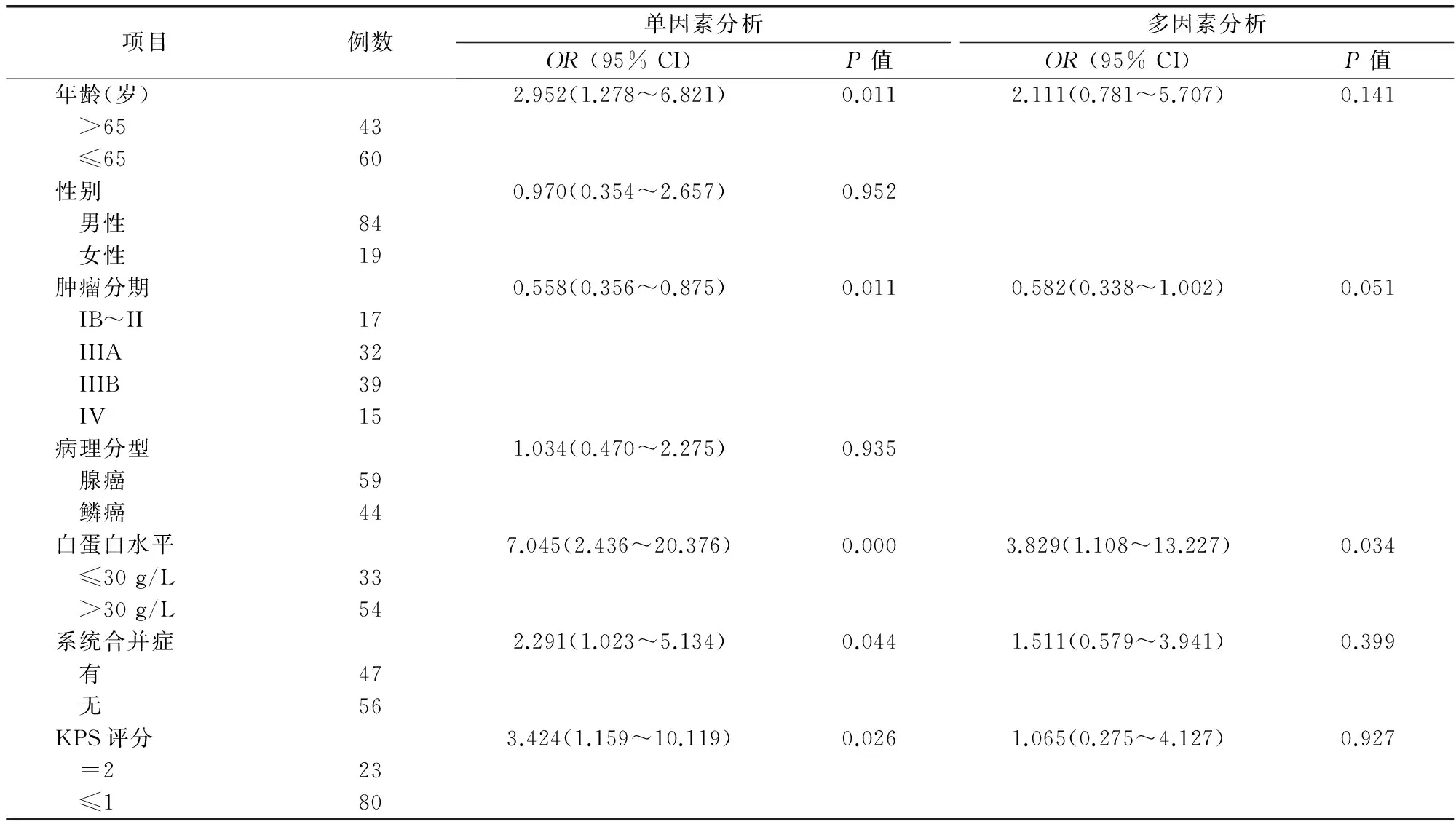
表2 化疗后贫血潜在影响因素的单因素及多因素Logistic分析
49例患者白蛋白水平≤30 g/L,其中33例患者(67.3%)出现新发贫血或贫血加重;而在54例白蛋白水平>30 g/L的患者中则有13例患者(24.0%)新发贫血或贫血加重,2组患者间差异具有统计学意义(P<0.01)。共有47例患者合并高血压、糖尿病等系统性疾病,在这47例患者里面有29例患者(61.7%)新发贫血或贫血加重;而在56例没有合并系统性疾病的患者中则有17例患者(30.3%)。在23例ZPS评分=2的患者中有16例患者(69.6%)新发贫血或贫血加重,而在80例ZPS评分≤1的患者中则有30例新发贫血或贫血加重的患者(37.5%)。贫血新发和加重率在是否合并系统性疾病以及不同ZPS评分组均具有差异,P值分别为0.003、0.009。
对引起化疗后贫血的潜在影响因素进行单因素Logistic分析,结果发现,年龄、肿瘤分期、白蛋白水平、有无系统合并症、ZPS评分与化疗后贫血密切相关,与χ2检验得到的结果相似。而多因素Logistic分析则显示白蛋白水平对化疗后贫血的影响最大(P=0.034),为化疗后贫血的危险因素(OR=3.829),见表2。
2.3 化疗后贫血对患者生活质量的影响 采用QLQ-C30量表对NSCLC患者进行调查,评价化疗后贫血对其生活质量的影响。结果显示,在化疗后,贫血患者与非贫血患者的躯体、情绪、社会功能以及总体健康状况均存在统计学差异(P<0.01),非贫血患者组在这些方面的的平均得分比贫血患者组分别高13.31、16.32、3.27、13.14分。而在肿瘤相关症状方面,疲劳、失眠、气促、食欲丧失和腹泻便秘等症状在贫血患者中较为明显(P<0.01),其症状得分分别比非贫血患者高6.88、8.17、2.98、4.43、8.95分。以上均说明在化疗后,与非贫血患者相比,贫血患者的生活质量较差,见表3。
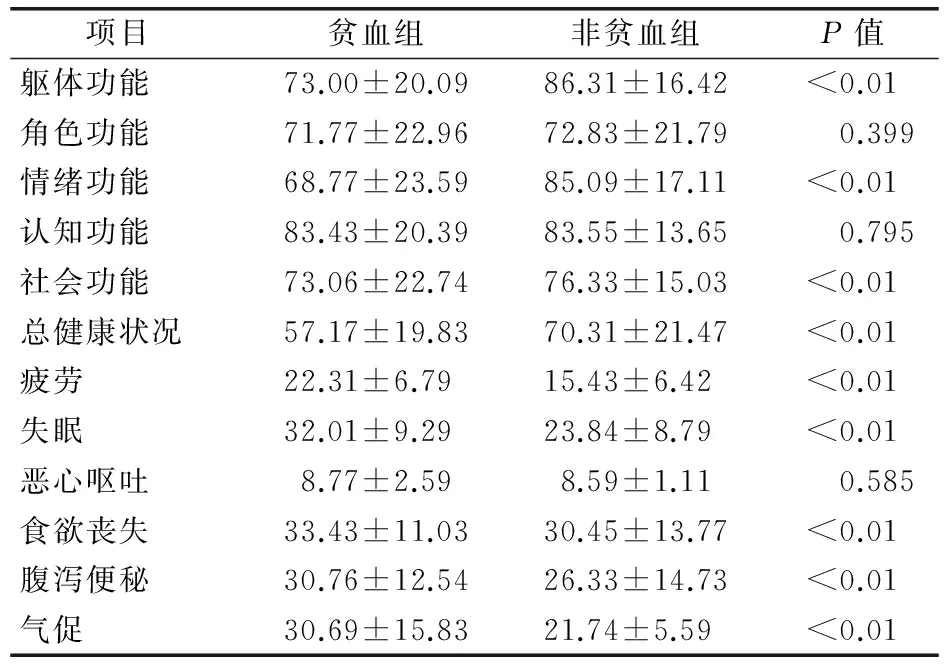
表3 2组患者的QLQ-C30评分比较(x±s)
4 讨论
此前研究所报道的肿瘤患者的贫血发生率各不相同,这可能与入组患者特征、治疗方法以及研究方法不同有关。但大部分研究均显示贫血发生率在肿瘤患者接受化疗后会有所增加。Xu等[3]开展的美国南加州健康计划调查显示NSCLC患者在接受化疗后贫血发生率从71%上升至85.2%;在欧洲开展的研究发现NSCLC患者化疗前贫血发生率为18.3%,接受第3个周期化疗后贫血发生率上升至28.4%[4];苏贺等[5]报道NSCLC患者在完成第1个以及第3个周期化疗后贫血发生率分别为6.9%和57.9%,差异有统计学意义(P=0.001);这些研究均说明化疗能在一定程度上引起贫血的发生。本组患者在化疗前贫血发生率为32.0%,化疗后贫血发生率为57.3%;化疗前后贫血发生率具有差异(P<0.001),亦证实了该结论。本组患者接受包含顺铂在内的两药化疗方案进行化疗,为NSCLC的一线化疗方案。顺铂可引起骨髓抑制,直接造成造血减少;并且能够影响体内铁代谢,造成红细胞前体生成减少[6];同时其具有较强的肾毒性,损伤肾脏从而导致促红细胞生成素分泌减少,所以使用顺铂进行化疗容易引起贫血,尤其是在大剂量、重复应用时(80 mg/m2以上)[7]。本研究未发现在同样应用顺铂进行化疗时,联合应用不同的化疗药物对贫血影响存在差异,这与Xu等人[3]的研究一致。
除了NSCLC疾病本身以及化疗对贫血的影响外,本研究亦发现化疗后贫血新发与加重率与年龄、肿瘤分期、是否有系统合并症、白蛋白水平以及ZPS评分有关。>65岁患者组的贫血发生率要高于≤65岁患者。这可能由对于化疗药物的肾脏清除率以及骨髓储备再生能力随着年龄增加而降低引起[8]。此外在年龄较大的患者里面合并患有系统性疾病(如心血管疾病、糖尿病等)以及使用相应药物的几率较大,药物的联合应用以及年龄相关药代学的改变最终会导致器官毒性的增加,使他们更容易受到贫血影响[9]。笔者研究亦发现贫血的发生与肿瘤分期有关,这可能与随着肿瘤进展,肿瘤本身对机体的消耗更严重,分期较高的肿瘤患者更容易出现营养不良;另外肿瘤进展能引起机体能量代谢的改变以及炎症反应,导致血浆中瘦素的下降及白细胞介素1、干扰素-γ等炎症因子的增加,从而抑制骨髓造血[10]。类似地,ZPS评分为2分的患者更容易出现贫血,亦与该亚组患者整体身体状况更差有关。笔者发现白蛋白水平对贫血的影响最大。低血浆白蛋白水平与营养不良密切相关,能够使转铁蛋白和血红蛋白减少,导致贫血的发生[11-12]。
本研究还发现化疗后贫血的发生或加重能够降低NSCLC患者的生活水平。QLQ-C30量表调查发现在化疗后,贫血患者的躯体、情绪、社会功能以及总体健康状况均低于非贫血患者,而肿瘤相关症状的调查亦显示贫血患者的疲劳、失眠、气促、食欲丧失和腹泻便秘较为明显。这些症状均能影响患者的日常生活运作,使患者产生无助感,从生理上和心理上对NSCLC患者造成不良影响;另外,对贫血的不耐受还会导致化疗疗程的推迟以及化疗药物剂量的减少,其造成的不适感使患者对化疗本身产生一定抗拒,影响抗NSCLC治疗的效果并与NSCLC患者的不良预后相关[13]。Mouysset JL等[14]的研究亦显示,对接受化疗的肿瘤患者进行干预,使Hb维持在100~120 g/L能够使患者在临床治疗上获益,并能提高患者的生活质量评分。所以肿瘤患者的贫血程度与其生活质量密切相关,在化疗过程中对NSCLC患者的贫血状况进行干预尤为必要。
贫血在NSCLC患者中常见,在接受化疗时其发生率更高。在临床上对重度贫血的处理是输血,但在面对轻至中度贫血时临床工作者的处理仍比较保守。另外贫血所引起的症状如疲乏、气促等亦是肺癌患者经常会出现的症状。所以相对于化疗所造成的白细胞减少和血小板下降,贫血受到的关注较少。本研究探讨了化疗对于NSCLC患者贫血的影响及化疗过程中造成贫血的其它潜在危险因素,发现NSCLC患者化疗后贫血的发生和加重率有所上升并且与NSCLC患者的年龄、肿瘤分期、是否有系统合并症、白蛋白水平以及ZPS评分有关;还调查了贫血程度与生活质量评分的相关性,发现贫血患者具有更低的生活质量。鉴于贫血对于NSCLC化疗患者的危害性,临床工作者应该予以重视、及时发现并进行相应处理,从而能够更全面地改善NSCLC化疗患者的生活质量、提高抗肿瘤治疗的效果。
[1] Ludwig H, Van Belle S, Barrett-Lee P, et al. The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients[J]. Eur J Cancer, 2004, 40(15): 2293-2306. DOI:10.1016/j.ejca.2004.06.019.
[2] Birgegard G, Aapro MS, Bokemeyer C, et al. Cancer-related anemia: pathogenesis, prevalence and treatment[J]. Oncology, 2005, 68(Suppl 1): 3-11. DOI:10.1159/000083128.
[3] Xu HR, Xu LF, John HP,et al.Incidence of anemia in patients diagnosed with solid tumors receiving chemotherapy, 2010-2013[J]. Clin Epidemiol,2016,8:61-71.
[5] 苏贺, 张凌云, 刘云鹏. 老年恶性肿瘤患者术后化疗相关性贫血的临床分析[J]. 中华肿瘤杂志, 2015, 37(4): 290-292. DOI:10.3760/cma.j.issn.0253-3766.2015.04.010.
[6] Maloisel F, Kurtz JE, Andres E, et al. Platin salts-induced hemolytic anemia: cisplatin- and the first case of carboplatin-induced hemolysis[J]. Anticancer Drugs, 1995, 6(2): 324-326. DOI:10.1097/00001813-199504000-00018.
[7] Wood PA, Hrushesky WJ. Cisplatin-associated anemia: an erythropoietin deficiency syndrome[J]. J Clin Invest, 1995, 95(4): 1650-1659. DOI:10.1172/JCI117840.
[8] Barrat FS, Lesourd BM, Louise AS, et al. Pregnancies modulate B lymphopoiesis and myelopoiesis during murine ageing[J]. Immunology, 1999, 98(4): 604-611. DOI:10.1046/j.1365-2567.1999.00918.x.
[9] Rattanasompattikul M, Molnar MZ, Zaritsky JJ, et al. Association of malnutrition-inflammation complex and responsiveness to erythropoiesis-stimulating agents in long-term hemodialysis patients[J]. Nephrol Dial Transplant, 2013, 28(7): 1936-1945. DOI:10.1093/ndt/gfs368.
[10] Lee M J, Fried S K. Integration of hormonal and nutrient signals that regulate leptin synthesis and secretion[J]. AJP: Endocrinol Metabol, 2009, 296(6): E1230-E1238. DOI:10.1152/ajpendo.90927.2008.
[11] Heidari B, Taheri H, Hajian-Tilaki K, et al. Low baseline serum albumin as a predictor of anemia in chronic hemodialysis patients[J]. Caspian J Intern Med, 2015, 6(3): 161-164.
[12] Mercadante S, Gebbia V, Marrazzo A, et al. Anaemia in cancer: pathophysiology and treatment[J]. Cancer Treat Rev, 2000, 26(4): 303-311. DOI:10.1053/ctrv.2000.0181.
[13] Watine J, Bouarioua N. Anemia as an independent prognostic factor for survival in patients with cancer[J]. Cancer, 2002, 94(10): 2793-2796. DOI:10.1002/1097-0142(20010615)91:12<2214::aid-cncr1251>3.0.co;2-p.
[14] Mouysset JL, Freier B, van den Bosch J, et al. Hemoglobin levels and quality of life in patients with symptomatic chemotherapy-induced anemia: the eAQUA study[J]. Cancer Manag Res, 2016: 1. DOI:10.2147/cmar.s88110.
(本文编辑:甘辉亮)
Incidence of anemia after chemotherapy in patients with non small cell lung cancer and its impact on life quality
ZhangChunyan,HuangXiaoli,YangWen
(DepartmentofGastroenterology,FirstHospitalAffiliatedtoChengduMedicalCollege,Chengdu610500,China)
Objective To investigate the incidence of anemia after chemotherapy in patients with non small cell lung cancer (NSCLC) and to analyze potential factors associated with anemia in the course of chemotherapy, and also to assess the impact of anemia on life quality of the patients.Methods One hundred and three patients with NSCLC admitted into the First Hospital Affiliated to Chengdu Medical College for chemotherapy from June 2014 to December 2015 were enrolled for the study. The incidence of anemia after chemotherapy and potential factors associated with anemia in the course of chemotherapy were analyzed retrospectively. The potential factors that might affect the incidence of anemia might include individual general conditions, tumor disease, nutritional status and so on. Then, assessment was made in the impact of chemotherapy on life quality, and the association between anemia and life quality was also analyzed.Results The incidence of anemia was 32.0% in the patients before chemotherapy, while the incidence of anemia after chemotherapy rose sharply to 57.3%. Statistical difference could be noted, when comparisons were made between pre and post chemotherapy. The incidence and deterioration of anemia were associated with the patient age, systemic complications, tumor stage, serum albumin level and ZPS scores. The life quality of the patients with anemia was obviously poorer, as compared with that of the patients without anemia. Conclusion Clinical physicians should be highly aware of the incidence of anemia in the NSCLC patients in the course of chemotherapy and its impact on the life quality of patients. Efforts should be made on the part of medical workers for early diagnosis and positive intervention of anemia, so as to improve the life quality and psychological experience of those NSCLC patients.
Chemotherapy; Anemia; Non small cell lung cancer; Life quality
610500 成都,成都医学院第一附属医院消化内科
R73
A
10.3969/j.issn.1009-0754.2017.03.023
2016-11-23)

