泥蒿叶总黄酮的酶法提取及其抗氧化活性评价
陈瑶,吴龙月,向福,2*,曹佩佩,向睿富,方元平,2
(1.黄冈师范学院生命科学学院,湖北黄冈438000;2.大别山特色资源开发湖北省协同创新中心,湖北黄冈438000)
泥蒿叶总黄酮的酶法提取及其抗氧化活性评价
陈瑶1,吴龙月1,向福1,2*,曹佩佩1,向睿富1,方元平1,2
(1.黄冈师范学院生命科学学院,湖北黄冈438000;2.大别山特色资源开发湖北省协同创新中心,湖北黄冈438000)
以大别山黄州地区泥蒿叶为原料,采用酶法辅助提取总黄酮。基于单因素和正交试验优化了泥蒿叶总黄酮的酶法提取工艺,并探讨了总黄酮提取物的抗氧化活性。结果表明,总黄酮提取的最佳工艺为纤维素酶用量3%,乙醇体积分数40%,料液比1∶10(g∶mL),提取温度50℃,提取时间4 h。在此条件下,总黄酮提取率为4.12%。泥蒿叶总黄酮提取液总抗氧化能力相当于相同质量浓度VC的50%,羟基自由基清除能力是相同质量浓度VC的1.4~2.7倍,表明其具有较强的抗氧化活性。
泥蒿叶;总黄酮;酶法提取;抗氧化活性;羟基自由基清除能力
泥蒿(Artemisia selengensis)是菊科(Asteraceae)蒿属多年生宿根草本植物,学名狭叶艾,又名水艾、芦蒿、蒌蒿、藜蒿、水蒿等[1],广泛分布于华北、东北及长江中下游等地区。《神农本草经》记载泥蒿“久服轻身,耳聪目明,不老”;《本草纲目》描述其“补中益气,利膈开胃,疗心悬”、“祛风寒湿痹”;民间以其全草入药,可治创伤、急性肝炎、寒冷腹痛等,且无副作用[2]。因此,泥蒿是一种集食用和药用于一身的保健蔬菜,在医药保健领域具有广阔的应用前景。
大别山地区泥蒿资源丰富,以采食其冬春季节的嫩茎为主,成熟的老茎、叶则大量废弃。泥蒿及其叶富含黄酮、谷甾醇及香豆素等生物活性物质[2-4],而黄酮类化合物则被认为是泥蒿的主要活性成分[5-6],具有防衰老、抗氧化、增强机体免疫力、抑菌、降血脂、降血糖、降血压以及缓解心血管疾病等功效[3,7-9]。探讨绿色环保、经济可行的泥蒿叶黄酮提取工艺,对综合利用泥蒿资源,发展高附加值的泥蒿产业具有较好的经济效益和现实意义。
乙醇价廉易得且毒性小,便于回收使用,故植物总黄酮的提取多采用醇提法[10]。文献报道纤维素酶通过酶解细胞壁不仅能促进植物活性成分的溶出,且和乙醇联用提取黄酮类物质还具有协同作用[11-12]。本研究以大别山黄州地区泥蒿叶为研究对象,采用酶法辅助乙醇提取泥蒿叶中总黄酮,通过单因素和正交设计试验优化提取工艺条件,并利用总抗氧化活性和羟基自由基清除能力评价泥蒿叶总黄酮提取物的抗氧化活性,以期为综合利用泥蒿资源、生产高附加值的黄酮类物质提供依据。
1 材料与方法
1.1 材料与试剂
泥蒿叶:采自黄冈市黄州区春阳蔬菜合作社基地,阴干、粉碎备用;无水乙醇、亚硝酸钠、氢氧化钠(均为分析纯):天津市凯通化学试剂有限公司;硝酸铝(分析纯):上海新宝精细化工厂;芦丁标准品(分析纯):上海金穗生物科技有限公司;酸性纤维素酶(20 000 U/g)CAS 9012-54-8:湖北帝鑫化工制造有限公司;维生素C(vitamin C,VC)标准品(纯度≥99.99%):上海麦克林生化科技有限公司;总抗氧化试剂盒(批号20161117)、羟基自由基试剂盒(批号20161121):南京建成生物工程研究所。
1.2 仪器与设备
FA2104电子分析天平:上海精细天平有限公司;Cary-100紫外可见分光光度计:美国Varian公司;DZKW-D-2电热恒温水浴锅:北京西城区医疗器械厂。
1.3 实验方法
1.3.1 芦丁标准曲线及总黄酮提取率测定
根据文献[13]的方法,准确称取芦丁标准品10.66 mg,用体积分数60%乙醇溶液配成母液,分别取母液0、1 mL、2 mL、3 mL、4 mL、5 mL、6 mL于25 mL容量瓶中,加体积分数为60%乙醇溶液5.5 mL,加5%亚硝酸钠1 mL后摇匀放置6 min,加入10%的硝酸铝溶液1 mL后摇匀放置6 min,加入4%氢氧化钠溶液10 mL,用体积分数60%乙醇溶液定容至刻度,放置15 min后,以未加入标准品溶液的试剂为空白,在波长509 nm处检测其吸光度值,以芦丁质量浓度(C)为横坐标,吸光度值(A)为纵坐标,得芦丁标准曲线回归方程为:A=12.197C+0.003 9,R2=0.999 6,表明芦丁质量浓度在8.6~59.7 μg/mL范围内与吸光度值线性关系良好。根据芦丁标准曲线方程计算泥蒿叶样品中总黄酮的含量及总黄酮提取率,总黄酮提取率计算公式如下:

式中:E为总黄酮提取率,%;C为提取液中总黄酮质量浓度,μg/mL;V为提取液体积,mL;N为提取液稀释倍数;m为泥蒿叶的质量,g。
1.3.2 单因素试验
称取5份泥蒿叶粉末5 g置于圆底烧瓶,分别考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))、乙醇体积分数(20%、30%、40%、50%、60%)、纤维素酶量(泥蒿叶质量1%、2%、3%、4%、5%)、提取时间(1 h、2 h、3 h、4 h、5 h)和提取温度(30℃、40℃、50℃、60℃、70℃)等因素对泥蒿叶中总黄酮提取率的影响。
1.3.3 正交优化试验

表1 总黄酮提取工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for total flavonoids extraction process optimization
在单因素试验结果的基础上,选取对泥蒿叶总黄酮提取率影响较显著的纤维素酶用量(A)、提取时间(B)和乙醇体积分数(C)等因素进行正交试验设计,正交试验因素与水平如表1所示。
1.3.4 总抗氧化能力评价
分别配制0.065 g/L、0.130 g/L、0.220 g/L、0.260 g/L和0.325g/L系列质量浓度的泥蒿叶总黄酮提取液,并以相同质量浓度的VC溶液为阳性对照,根据总抗氧化试剂盒说明书操作后,将测试管、对照管样液在波长520nm处测定吸光度值。
在37℃时,每毫升样品每分钟使反应体系的吸光度每增加0.01时,定义为一个总抗氧化能力单位(U),则总抗氧化能力计算公式如下:

式中:T为总抗氧能力,U/mL;As为测定管吸光度值;Ac为对照管吸光度值;Vt为反应液总体积,mL;Vs为取样量,mL;n为样品测试前稀释倍数。
1.3.5 羟基自由基清除能力评价
分别配制0.065 g/L、0.130 g/L、0.220 g/L、0.260 g/L和0.325 g/L系列质量浓度的泥蒿叶总黄酮提取液,并以相同质量浓度的VC溶液为阳性对照,根据羟基自由基试剂盒说明书操作后,将测定管、空白管、对照管样液在波长536 nm处测定吸光度值。羟基自由基清除率计算公式如下:

式中:H为羟基自由基清除率,%;OD1为测定管吸光度值;OD2为对照管吸光度值;OD3为空白管吸光度值。
1.3.6 统计分析
利用正交设计助手II v3.1和EXCEL 2003软件进行实验设计和数据分析,通过F值分析显著性。
2 结果与分析
2.1 单因素结果
2.1.1 纤维素酶量对总黄酮提取率的影响
考察纤维素酶用量对总黄酮提取率的影响,结果如图1所示。
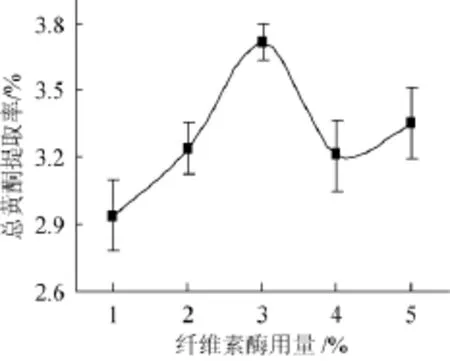
图1 纤维素酶用量对总黄酮提取率的影响Fig.1 Effect of cellulase addition on the extraction rate of total flavonoids
由图1可知,总黄酮提取率随纤维素酶用量的增加呈先升后降趋势,当纤维素酶用量为3%时,总黄酮提取率最高,为3.71%,继续添加酶量,则总黄酮提取率下降。尽管纤维素酶用量为4%和5%时所得总黄酮提取率发生起伏变化,但二者统计分析并无显著差异(P=0.33>0.05)。这是因为酶量增加到一定程度时,酶分子过于饱和,一部分酶不能与底物结合,使得水解速度变慢[14],且酶量太多则具有粘附性[15],阻碍黄酮物质的溶出,从而使总黄酮得率下降。因此,选择纤维素酶用量3%为宜。
2.1.2 提取时间对总黄酮提取率的影响
考察提取时间对总黄酮提取率的影响,结果如图2所示。

图2 提取时间对总黄酮提取率的影响Fig.2 Effect of extraction time on the extraction rate of total flavonoids
由图2可知,随着提取时间从1 h增加至3 h,总黄酮提取率达到峰值,为4.11%,继续增加提取时间,总黄酮提取率下降趋势明显。这可能是由于随着提取时间的延长,某些在乙醇溶液中对热不稳定的黄酮类物质的结构被分解转化或氧化破坏,从而导致总黄酮提取率出现下降的趋势[16]。因此,选择泥蒿叶总黄酮提取时间3 h为宜。
2.1.3 乙醇体积分数对黄酮得率的影响
考察乙醇体积分数对总黄酮提取率的影响,结果如图3所示。

图3 乙醇体积分数对总黄酮提取率的影响Fig.3 Effect of ethanol concentration on the extraction rate of total flavonoids
由图3可知,当乙醇体积分数为20%~40%时,总黄酮提取率随着乙醇体积分数的增加而逐渐升高,当乙醇体积分数为40%时,总黄酮提取率达到峰值,为4.01%,继续增加乙醇体积分数,总黄酮提取率则开始下降。这可能是由于随着乙醇体积分数的增加,亲脂性物质、色素等成分大量溶出,与黄酮类物质竞争结合乙醇-水分子[17-18],从而降低了泥蒿叶总黄酮的提取效果。因此,选择乙醇体积分数40%为宜。
2.1.4 提取温度对总黄酮提取率的影响
考察提取温度对总黄酮提取率的影响,结果如图4所示。
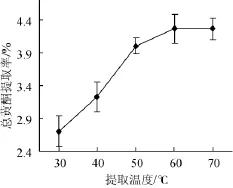
图4 提取温度对总黄酮提取率的影响Fig.4 Effect of extraction temperature on the extraction rate of total flavonoids
由图4可知,随着提取温度的增加,泥蒿叶总黄酮提取率不断上升,当提取温度为50℃时,总黄酮提取率急剧增加至4.01%;60℃时达到最高提取率4.27%,然后趋于稳定。统计分析发现50℃和60℃条件下所得总黄酮提取率无显著性差异(P=0.14>0.05),即50℃时泥蒿叶总黄酮提取率已趋于稳定,继续升高温度提取率增幅不明显。因此,综合考虑选择提取温度50℃为宜。
2.1.5 料液比对总黄酮提取率的影响
考察料液比对总黄酮提取率的影响,结果如图5所示。
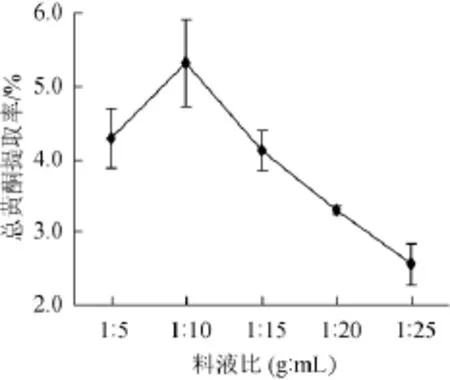
图5 料液比对总黄酮得率的影响Fig.5 Effect of solid-liquid ratio on the extraction rate of total flavonoids
由图5可知,料液比对泥蒿叶总黄酮提取率有显著影响。料液比从1∶5(g∶mL)增加至1∶10(g∶mL)时,泥蒿叶总黄酮提取率增加到峰值,为5.32%,差异性显著(P=0.04<0.05);继续增加料液比,总黄酮提取率开始下降,且下降趋势明显(P=0.04<0.05)。因此,选择料液比1∶10(g∶mL)为宜。
2.2 正交试验结果
根据单因素试验结果,固定料液比为1∶10(g∶mL),提取温度50℃,以总黄酮提取率(Y)为评价指标,以纤维素酶用量(A)、提取时间(B)和乙醇体积分数(C)为变量因子,设计L9(33)正交优化试验,试验设计及结果见表2,方差分析结果见表3。
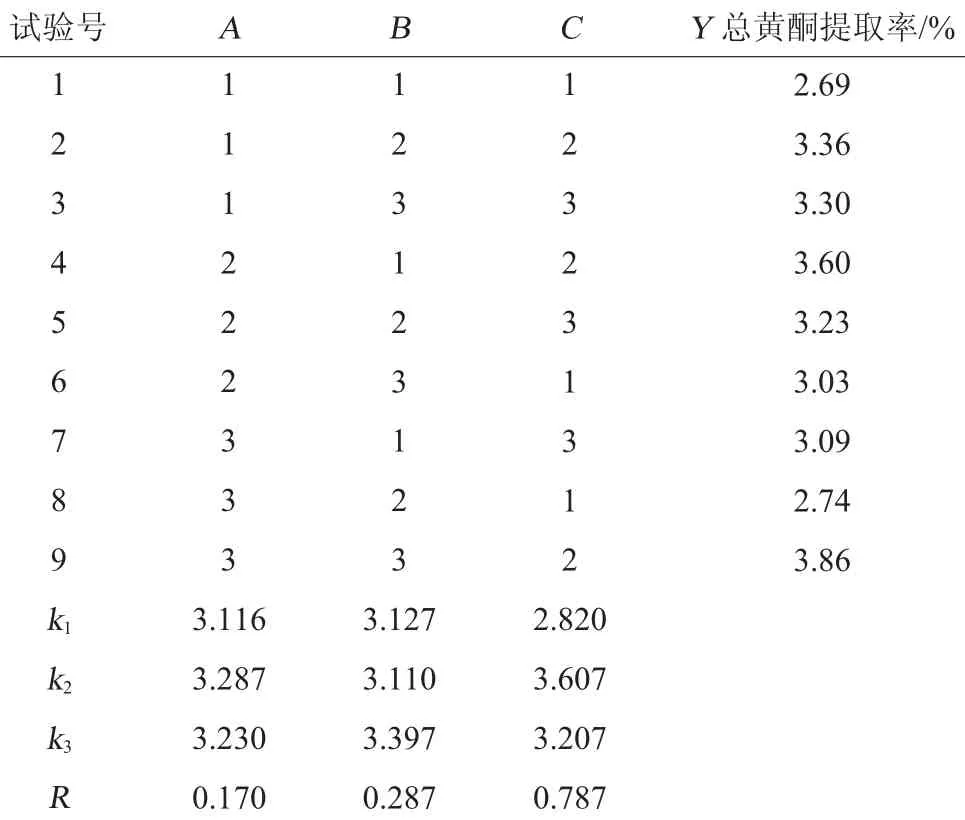
表2 总黄酮提取工艺优化正交试验设计及结果Table 2 Design and results of orthogonal experiments for total flavonoids extraction process optimization
由表2极差分析结果可知,各因素对总黄酮提取率的影响次序为:C>B>A,即乙醇体积分数>提取时间>纤维素酶用量,表3方差分析也表明乙醇体积分数对泥蒿叶总黄酮提取的影响达到显著水平(P<0.05),其他因素影响不显著。总黄酮提取最佳工艺条件为A2B3C2,即纤维素酶用量为3%,提取时间为4 h,乙醇体积分数为40%。

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
2.3 验证试验
在总黄酮提取最佳工艺条件下,即料液比1∶10(g∶mL)、提取温度50℃、纤维素酶用量3%、提取时间4 h和乙醇体积分数40%,平行提取3次,总黄酮提取率为(4.12±0.09)%,高于表2中最大总黄酮提取率(3.86%),表明正交设计所确定的条件为优选。
2.4 总抗氧化能力评价
测定泥蒿叶提取液中总黄酮质量浓度为6.50 g/L,分别稀释100倍、50倍、30倍、25倍、20倍后得到0.065 g/L、0.130 g/L、0.220 g/L、0.260 g/L和0.325 g/L等系列质量浓度的泥蒿叶总黄酮样品,以VC为阳性对照,各样品的总抗氧化能力如图6所示。

图6 泥蒿叶总黄酮和VC的总抗氧化能力比较Fig.6 Comparison of total antioxidant activity of total flavonoids fromA.selengensisleaves and VC
由图6可知,5种质量浓度泥蒿叶总黄酮提取液的总抗氧化能力均低于相同质量浓度的VC。当总黄酮提取液质量浓度从0.065 g/L增至0.130 g/L时,泥蒿叶总黄酮提取液和VC的总抗氧化能力急剧增加,增加至0.220 g/L时,二者的总抗氧化能力分别达到13.45 U/mL和27.06 U/mL,继续增加溶液的质量浓度,二者的总抗氧化能力趋于稳定。泥蒿叶总黄酮提取液的总抗氧化能力相当于相同质量浓度VC的50%,表现出一定的抗氧化能力,但抗氧化能力不强,这可能是由于泥蒿叶中总抗氧化能力主要是由酚酸类物质决定,而黄酮类物质只是其中一种抗氧化成分[19-22]。
2.5 羟基自由基清除能力评价
泥蒿叶总黄酮和VC样品的羟基自由基清除能力如图7所示。
由图7可知,泥蒿叶总黄酮提取液和VC的羟基自由基清除率均随着质量浓度的升高而增加,当质量浓度为0.325 g/L时,羟自由基清除率达到最高,分别达到93.80%和64.14%;总黄酮提取液从0.130 g/L浓度开始,尽管差异性显著(P<0.05),但增幅较小;而VC的羟基自由基清除能力则上升趋势明显(P<0.001)。五种质量浓度的泥蒿叶总黄酮提取液的羟基自由基清除能力均明显高于相同质量浓度的VC,且羟基自由基清除率是相同质量浓度VC的1.4~2.7倍。因此,泥蒿叶总黄酮提取液具有较强的羟基自由基清除能力。

图7 泥蒿叶总黄酮和VC的羟基自由基清除能力的比较Fig.7 Comparison of hydroxyl radical scavenging activity of total flavonoids fromA.selengensisleaves and VC
3 结论
本研究以大别山黄州地区泥蒿叶为材料,在单因素试验结果的基础上,采用正交试验对酶法提取泥蒿叶总黄酮的工艺进行了优化。结果表明,总黄酮提取的最佳工艺条件为纤维素酶用量3%,乙醇体积分数40%,料液比1∶10(g∶mL),提取温度50℃,提取时间4 h,在此条件下,总黄酮提取率可达4.12%。同时泥蒿叶总黄酮提取液总抗氧化能力相当于相同质量浓度VC的50%,而羟基自由基清除能力较强,是相同质量浓度VC的1.4~2.7倍,对科学利用泥蒿资源,发展高附加值的泥蒿产业具有参考价值和应用前景。
[1]林有润.中国植物志(第76卷,第2分册)[M].北京:科学出版社,1991:87-117.
[2]邵增龙,黄和平,高山林.芦蒿研究进展[J].海峡药学,2010,22(1):67-69.
[3]付明,牛友芽,胡兴,等.藜蒿成分及开发利用[J].安徽农业科学,2008,36(7):2803-2804,2929.
[4]张健,林玉英,孔令义.蒌蒿的化学成分研究[J].中草药,2004,35(9):979-980.
[5]涂宗财,毛沅文,李志,等.野生藜蒿叶中黄酮类化合物的提取工艺[J].南昌大学学报·工科版,2011,33(3):234-238.
[6]江苏新医学院.中药大辞典[M].上海:上海科技出版社,1997:2008-2011.
[7]杨安树,邓丹雯,郑功源.藜蒿中黄酮类物质抗氧化作用的研究[J].食品科学,2003,24(7):67-70.
[8]郑功源,陈红兵,邓丹雯,等.藜蒿提取物抑菌作用的初步研究[J].天然产物研究与开发,1999,11(3):72-76.
[9]YAO L H,JIANG Y M,SHI J,et al.Flavonoids in food and their health benefits[J].Plant Food Hum Nutr,2004,59(3):113-122.
[10]王毓宁,陈和平,冯作山.超声波-乙醇法提取芦蒿总黄酮的工艺研究[J].江苏农业科学,2007(5):215-217.
[11]魏凤玉,王欣.纤维素酶-乙醇协同提取黄芩总黄酮[J].天然产物研究与开发,2014,26(4):575-578.
[12]刘海鸥,虎春艳,赵声兰,等.滇黄芩总黄酮酶解超声提取工艺及抗氧化活性研究[J].中国酿造,2016,35(1):110-114.
[13]向福,付建强,胡淇淞,等.响应面法优化大别山松针黄酮的提取工艺[J].河南农业科学,2015,44(9):145-149.
[14]黄凤婷,马永良,林春颖,等.酶法辅助提取南板蓝叶中靛玉红的工艺研究[J].安徽农业科学,2012,40(26):12866-12867,12879.
[15]杨海涛,曹小燕.酶-超声辅助提取苦荞秆中总黄酮及抗氧化活性研究[J].中国酿造,2016,35(9):72-76.
[16]蒋益虹.荷叶黄酮的乙醇提取工艺优化研究[J].农业工程学报,2004,20(4):168-171.
[17]扶庆权,侯佩,柳闽生,等.蒌蒿叶总黄酮的响应面法优化微波辅助提取工艺及其抗氧化活性研究[J].食品工业,2014,35(2):139-143. [18]吕丽爽,黄健花,周庆,等.芦蒿中黄酮类化合物提取工艺研究[J].食品工业科技,2002,23(9):48-49.
[19]SHI F,JIA X,ZHAO C,et al.Antioxidant activities of various extracts fromArtemisisa selengensisTurcz(LuHao)[J].Molecules,2010,15(7): 4934-4946.
[20]ZHANG L,TU Z C,YUAN T,et al.Solvent optimization,antioxidant activity,and chemical characterization of extracts fromArtemisia selengnesisTurcz[J].Ind Crop Prod,2014,56:223-230.
[21]ZHANG L,TU Z C,WANG H,et al.Metabolic profiling of antioxidants constituents inArtemisia selengensisleaves[J].Food Chem,2015,186: 123-132.
[22]ZHANG L,TU Z C,WANG H,et al.Antioxidant activity and phenolic acids profiles ofArtemisia selengensisTurcz extracted with various methodsbyHPLC-QTOF-MS/MS[J].J Food Biochem,2016,40(4):603-612.
Optimization of enzyme extraction conditions of total flavonoids fromArtemisia selengensisleaves and its antioxidant activity
CHEN Yao1,WU Longyue1,XIANG Fu1,2*,CAO Peipei1,XIANG Ruifu1,FANG Yuanping1,2
(1.College of Life Sciences,Huanggang Normal University,Huanggang 438000,China; 2.Hubei Collaborative Innovation Center for the Characteristic Resources Exploitation of Dabie Mountains,Huanggang 438000,China)
Using theArtemisia selengensisleaves in the Dabie Mountain area as raw material,the total flavonoids was extracted by enzyme-assisted extraction.Based on the single factor and orthogonal experiments,the enzyme extraction process conditions of total flavonoids fromA.selengensis leaves were optimized,and the antioxidant activities of total flavonoid extracts were discussed.The results showed that the optimum extraction conditions of total flavonoids were cellulase addition 3%,ethanol concentration 40%,solid-liquid ratio 1∶10(g∶ml),extraction temperature 50℃and time 4 h.Under the conditions,the extraction rate of total flavonoids was 4.12%.In addition,with the same mass concentrations,the total antioxidant activity of total flavonoids extracts fromA.selengensisleaves was 50%of that of VC,the hydroxyl free radical scavenging ability was 1.4-2.7 times of that of VC,which revealed that the total flavonoids fromA.selengensleaves had strong antioxidant activity.
Artemisia selengensisleaves;total flavonoids;enzyme extraction;antioxidant activity;hydroxyl free radical scavenging ability
R284.2
0254-5071(2017)06-0142-05
10.11882/j.issn.0254-5071.2017.06.029
2017-02-20
大学生创新培育项目(sgpx201602)
陈瑶(1995-),女,本科生,研究方向为天然产物提取。
*通讯作者:向福(1977-),男,教授,博士,研究方向为天然植物资源利用。

