肺癌合并肺部流感嗜血杆菌感染的临床病因、血清分型及耐药性分析
朱 珊,方寅飞(金华市中心医院检验科,浙江金华 321000)
肺癌合并肺部流感嗜血杆菌感染的临床病因、血清分型及耐药性分析
朱 珊*,方寅飞(金华市中心医院检验科,浙江金华 321000)
目的:探讨肺癌合并肺部流感嗜血杆菌(Hi)感染的临床病因、血清分型及耐药情况,为预防感染和合理用药提供参考。方法:收集我院2009年1月-2016年6月8 025例肺癌合并肺部感染住院患者的临床资料,分析肺部Hi感染的临床病因。采用玻片凝集法进行Hi血清分型试验,头孢硝噻吩纸片法检测其产β-内酰胺酶情况,纸片扩散法进行药敏试验,并采用WHONET 5.6软件处理药敏试验结果。结果:年龄、临床分期、侵入性操作、手术、放化疗、住院时间、使用广谱抗菌药物或激素等11种因素与肺癌患者发生肺部Hi感染密切相关(P<0.05或P<0.01)。8 025份标本中,共检出Hi 104株,检出率为1.30%。其血清分型以非分型为主,占44.23%;可分型菌株以b型居多(22.12%),其次为f型(17.31%)和a型(11.54%)。104株Hi中,检出产β-内酰胺酶菌株56株,产酶率为53.85%。104株Hi对氨苄西林、阿莫西林、复方磺胺甲噁唑和氯霉素的耐药率均超过35%,对β-内酰胺酶抑制剂、头孢菌素类、碳青霉烯类和阿奇霉素等其他抗菌药物的耐药率均低于20%;产β-内酰胺酶菌株对氨苄西林、阿莫西林、复方磺胺甲噁唑和氯霉素的耐药率显著高于非产酶菌株,差异均有统计学意义(P<0.01);而产酶和非产酶菌株对其他抗菌药物的耐药率比较,差异均无统计学意义(P>0.05)。结论:肺癌患者发生肺部Hi感染的临床病因十分复杂。我院检出的Hi以非分型为主,且产酶情况不容乐观,但对多数抗菌药物耐药率较低。临床治疗可首选β-内酰胺酶抑制剂、头孢菌素类、碳青霉烯类和阿奇霉素等抗菌药物。
流感嗜血杆菌;肺癌;肺部感染;临床病因;血清分型;耐药性
肺癌是临床中较为常见的恶性肿瘤,发病率和病死率均较高,多数患者在临床确诊时已属晚期[1]。手术和放化疗作为治疗晚期肺癌的主要手段,可引起术后感染和机体免疫功能损伤,导致肺部感染率增高,已成为肺癌患者最主要的死亡原因[2]。流感嗜血杆菌(Haemophilus influenzae,Hi)是嗜血杆菌属中常见的致病菌,寄居于正常人的上呼吸道,属于条件致病菌,当人体免疫力下降时即可引起肺部感染[3]。本研究通过回顾性分析2009年1月-2016年6月我院肺癌合并肺部Hi感染住院患者的临床资料,分析其感染的临床病因、血清分型及耐药情况,以期为临床预防感染和合理用药提供参考。
1 资料与方法
1.1 资料来源
1.1.1 研究对象 纳入标准:(1)参照2010年美国癌症联合委员会/国际抗癌联盟(AJCC/UICC)肺癌TNM分期标准(第7版),经细胞学或病理学明确诊断为肺癌;(2)参照原卫生部实行的诊断标准[4],并根据患者的临床症状、体征、相关放射学和病原学检查确诊为肺部感染。排除合并其他肺部疾病(如肺结核、支气管扩张、慢性阻塞性肺疾病、病毒性肺炎、真菌性肺炎等)的患者。2009年1月-2016年6月我院共收治肺癌合并肺部感染患者8 025例,其中男性3 745例、女性4 280例,年龄34~89岁、平均年龄为(57.42±10.25)岁。
1.1.2 标本来源 标本取自纳入患者送检的痰液标本[晨起漱口后第一口痰,且标本中白细胞计数(WBC)与上皮细胞计数的比值≥25],共8 025份。
1.2 材料
Vitek2-Compact全自动细菌鉴定仪(含配套鉴定条,法国生物梅里埃公司);BIOBASE型生物安全柜(山东鑫科生物有限公司);HF212型CO2培养箱(上海力申科学仪器有限公司);a、b、c、d、e、f型血清分型试剂和头孢硝噻吩等药敏纸片(英国Oxoid公司);Ⅴ、Ⅹ、Ⅴ+Ⅹ因子诊断纸片(丹麦Rosco公司);Hi专用巧克力培养基(批号:07F3H044E)、Hi专用药敏培养基(批号:07T2J743K)、哥伦比亚血培养基(批号:02E1M213W)和M-H培养基(批号:XWD1501441)均购自郑州安图生物工程股份有限公司;质控菌株Hi(ATCC 49247、ATCC 49766)、金黄色葡萄球菌(ATCC 25923)由国家卫生计生委临床检验中心提供。
1.3 方法
1.3.1 临床病因分析 回顾性调查8 025例肺癌合并肺部感染患者的临床资料,包括性别、年龄、病理分型、临床分期、使用广谱抗菌药物、使用激素、侵入性操作、手术、放化疗、住院时间、白蛋白、血红蛋白和WBC等,分析肺癌患者发生肺部Hi感染的临床病因。
1.3.2 Hi菌株分离与鉴定 (1)参照《全国临床检验操作规程》(第4版)[5],将患者痰液标本分别接种于哥伦比亚血培养基和Hi专用巧克力培养基中,置于35℃、含5%~10%CO2的培养箱中,孵育24~48 h,根据菌落形态及其生长特性,挑取透明或半透明、扁平、湿润、灰白色的露滴状疑似菌株进行革兰氏染色,采用Vitek2-Compact全自动细菌鉴定仪及其配套鉴定条进行检测。(2)对疑似菌株进行卫星试验:将疑似菌株、金黄色葡萄球菌质控菌株接种于哥伦比亚血培养基和M-H培养基中,置于35℃、含5%~10%CO2的培养箱中,培养24 h。若疑似菌株在哥伦比亚血培养基中生长,而在M-H培养基中不生长,则判定卫星试验结果为阳性。(3)对卫星试验呈阳性的疑似菌株进行需求试验:取0.5麦氏浊度单位的疑似菌株菌悬液,涂抹于M-H培养基上,并将Ⅴ、Ⅹ、Ⅴ+Ⅹ因子诊断纸片贴于培养基上,置于35℃、含5%~10%CO2的培养箱中,培养24 h。若诊断纸片周围有菌株生长,而远离该纸片处无菌株生长,则判定需求试验阳性、疑似菌株为Hi。剔除同一患者同一部位分离的同种菌株。
1.3.3 血清分型试验 采用玻片凝集法进行血清分型试验。取0.5麦氏浊度单位的Hi菌悬液10 μL,分别加入等体积的a、b、c、d、e、f型血清分型试剂,1 min内观察结果。若与相应试剂发生凝集反应,则判定为阳性;若与各试剂均不发生凝集反应,则为非分型菌株。
1.3.4 产β-内酰胺酶菌株的检查 采用头孢硝噻吩纸片法。用头孢硝噻吩纸片蘸取Hi菌悬液,以已知产酶菌株[质控菌株Hi(ATCC 49247)]作为阳性对照,观察纸片颜色变化。10 min内纸片由黄色变为红色即判定为产β-内酰胺酶菌株,未变色则为非产β-内酰胺酶菌株。
1.3.5 药敏试验 将0.5麦氏浊度单位的Hi菌悬液涂布于专用药敏培养基上,选取15种常用抗菌药物的药敏纸片,采用纸片扩散(K-B)法进行药敏试验,其结果参照美国临床和实验室标准化协会(CLSI)2009年标准[6]进行判定。
以培养专业群通用能力为目标,改造综合控制实验室、嵌入式系统开发实验室,新建物联网创新成果展示实验室,整合现有的电子综合实训室,打造群平台通用能力技术实训中心。以培养专业能力为目标,新建无线传感网络实训室、大数据分析实验室、软件测试实训室,并升级移动应用开发实验室。
1.4 统计学方法
采用WHONET 5.6软件对药敏试验结果进行处理,应用SPSS 20.0软件对数据进行统计分析。计数资料以例数或率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 感染病因调查结果
我院8 025例肺癌合并肺部感染患者中,有104例患者的痰液标本检出Hi。其中,男性55例,女性49例;年龄37~84岁,平均年龄为(66.57±9.42)岁。临床病因调查结果显示,年龄、临床分期、使用广谱抗菌药物或激素、侵入性操作、手术、放化疗、住院时间、血清白蛋白、血红蛋白、WBC等11个因素是肺癌患者发生肺部Hi感染的重要危险因素,组间比较差异均有统计学意义(P<0.05或P<0.01),详见表1。
2.2 检出率与血清分型分布情况
8 025份送检标本中,共检出Hi 104株,检出率为1.30%。血清分型以非分型为主,占44.23%。可分型菌株以b型最多,占22.12%;其次为f型和a型,分别占17.31%和11.54%;而d、c、e型少见,详见表2。
2.3 产β-内酰胺酶菌株的检测结果
2.4 耐药情况
104株Hi对氨苄西林、阿莫西林、复方磺胺甲噁唑和氯霉素的耐药率均超过35%,对β-内酰胺酶抑制剂、头孢菌素类、碳青霉烯类和阿奇霉素等其他抗菌药物的耐药率低于20%。产β-内酰胺酶Hi对氨苄西林、阿莫西林、复方磺胺甲噁唑和氯霉素的耐药率分别为100%、100%、73.21%和51.79%,显著高于非产酶菌株的16.67%、6.25%、31.25%和16.67%,差异均有统计学意义(P<0.01);而产酶和非产酶菌株对其他抗菌药物的耐药率比较,差异均无统计学意义(P>0.05),详见表3。
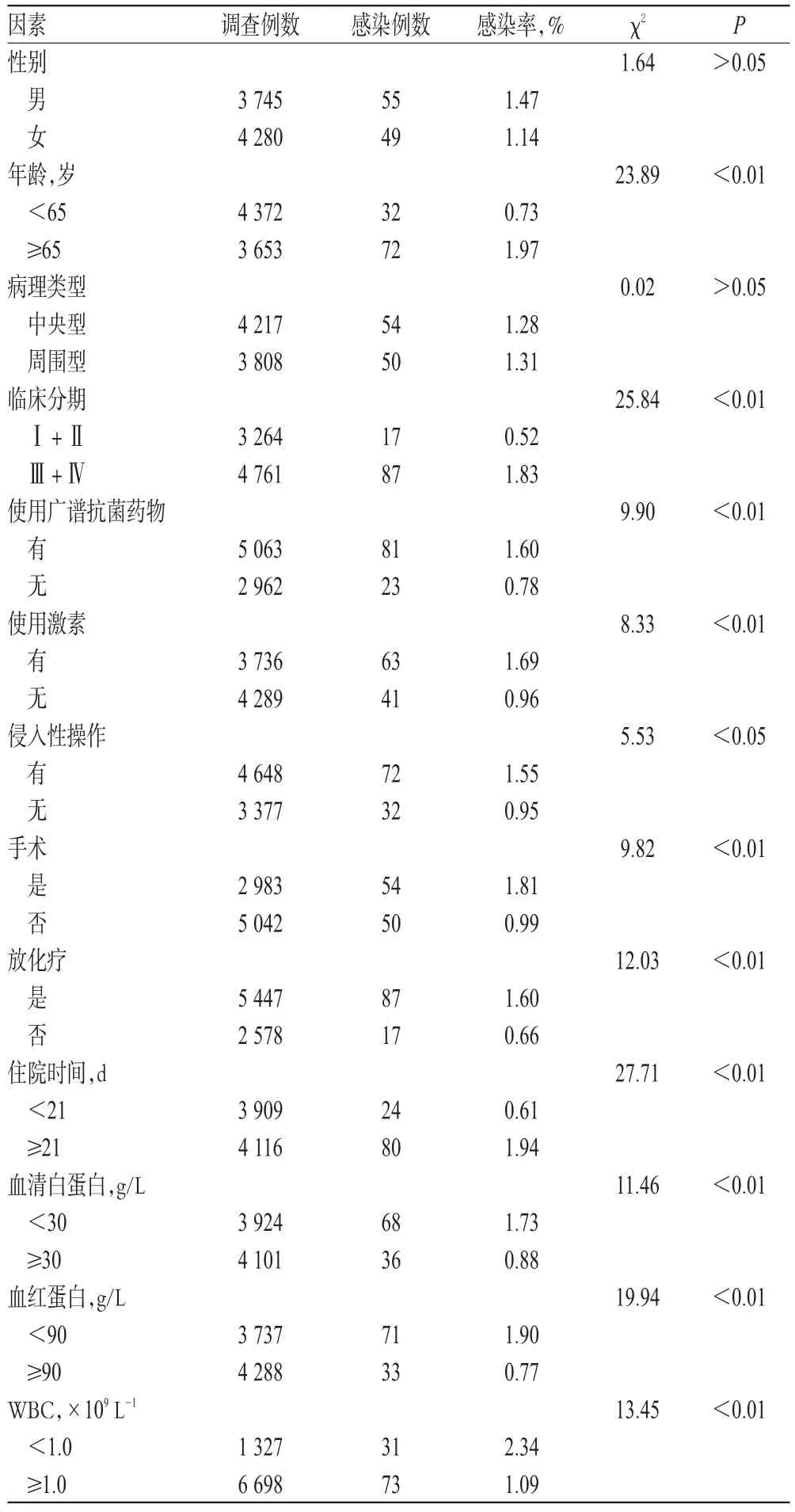
表1 肺癌合并肺部Hi感染的临床病因Tab 1 Clinical etiology of lung cancer complicated with pulmonary Hi infection

表2 104株Hi血清分型分布情况Tab 2 Serum type distribution of 104 strains of Hi
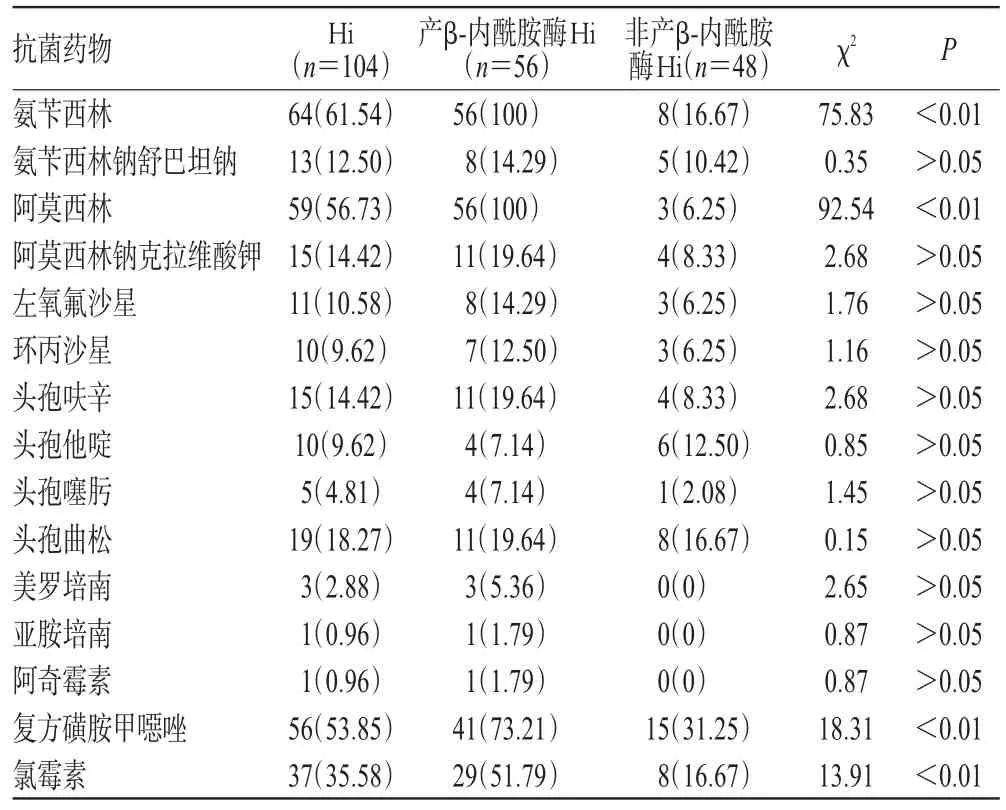
表3 Hi对常用抗菌药物的耐药情况[株(%%)]Tab 3 Drug resistance of Hi to commonly used antibiotics[strain(%%)]
3 讨论
3.1 临床病因分析
Hi是呼吸道的定植菌,可诱导炎症介质的释放和表达,导致炎症细胞浸润,从而引发肺部感染[7]。近年来,随着抗菌药物的广泛使用,Hi作为条件致病菌引发的感染越来越多见。本研究回顾性地分析了肺癌合并肺部感染患者的性别、年龄、病理类型、临床分期、使用广谱抗菌药物或激素、侵入性操作、手术、放化疗、住院时间、血清白蛋白、血红蛋白和WBC等因素对其发生肺部Hi感染的影响。结果表明,年龄、临床分期、使用广谱抗菌药物或激素、侵入性操作、手术、放化疗、住院时间、血清白蛋白、血红蛋白、WBC等均是诱发肺癌患者肺部感染的危险因素(P<0.05或P<0.01)。侵入性操作、手术损害了患者机体的免疫屏障,为病原菌入侵创造了条件[8];放化疗、使用广谱抗菌药物或激素使血液中WBC减少,同时也削弱了机体单核吞噬系统的防御功能,使机体内微生态结构遭到破坏,导致菌群移位与失调;患者临床分期越晚,其肿瘤消耗性越大,再加之高龄、贫血、低蛋白血症使机体抵抗力进一步减弱,易诱发感染;住院时间超过21 d,使得患者与条件致病菌接触的机会增多,增加了Hi致肺部感染的几率[1]。
3.2 检出率与血清分型分析
Hi为苛养菌,生长需要特殊的营养物质,导致该菌检出率较低,只有在含5%~10%CO2、含有Ⅹ和Ⅴ因子、pH为7.6~7.8的新鲜血液培养基中才能生长。本研究共从8 025份送检标本中检出Hi 104株,检出率为1.30%,与文献[9]报道较为接近。血清分型是研究Hi致病性和流行病学的重要基础,根据其表面荚膜有无多糖抗原,将Hi分为可分型和非分型菌株;可分型菌株根据表面荚膜多糖抗原类型又分为a、b、c、d、e、f等6个血清分型。本研究结果显示,我院检出的Hi以非分型最为多见,占44.23%,明显低于裘益辉等[10]关于杭州地区非分型菌株占97.37%的报道,这可能与不同人群、不同地区有关[11]。我院b型Hi的检出率为22.12%。b型是目前公认毒力最强、危害最大的血清分型,但随着Hi疫苗b型(Hib)的广泛接种,使得b型Hi感染率显著下降,随之而来的是其他各型特别是非分型菌株感染率的逐步上升[12]。非分型菌株已成为Hi致病的重要血清分型,其致病力可能与其表面能表达多种特异性黏附素有关。Hi的高分子量表面蛋白质(HMW)、菌毛和Hi黏附素等有助于其黏附在无纤毛的上皮细胞,其分泌的白细胞蛋白酶抑制因子与菌株的黏附和穿透分子(Hap)可促进菌株间的相互作用,导致菌落聚集,为非分型菌株的入侵提供了有利的微生态环境[12]。
3.3 产酶和耐药情况分析
本研究结果显示,104株Hi中,产β-内酰胺酶的菌株有56株,产酶率为53.85%,与孙淑红等[13]的报道(51.4%)接近,但高于全国水平(28.1%)[14],表明Hi的产酶率存在地域差异。由于Hi对氨苄西林、阿莫西林的耐药机制主要与质粒介导的β-内酰胺酶(该酶可水解氨苄西林、阿莫西林的β-内酰胺环,使其失去活性)有关[13],因此,可初步预测产β-内酰胺酶菌株对同类抗菌药物的耐药情况。
药敏试验结果显示,产β-内酰胺酶Hi对氨苄西林、阿莫西林、复方磺胺甲噁唑和氯霉素的耐药率明显高于非产β-内酰胺酶株,差异有统计学意义(P<0.01);而对其他抗菌药物的耐药率比较,差异均无统计学意义(P>0.05)。产β-内酰胺酶Hi对氨苄西林和阿莫西林的耐药率均为100%,而非产β-内酰胺酶Hi对上述2种抗菌药物仍具有较好的抗菌活性,耐药率分别为16.67%和6.25%。因此,在使用氨苄西林和阿莫西林时,应注意Hi菌株的产酶情况。104株Hi对氨苄西林、阿莫西林和氯霉素的耐药率分别为61.54%、56.73%和35.58%。有文献报道,对氨苄西林、阿莫西林耐药的Hi往往同时对氯霉素双重耐药(对氯霉素耐药大多与合成氯霉素乙酰基转移酶有关,而Hi可同时产生质粒介导的β-内酰胺酶和氯霉素乙酰基转移酶,可导致其对氨苄西林和氯霉素双重耐药)[15]。此外,对复方磺胺甲噁唑的高耐药率(53.85%)可能是由于该菌过度产生双氢叶酸还原酶所致[16]。因此,氨苄西林、阿莫西林、氯霉素和复方磺胺甲噁唑不宜作为Hi感染的临床经验用药。Hi对氨苄西林钠舒巴坦钠、阿莫西林钠克拉维酸钾、左氧氟沙星、环丙沙星、头孢呋辛、头孢他啶、头孢噻肟、头孢曲松、美罗培南、亚胺培南和阿奇霉素均保持较低的耐药率,可能与其对β-内酰胺酶高度稳定有关,上述药物可作为临床治疗的首选药物;极重症患者推荐使用第四代头孢菌素或碳青霉烯类抗菌药物[17]。
综上所述,Hi致肺癌患者肺部感染的临床病因十分复杂,我院Hi的血清分型以非分型为主,且产酶情况不容乐观,但对多数抗菌药物具有较低的耐药率。临床应重视对Hi耐药情况的监测,合理使用抗菌药物和免疫抑制剂,提高机体免疫力,有效预防肺癌患者肺部感染的发生;治疗Hi感染建议首选β-内酰胺酶抑制剂、头孢菌素类、碳青霉烯类和阿奇霉素等。本研究通过大样本量回顾性分析了近8年我院肺癌合并肺部Hi感染患者的临床病因、血清分型及耐药情况,对临床预防和治疗感染有一定的指导意义。但可能由于人群和地域的差异,因而结果存在一定的局限性,后续需要收集不同地区、多家医院、更多标本进行进一步的研究。
[1] 许崇安,刘艳,李琳,等.肺癌患者医院感染危险因素分析[J].中华肿瘤防治杂志,2011,18(9):651-654.
[2] 尚学琴,王继营,段玉印,等.晚期肺癌化疗患者医院感染的危险因素分析[J].中华医院感染学杂志,2015,25(15):3477-3479.
[3] 杨晓华,谭南,林爱心,等.儿童呼吸道流感嗜血杆菌的耐药性分析[J].中国感染与化疗杂志,2014,14(5):436-439.
[4] 卫生部.医院感染诊断标准:试行[J].中华医学杂志,2001,81(5):314-320.
[5] 尚红,王毓三,申子瑜.全国临床检验操作规程[M].4版.北京:人民卫生出版社,2015:734-736.
[6] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:M100/ S18-2009[S].2009-01-30.
[7] 修清玉,钱建美,王桂芳,等.不可分型流感嗜血杆菌诱导A549细胞分泌和表达前炎症细胞因子及机制研究
[J].中国呼吸与危重监护杂志,2008,7(3):210-213.
[8] 陈秀花,祝进,陆军.肺炎克雷伯菌致肺癌患者术后肺部感染的病因与耐药性分析[J].中国微生态学杂志,2015,27(4):467-470.
[9] 张文芳,郑珊,李丁,等.肿瘤患者呼吸道感染嗜血杆菌的临床分布与耐药性分析[J].中国肿瘤临床,2012,39(17):1292-1298.
[10] 裘益辉,张艳,华春珍,等.杭州市上呼吸道感染患儿分离的流感嗜血杆菌分离株的血清分型及其对氨苄西林的耐药性分析[J].中国当代儿科杂志,2009,11(3):217-220.
[11] 刘东华,胡艳华.儿童呼吸道不可分型流感嗜血杆菌感染及耐药现状[J].中华全科医学,2014,12(8):1304-1308.
[12] 何多姣,张彦霞,贾天军,等.不可分型流感嗜血杆菌候选疫苗的研究进展[J].现代预防医学,2011,38(23):4958-4960.
[13] 孙淑红,胡晓峰,冯尚彩,等.2009-2013年呼吸道感染患者流感嗜血杆菌分离株的耐药性分析[J].现代预防医学,2015,42(11):2049-2053.
[14] 张泓,孔菁,王传清,等.2010中国CHINET流感嗜血杆菌和卡他莫拉菌耐药性监测[J].中国感染与化疗杂志,2012,12(3):180-184.
[15] 章娟娟,陈建飞.流感嗜血杆菌致恶性肿瘤患者下呼吸道感染情况与耐药性分析[J].中国微生态学杂志,2015,27(4):460-463.
[16] 谢成彬,王频佳,吴雨露,等.儿童呼吸道流感嗜血杆菌分离株耐药性与ftsⅠ基因分型研究[J].中国感染与化疗杂志,2015,15(4):324-329.
[17] 马芳军,王春霞,姜海迪,等.兰州地区呼吸道感染流感嗜血杆菌分布特点及耐药性分析[J].中国初级卫生保健,2014,28(9):106-108.
(编辑:张元媛)
Analysis of Clinical Etiology,Serum Type and Drug Resistance of Lung Cancer Complicated with Pulmonary Haemophilus influenzae Infection
ZHU Shan,FANG Yinfei(Laboratory Department,Jinhua Municipal Central Hospital,Zhejiang Jinhua 321000,China)
*技师。研究方向:临床检验。电话:0579-82552088。E-mail:18969387286@163.com
ABSTRACTOBJECTIVE:To investigate the clinical etiology,serum type and drug resistance of lung cancer complicated with pulmonary Haemophilus influenzae(Hi)infection,in order to provide reference for infection prevention and rational drug use. METHODS:Clinical data of 8 025 inpatients with lung cancer complicated with pulmonary infection in our hospital from Jan.2009 to Jun.2016 were collected,and the clinical etiology of pulmonary Hi infection was analyzed.The slide agglutination method was used for serotyping,nitrocefin slip method was used to detect β-lactamase,K-B method was used for drug sensitivity test,WHONET 5.6 software was used to deal with the results of drug sensitivity test.RESULTS:Eleven factors as age,clinical classification,invasive operation,surgery,radiotherapy and chemotherapy,hospitalization time,use of broad-spectrum antibiotics or hormones and other were closely related to pulmonary Hi infection in lung cancer patients(P<0.05 or P<0.01).Among 8 025 specimens,104 strains of Hi were detected with detection rate of 1.30%.Serum type NTHi accounted for 44.23%.Separable strains were mainly b type(22.12%),followed by f type(17.31%)and a type(11.54%).Among 104 strains of Hi,56 strains of β-lactamase were detected with enzyme-producing rate of 53.85%.Drug resistance of 104 strains of Hi to ampicillin,amoxicillin,compound sulfamethoxazole and chloramphenicol were all higher than 35%;drug resistance of Hi to β-lactamase inhibitors,cephalosporins,carbapenems,azithromycin and other antibiotics were all lower than 20%.Drug resistance of β-lactamase producing stains to ampicillin,amoxicillin,compound sulfamethoxazole and chloramphenicol were all higher than those of non-producing strains,with statistical significance(P<0.01).There was no statistical significance in drug resistance to other antibiotics between producing stains and non-producing strains(P>0.05).CONCLUSIONS:The clinical etiology of pulmonary Hi infection in patients with lung cancer is complicated.The serum type of the isolate is mainly NTHi;enzyme production situation is not optimistic,but Hi keeps a low rate of drug resistance to most antibiotics.β-lactamase inhibitors,cephalosporins,carbapenems and azithromycin are first choice for the treatment of Hi infections.
Haemophilus influenzae;Lung cancer;Pulmonary infection;Clinical etiology;Serum type;Drug resistance
R378.4
A
1001-0408(2017)17-2346-05
2016-07-25
2016-09-21)
DOI10.6039/j.issn.1001-0408.2017.17.12

