血管内皮细胞联合同种异体神经移植修复长距离大鼠坐骨神经缺损
徐沁同, 孟德华, 张 键, 潘剑锋, 江立波, 陈增淦, William C. Lineaweaver, 张 峰,*
1. 复旦大学附属中山医院骨科,上海 200032 2. Joseph M. Still Burn and Reconstructive Center, Jackson, Mississippi 39204
·论 著·
血管内皮细胞联合同种异体神经移植修复长距离大鼠坐骨神经缺损
徐沁同1△, 孟德华1△, 张 键1, 潘剑锋1, 江立波1, 陈增淦1, William C. Lineaweaver2, 张 峰1,2*
1. 复旦大学附属中山医院骨科,上海 200032 2. Joseph M. Still Burn and Reconstructive Center, Jackson, Mississippi 39204
目的: 探讨血管内皮细胞(EC)联合去细胞同种异体神经移植修复长距离大鼠坐骨神经缺损的效果。方法: 80只雌性Sprague-Dawley大鼠,20只取双侧1.5 cm长坐骨神经,Hudson优化法制备去细胞同种异体神经(ANA);60只均于右侧建立1.5 cm长坐骨神经缺损模型,随机分为反转吻合坐骨神经的自体神经(ANG)移植组、ANA移植组及ANA+EC移植组(n=20)。术后1、2、4、12周,每组各取5只进行测试,指标包括:坐骨神经功能指数(SFI)、电生理检查[动作电位潜伏延迟率(LDR)、神经传导速度恢复率(NCVRR)和复合肌动作电位恢复率(CMAPRR)]、最大强直收缩力恢复率(MTFRR)、腓肠肌湿重恢复率(MWRR)、微血管增生率(MVDPR),术后12周甲苯胺蓝染色下测量神经纤维数量、髓鞘厚度、G ratio,并行电镜观察。结果: 术后早期,ANA+EC移植组大鼠SFI、MVDPR较ANA移植组改善明显(P<0.05);术后晚期,ANA+EC移植组大鼠CMAPRR、MTFRR、MWRR较ANA移植组恢复更佳(P<0.05);术后12周时,ANA+EC移植组再生神经数量和形态更接近ANG移植组。结论: 对于长距离坐骨神经缺损的大鼠模型,使用载血管内皮细胞的去细胞同种异体神经进行神经移植修复,早期肌肉功能优于单独使用去细胞同种异体神经,晚期神经纤维的数量和质量更接近于自体神经移植。
周围神经;血管内皮细胞;去细胞同种异体神经
周围神经损伤是临床常见疾患,占创伤患者的2%~3%[1]。神经纤维再生缓慢,对修复环境要求苛刻,因此在长距离神经缺损时,治疗尤为困难,预后较差,易导致患者肢体功能障碍,严重影响患者的生活质量。目前,治疗周围神经缺损的最佳方法为自体神经移植(autologous nerve graft, ANG),但该方法存在供体有限、牺牲供区正常功能、医源性损伤、增加诸如感染等并发症的缺点和风险。
因具有取材来源广泛、取材量相对较大、与宿主结构相似等优点,去细胞同种异体神经(acellular nerve allograft, ANA)移植近年来成为较好的修复周围神经缺损的选择。采用Sondell提出的化学法[2]及此后Hudson对此作出改良的优化法[3]可以克服同种异体神经移植后引起的排异反应,在动物实验中取得了与自体神经移植类似的结果[4-5],但在临床上较ANG仍存在疗效上的差距[6]。最近有研究指出,长段ANG移植术后血供恢复较ANA更快,提示神经血供与修复疗效之间可能存在相关性[7]。
血供一直被认为是影响神经再生及功能恢复的重要因素。当神经损伤伴有血管损伤时,会导致较高的致残率[8]。最新研究表明,若失去血供的支持将使得移植神经再生缓慢并造成功能恢复障碍[9];而CD31+细胞能够高表达促血管形成基因,与改善移植神经功能有关[10],提示神经再生可能依赖于血管生成。组织血管内皮细胞(endothelial cells, ECs)是构成血管的主要成分之一,在各种因素如血管内皮生长因子(vascular endothelial growth factor, VEGF)驱动下激活迁徙和增生[11],但其在神经移植修复中的作用尚不明确。因此,本研究采用ANA治疗大鼠坐骨神经长段缺损,并在其中加入促血管形成的EC,观察局部血管形成数量的变化、神经再生、神经功能的恢复情况,以初步探讨EC和微血管血供在周围神经损伤修复中的价值。
1 资料与方法
1.1 动物来源及分组 80只雌性Sprague-Dawley大鼠(复旦大学上海医学院实验动物部),体质量250~300 g,取20只双侧坐骨神经制备ANA,其余随机分为3组:自体神经(ANG)移植组、去细胞同种异体神经(ANA)移植组、载血管内皮细胞+去细胞同种异体神经(ANA+EC)移植组。术后1、2、4、12 周各时间点,从3组各随机选取5只大鼠进行手术侧及非手术侧取材。
1.2 坐骨神经损伤模型的制作及处理 大鼠用1%戊巴比妥经腹腔注射麻醉消毒后,从右侧股二头肌与臀大肌肌间隙入路进入,显露坐骨神经,在10倍显微镜下,清除坐骨神经外膜与周围组织之间的粘连,游离坐骨神经,自坐骨结节处起向远端锐性切取1.5 cm长坐骨神经。取材时切取双侧坐骨神经;修复实验时切取右侧坐骨神经建立模型,按分组进行坐骨神经缺损修复,ANG移植组将切取神经180°翻转后作端端吻合,ANA移植组和ANA+EC移植组将事先制备的ANA或ANA+EC材料行端端吻合。之后逐层缝合,术后给予FK506免疫抑制治疗。所有手术实验均在复旦大学上海医学院实验动物部SPF级手术室内完成。
1.3 修复材料的制备
1.3.1 ANA的制备 根据Hudson优化法[3]制备去细胞大鼠同种异体神经。在25℃环境下,将切取所得15 mm坐骨神经放入无菌去离子蒸馏水的锥形试管中搅动7 h,125 mmol/L SB-10(美国Sigma-Aldrich)漂洗15 h,含0.14%Triton X-200(美国Sigma-Aldrich)和0.6 mmol/L SB-16(美国Sigma-Aldrich)溶液洗涤24 h,重复在SB-10中洗涤7 h,Triton X-200/SB-16中15 h,最终于4℃磷酸钠溶液中保存。
1.3.2 载血管内皮细胞去细胞同种异体神经的制备 EC为第4代大鼠主动脉血管内皮细胞(Raoec,中国科学院),当细胞生长融合率达90%时,使用含0.02%EDTA(美国Gibco)的0.25%胰蛋白酶消化,离心后加入完全培养基重悬细胞,调整细胞密度为3×107/mL。在12孔板内按每孔放入1根ANA并滴加1 mL细胞悬液,再加入含有细胞的完全培养基使ANA完全浸泡入内,置于湿化培养箱(37℃、5% CO2)内孵育,共培养2~3 d后手术用。
1.4 观察指标
1.4.1 坐骨神经功能指数(SFI) 自制1个长约1 m、宽约5 cm的行走槽,于槽底铺A4纸。将大鼠后肢涂抹蓝色染料至踝部,待足部着色后,使大鼠从槽的一端向另一端行走以留下足印,取其中最清楚的1枚足印,测量大鼠实验足(E)及正常足(N)的3个指标:足印长度(PL)即从足尖到足跟的最大距离;足趾宽度(TS)即第1趾到第5趾的距离;中间足趾距离(IT):第2趾到第4趾的距离。SFI=-38.3×(EPL-NPL)/NPL+109.5×(ETS-NTS)/NTS+13.3×(EIT-NIT)/NIT-8.8。
1.4.2 神经电生理恢复率检测 大鼠用相同建模方法手术显露术侧移植坐骨神经与非手术侧坐骨神经,将阔筋膜张肌向远端分离切开,显露两侧腓肠肌。采用Neuromatic-2000型二通道神经电生理仪(丹麦Dantec)行电生理检测:将黑色单极记录电导针插入靶肌肉的肌腹,将红色单极记录电导针插入黑色电极远端(靶肌肉的肌腱上),绿色接地电极插入刺激电极和记录电极之间处。打开KEYPOINT v5.06软件(美国Medtronic),选择要做的左(健)/右(患)侧神经,选择MCV选项,设置刺激电流0.5 mA,刺激时长0.2 ms,刺激频率0.5 Hz。将刺激电极放置于移植神经的远近两端两个吻合端,分别测量动作电位潜伏期(latency)、神经传导速度(nerve conduction velocity, NCV)和复合肌动作电位(compound muscle action potential, CMAP),并计算动作电位潜伏延迟率(latency delay rate, LDR)=手术侧动作电位潜伏期/非手术侧动作电位潜伏期×100%;神经传导速度恢复率(NCV RR)=手术侧神经传导速度/非手术侧神经传导速度×100%;复合肌动作电位恢复率(CMAPRR)=手术侧复合肌动作电位/非手术侧复合肌动作电位×100%。
1.4.3 最大强直收缩力(maximum tetanic force, MTF)恢复率(RR)检测 显露腓肠肌,固定大鼠的膝关节,使腓肠肌和胫前肌近端位于膝关节的止点保持固定,将腓肠肌和胫前肌于远端止点切断,连接于JZJ101型压力换能器(成都仪器厂),再与SMUP-E型生物信号处理系统(复旦大学上海医学院生理和病理学系研制)连接。打开MFLab 3.01软件(复旦大学上海医学院生理和病理学系研制),选择最大强直收缩力测定,设置脉冲强度0.5 V,脉冲频率1 Hz,脉冲串长10 s,脉冲宽度0.2 ms。将电刺激置于手术侧移植神经干中点,非手术侧置于相对应位置,进行刺激,软件记录手术侧与非手术侧MTF数值,计算MTFRR=手术侧MTF/非手术侧MTF×100%。
1.4.4 腓肠肌湿重(muscle wet weight,MW)恢复率(RR)测定 将腓肠肌近端止点切断,游离腓肠肌并剔除表面结缔组织,置于R200D型1/10万分析天平(德国Sartorius)上称重,得到肌肉湿重数值。计算肌肉湿重恢复率(MWRR)=手术侧腓肠肌MW/非手术侧腓肠肌MW×100%。
1.5 免疫组织化学染色及染色结果分析 标本用4%甲醛溶液固定,石蜡包埋。作5 μm切片,5% H2O2灭活内源性过氧化物酶,柠檬酸修复液(0.4 g柠檬酸+3 g柠檬酸三钠+1 L水)热修复,5% BSA(10 mL双蒸水+0.5 g BSA干粉,美国Gibco)封闭30 min,加入1%BSA配置、1∶100稀释的CD31兔抗鼠一抗(美国SAB)4℃下孵育18 h。PBS洗涤后,最后使用鼠兔通用二抗(丹麦Dako)进行染色并在显微镜下观察。
染色结果分析:基于CD31的微血管密度计数(microvessel density, MVD)是指管径小于8个红细胞、无厚血管壁、非纤维化区的微血管;单一内皮细胞或内皮细胞团,不管其有无管腔均被认为是独立的微血管。以EC染成棕黄色为阳性,单个EC着色也判断为阳性。参照Weidner等[12]的判断际准,先在低倍镜下(×10)选3个微血管数量最多的区域,再在高倍视野(×200)计数每个区域中的微血管数目,取其平均值。手术侧和非手术侧分别计数,然后计算微血管(MVD)增生率(PR)=手术侧MVD/非手术侧MVD。
1.6 甲苯胺蓝染色及电镜观察 术后12周时将大鼠移植神经中点及非手术侧对应点获取小段神经标本,在4℃先后于2.5%戊二醛、1%四氧化锇下固定各2 h脱水后于100%丙酮+环氧树脂(1∶1)室温过夜,纯环氧树脂37℃烘箱2 h后60℃包埋24 h。以1 μm厚度切片,5%甲苯胺蓝染色,20%醋酸分色,烘干、封固。LKB切片机(德国Leica)做半薄切片(400~500 nm),2%甲苯胺蓝染色,光镜下观察有髓神经等并做定位,为电镜观察做准备。超薄切片机(德国Leica)切片70 nm,在铜片上先用3%醋酸铀染色8~15 min,再用枸橼酸铅染色。在JEM 1400透射电子显微镜下观察(日本电子株式会社)。
甲苯胺蓝结果分析:光镜下观察,截取神经纤维密度较高的5个视野,通过传感器截图后保存。每个截图应用Image C软件(德国Imtronic),对每个视野内的神经纤维数量(nerve fiber)、髓鞘厚度(myelin thickness)、G ratio值(髓鞘面积在神经纤维横截面所占比例)进行测算,对均数进行比较。

2 结 果
2.1 坐骨神经功能指数(SFI)的比较 60只实验用大鼠均存活,未发生明显并发症。术后各组SFI随修复时间增长而逐渐升高,4 周起较前明显(P<0.01)。2周时ANA+EC移植组有优于ANA移植组的趋势(P=0.07);4 周时ANA+EC移植组SFI明显高于ANA移植组(P<0.05),并与ANG移植组相当;12 周时ANG移植组、ANA移植组和ANA+EC移植组SFI值差异无统计学意义(图1A)。
2.2 神经电生理恢复率的比较 术后12 周时各组LDR较前改善明显(P<0.05)。术后12 周ANA+EC移植组与ANA移植组间LDR差异无统计学意义(图1B)。术后NCVRR,ANA+EC移植组与ANA移植组相近,两者均明显低于ANG移植组(P<0.05);术后各时间点CMAPRR均较前改善,术后12 周时ANA+EC移植组均值高于ANA移植组,但差异无统计学意义,同时较ANG移植组仍有差距(P<0.05,图1C)。
2.3 最大强直收缩力恢复率(MTFRR)的比较 术后12 周时各组MTFRR较前明显增加(P<0.05)。术后4周时ANG移植组明显优于ANA移植组和ANA+EC移植组(P<0.01);12 周时ANA+EC移植组明显优于ANA移植组(P<0.05),ANG移植组最佳(P<0.05,图1D)。
2.4 腓肠肌湿重恢复率(MWRR)的比较 术后4 周前各组MWRR递减,12 周时与1周时相似。术后4 周时3组均值相似,12 周时ANG移植组、ANA+EC移植组、ANA移植组组间差异均有统计学意义(P<0.05,图1E)。
2.5 微血管(MVDPR)的比较 术后各组MVDPR随时间递减(P<0.05)。术后1 周时CD31染色(图2),ANA+EC移植组与ANG移植组相当,后者高于ANA移植组(P<0.05);术后2周时ANA+EC移植组与ANA移植组差异无统计学意义(图1F)。

图1 术后不同时间点3组大鼠神经功能的比较
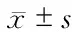
2.6 甲苯胺蓝染色后形态学观察 术后12 周,ANA+EC移植组神经纤维数量明显多于ANA移植组(P<0.01),但少于ANG移植组(P<0.01,图3A)。ANA+EC移植组髓鞘厚度稍多于ANA移植组,两者均少于ANG移植组(P<0.01,图3B)。ANG移植组G ratio更接近0.6,ANA移植组更接近1.0,ANA+EC移植组优于ANA移植组(P<0.01,图3C)。光镜与电镜下分别观察所见ANG移植组有髓神经再生形态较为规则(图4A、4D),ANA移植组形态不规整(图4B、4E),ANA+EC移植组亦介于二者之间(图4C、4F)。

图2 各组大鼠神经组织术后1 周时CD31染色

图3 各组大鼠术后12周再生神经纤维形态学特征的比较

图4 各组大鼠再生神经纤维的形态学特征
3 讨 论
近年来,一些学者尝试将内皮细胞或具有内皮细胞分化潜能的细胞应用到损伤区域。Taguchi等[13]给卒中大鼠注射了CD34+细胞后,通过改善脑部缺血环境以促进神经功能恢复;Sasaki等[14]发现外周血源性CD133+细胞可减少脊髓损伤后的空泡形成,获得更好的脊髓功能恢复;而使用经过分化的间充质干细胞(MSCs)可以提早再血管化,有髓神经形成较多,神经功能恢复也较好[15]。除了直接应用外源性细胞,一些生长因子也被用于加快神经损伤后的血供重建。目前已有不少将VEGF联合ANA进行神经修复的试验研究[16-17]。VEGF是促进血管形成的重要生长因子,在术后5~10 d通过增强神经内的血管形成,使雪旺细胞和轴突加快再生,程度和VEGF浓度呈剂量相关[18]。VGEF引起的血管增生可持续至术后30 d,在术后180 d有髓神经的数目相比对照组多78%[19]。VEGF同时也是对EC迁徙起到重要作用的因子,通过作用于Notch/Dll4系统刺激内皮细胞出芽,而各类整合素对血管内皮的极化、迁徙及细胞突起形成均有作用[20]。由此可见,神经修复早期对血供的要求较高,早期改善血供对神经再生效果具有帮助。
本研究在上述理念的基础上,利用Hudson优化法制备ANA作为移植神经,在其中加入EC构成新的组织工程神经,进一步探索EC在神经再生中的作用。研究结果显示,神经移植术后,早期血供要求较高,MVDPR明显升高,后逐渐下降,12周时已基本恢复至正常水平(MVDPR=1),与以往研究结果相似。术后早期,ANA+EC组微血管数目接近于ANG组,而ANA组则明显较ANG差;术后12周,ANA+EC组比ANA组有更多的有髓神经及粗大的神经纤维形成,G ratio更接近最佳预测理论值0.6[21],并获得了更大程度的CMAP和MTF恢复,提供了更好的肌肉营养作用(MWRR)。这些结果提示,载EC的ANA在神经修复早期能提供较好的血供,之后移植神经则获得了更好的神经再生效果。
ANA+EC移植组与ANA移植组在神经电生理结果中差异无统计学意义,仅在12 周时ANA+EC移植组具有优于ANA移植组的趋势,与预期结果并不一致。有文献指出,形态学特征(纤维数量、髓鞘厚度、G ratio)与神经电生理特征从不同角度对再生神经进行了描述,然而二者之间并不存在明显的相关性[22]。Kim等[23]研究则显示,加入VEGF的ANA移植组术后1个月时再生神经微血管分布及支配肌肉功能明显高于单纯ANA移植组,而电生理特征两者之间同样缺乏明显差异,这与本实验结论较为相似。当然,本研究神经电生理实验结果部分数值离散程度较大,可能存在样本量不足的情况。因此,血供在神经再生过程中与神经电生理是否具有关联,需要从更多角度和数量上进行进一步研究。
综上所述,对于长距离坐骨神经缺损的大鼠模型,使用载血管内皮细胞的去细胞同种异体神经进行神经移植修复,早期肌肉功能恢复优于单独使用去细胞同种异体神经,晚期神经纤维的数量和质量更接近于自体神经移植,提示血管内皮细胞在神经移植修复中具有一定作用。
[1] SELECKI B R, RING I T, SIMPSON D A, et al. Trauma to the central and peripheral nervous systems. Part Ⅱ: A statistical profile of surgical treatment New South Wales 1977[J].Aust N Z J Surg, 1982,52(2):111-116.
[2] SONDELL M, LUNDBORG G, KANJE M.Regeneration of the rat sciatic nerve into allografts made acellular through chemical extraction[J]. Brain Res, 1998,795(1-2):44-54.
[3] HUDSON T W, ZAWKO S, DEISTER C, et al. Optimized acellular nerve graft is immunologically tolerated and supports regeneration[J]. Tissue Eng, 2004,10(11-12):1641-1651.
[4] WHITLOCK E L, TUFFAHA S H, LUCIANO J P, et al. Processed allografts and type Ⅰ collagen conduits for repair of peripheral nerve gaps[J]. Muscle Nerve, 2009,39(6):787-799.
[5] GIUSTI G, WILLEMS W F, KREMER T, et al. Return of motor function after segmental nerve loss in a rat model: comparison of autogenous nerve graft, collagen conduit, and processed allograft (AxoGen)[J]. J Bone Joint Surg Am, 2012,94(5):410-417.
[6] BROOKS D N, WEBER R V, CHAO J D, et al. Processed nerve allografts for peripheral nerve reconstruction: a multicenter study of utilization and outcomes in sensory, mixed, and motor nerve reconstructions[J]. Microsurgery, 2012,32(1):1-14.
[7] FARBER S J, HOBEN G M, HUNTER D A, et al. Vascularization is delayed in long nerve constructs compared with nerve grafts[J]. Muscle Nerve, 2016,54(2):319-321.
[8] NICHOLS J S, LILLEHEI K O. Nerve injury associated with acute vascular trauma[J]. Surg Clin North Am, 1988,68(4):837-852.
[9] GIUSTI G, LEE J Y, KREMER T, et al. The influence of vascularization of transplanted processed allograft nerve on return of motor function in rats[J]. Microsurgery, 2016,36(2):134-143.
[10] LI Y, ZHANG Z, KIM H S, et al. CD31(+) cell transplantation promotes recovery from peripheral neuropathy[J]. Mol Cell Neurosci, 2014,62:60-67.
[11] CARMELIET P. Angiogenesis in health and disease[J]. Nat Med, 2003,9(6):653-660.
[12] WEIDNER N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors [J]. Breast Cancer Res Treat, 1995, 36(2): 169-180.
[13] TAGUCHI A, SOMA T, TANAKA H, et al. Administration of CD34+cells after stroke enhances neurogenesis via angiogenesis in a mouse model[J]. J Clin Invest, 2004,114(3):330-338.
[14] SASAKI H, ISHIKAWA M, TANAKA N, et al. Administration of human peripheral blood-derived CD133+cells accelerates functional recovery in a rat spinal cord injury model[J]. Spine (Phila Pa 1976), 2009,34(3):249-254.
[15] KEILHOFF G, GOIHL A, STANG F, et al. Peripheral nerve tissue engineering: autologous Schwann cellsvs. transdifferentiated mesenchymal stem cells[J]. Tissue Eng, 2006,12(6):1451-1465.
[16] ZOR F, DEVECI M, KILIC A, et al. Effect of VEGF gene therapy and hyaluronic acid film sheath on peripheral nerve regeneration[J]. Microsurgery, 2014,34(3):209-216.
[17] HILLENBRAND M, HOLZBACH T, MATIASEK K, et al. Vascular endothelial growth factor gene therapy improves nerve regeneration in a model of obstetric brachial plexus palsy[J]. Neurol Res, 2015,37(3):197-203.
[18] HOBSON M I, GREEN C J, TERENGHI G.VEGF enhances intraneural angiogenesis and improves nerve regeneration after axotomy[J]. J Anat, 2000,197 Pt 4:591-605.
[19] HOBSON M I. Increased vascularisation enhances axonal regeneration within an acellular nerve conduit[J]. Ann R Coll Surg Engl, 2002,84(1):47-53.
[20] LOBOV I B, RENARD R A, PAPADOPOULOS N, et al. Delta-like ligand 4 (Dll4) is induced by VEGF as a negative regulator of angiogenic sprouting[J]. Proc Natl Acad Sci U S A, 2007,104(9):3219-3224.
[21] CHOMIAK T, HU B. What is the optimal value of the g-ratio for myelinated fibers in the rat CNS? A theoretical approach[J]. PLoS One, 2009,4(11):e7754.
[22] IKEDA M, OKA Y. The relationship between nerve conduction velocity and fiber morphology during peripheral nerve regeneration[J]. Brain Behav, 2012,2(4):382-390.
[23] KIM B S, YOO J J, ATALA A. Peripheral nerve regeneration using acellular nerve grafts[J]. J Biomed Mater Res A, 2004,68(2):201-209.
[本文编辑] 廖晓瑜, 贾泽军
Role of vascular endothelial cells in repair of rat sciatic nerve defect using acellular nerve allograft
XU Qin-tong1△, MENG De-hua1△, ZHANG Jian1, PAN Jian-feng1, JIANG Li-bo1, CHEN Zeng-gan1, William C. LINEAWEAVER2, ZHANG Feng1,2*
1. Department of Orthopedics, Zhongshan Hospital, Fudan University, Shanghai200032, China2. Joseph M. Still Burn and Reconstructive Center, Jackson, Mississippi 39204, USA
Objective: To explore the effect of vascular endothelial cells (EC) in the repair of long sciatic nerve defect in rats using acellular nerve allograft (ANA). Methods: Totally 80 female Sprague. Dawley rats were used in this study, of which 20 rats were sacrificed for the harvest of bilateral sciatic nerves as acellular nerve allograft and prepared according to Hudson's method. The remaining 60 rats were transected on the right sciatic nerve a 1.5 cm defect and evenly divided into three groups, ANG for autologous nerve graft using flipped sciatic nerve, ANA for acellular nerve graft alone, and ANA+EC for ANA loaded with EC. At 1, 2, 4 and 12 weeks after operation, 5 rats from each group were selected for tests including sciatic functional index (SFI), LDR, nerve conduction velocity recovery rate (NCVRR), complex muscle action potential recovery rate (CMAPRR), max traction force recovery rate (MTFRR), gastrocnemius muscle wet weight recovery rate (MWRR) and microvessel density proliferation rate (MVDPR). The nerve fibers, myelin thickness, G ratio and electron microscopic examination were performed at 12 weeks after operation. Results: At early stage after surgery, ANA+EC group showed an increase in SFI and MVDPR compared to ANA group (P<0.05). At later stage after surgery, ANA+EC group showed an increase in CMAPRR, MTFRR, MWRR compared to ANA group (P<0.05). ANA+EC also exhibited more similar morphology to ANG in the long term. Conclusions: In the treatment of long sciatic nerve defect rat model, muscle function is superior in the short term when using ANA+EC compared to using ANA alone. In the long term, the amount and quality of nerve fibers in ANA+EC is more comparable to that in ANG. Thus indicates the possible effect of improvement of nerve regeneration in vascular endothelial cells.
peripheral nerve; endothelial cell; acellular nerve allograft
2017-03-29 [接受日期] 2017-05-08
国家自然科学基金面上项目(81371376),复旦大学“千人计划”. Supported by National Natural Science Foundation of China General Program (81371376) and Fudan University’s 1000-talent plan.
徐沁同,博士,住院医师. E-mail: xu.qintong@zs-hospital.sh.cn;孟德华,博士,主治医师. E-mail: meng.dehua@zs-hospital sh.cn
10.12025/j.issn.1008-6358.2017.20170269
R 651.3
A
△共同第一作者(Co-first authors).
*通信作者(Corresponding author). Tel: 021-64041990, E-mail: feng.zhang@burncenters.com
——从一道浙江选考生物学试题谈起

