鱼类催产激素对齐口裂腹鱼繁殖的影响
杨军+董舰峰+冯德品+易家新+汪波

摘要:分别使用促黄体素释放激素(LHRH-A2)、绒毛膜促性腺激素(HCG)和地欧酮(DOM)3种鱼类催产激素6个组合,对齐口裂腹鱼(Schizothorax prenanti Tchang)亲鱼进行注射催产处理,比较催产率、受精率和孵化率的变化,探讨齐口裂腹鱼对不同催产激素及其组合的适应性和敏感性,从而找出最适合齐口裂腹鱼繁殖的催产激素组合。结果表明,齐口裂腹鱼亲鱼对LHRH-A2、HCG和DOM组合的敏感度最高,催产率和孵化率显著优于单一激素和其他激素组合。
关键词:齐口裂腹鱼(Schizothorax prenanti Tchang);催产激素;繁殖;孵化
中图分类号:S965.199.2 文献标识码:A 文章编号:0439-8114(2017)12-2316-05
DOI:10.14088/j.cnki.issn0439-8114.2017.12.029
The Effect of Fish Oxytocin on the Reproductive of Schizothorax prenanti
YANG Jun1, DONG Jian-feng1, FENG De-pin1, YI Jia-xin2, WANG Bo3
(1.Yichang Aquaculture Technology Extension Station, Yichang 443000, Hubei, China;
2.Zhijiang Aquaculture Technology Extension Station, Zhijiang 443200, Hubei, China;
3.Maoyuanxiang Family Fish Farm of Lianghekou Town, Zigui 443600, Hubei, China)
Abstract: The parent fish of Schizothorax prenanti Tchang were injected with six combinations of luteinizing hormone releasing hormone A2(LHRH-A2), human chorionic gonadotropin(HCG) and domperidone(DOM) to hasten parturition. The spawning rate, fertilization rate and hatching rate were compared to investigate the adaptability and sensitivity of S. prenanti to different oxytocic hormones and oxytocic hormone combinations, thereby screening an appropriate combination of oxytocic hormones for the reproduction of S. prenanti. The results showed that S. prenanti exhibited the highest sensitivity to LHRH-A2 + HCG + DOM. The spawning rate and hatching rate of S. prenanti injected with LHRH-A2 + HCG + DOM were significantly higher than that of S. prenanti injected with single oxytocic hormone or other hormone combinations.
Key words: Schizothorax prenanti Tchang; oxytocic hormones; reproduction; hatch
齊口裂腹鱼(Schizothorax prenanti Tchang)属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothoracinae)、裂腹鱼属(Schizothorax Heckel),俗称洋鱼、细甲鱼、齐口细鳞鱼等,主要分布在长江上游的金沙江、岷江、大渡河、青衣江及乌江下游等水域[1,2]。齐口裂腹鱼个体较大,一般可长至1~3 kg,最大个体可达10 kg,历史上曾是产区最主要的经济鱼类。齐口裂腹鱼营养价值高,肌肉中蛋白质含量高达16.7%,脂肪含量较低,主要含有27种脂肪酸,不饱和脂肪酸含量高于饱和脂肪酸,多不饱和脂肪酸含量占脂肪酸总量的19.9%,必需氨基酸含量占氨基酸总量的47.9%,谷氨酸含量高,占氨基酸总量的14.6%[3],是一种极具开发潜力的名优鱼类。但近年来随着长江上游干支流水电梯级开发和大量水利工程的修建,导致长江上游水域生态系统出现严重的片段化,加之水体环境污染和过度捕捞等因素,使长江流域特有鱼类资源急剧下降[4]。而且水电开发也导致群落结构发生改变,阻隔了鱼类在不同江河流域群体间的基因交流,导致鱼类种类组成和种群结构小型化、鱼类多样性发生改变[5]。目前对齐口裂腹鱼的研究涉及生物学特征、发育研究、肌肉组成、消化生理、血液生理等方面[3,6-13],而人工催产技术的报道较少。合理使用催产激素是鱼类人工繁殖成功的关键技术之一,现在鱼类催产技术已经在鲢鱼(Hypophthalmichthys molitrix Valenciennes)、草鱼(Ctenopharyngodon idellus Cuvier et Valenciennes)、鳙鱼(Aristichthys nobilis Richardson)、青鱼(Mylopharyngodon piceus Richardson)中得到了广泛应用,并取得了良好效果[14]。若木等[12]于2001年对捕捞自四川省杜柯河的齐口裂腹鱼进行了人工催产,但催产效果不稳定,鱼卵孵化率低,鱼苗平游能力弱。董艳珍等[13]于2010年对养殖的齐口裂腹鱼亲鱼实施催产,在亲鱼成熟度判断、催产药物使用等方面进行了一些尝试。目前,人工养殖齐口裂腹鱼正在兴起,而鱼苗供给不稳定严重制约了规模化养殖的发展。为此,作者开展了几种鱼类催产激素及其组合对齐口裂腹鱼繁殖效果的影响试验,比较了不同鱼类催产激素及其组合对齐口裂腹鱼的催产效果,以期为进一步提高齐口裂腹鱼的繁殖率和资源保护与利用提供理论依据。
1 材料与方法
1.1 亲本来源与培育
试验在湖北省秭归县两河口镇懋源祥渔业养殖家庭农场繁育基地实施,所用亲鱼来自懋源祥渔业养殖家庭农场繁育基地,均为2010-2011年从天然水域收集到的野生齐口裂腹鱼,并经过近6年的人工驯养、培育。基地的齐口裂腹鱼亲鱼采取流水专池培育,所用水源为山泉水,溶氧≥6.0 mg/L。在培育期间,于每年的4-8月、11月到翌年的3月,投喂粗蛋白≥35.0%的鲤鱼成鱼饲料,9-10月投喂粗蛋白≥38.0%的黄颡鱼成鱼饲料,并在饲料里拌入适量的其他鱼鱼糜,繁殖前1个月强化冲水刺激,以促进性腺发育。试验选择体质健壮、无伤病个体作为亲鱼,雌鱼腹部要明显膨大,手摸松软,有弹性,生殖孔红润、突出,手摸尾柄下缘粗糙感明显;雄鱼吻部“珠星”突出,生殖孔略突出,轻压腹部有精液流出。
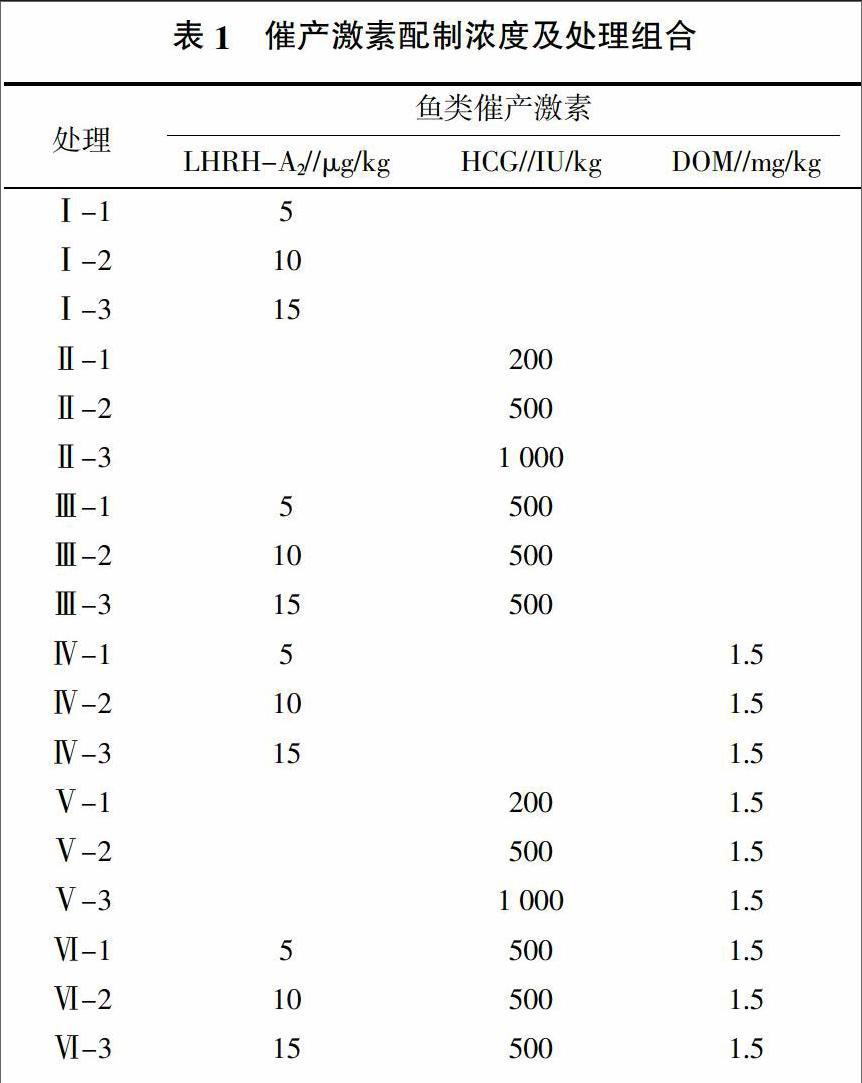
1.2 鱼类催产激素
注射用鱼类催产激素促黄体素释放激素(Luteinizing hormone releasing hormone A2,LHRH-A2)、绒毛膜促性腺激素(Human chorionic gonadotropin,HCG)和地欧酮(Domperidone,DOM)均由宁波市三生药业有限公司生产。将注射用LHRH-A2、HCG、DOM分别溶解于一定量的生理盐水中,按表1所列浓度和组合配制催产激素试验处理,置于密封玻璃瓶中,备用。
1.3 人工催产
试验时间为2015年的3月25日至5月25日。当水池水温稳定达到11 ℃以上后实施人工催产。对雌亲鱼腹腔注射2次催产药物;对雄亲鱼腹腔注射1次催产药物,在雌亲鱼第二次注射时进行,剂量为雌亲鱼的50%。注射催产药物后,将亲鱼放于催产池里,保持流水,加强冲水刺激。池面用遮阳网盖住,防止阳光照射和亲鱼跳跃出催产池。定时观察亲鱼活动情况,发现亲鱼有明显发情征兆后,适时拉网检查,防止卵粒过熟而退化。
采用干法受精,具体操作是从池中取出雄鱼放入担架内备用;检查雌鱼,把已经达到催产效应期的雌鱼擦干体表,将卵挤入干净的塑料盆内,并迅速擦干雄魚体表,将精液挤于盆内卵上,轻轻摇动塑料盆30~60 s,使精卵混合均匀,随即加入适量保护液,再摇动塑料盆60 s左右,加入清水,使受精卵卵膜及时吸水膨胀,再用清水清洗受精卵3~4次,然后放入孵化箱内进行下一步的孵化。
1.4 人工孵化
孵化水槽规格为400 cm×80 cm×35 cm,底部设置排水管。孵化箱为木质框架,规格为40 cm×40 cm×20 cm,底部及四周用40目的网布包裹。孵化用水为山泉水,进水口用80目过滤网过滤,采取淋喷式表面进水,底部排水。将孵化箱放置于孵化水槽内,箱底浸没于水下10~12 cm。每个孵化箱放卵8 000~10 000粒,轻摇孵化箱使受精卵均匀平铺。在孵化过程中保持微流水,定时轻摇孵化箱,防止受精卵堆积。剔除水霉卵,控制水霉病发生。
1.5 孵化指标
孵化指标有效应时间(注射鱼类催产激素时间到发情时间的时间间隔,h)、催产率、受精率、孵化率,公式如下:
催产率=产卵雌鱼总数/催产雌鱼总数×100%,
受精率=受精卵数/总卵数×100%,
孵化率=出膜仔鱼数/入孵受精卵总数×100%。
1.6 不同水温下注射对齐口裂腹鱼繁殖的影响
分别于2015年的4月24日、5月15日,都选用Ⅵ-1、Ⅵ-2、Ⅵ-3处理,在不同的水温(11~15 ℃、15~18 ℃)里对30尾齐口裂腹鱼亲鱼注射LHRH-A2+HCG+DOM(组合处理),比较不同温度对齐口裂腹鱼繁殖的影响。
2 结果与分析
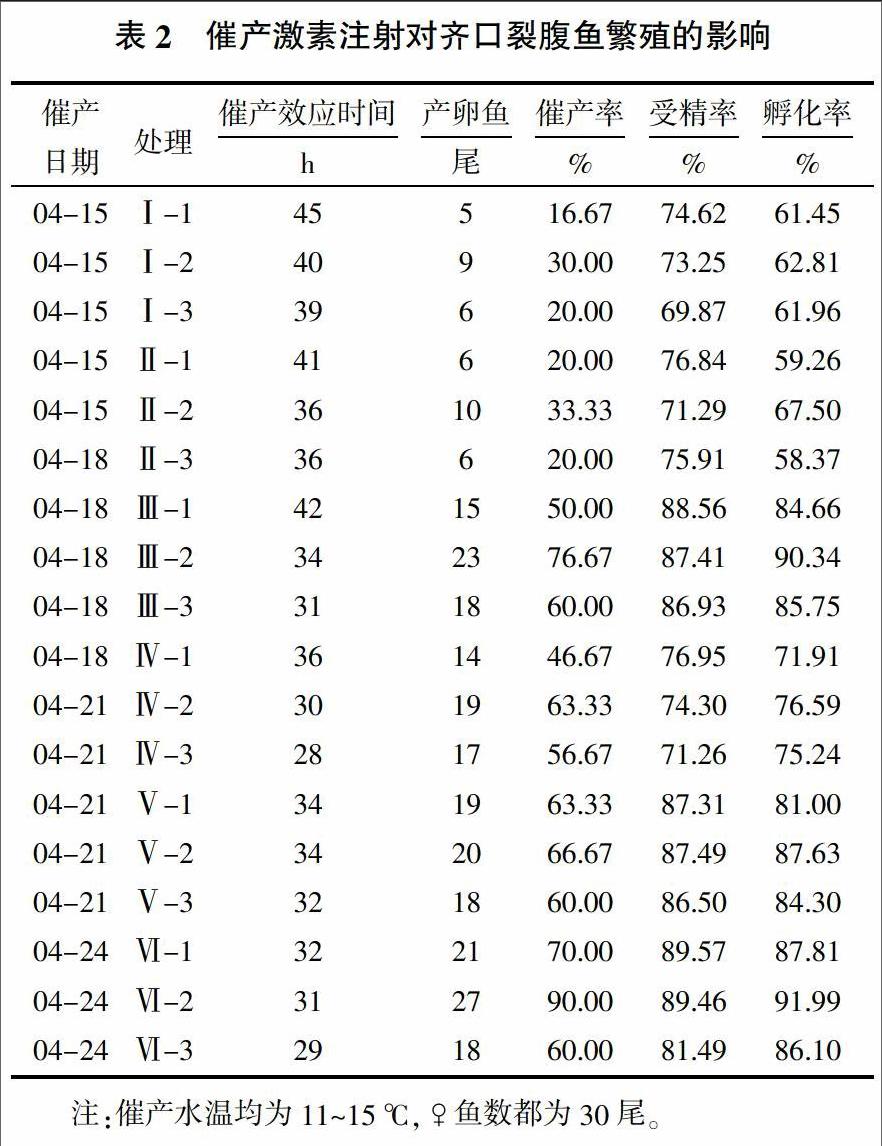
2.1 催产激素注射对齐口裂腹鱼繁殖的影响
鱼类催产激素对齐口裂腹鱼亲鱼繁殖效果的影响情况见表2。从表2分析可知,在相同水温条件下,催产效果最好的处理为Ⅵ-2,催产率达90.00%,而催产率最低的处理是Ⅰ-1,仅为16.67%。受精率最高的处理为Ⅵ-1,达89.57%,最低的处理是Ⅳ-3,为71.26%。孵化率最高的处理为Ⅵ-2,达91.99%,最低的处理是Ⅱ-3,为58.37%。综合比较发现,使用催产激素LHRH-A2+HCG+DOM的组合处理,其齐口裂腹鱼亲鱼催产率和孵化率明显高于其他处理,而受精率与其他各处理差异不大;对比催产率、受精率和孵化率的结果,以Ⅵ-2的组合处理繁殖效果最佳。
2.2 催产激素注射后齐口裂腹鱼的催产效应时间变化
从表2还可见,在催产水温均为11~15 ℃,♀鱼数都为30尾条件下,各鱼类催产激素处理对齐口裂腹鱼亲鱼的催产效应时间分别是Ⅰ-1为45 h、Ⅰ-2为40 h、Ⅰ-3为39 h、Ⅱ-1为41 h、Ⅱ-2为36 h、Ⅱ-3为36 h、Ⅲ-1为42 h、Ⅲ-2为34 h、Ⅲ-3为31 h、Ⅳ-1为36 h、Ⅳ-2为30 h、Ⅳ-3为28 h、Ⅴ-1为34 h、Ⅴ-2为34 h、Ⅴ-3为32 h、Ⅵ-1为32 h、Ⅵ-2为31 h、Ⅵ-3为29 h。这个结果说明在同种催产激素作用下, 不同体重的亲鱼其催产效应时间相差不大,反映出体重相差不大的齐口裂腹鱼亲鱼的性成熟度类似,在同一催产激素作用下催产效应时间相近;但在不同剂量的催产激素作用下,齐口裂腹鱼亲鱼的催产效应时间产生一定的差异,相同催产激素处理的亲鱼随着催产激素剂量的增加,催产效应时间呈缩短的变化趋势,说明催产激素对齐口裂腹鱼亲鱼的性腺成熟具有促进作用,它影响亲鱼性腺成熟的快慢。另外,加入DOM的催产激素组合处理能缩短催产效应时间,提高催产率,而且尽管催产效应时间短,但产卵量集中稳定。
2.3 催产激素注射对齐口裂腹鱼亲鱼孵化指标的影响
催产激素注射对齐口裂腹鱼亲鱼催产率、受精率、孵化率的影响情况见图1。从图1分析可知,使用催产激素LHRH-A2、HCG和DOM对齐口裂腹鱼亲鱼进行注射催产,无论是单独使用还是组合使用,都能起到催产作用,并且将3种催产激素按一定剂量组合使用则催产和孵化的效果更佳,其中催产率最高的可达到90.00%,孵化率达到91.99%。不过对受精率的影响没有象催产率、孵化率那样明显。
2.4 催产激素在不同水温里注射对齐口裂腹鱼繁殖的影响
在不同水温里注射鱼类催产激素对齐口裂腹鱼亲鱼繁殖效果的影响情况见表3。从表3分析可知,同种组合处理、相同剂量的催产激素在不同水温条件下对齐口裂腹鱼的催产率影响较大,以Ⅵ-2处理为例,当水温从11~15 ℃上升至15~18 ℃后,催产率从90.00%下降至23.33%,受精率和孵化率分别从89.46%、91.99%下降至62.40%、67.36%,甚至有个别亲鱼死亡,说明在齐口裂腹鱼人工繁殖时,水温对齐口裂腹鱼的繁殖效果影响很大,繁殖的适宜水温为11~15 ℃。
3 小结与讨论
3.1 催产激素
在鱼类养殖过程中,人工催产技术一直是提高养殖经济效益的关键技术。其中激素的合理选择、对激素适应性和敏感性的确认是鱼类人工催产有无效果的重要因素[15,16]。目前鱼类人工繁殖采用的催产药物主要有LHRH-A、HCG、DOM、鲤鱼脑垂体(Pituitary gland,PG)等[17]。
HCG是由胎盘的滋养层细胞分泌的一种糖蛋白,它是由α和β二聚体的糖蛋白组成。其商品为白色、灰白色或淡黄色粉末,易溶于水,受热易失效。HCG大量存在于孕妇的尿液和血液中,HCG制剂一般从孕妇的尿液和刮宫液中提取。该激素主要有促进排卵、加快性腺发育和促使雌、雄性激素分泌的作用,与促黄体素(Luteinizing hormone,LH)功能相似,可刺激黄体持续分泌黄体酮和雌激素,以促进子宫蜕膜的形成,使胎盘生长成熟。在处理动物时,该激素能促进卵泡成熟、排卵并形成黄体[18]。该激素用于鲢、鳙鱼催产效果较好,一般用量雌鱼是800~1 200 IU/kg,雄鱼用量为雌鱼的1/3~1/2[19]。试验采用腹腔注射对齐口裂腹鱼进行人工催产,从结果来看,HCG可以用作单一催产激素,但是用量较大,大批量使用成本极其昂贵,不适合规模化人工繁殖。试验中HCG的最高剂量只有1 000 IU/kg,继续加大HCG剂量是否会导致齐口裂腹鱼产卵量再增大、是否会出现产卵量先升后降或者导致雌鱼死亡,还需要进一步验证。
LHRH-A的主要作用是引起垂体释放促卵泡素(Follicle stimulating hormone,FSH)和LH,尤其是对LH作用大,促使卵巢血流加速、卵泡排卵和LH形成。前人研究发现[20],生长卵泡的继续发育需要有垂体分泌的FSH和LH参与,卵泡腔的形成及其最后生长则完全依赖于FSH和LH。在鱼类,下丘脑分泌的促性腺激素释放激素(Gonadotropin releasing hormone,GnRH)及其类似物(GnRH-A)具有促进脑垂体促性腺激素(Gonadotropin,GtH)和生长激素(Growth hormone,GH)释放的双重作用,因而它既能促进鱼的生殖活动,又能促进鱼体生长[21]。LHRH-A被用作鱼类人工催产激素已经有相当时间了[22,23],在对鲤、鲢、草鱼注射LHRH-A后,短时间内能有效诱导促性腺素分泌,达到催产效果。但在本试验中,单用LHRH-A虽能导致齐口裂腹鱼发情产卵,但无论是催产率、产卵率,还是受精率都较低,效果都不理想;所以在齐口裂腹鱼的催产中应尽量避免单独使用LHRH-A。至于为什么LHRH-A对四大家鱼有较好的催产效果、但对齐口裂腹鱼却效果不佳的原因还有待以后深入探寻。
DOM为多巴胺拮抗物,是一种高活性的新型鱼类催产剂,由加拿大的Peter 和中国的林浩然于1987年提出,并在新加坡举行的“诱导鱼类繁殖”国际学术会议上定名为“林-彼方法”。其能阻断多巴胺对GtH释放的抑制作用,促进GtH释放。DOM可抑制 LHRH-A负反馈, 具有辅助增效作用[24]。DOM与LHRH-A和鲑鱼促性腺激素释放激素类似物(Salmon gonadotropin-releasing hormone-analog,S-GnRHa)共同使用,可完全取代鱼脑下垂体,适用于鱼类人工繁殖。该方法催产效果好而稳定,己在国内四大家鱼及鲤鱼(Cyprinus carpio L.)、鲮鱼(Cirrhinus molitorella Cur.et Val.)、鲂鱼(Megalobrama Dybowsky)等许多鱼类的人工催产中广泛应用。试验将DOM与LHRH-A、HCG混合使用,取得了良好效果,通过比较得到了最佳的激素组合和剂量,在催产效果和催产成本上都有了较大的改进。
3.2 水温
试验选择2个水温范围进行催产比较,结果表明,水温在11~15 ℃时的催产率、受精率和孵化率要高于水温15~18 ℃的。因此,齐口裂腹鱼人工繁殖时,水温最好选择11~15 ℃,且要求水温稳定,昼夜水温变化不超过1 ℃。
3.3 亲鱼成熟度
亲鱼性腺发育水平是鱼类人工繁殖能否成功的决定性因素之一,不仅直接关系到催产率、受精率及孵化率,而且也关系着苗种的成活率,甚至影响苗种质量。保证性腺发育的关键是为齐口裂腹鱼创造适宜的生活环境,并注意亲鱼培育的方式方法。试验根据齐口裂腹鱼的生物学、繁殖生理及营养需求,在不同阶段投喂不同的饲料,以保证亲鱼营养需求,并通过对水流等生态因子的调节,促进齐口裂腹鱼的性腺发育,以培育出优良亲本。亲鱼培育主要是使用商品饲料,在4-8月、11月至翌年3月投喂粗蛋白≥35.0%的鲤鱼成鱼饲料;9-10月投喂粗蛋白≥38.0%的黄颡鱼成鱼饲料,并在饲料里拌入适量的鱼糜;繁殖前1个月强化冲水刺激,增大亲鱼活动量,消耗多余脂肪,促进性腺发育。
试验结果表明,人工培育的性成熟齐口裂腹鱼雌、雄亲鱼,在使用LHRH-A2、HCG、DOM 3种催产激素并按一定剂量组合注射后,可使齐口裂腹鱼适应催产激素,产生敏感性,极大提高催产率、受精率、孵化率,其催产率达到90.00%,受精率达到89.46%,孵化率达到91.99%;适宜繁殖的水温为11~15 ℃。所以,齐口裂腹鱼亲鱼在人工培育条件下人工繁育,選择达到繁殖要求的亲鱼、合理配制催产激素及比例是人工繁育提高成功率的关键。
参考文献:
[1] 武云飞,吴翠珍.青藏高原鱼类[M].成都:四川科学技术出版社,1992.
[2] 乐佩琦.中国动物志·硬骨鱼纲·鲤形目(下)[M].北京:科学出版社,2000.273-390.
[3] 周兴华,郑曙明,吴 青,等.齐口裂腹鱼肌肉营养成分的分析[J].大连水产学院学报,2005,20(1):20-24.
[4] 谢佳燕.我国齐口裂腹鱼的研究现状[J].安徽农业科学,2010, 38(25):13721-13722,13726.
[5] 黄 亮.水工程建设对长江流域鱼类生物多样性的影响及其对策[J].湖泊科学,2006,18(5):553-556.
[6] 李山友,周小宁,段玉磊.齐口裂腹鱼的生物学特性与资源保护[J].内陆水产,2002(10):15.
[7] 周 波,龙治海,何 斌.齐口裂腹鱼繁殖生物学研究[J].西南农业学报,2013,26(2):811-813.
[8] 吴 青,王 强,蔡礼明,等.齐口裂腹鱼的胚胎发育和仔鱼的早期发育[J].大连水产学院学报,2004,19(3):218-221.
[9] 周兴华,郑曙明,向 枭,等.齐口裂腹鱼对膨化和非膨化饲料粗蛋白质酶解速率研究[J].粮食与饲料工业,2006(4):38-40.
[10] 陈永祥,肖玲远,严太明,等.野生和养殖裂腹鱼血液学指标的比较研究[J].水生生物学报,2009,33(5):905-910.
[11] 段 彪,向 枭,周兴华.齐口裂腹鱼饲料中适宜脂肪需要量的研究[J].动物营养学报,2007,19(3):232-236.
[12] 若 木,王鸿泰,殷启云,等.齐口裂腹鱼人工繁殖的研究[J].淡水渔业,2001,31(6):3-5.
[13] 董艳珍,邓思红.齐口裂腹鱼的人工繁殖与苗种培育[J].水产科学,2010,30(10):638-640.
[14] 刘焕亮.我国鱼类催情产卵药物的研究与实践[J].科学养鱼,2001(2):34.
[15] WHITT G S,CHILDERS W F,CHO P L. Allelic expression at enzyme loci in anintertribal hybrid sunfiish[J]. J Hered,1973, 64:55-61.
[16] SHAW C R,PRASAD R. Starch gel electgroph0resis of enzymes-A compilation of recipes biochem[J].Biochem Genet,1970,4(2):297-320.
[17] 熊谱成.鱼类催产剂的合理使用[J].中国动物保健,2001(6):11.
[18] 張忠诚.家畜繁殖学[M].北京:中国农业出版社,2004.37.
[19] 李润潼.四大家鱼的人工繁殖技术[J].生物学通报,1985(12):8-10,14.
[20] LIN H R,SUN Y. The effects of neuroend crine factor administration in diet on growth hormone(GH) secretion and growth in juvenile grass carp(Ctenopharyngodon idellus)[A].Asian Fisheries Society. The fifth Asian fisheries forum[C].Thailand: Aquatic Resources Research Institute,Chulalongkorn University,1998.190.
[21] 龙 进,刘晓春,谢嘉华,等.投喂LHRH-A粗制品对鲫鱼生长激素释放和生长速率的影响[J].中山大学学报(自然科学版),2004,43(6):37-40.
[22] 许谷星,沈仁澄,王育西,等.产卵季节LHRH-A对鲤、鲢、草鱼促性腺激素分泌的诱导[J].水产学报,1981,5(2):103-109.
[23] 福建、江苏、上海淡水经济鱼类人工繁殖协作组.合成丘脑下部促黄体生成素释放激素(LRH)的类似物对家鱼的催情产卵[J].生物化学生物物理学报,1976,8(2):107-114.
[24] 宋 艳,曹 阳,梁仁福.鱼类催产药物应用中注意的问题[J].齐鲁渔业,2002,19(12):21.

