复方槲皮素乳膏治疗白癜风临床评价
胡丽敏,孙绍伟,王滨,于鹏飞,魏传梅
(滨州医学院附属医院药学部,山东滨州256603)
·临床研究·
复方槲皮素乳膏治疗白癜风临床评价
胡丽敏,孙绍伟,王滨,于鹏飞,魏传梅
(滨州医学院附属医院药学部,山东滨州256603)
目的观察复方槲皮素乳膏治疗白癜风的临床疗效及安全性。方法将医院皮肤科门诊诊治的76例白癜风患者随机分为3组,治疗组(A组)36例,病变局部外用复方槲皮素乳膏;对照1组(B组)20例,病变局部外用复方甲氧沙林乳膏;对照2组(C组)20例,病变局部外用0.1%他克莫司软膏。结果3组总有效率分别为72.22%,44.44%和75.00%,A组、C组均明显优于B组(P<0.05);3组不良反应发生率分别为5.56%,60.00%和25.00%,A组、C组明显低于B组(P<0.01),且A组明显低于C组(P<0.05)。结论复方槲皮素乳膏与0.1%他克莫司软膏外涂治疗白癜风疗效相当,较复方甲氧沙林乳膏疗效显著,且不良反应少,值得临床推广。
复方槲皮素乳膏;复方甲氧沙林乳膏;他克莫司软膏;白癜风;临床疗效;安全性
近年来的文献报道,氧化应激和免疫反应是白癜风发病的2个重要因素[1],抗氧化剂在白癜风治疗中的应用越来越受到关注。复方槲皮素乳膏是本院制剂复方甲氧沙林乳膏(主要成分为甲氧沙林和消旋山莨菪碱)的改进制剂,新剂型对原处方成分进行了改进,增添了适量具有强大抗氧化作用的槲皮素[2-3]。为观察该药治疗白癜风的疗效及安全性,我院皮肤科门诊将2015年4月至2016年4月收治的76例白癜风患者分为3组,分别给予复方槲皮素乳膏、复方甲氧沙林乳膏、0.1%他克莫司软膏治疗。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:年龄16~62岁;临床诊断及分型、分期参考全国色素病学组制订的标准。
排除标准:孕妇、哺乳期妇女;严重心、肝、肾疾病;治疗前1个月用过糖皮质激素、免疫抑制剂;治疗部位合并有其他皮肤病;中途退出,未完成疗程。
病例选择与分组:选择我院皮肤科门诊诊治的白癜风患者76例,其中男36例,女40例;年龄16~62岁,平均31.8岁;病程3个月至10年,6个月至2年38例(50.00%),2~7年30例(39.47%),7年以上8例(10.53%);进展期30例,稳定期46例;局限型41例,散发型24例,指端型11例。皮损大多分布于面颈部、躯干部、手足等,皮损面积大者3.2 cm×5.1 cm,小者1.1 cm×0.7 cm。按治疗方法的不同将患者分为3组,其中治疗组(A组)36例,男16例,女20例;对照1组(B组)20例,男、女各10例;对照2组(C组)20例,男、女各10例。3组患者的年龄、病程、皮损情况等一般资料比较,差异无显著性(P>0.05),具有可比性。
1.2 治疗方法
A组皮损部位外用复方槲皮素乳膏(本院制剂室自制,批号为20150306,规格为每支含槲皮素0.2%,含消旋山莨菪碱0.2%,含倍他米松0.1%,含甲氧沙林0.1%),B组外用复方甲氧沙林乳膏(本院制剂室自制,批号为20150306,规格为每支含甲氧沙林0.1%,含消旋山莨菪碱0.2%,含醋酸地塞米松0.04%),C组外用0.1%他克莫司软膏(安斯泰来制药<中国>有限公司,批号为20141205,规格为0.1%)。3组患者均每日涂抹2次,涂药后30 min日光照射患处10 min,同时口服转移因子胶囊[长春海外制药集团有限公司,批号为20150126,规格为每粒3mg(多肽)∶100μg(核糖)],每次6 mg,每日2次。用药期间患者如局部发生红肿、水疱等应暂停应用,待症状消失后再用。3组患者均治疗2个疗程(2个月为1个疗程),1个月复查1次,4个月后判定临床疗效和不良反应。
1.3 观察指标及疗效判定标准
用药后1,2,3,4个月观察临床症状和体征,包括白斑面积是否有变化,白斑边缘是否清晰,是否出现色素加深,白斑中央是否有毛囊性黑点生长。白癜风患者治疗1个月后,如有下述表现之一,提示治疗有效:白斑不再发展;白斑边缘由模糊不清转为清晰;白斑边缘出现着色加深的现象;白斑中央有1/4长出毛囊性黑点;白斑色泽有1/2转红或渐变淡、变模糊。并记录不良反应出现的时间、程度及处理经过。患者在治疗过程中的情况始终由同一人负责记录。
根据中国中西医结合学会皮肤性病学分会制订的《白癜风临床分型及疗效标准(2003年修订稿)》[4]判定疗效。痊愈:白斑全部消退,恢复正常肤色;显效:白斑部分消退或缩小,恢复正常肤色的面积占皮损面积不小于50%;有效:白斑部分消退或缩小占皮损面积小于50%;无效:白斑无色素再生或范围扩大。总有效=痊愈+显效。同时,将不良反应分为4级。无反应:用药后无任何继发皮疹出现;轻度反应:用药后局部充血瘙痒;中度反应:用药后局部出现红斑、丘疹,但仍能坚持治疗;重度反应:用药后局部发生红肿、水疱、渗出、糜烂,不能继续治疗。
1.4 统计学处理
2 结果
2.1 临床疗效
B组患者中2例因不良反应严重,用药1周即中断治疗而被剔除,未纳入统计,其余患者均完成治疗。治疗后,A组、C组总有效率均明显优于B组(P<0.05)。详见表1。

表1 3组患者临床疗效比较[例(%)]
2.2 皮损面积
治疗4个月后,3组患者的皮损面积均明显缩小(P<0.01,P<0.05)。详见表2。
表2 3组患者皮损面积变化比较(,cm2)

表2 3组患者皮损面积变化比较(,cm2)
注:与本组治疗前比较, P<0.01,#P<0.05。
2.3 不良反应
结果见表3。其中,A组有1例出现皮肤瘙痒,1例出现红斑;B组有3例出现皮肤瘙痒,4例出现红斑,3例出现红肿、水疱、糜烂;C组有2例出现皮肤瘙痒,2例出现红斑,2例出现斑疹。A组和C组患者的症状均经减少用药剂量或暂停治疗,给予对症治疗后消失,均无因不良反应而终止试验的病例。
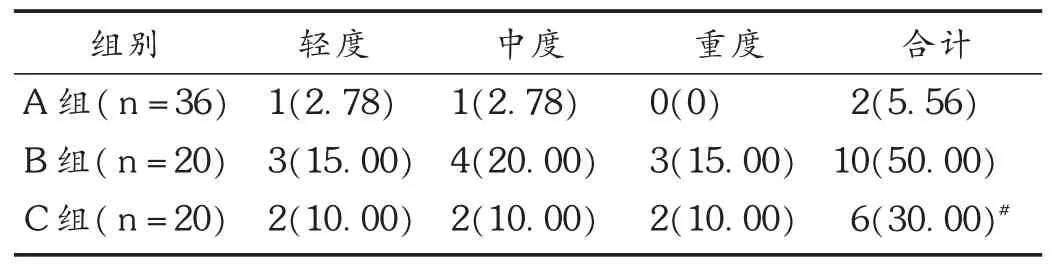
表3 3组患者不良反应发生情况比较[例(%)]
3 讨论
复方甲氧沙林乳膏主要成分为甲氧沙林、山莨菪碱、地塞米松。其中,甲氧沙林是传统的治疗白癜风的光敏剂,配合日晒,可提高酪氨酸酶活性,促进表皮黑色素形成,促使毛囊中的黑色素细胞向表皮移动,从而使皮肤上出现色素沉着,但其光敏作用可引起较严重的局部炎性反应,如水疱、糜烂等,致使患者不能继续用药;山莨菪碱为乙酰胆碱拮抗剂,可有效对抗乙酰胆碱破坏黑色素细胞作用,阻止白癜风的发生。白癜风患者在全身氧化应激状态下,乙酰胆碱酶被灭活,乙酰胆碱聚集导致黑色素细胞破坏,从而诱发白癜风[5]。糖皮质激素地塞米松的可抑制皮肤受损部位的黑色素细胞的自身免疫反应,促进其功能恢复[6]。另外,糖皮质激素具有较好的抗炎、抗过敏作用,可对抗甲氧沙林光敏作用导致的局部炎性反应。但在使用过程中发现,复方甲氧沙林乳膏仍有较严重的局部炎性反应发生,导致部分患者中断治疗。
他克莫司为强效免疫抑制剂,可阻止一些淋巴因子的基因转录。其阻止白癜风的发展与抑制局部异常免疫反应,刺激角质形成细胞释放干细胞因子,促进黑色素细胞的增殖、生长,创造有利于黑色素细胞迁移的环境有关。外用他克莫司后,皮损局部异常免疫反应消失,使得残存的黑色素细胞得以继续生长增殖,毛囊中的黑色素细胞向表皮内游走、分裂、增殖,然后产生色素,使白癜风的发展停滞[7],临床疗效较好。但由于缺乏长期安全性的资料和存在潜在的致癌风险,美国食品药物管理局(FDA)要求外用他克莫司在包装上加黑框警告,这是FDA关于药品不良反应最严厉的警告[8]。有文献报道,外用他克莫司可引起许多严重的不良反应[9],如出现鳞状细胞癌、黑色素瘤和感染性疾病等。基于外用他克莫司具有较强的免疫抑制作用和潜在的系统吸收问题,长期使用的安全性问题备受关注,专家建议,应考虑监测长期外用他克莫司患者的血药浓度以减少用药危险[8];建议在长期外用他克莫司治疗前应对顽固性疾病进行病理检查,而长期治疗后,对治疗区域内新出现的增生性或溃疡性损害应做必要的病理检查。
复方槲皮素乳膏的主要成分为槲皮素、甲氧沙林、山莨菪碱和倍他米松。白癜风患者表皮内氧化应激增加,出现高浓度的H2O2聚集,并导致黑色素细胞形态及功能改变[10]。Dell′Anna等[11]使用抗氧化剂联合窄谱中波紫外线(NB-UVB)治疗白癜风,疗效明显,表明白癜风患者中存在氧化应激失衡,且与H2O2关系密切。处方中的槲皮素具有较强的抗氧化作用,可以强力抑制由H2O2诱导的氧化应激,从而阻断H2O2对黑色素细胞的破坏作用[12],且槲皮素较强的抗氧化作用导致其产生较好的抗炎活性。胡蓉等[13]研制的槲皮素醇质体凝胶剂对二甲苯致小鼠耳廓肿胀有较显著的抑制作用,其抗炎机制为抑制炎症的发生与发展,阻断或减少炎性介质的释放,从而缓解炎症。另外,倍他米松是地塞米松的差向异构体,作用与地塞米松相同,但抗炎作用较地塞米松强[14],作用迅速,不良反应少而轻。4种药物可从不同角度促进病损处黑色素细胞的增长,同时治疗白癜风又具有互补作用。山莨菪碱有改善微循环和扩张毛细血管作用,可促进槲皮素和甲氧沙林的吸收;槲皮素和倍他米松的抗炎作用可对抗甲氧沙林的光敏作用引起的局部炎性反应。本研究结果显示,该软膏临床疗效较好,且明显高于复方甲氧沙林乳膏,但与0.1%他克莫司软膏相比无显著性差异,且局部无刺激,不良反应少而轻,发生率明显低于复方甲氧沙林和他克莫司软膏,克服了复方甲氧沙林乳膏较严重的局部炎性反应的发生,使大多患者能按疗程治疗,从而提高疗效。
[1]Wang X,Du J,Wang T,et al.Prevalence and clinical profile of vitiligo in China:a community-based study in six cities[J].Acta Derm Venereol,2013,93(1):62-65.
[2]Boots AW,Haenen GR,Bast A.Health effects of quercetin:From antioxidanttonutraceutical[J].Eur JPharmacol,2008,585(2-3):325-337.
[3]Min K,Ebeler SE.Quercetin inhibits hydrogen peroxide-induced DNA damage and enhances DNA repair in Caco-2 cells[J].Food Chem Toxicol,2009,47(11):2716-2722.
[4]中国中西医结合学会皮肤性病专业委员会色素病学组.白癜风临床分型及疗效标准(2003年修订稿)[J].中华皮肤科杂志,2004,37(7):440.
[5]Kamaraj S,Vinodhkumar R,Anandakumar P,et al.The effects of quercetin on antioxidant status and tumormarkers in the lung and serum ofmice treated with benzo(a)pyrene[J].Biol Pharm Bull,2007,30(12):2268-2273.
[6]Boone B,Ongenae K,Van Geel N,et al.Topical pimecrolimus in the treatmentofvitiligo[J].Eur JDermatol,2007,17(1):55-61.
[7]Kang HY,Choi YM.FK506 increases pigmentation and migration of human melanocytes[J].Br JDermatol,2006,155(5):1037-1040.
[8]Ring J,Mehrenschlager M,Henkel V,et al.The US FDA′black box′warning for topical calcineurin inhibitors:an ongoing controversy[J].Drug Saf,2008,31(3):185-198.
[9]王瑞华,张堂德.外用他克莫司安全性研究进展[J].国际皮肤性病学杂志,2012,38(2):77-80.
[10]Schallreuter KU,Moore J,Wood JM,etal.In vivo and in vitro evidence for hydrogen peroxide(H2O2)accumulation in the epidermis of patients with vitiligo and its successful removal by a UVB-activated pseudocatalase[J].J Investig Dermatol Symp Proc,1999,4(1):91-96.
[11]Dell′Anna ML,Mastrofrancesco A,Sala R,et al.Antioxidants and narrow band-UVB in the treatment of vitiligo:a doubleblind placebo controlled trial[J].Clin Exp Dermatol,2007,32(6):631-636.
[12]Casp CB,She JX,McCormack WT.Genetic association of the catalase gene(CAT)with vitiligo susceptibility[J].Pigment Cell Res,2002,15(1):62-66.
[13]胡蓉,邓琪,张纪法,等.槲皮素醇质体凝胶剂的研制[J].药物生物技术,2013,20(2):149-151.
[14]陈新谦,金有豫,汤光.新编药物学[M].第17版.北京:人民卫生出版社,2011:616.
C linical Effect of Com pound Quercetin Ointm ent in Treating Leukoderm a
Hu Limin,Sun Shaowei,Wang Bin,Yu Pengfei,Wei Chuanmei
(Department of Pharmaceutical,The Affiliated Hospital of Binzhou Medical University,Binzhou,Shandong,China 256603)
Objective To observe the clinical effect and safety of Compound Quercetin Ointment in treating leukoderma.M ethods Totally 76 patients with leukoderma in our hospital were divided into 3 groups,the group A(36 cases)was given Compound Quercetin Ointment,the control group 1(group B,20 cases)was given Compound Methoxsalen Ointment,and the control group 2(group C,20 cases)was given 0.1%Compound Tacrolimus Ointment.Results The total effective rates of 3 group were 72.22%,44.44%,75.00%,respectively,the group A and group C are obviously better than group B(P<0.05).The incidence rates of adverse reaction in the 3 groups were 5.56%,60.00%,25.00%,respectively,the group A and group C were obviously lower than group B(P<0.01),and the the group A were obviously lower than group C(P<0.05).Conclusion Compound Quercetin Ointment and 0.1%Compound Tacrolimus Ointment in treating leukoderma has similar effect,which is more effective than Compound Methoxsalen Ointment,it has less adverse reactions and worthy of clinical promotion.
Compound Quercetin Ointment;Methoxsalen Compound Ointment;Tacrolimus Ointment;leukoderma;clinical effects;safety
R969.4;R986
A
1006-4931(2017)10-0045-03
2016-09-22;
2017-01-21)
10.3969/j.issn.1006-4931.2017.10.012
山东省滨州市科技发展计划项目[2013ZC1801]。
胡丽敏(1988-),女,大学本科,药师,研究方向为医院制剂学,(电话)0543-3256752(电子信箱)byfywy@163.com。
魏传梅(1972-),女,硕士研究生,副主任药师,研究方向为医院制剂学与临床药学,(电话)0543-3256750(电子信箱)18606490062@163.com。

