Kozak序列对nNOS基因表达及神经细胞分化的影响
李巧彦,刘宗智,张婷,田云云,张倩,谢建新,王铁鹏*
(石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832000)
Kozak序列对nNOS基因表达及神经细胞分化的影响
李巧彦,刘宗智,张婷,田云云,张倩,谢建新,王铁鹏*
(石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832000)
为探讨Kozak调控序列对nNOS(neuronal nitric oxide synthase,神经型一氧化氮合酶)基因表达的影响,并验证其在神经细胞分化过程中的作用。构建了含有经典Kozak序列调控元件及野生型前导序列的人源nNOS表达载体;通过qPCR和western blot技术检测不同表达载体在SH-SY5Y细胞中的转录水平和翻译效率;利用SH-SY5Y神经细胞的诱导分化模型进一步验证不同的nNOS表达调控序列对于神经细胞分化的影响;通过测量和定量神经突起长度,结合qPCR法定量神经细胞分化关键标志物Tau和MAP2的表达来表征神经细胞分化程度。结果显示,经典Kozak调控元件(-3位A和G)和野生型前导序列(含-3位A)都能显著提高nNOS载体的表达效率,其中,野生型序列效率更高,但Kozak元件和野生型序列均不影响nNOS转录。在SH-SY5Y神经细胞分化模型中,Kozak元件也能促进分化进程,野生型序列的促分化作用最强。由此可知,通过对比不同调控序列,获得了以野生型序列引导的nNOS高效表达载体。Kozak元件对不同基因的调节效果差异较大,针对特定基因,有必要通过详细的对比实验确认最佳调控序列。
Kozak 序列;nNOS;神经细胞分化;Tau;MAP2
Kozak序列是由美国科学家Marilyn Kozak于1987年首先提出的,其基本内容是研究蛋白质翻译起始密码子ATG周边碱基序列的保守性及其对蛋白表达效率的影响[1]。在真核细胞中,mRNA分子上的Kozak序列可能影响其与核糖体小亚基的结合及翻译起始复合体的组装[2]。Kozak序列并没有绝对的规则,如果将起始密码子的AUG分别标记为+1、+2、+3位碱基,Marilyn发现其前方-3位处出现嘌呤碱(尤其是腺嘌呤A),其后方+4位为鸟嘌呤G的概率较高,且-3位嘌呤碱(A或G)和+4位G的出现可能带来较高的蛋白表达效率。基于上述理论,Kozak序列元件经常被用于构建真核基因载体,以获得高表达效率。
然而,进一步的研究发现,Kozak序列的变异性较大,一致性的Kozak序列在真核生物中出现的比例并不高,而且对于某些基因,加入Kozak元件后,其蛋白表达效率并没有野生型序列高[2]。上述发现对Kozak序列的有效性和传统的质粒构建经验提出了挑战。
在本研究中,我们通过构建含有Kozak序列关键碱基元件的表达载体,结合对比野生型nNOS基因前导序列,确定Kozak元件对nNOS基因表达效率的影响,以期获得nNOS基因的高表达载体,并应用于神经细胞分化模型中作进一步印证。
1 材料与方法
1.1 试剂和材料
SH-SY5Y细胞购自中国医学科学院细胞资源中心;DMEM培养基、qPCR试剂盒购自 Life Technologies公司;胎牛血清采用以色列BI(Biological Industries)产品;RA(all-trans-retinoic acid,全反式视黄酸)购自Sigma公司;质粒提取试剂盒购自天根生化科技有限公司;DNA回收试剂盒购自康维世纪生物科技有限公司;限制性内切酶、连接酶购自TaKaRa公司;DNA突变试剂盒购自全式金生物技术有限公司;nNOS抗体及二抗购自Abcam公司;逆转录试剂盒、Western发光试剂盒购自Thermo Scientific公司;PBS-nNOS cDNA、pcDNA3.0为实验室自有质粒和载体。PCR引物合成及DNA测序由上海生工生物工程有限公司完成;其他生化试剂采用国产分析纯。
1.2 方法
1.2.1 3T3-L1细胞培养、质粒转染及诱导分化
SH-SY5Y神经母细胞瘤采用完全培养基培养,其成分为高糖DMEM培养基培养,添加10%胎牛血清及双抗(100 mg/L青霉素和100 mg/L硫酸链霉素),细胞传代采用0.25%胰酶消化,以完全培养基终止消化。细胞转染采用Lonza公司的Nucleofector TM2b电转仪,电转程序为G-004。
1.2.2 nNOS克隆及突变体构建
PBS载体上的nNOS cDNA采用EcoR I和Xho I双酶切后凝胶回收,利用T4连接酶克隆到经过相同双酶切处理的pcDNA3.0载体上。Kozak突变体构建按照试剂盒步骤进行,关键的Kozak功能元件及其构建的突变引物如表1和表2所示。突变体PCR条件为94℃预变性5 min;PCR反应94℃ 30 s,55℃ 30 s,72℃ 5 min,重复25个循环。PCR产物经1%琼脂糖凝胶电泳回收后,加入DMT酶,37℃处理1 h。DMT酶消化产物转化DMT感受态细菌,利用氨苄青霉素培养板筛选阳性克隆,经酶切检验及测序后确认正确克隆。
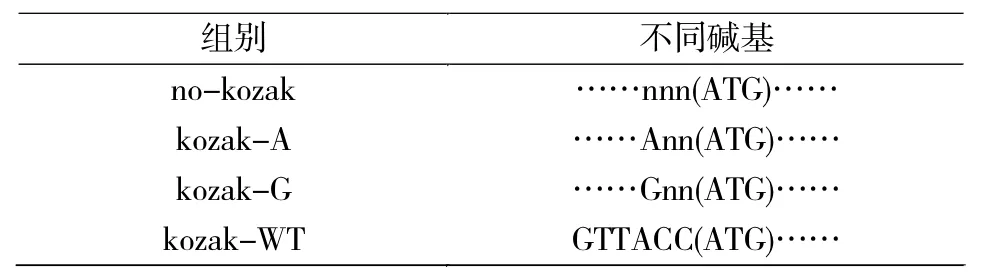
表1 Kozak功能元件Tab.1 Kozak elements
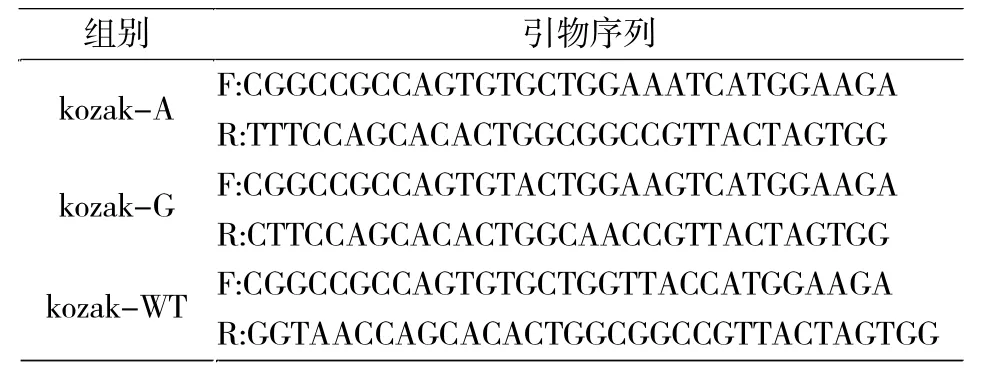
表2 Kozak元件突变引物Tab.2 Kozak element mutation primers
1.2.3 实时定量qPCR
SH-SY5Y细胞用PBS润洗3次,利用TrizolTM试剂抽提总RNA,按试剂盒程序进行逆转录,获得总cDNA。使用qPCR试剂盒,利用ABI 7500 Fast实时荧光定量PCR仪分析样本中目的基因mRNA含量,使用的引物信息如表3所示。
PCR反应体积为 20μL,成分为:cDNA 2 μL,上、下游引物(10 μmol/L)各 0.8 μL,Mixture(2×)10 μL,H2O 6.4 μL。扩增程序条件为:95 ℃预变性 5 min;PCR反应 95 ℃ 15 s,55 ℃ 15 s,72℃ 40 s,重复30个循环。扩增结果以GAPDH为内参[3],利用 2-△△Ct法做相对定量分析。

表3 实时荧光定量PCR引物Tab.3 Primer sequences of Real-time fluorescent quantitative PCR
1.2.4 Western Blot及定量
细胞总蛋白抽提采用RIPA裂解液,使用BCA法定量蛋白浓度,单泳道上样蛋白25 μg。SDS-聚丙烯酰胺凝胶电泳采用恒压法,浓缩胶电压80V,分离胶电压120 V。蛋白印迹采用湿转法将蛋白转移到硝酸纤维素(NC)膜上,恒压湿转条件为80 V,2 h。采用丽春红S染色,用含5%脱脂奶粉的TBST缓冲液室温封闭NC膜1 h,之后加入一抗4℃过夜。次日,TBST洗4次,每次10 min。室温孵育二抗1 h,TBST洗4次,每次10 min。采用ECL试剂盒进行化学发光,利用ProteinSimple公司的FluoChem HD-2成像仪采集图片并分析。组间实验结果以目的条带/内参条带的灰度比值形式做半定量分析。
1.2.5 神经细胞诱导分化及突起长度统计
SH-SY5Y细胞转染相应质粒(8 μg/组)后,以1×104/cm2的密度接种在33 mm直径培养皿中[4-5],48 h后,将细胞培养液换为含有2 μmol/L RA的完全培养基,继续培养72 h后,采用奥林巴斯IX71倒置显微镜拍照记录细胞可见光形态。神经细胞的突起长度采用ImageJ软件的NeuronJ插件进行分析,突起长度以μm为单位。
1.2.6 统计学分析
所有数据采用SPSS19.0软件进行统计分析,实验数据以平均值±标准差(X±S)形式表示,组间数据比较采用t检验,以P<0.05为显著性差异标准。
2 结果
2.1 Kozak元件表达载体构建
采用EcoR I/Xho I双酶切法从PBS-nNOS cDNA质粒上获得nNOS片段,通过T4 DNA连接酶连接,将nNOS的cDNA克隆到pcDNA3.0载体上(图1a),记做no Kozak-nNOS。为检验经典Kozak序列-3位嘌呤碱的作用,采用DNA突变试剂盒分别构建起始密码子AUG前-3位为A及G的表达载体,记作Kozak-A-nNOS和Kozak-G-nNOS。为对比野生型调控序列的作用,将AUG前-6至-1位的碱基突变为野生型序列GTTACC,记作Kozak-WT-nNOS。突变后的质粒,无法被EcoR I切割,借以鉴别定点突变是否成功。Kozak-A-nNOS载体的鉴定结果(图1b)。
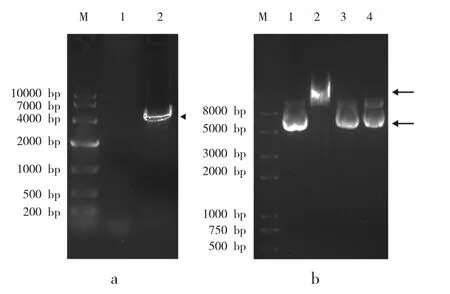
图1 Kozak元件表达载体构建及鉴定Fig.1 Kozak element vector construction and identification
2.2 Kozak序列对nNOS转录水平的影响
SH-SY5Y细胞分为6组,依次为非转染组、pcDNA3.0转染对照组、no Kozak-nNOS组、Kozak-G-nNOS组、Kozak-A-nNOS组和Kozak-WT-nNOS组。转染质粒后,继续培养48 h收集细胞,Trizol法提取总RNA,逆转录PCR法获得总cDNA,qPCR法检测nNOS和GAPDH mRNA含量,以nNOS/GAPDH表征各组细胞中nNOS mRNA的相对水平。结果(图2)显示,非转染组的nNOS转录水平较低,转染nNOS各组的mRNA含量都有显著提高,但是各kozak元件组的nNOS转录水平并未出现显著差异。
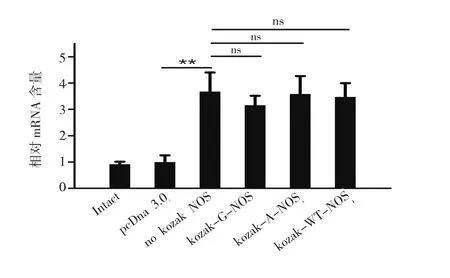
图2 Kozak序列对nNOS转录活性的的影响Fig.2 The impact of Kozak sequences on nNOS transcriptional activity
2.3 Kozak序列对nNOS翻译水平的影响
SH-SY5Y细胞仍分为6组,细胞转染48 h后RIPA法裂解细胞,抽提蛋白通过western blot法检测nNOS蛋白含量。
实验结果显示,no-Kozak-nNOS组的蛋白含量相对非nNOS转染组有显著升高(图3)。含有Kozak元件的转染组中,nNOS表达水平由低到高依次为Kozak-G-nNOS、Kozak-A-nNOS、Kozak-WT-nNOS 转染组,三组间的蛋白含量有显著差异(图3)。另外,Kozak元件各组nNOS蛋白含量相比no-kozak-nNOS组均有显著性升高。以上数据表明,转染无Kozak序列的nNOS质粒能在一定程度上提高蛋白的表达量,但Kozak元件对蛋白表达的提升作用更加明显。Kozak元件中,-3位为A时的表达效率高于G,而野生型的GTTACC(-6至-1位)序列对蛋白表达的贡献更加明显。

图3 Kozak序列对nNOS翻译活性的影响Fig.3 The impact of Kozak sequences on nNOS translational activity
2.4 Kozak序列对神经突起生长的影响
神经型一氧化氮合酶(nNOS)是神经细胞分化的必要条件,其产物一氧化氮能够促进神经细胞系和神经干细胞向神经元的分化[6-8]。我们采用SH-SY5Y细胞的诱导分化模型,进一步检验不同的Kozak元件诱导的nNOS表达对于SH-SY5Y细胞分化的影响。6组细胞分别转染不同质粒,铺板后培养48 h,而后添加RA诱导分化72 h,拍照并统计各组神经突起长度。
实验结果显示,no-Kozak-nNOS组的神经突起显著长于非nNOS转染组;Kozak-G-nNOS组的突起长度显著长于no-Kozak-nNOS组;但是kozak-G-nNOS与kozak-A-nNOS的长度未检测到显著差异;Kozak-WT-nNOS组的神经突起长度在6组中最长(图4)。
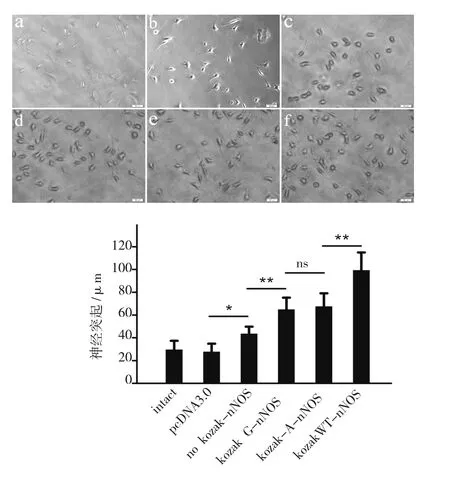
图4 Kozak序列对神经突起生长的影响Fig.4 The impact of Kozak sequences on neurite outgrowth
2.5 Kozak序列对神经细胞分化marker的影响
转染不同质粒的SH-SY5Y细胞继续培养48 h,之后RA诱导分化24 h收样。采用Trizol法提取总RNA,经过逆转录PCR获得细胞总 cDNA。通过qPCR法,结合特异性引物分别检测神经细胞分化标志物 Tau[9-11]和 MAP2[12,13]的 mRNA含量。
实验结果表明,与非nNOS转染组相比,no-Kozak-nNOS组能显著提高Tau的 mRNA含量;Kozak元件各组均能显著升高Tau和MAP2的转录水平,其中Kozak-WT-nNOS的提升作用最显著,而Kozak-A-nNOS和Kozak-G-nNOS组的提升效果差异不显著(图 5)。
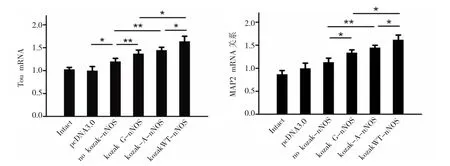
图5 Kozak序列对神经分化marker的影响Fig.5 The impact of Kozak sequences on neuronal differentiation markers
3 讨论
信使RNA分子上的Kozak序列参与其同核糖体小亚基的结合,能够辅助启动相关基因的表达[1,2],其中,起始密码子AUG附近-3位的嘌呤碱基和+4位的G被认为是最关键的碱基序列[14-16]。然而,有研究报道,经典的Kozak虽然有效,但其序列变异性较大,在真核生物基因中出现频率并不高,而且野生型非Kozak形式的基因前导序列往往具有比经典Kozak序列更高的促翻译效率[2],这些发现给传统Kozak序列的作用带来了不确定性。按照研究需要,我们构建nNOS基因的过表达载体,为确定经典的Kozak序列元件及野生型前导序列对nNOS表达的影响,我们分别构建了-3位为A、G碱基以及野生型前导序列GTTACC(-6至-1位)所引导的nNOS过表达载体。经典的关键Kozak序列元件还包括+4位的碱基G,但nNOS基因的+4位本身就是该碱基,故不予考虑。我们的实验结果表明,Kozak序列元件和野生型前导序列并不影响nNOS基因的转录(图2),但在翻译环节上有显著的调节作用(图3)。与不含Kozak序列的质粒相比,-3位的G能显著提高nNOS的蛋白表达量,-3位为A时,nNOS的蛋白含量更多,而含有野生型前导序列的组别具有最高的蛋白表达水平。由于野生型序列中-3位碱基本身就是A,说明野生序列中的其他碱基也对促进nNOS蛋白翻译做出重要贡献,推测可能与加强核糖体的结合作用有关。
神经型一氧化氮合酶(nNOS)是神经细胞分化的必要因素[6-8],其在神经细胞分化中的重要性在神经干细胞和神经细胞系的分化模型中都得到证实。为了进一步印证Kozak调控序列元件和野生型前导序列对nNOS表达的影响,我们利用神经母细胞瘤SH-SY5Y细胞系的诱导分化模型确认不同调控序列对于神经细胞分化的影响,并以分化细胞的突起长度及分化标志物Tau和MAP2[9-13]的表达水平作为描述其分化水平的依据。在神经突起生长方面,过表达无引导序列的nNOS就可以显著增加突起长度,-3位G和A碱基的引入,进一步增加神经突的生长,野生型前导序列组的神经突最长(图4)。在神经分化marker方面,-3位的G和A也能显著提高Tau和MAP2的含量(虽然G与A组的差别不显著),野生型序列组的分化marker含量最高。Kozak调控序列在分化模型中的作用与生化检测结果基本一致,即经典的Kozak调控序列能够增加nNOS蛋白的表达,但野生型引导序列(含-3位Kozak碱基A)的促进效率更高,体现了自然选择的高效性[2]。据此,我们选择野生型的GTTACC作为nNOS表达的前导序列,用于后续的研究工作。
Kozak序列对于不同基因的引导作用差异较大,有的基因并不具有经典的Kozak调节序列,甚至非Kozak型翻译前导序列的效率远远高于经典的Kozak模式[1-2],因此,为不同的基因选择翻译前导序列必须做详细的对比实验,以达到更高的表达效率。本研究以此种思路筛选和优化了促进nNOS基因高表达的翻译引导序列,并在神经细胞分化模型中得到验证。该种方法可以推广到人体及动植物基因工程研究各领域,以期得到更显著的表达效率和收益。
[1] Kozak M.An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs[J].Nucleic Acids Res,1987,15(20):8125-8148.
[2] Grzegorski S J,Chiari E F,Robbins A,et al.Natural variability of Kozak sequences correlates with function in a zebrafish model[J].PLoS One 2014,9(9):108475.
[3] Soppa U,Schumacher J,Florencio Ortiz V,et al.The Downsyndrome-related protein kinase DYRK1A phosphorylates p27(Kip1)and Cyclin D1 and induces cell cycle exit and neuronal differentiation[J].Cell Cycle,2014,13(13):2084-2100.
[4] Encinas M,Iglesias M,Liu Y,et al.Sequential treatment of SH-SY5Y cells with retinoic acid and brain-derived neurotrophic factor gives rise to fully differentiated,neurotrophic factor-dependent,human neuron-like cells[J].J Neurochem,2000,75(3):991-1003.
[5] Fujibayashi T,Kurauchi Y,Hisatsune A,et al.Mitogenactivated protein kinases regulate expression of neuronal nitric oxide synthase and neurite outgrowth via non-classical retinoic acid receptor signaling in human neuroblastoma SH-SY5Y cells[J].J Pharmacol Sci 2015,129(2):119-126.
[6] Peunova N,Enikolopov G.Nitric oxide triggers a switch to growth arrest during differentiation of neuronal cells[J].Nature,1995,375(6526):68-73.
[7] Luo C X,Jin X,Cao C C,et al.Bidirectional regulation of neurogenesis by neuronal nitric oxide synthase derived from neurons and neural stem cells[J].Stem Cells 2010,28(11):2041-2052.
[8] 萨喆燕,郭试瑜,单立冬,等.一氧化氮促进体外培养大鼠脑室下区神经干细胞的分化 [J].中国应用生理学杂志,2010,26(3):359-364.Sa Z Y,Guo S Y,Shan L D,et al.Nitric oxide promotes the differentiation of neural stem cells in vitro derived from the subventricular zone of neonatal rats[J].Chin J Appl Physiol,2010,26(3):359-364.
[9] Yan Y,Zhao J,Cao C,et al.Tetramethylpyrazine promotes SH-SY5Y cell differentiation into neurons through epigeneticregulation ofTopoisomeraseIIbeta[J].Neuroscience 2014(278):179-193.
[10]Graser S,Mentrup B,Schneider D,et al.Overexpression of tissue-nonspecific alkaline phosphatase increases the expression of neurogenic differentiation markers in the human SH-SY5Y neuroblastoma cell line[J].Bone,2015(79):150-161.
[11]Agholme L,Lindstrom T,Kagedal K,et al.An in vitro model for neuroscience:differentiation of SH-SY5Y cells into cells with morphological and biochemical characteristics of mature neurons[J].J Alzheimers Dis,2010,20(4):1069-1082.
[12]Xue T,Wei L,Zha D J,et al.Exposure to acoustic stimuli promotes the development and differentiation of neural stem cells from the cochlear nuclei through the clusterin pathway[J].Int J Mol Med,2015,35(3):637-644.
[13]Zogovic N,Tovilovic-Kovacevic G,Misirkic-Marjanovic M,et al.Coordinated activation of AMP-activated protein kinase,extracellular signal-regulated kinase,and autophagy regulates phorbol myristate acetate-induced differentiation of SH-SY5Y neuroblastoma cells[J].J Neurochem,2015,133(2):223-232.
[14]Xu H,Wang P,You J,et al.Screening of Kozak-motiflocated SNPs and analysis of their association with human diseases[J].Biochem Biophys Res Commun,2010,392:89-94.
[15]Kozak M.An analysis of vertebrate mRNA sequences:intimations of translational control[J].J Cell Biol,1991,115(4):887-903.
[16]Kozak M.Recognition ofAUG and alternative initiator codons is augmented by G in position+4 but is not generally affected by the nucleotides in positions+5 and+6[J].Embo J,1997,16(9):2482-2492.
The effect of Kozak sequence on the expression of nNOS and neuronal cell differentiation
Li Qiaoyan,Liu Zongzhi,Zhang Ting,Tian Yunyun,Zhang Qian,Xie Jianxin,Wang Tiepeng*
(The Key Laboratory of Xinjiang Endemic and Ethnic Diseases/Department of Biochemistry/School of Medicine,Shihezi University 832000,Shihezi,Xinjiang 832002,China)
To investigate the regulatory role of canonical Kozak sequence in nNOS expression,and to validate this role in neuronal cell differentiation process.The nNOS expression vectors containing canonical Kozak sequence elements or wild type leader sequence were constructed and the transcriptional and translational efficiency of these vectors in SH-SY5Y cell line was identified by western blot and qPCR methods.The effect of different nNOS leader sequences on neuronal differentiation was further tested in drug induced SH-SY5Y differentiation model.The differentiation degree of neuronal cell was described by both the neurite length quantification and the content of key differentiation markers,Tau and MAP2,through qPCR.Though the canonical Kozak sequence elements(A or G at-3 residue)and the wild type leader sequence(containing A at-3 residue)didn't affect the nNOS transcriptional level,both the two kinds of sequences could significantly increase the expression efficiency of nNOS,with a higher efficiency by the wild type sequence.In the SH-SY5Y differentiation models,Kozak elements could also promote the differentiation process,and a stronger promotional effect was achieved by the wild type sequence.By comparing the effects of different regulatory sequences,we final obtained a high efficiency expression vector containing the wild type leader sequence.Kozak elements may have distinct regulatory roles for some specific genes,so it is necessary to optimize the regulatory sequence through detailed comparison study.
Kozak sequence;nNOS;neuronal cell differentiation;Tau;MAP2
Q786
A
10.13880/j.cnki.65-1174/n.2017.02.005
1007-7383(2017)02-0157-06
2016-12-20
国家自然科学基金项目(81460202),新疆兵团重点领域科技攻关项目(2014BA041),生物大分子国家重点实验室开放课题(2013kf07)
李巧彦(1989-),女,硕士研究生,专业方向为生物化学与分子生物学。
*通信作者:王铁鹏(1979-),男,副教授,从事医学分子生物学研究,e-mail:wangtiepeng2002@163.com。

