傣药九翅豆蔻不同溶剂提取物的化学成分分析及其抗氧化、抗炎和降血糖活性研究
卢传礼 董丽华.中国科学院西双版纳热带植物园园林园艺部,云南 勐腊 666303;.中国科学院大学研究生部,北京 00049
傣药九翅豆蔻不同溶剂提取物的化学成分分析及其抗氧化、抗炎和降血糖活性研究
卢传礼1董丽华2
1.中国科学院西双版纳热带植物园园林园艺部,云南 勐腊 666303;2.中国科学院大学研究生部,北京 100049
目的:研究九翅豆蔻根茎不同溶剂提取物的化学成分。方法:采用索氏提取法制备了其石油醚(PE)、三氯甲烷(CH)、甲醇(ME)和水(AQ)等四种不同极性溶剂提取物,利用显色法分析了各提取物中总黄酮、总多酚和总萜类的含量。并通过1,1-二苯基-2-三硝基苯肼(DPPH)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺基)二铵盐(ABTS)自由基清除法,α-葡萄糖苷酶活性抑制法和脂多糖(LPS)诱导RAW264.7巨噬细胞模型评价了各提取物的体外抗氧化、降血糖和抗炎活性。结果:四种提取物均对DPPH和ABTS显示出不同程度的清除活力,其中ME清除自由基的能力最强;PE和ME能够显著抑制α-葡萄糖苷酶的活性(IC50 值分别为12.87和16.70μg/mL),且作用强度与阳性对照阿卡波糖相当(P>0.05);PE和CH在12.5~25μg/mL以及ME在100μg/mL浓度水平,均能明显地降低脂多糖诱导的RAW 264.7细胞释放一氧化氮的水平,且对细胞的正常增殖无明显影响;而AQ在本研究所测试模型中均不表现出明显的活性。此外,CH中总黄酮的含量最高,PE中萜类成分的含量最高,ME中多酚的含量最高,AQ中三类成分的含量都是最低的。结论:九翅豆蔻的药效物质应该属于脂溶性成分而不是水溶性成分,对其临床疗效的有效成分和作用机制等方面科学内涵还有待进一步的研究。
九翅豆蔻;抗炎;清除自由基;α-葡萄糖苷酶;成分分析
九翅豆蔻(AmomummaximumRoxb.)属于姜科豆蔻属,广泛分布于我国云南南部和东南亚热带地区[1]。在傣医药中,九翅豆蔻的果实或根茎入药(傣语称作贺姑、郭姑等),入土、风塔,主治“短赶短接”(腹部胀痛),“沙呃、短昏(呃逆、消化不良)”,“拢梅兰申(肢体关节酸痛、屈伸不利)”[2]。在印度、越南等东南亚热带地区和国家,九翅豆蔻的花、果实和嫩杆被用作蔬菜食用,果实和根茎也被民间作为传统药物用来治疗胃肠道疾患[3-5]。
然而目前对九翅豆蔻的生理活性、有效成分、作用机制及植物资源状况等尚缺乏深入的研究与调查。有研究报道表明,九翅豆蔻根茎中含有半日花烷型二萜类成分[3,6],茎叶中挥发油的主要成分为和α-和β-pinene[5,7]。九翅豆蔻粗提取物能够降低绦虫(Raillietinaechinobothrida)的运动能力和存活率,降低蠕虫体表磷酸酶、和腺苷三磷酸酶等关键酶的活性,具有潜在的驱虫药物开发价值[4]。另外,从九翅豆蔻根茎中得到的二萜类成分,Amomax C能够明显抑制MG-63细胞的增殖(IC50=3.3±0.8μg/mL),而Amomaxin B 能够有效抑制LPS诱导的RAW264.7巨噬细胞释放一氧化氮的水平(IC50=31.33 μM)[3,6]。
本研究对九翅豆蔻根茎不同极性溶剂提取物进行了体外的抗氧化、抗炎和降血糖活性评价,并对各提取物中的总黄酮、多酚和萜类成分含量进行了分析,以期评价其临床运用的科学性,为进一步的研究提供基础。
1 材料
脂多糖(LPS)、α-葡萄糖苷酶(来源于Bacillus stearothermophilus)、地塞米松、1,1-diphenyl-2-picrylhydrazyl (DPPH)、2,2′-azino-bis(3-ethylbenzthiazoline-6-sulphonic acid (ABTS)、(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT)和4-nitrophenyl-α-D-glucopyranoside (PNPG)等均购买自Sigma公司。 DMEM细胞培养基、胎牛血清 (FBS)、磷酸盐缓冲液 (PBS)、Gluta-Max (100x)和青-链霉素双抗 (100×) 购买自Thermo Scientific公司。胰酶购买自Millipore (MA, USA),Griess 试剂盒 (G2930)购买自Promega (Madison, WI, USA)。维生素C和芦丁购买自成都曼斯特生物科技有限公司。
九翅豆蔻根茎采集自云南省勐腊县勐仑镇植物园野生姜园,样品经黄建平(中国科学院西双版纳热带植物园)鉴定。
2 方法
2.1 九翅豆蔻不同溶剂提取物的制备 取九翅豆蔻根茎洗净切片,置阴凉处晾干,粉碎后过100目筛。取药材粉末50 g,滤纸包裹好后放置于索氏提取器中,依次用石油醚、三氯甲烷和甲醇提取,减压回收溶剂后分别得到石油醚提取物(PE, 0.91g)、三氯甲烷提取物(CH, 0.82g)和甲醇提取物(ME, 1.55g)。药渣取出后在通风处,充分挥去有机溶剂后,转移至圆底烧瓶中,加入500mL去离子水,加热回流提取1.5h。趁热过滤,滤液经冷冻干燥得到水提取物(AQ, 0.31g)。
2.2 总黄酮、总多酚、总萜类成分的含量测定 样品中总黄酮的含量测定参考文献报道方法[8],并作适当调整。即100μL样品溶液与10μL 5%的NaNO3溶液混合后室温下放置6min后,加入10μL10%的Al(NO3)3溶液,充分混合后室温下放置6min。最后加入80μL4%的NaOH溶液并在室温下放置15min。使用酶标仪(VarioSkan Flash, Thermo Scientifi)读取反应体系在510nm处的吸光度值(OD),每个样品设置三次平行试验。用芦丁标准品按照上述步骤建立反应体系吸光度值与芦丁浓度间的标准曲线,并由此标准曲线计算出个样品中总黄酮的相对含量(单位为mg芦丁当量/g药材))。
样品中总多酚含量测定采用Folin-Ciocalteu法[9],并作适当调整。即100μL 样品溶液与 40μL Folin-Ciocalteu 试剂 (0.2M)混合后室温下放置5min,然后加入60μL Na2CO3溶液(15%),并在30℃水浴上反应60min。用酶标仪记录各反应体系在755nm处的吸光度值。使用没食子酸标准品按照上述步骤建立反应体系吸光度值与没食子酸浓度之间的标准曲线,并由此标准曲线计算出各样品中总多酚的相对含量(单位为mg没食子酸当量/g药材)。所有实验设置三组平行。
总萜类成分含量的测定参照文献报道的方法进行[10],并作适当调整。即1.0mL样品溶液,1.0mL冰醋酸 (含5%香兰素)和1.0mL硫酸依次加入5 mL容量瓶中,充分混合后置于65℃水浴中反应20min。反应结束后用流水冷却至室温,并用冰醋酸补足至5mL。使用分光光度计测反应体系在545nm处的吸光度值。用千金子二萜醇(lathyrol)按照上述方法建立反应体系吸光度值与千金子二萜醇浓度之间的标准曲线,并由此标准曲线计算个样品中总萜类成分的含量(单位为mg千金子二萜醇当量/g药材)。所有实验设置三组平行。
2.3 自由基清除试验 样品的抗氧化活性通过其清除DPPH和ABTS自由基的能力进行评价。DPPH自由基清除能力测试参照文献描述的方法进行[11]。即100μL不同浓度的样品溶液与等体积的DPPH溶液(0.10mg/mL溶解于甲醇)混合后室温下暗处放置30min。用酶标仪记录反应体系在517nm处的吸光度值。等体积的甲醇代替样品溶液作为空白组,维生素C作为阳性对照,每组实验设置三组平行。DPPH 自由基的清除率按照下式计算。
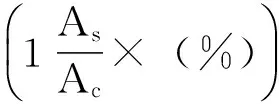
(1)
As为样品组吸光度值,Ac为空白组吸光度值。
ABTS自由基清除能力测试按照文献报道的方法进行[12]。7.4mM 的ABTS溶液与2.6mM 的过硫酸钾溶液充分混合后置于暗处放置12h以上,制成ABTS自由基储备液。临用前,储备液用乙醇稀释至在734nm处的吸光度值为0.7± 0.02成为工作液用于实验。100μL不同浓度的样品溶液与等体积的ABTS工作液混合后室温下暗处放置10min。用酶标仪记录反应体系在734nm处的吸光度值。等体积的乙醇代替样品溶液作为空白组,维生素C作为阳性对照,每组实验设置三组平行。ABTS自由基的清除率按照下式计算。

(2)
As为样品组吸光度值,Ac为空白组吸光度值。
2.4 体外抑制α-葡萄糖苷酶活性评价 九翅豆蔻根茎四种不同溶剂提取物的降血糖活性通过其抑制α-葡萄糖苷酶的作用效果进行评价,试验参考文献报道的方法进行[13],并作适当的调整。30 μL a-葡萄糖苷酶溶液(0.5U/mL,溶解于10mM pH 6.8磷酸盐缓冲液) 和 10μL不同浓度的样品溶液(6.25-100μg/mL)混合后,室温下孵育20 min。加入30μL PNPG溶液(5.0mM, 溶解于10mM pH 6.8磷酸盐缓冲液中),37℃水浴中反应40min,加入100μL Na2CO3溶液(1M)终止反应。酶标仪记录各反应体系在405nm处的吸光度值。等体积的蒸馏水代替样品溶液作为空白组,等体积的磷酸盐缓冲液代替酶溶液作为样品背景组,阿卡波糖作为阳性对照,所有实验设置三次平行。样品对α-葡萄糖苷酶活性的抑制率按照下式进行计算。
(3)
A1为样品组吸光度值,A2为样品背景组吸光度值,A3为空白组吸光度值。
2.5 抗炎活性测试 按照文献报道的方法进行[14]。RAW 246.7 细胞培养于含10% 胎牛血清和1%青霉素-链霉素双抗的DMEM 培养液中,孵育在37℃含5% CO2的生化培养箱中。取对数生长期的细胞,调整细胞浓度为5×106 /mL,接种于96孔培养板中(100μL /孔),37 ℃孵育过夜。细胞用LPS进行刺激24h,同时加入不同浓度的样品进行干预。使用Griess反应测定实验细胞培养液中的亚硝酸根浓度以此反映NO的释放水平,即50 μl 细胞培养液与等体积Griess 试剂 A (1% sulfanilamide in 5% 磷酸)混合后室温下置于暗处反应10 min,再加入50μL的Griess试剂 B[0.1%N-(1-Naphthyl) ethylenediamine dihydrochloride in water] 室温下继续反应10min,酶标仪记录反应体系在535nm处的吸光度值。由亚硝酸钠按照上述步骤建立标准曲线,并由此标准曲线计算出各细胞培养液中的亚硝酸根浓度。同时利用MTT法测各种的细胞存活率。
2.6 统计学方法 采用SPSS17.0进行统计分析,结果以(x行统表示,各组间的数据满足正态性和方差齐性检验的条件下进行方差分析,两两组间比较采用Dunnet t检验。P<0.05表示差异具有统计学意义。
3 结果与讨论
3.1 九翅豆蔻根茎四种提取物中总黄酮、总多酚和总萜类成分的含量 在四种不同溶剂提取物中,CH的总黄酮含量最高,PE和ME中分别是萜类和总多酚的含量最高。但是AQ中三种成分的含量都是最低。详见表1。

表1 九翅豆蔻根茎四种不同溶剂提取物中总黄酮、多酚和萜类的含量
注::表示同列数据相比较a,b,cP<0.05[1]。
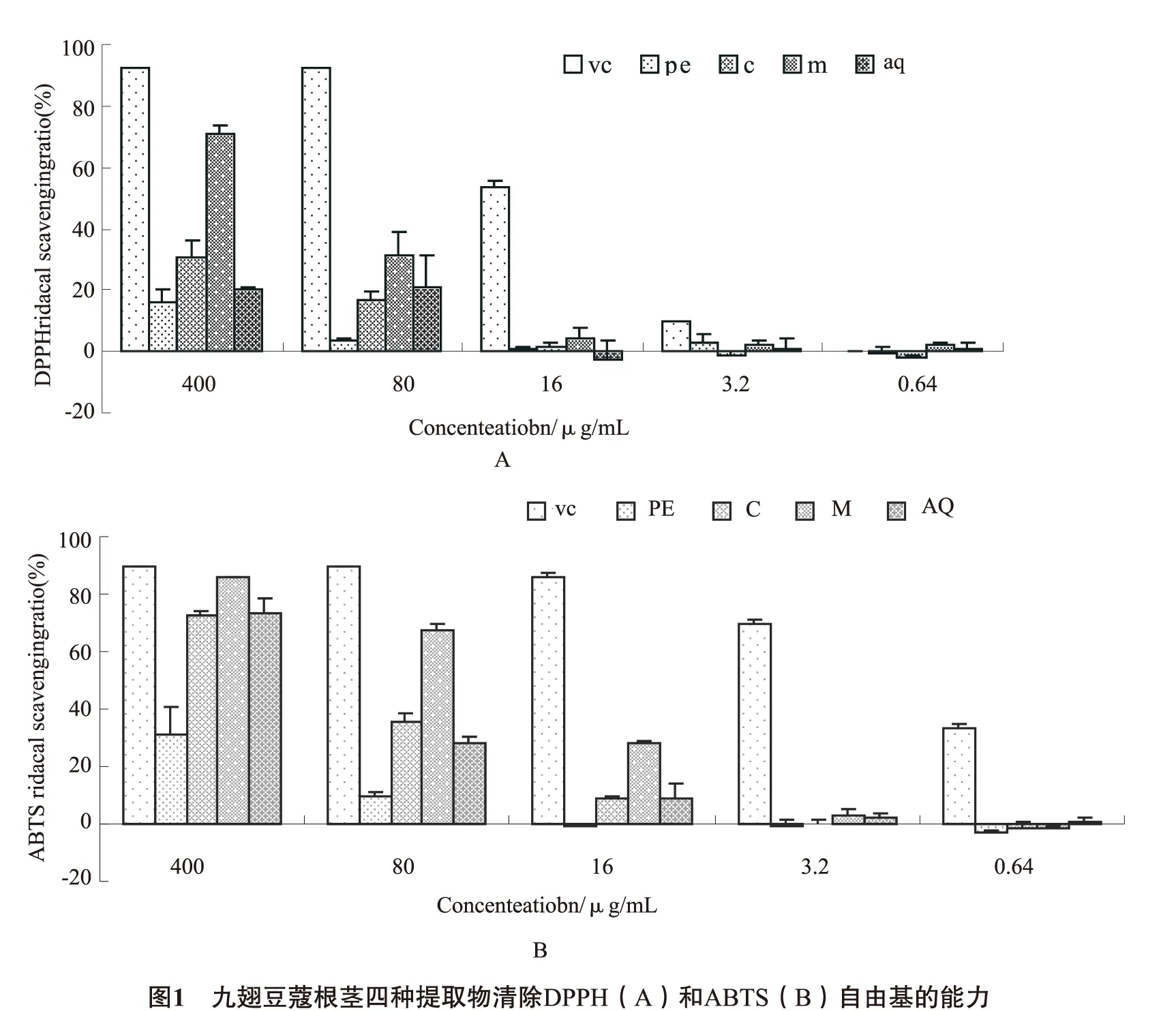
3.2 九翅豆蔻根茎四种不同提取物的抗氧化活性 九翅豆蔻根茎四种不同溶剂提取物对DPPH和ABTS两种自由基都显示出不同程度清除效果,且对自由基的清除效果具有浓度依赖性(图1)。其中,ME清除自由基的能力最强,而PE的能力最弱。但是所有样品对自由基的清除效果都低于阳性对照维生素C。
此外,样品中总多酚的浓度与其清除DPPH自由基的能力具有显著的相关性(R2=0.98,P<0.05),与ABTS自由基的清除能力也存在一定的相关性(R2=0.91,P=0.09)。而样品中总黄酮或萜类的含量与清除两种自由基的效果都没有明显的相关性。实验结果与文献中报道现象一致,即抗氧化活性与多酚的含量存在明显的关联,而与黄酮含量之间的关联较弱[15]。
3.3 降血糖活性 α-葡萄糖苷酶淀粉和多糖重要的消化酶之一,抑制该酶的活性能够有效延缓多糖消化的效率,进而降低小肠对葡萄糖的吸收速率,这样可以抑制餐后血糖水平大幅波动,对于控制糖尿病具有重要意义[16-17]。
研究结果表明,PE和ME能够显著地抑制α-葡萄糖苷酶的活性,抑制强度与阳性对照阿卡波糖的相当(P>0.05);CH显示出中等程度的α-葡萄糖苷酶抑制作用,而AQ无明显的抑制活性(IC50值>100mg/mL)(表2)。此实验结果与对同属植物草果(Amomum tsao-ko Crevost et Lemaire)的研究结果相似[18-19],即有机溶剂提取物具有明显的α-葡萄糖苷酶抑制效果,而水溶性成分无α-葡萄糖苷酶抑制活性。

表2 九翅豆蔻根茎四种不同提取物对α-葡萄糖苷酶活性的抑制作用 (IC50, μg/mL)
注:与阳性对照组比较,**P<0.01。
3.4 抗炎活性 利用LPS-诱导的RAW264.7细胞模型评价了九翅豆蔻四种不同溶剂提取物的抗炎活性。结果表明PE (25~100μg/mL)和CH (12.5~100μg/mL)均能够明显地抑制NO的过度释放,且抑制效果具有浓度依赖性。ME在最高测试浓度时也能够降低NO的释放水平,但是AQ对NO的释放水平无明显的效果。详见表3。同时检测四种提取物对RAW264.7细胞增殖的影响,ME和AQ对细胞正常增殖没有明显的影响,但是PE和 CH在 50和100μg/mL浓度时会显著抑制细胞的生长。综合考虑,PE,CH和ME具有潜在的抗炎活性,但是AQ无明显的抗炎活性。
Amomaxins B是YinH等[6]从九翅豆蔻根茎乙醇提取物的二氯甲烷萃取部位分离得的一个二萜类成分,能够显著抑制LPS诱导的RAW264.7细胞释放NO水平(IC50值为31.33μM),且在浓度高达100 μM时对细胞的正常增殖仍无明显的影响,但是同时分离得到的另外两个该类成分无次活性。

表3 九翅豆蔻根茎四种不同提取物对LPS诱导RAW264.7细胞NO释放量的抑制作用
注:与对照组比较,###P<0.001;与LPS组比较,***、**和*表示P值分别<0.001、0.01和0.05。
4 结论
研究表明ME提取物具有显著的α-葡萄糖苷酶抑制活性、抗氧化活性和较弱的抗炎活性,PE和CH提取物显示出明显的α-葡萄糖苷酶抑制活性和抗炎活性。但是AQ提取物在本研究所使用的三种活性测试中均没有显示出明显的作用效果。而且总黄酮、多酚和萜类在有机溶剂中的含量都明显高于水溶性部位,表明九翅豆蔻的有效成分应该属于脂溶性化合物,而不是水溶性化合物。因此在今后对九翅豆蔻的进一步研究中应该把更多注意力集中在有机溶剂部位。
[1]中国科学院昆明植物研究所. 云南植物志(第八卷) [M]. 北京: 科学出版社, 1997: 631.
[2]林燕芳, 衣专, 赵应红. 中国傣医药彩色图谱[M]. 昆明:云南民族出版社,2003: 9-11.
[3]Luo JG, Yin H, Fan BY, et al. Labdane dieterpenoids from the roots of Amomum maximum and their cytotoxic evaluation [J]. Helvetica Chimica Acta, 2013(97):1140-1145.
[4]Chetia M, Giri BR, Swargiary A, et al. Amomum maximum Roxb (Zingiberaceae), a medicinal plant of Tripura, India: a natural anthelmintic [J].Journal of Advanced Microscopy Research, 2014(9):148-153.
[5]Huong LT, Dai DN, Thang TD, et al. Volatile constituents of Amomum maximum Roxb and Amomum microcarpum C.F. Liang & D. Fang: two Zingiberaceae grown in Vietnam [J]. Natural Product Research, 2015(29):1469-1472.
[6]Yin H, Luo JG, Shan SM, et al. Amomaxins A and B, two unprecedented rearranged labdane norditerpenoids with a nine-membered ring from Amomum maximum [J]. Organic Letters, 2013(15):1572-1575.
[7]韩智强, 张虹娟, 郭生云, 等. GC-MS法分析姜科豆蔻属两种植物的挥发性成分[J]. 食品研究与开发, 2013, 34(20): 79.
[8]张华潭, 郑文丽, 魏艳婷, 等. 大孔树脂纯化黄蜀葵花总黄酮的工艺优选[J]. 中国实验方剂学杂志, 2015, 21(1): 28-31.
[9]宗颖, 王志颖, 孙佳明, 等. 锦灯笼果实提取工艺优选及抗氧化活性考察[J]. 中国实验方剂学杂志, 2014, 20(7): 15-18.
[10]Hu T. Guo, YY, Zhou QF, et al. Optimization of ultrasonic-assisted extraction of total saponins from Eclipta prostrasta L. using response surface methodology [J]. Journal of Food Science, 2012(77):975-982.
[11]宁德生, 黄思思, 谢运昌, 等. 油梨果渣中多酚类成分及其清除自由基能力 [J]. 中国实验方剂学杂志, 2016, 22(15): 88-92.
[12]Wang YF, Wang XY. Binding, stability, and antioxidant activity of quercetin with soy protein isolate particles [J]. Food Chemistry, 2015(188):24-29.
[13]Zhang YY, Zhang HK, Wang F, et al. The ethanol extract of Eucommia ulmoides Oliv. leaves inhibits disaccharidase and glucose transport in Caco-2 cells [J]. Journal of Ethnopharmacology, 2015(163):99-105.
[14]代艳文, 杨莉, 万静枝, 等. 竹节参醇提取物对LPS诱导RAW264.7细胞炎症的保护作用 [J]. 中国实验方剂学杂志, 2014, 20(2): 163-166.
[15]Kamiloglu S, Capanoglu E, Yilmaz O, et al. Investigating the antioxidant capacity of Turkish herbs and spices [J]. Quality Assurance and Safety of Crops & Foods, 2014(6):151-158.
[16]Shim YJ, Do HK, Ah SY, et al. Inhibitory effect of aqueous extract from the gall of Rhus chinensis on alpha-glucosidase activity and postprandial blood glucose [J]. Journal of Ethnopharmacology, 2003(85):283-287.
[17]Zhang L, Hogan S, Li JR, et al. Grape skin extract inhibits mammalian intestinal alpha-glucosidase activity and suppresses postprandial glycemic response in streptozocin-treated mice [J]. Food Chemistry, 2011(126): 466-471.
[18]Yu LQ, Shirai N, Suzuki H, et al. Effect of lipid extracted from Tsao-ko (Amomum tsao-ko Crevost et Lemaire) on digestive enzyme activity, antioxidant activity, plasma and liver lipids, and blood glucose levels of mice [J]. Journal of Nutritional Science and Vitaminology, 2008(54):378-383.
[19]Yu LQ, Shirai N, Suzuki H, et al. The effect of methanol extracts of Tsao-ko (Amomum tsao-ko Crevost et Lemaire) on digestive enzyme and antioxidant activity in vitro, and plasma lipids and glucose and liver lipids in mice [J]. Journal of Nutritional Science and Vitaminology, 2010(56):171-176.
Studies on Chemical Composition as well as Antioxidant, Anti-inflammatory and Hypoglycemic Activities of Different Solvent Extracts from the Rhizome ofAmomummaximumRoxb., a Dai Traditional Medicine Material
LU Chuanli1DONG Lihua2
1.Horticulture & Gardening Department, Xishuangbanna Tropical Botanical Garden,Chinese Academy of Sciences, Mengla 666303, China;2.University of Chinese Academy of Sciences, Beijing 100049, China
Objective To evaluate the chemical profile and in vitro antioxidant, anti-inflammatory and hypoglycemic activities of different extracts of Amomum maximum rhizome.Methods Four different solvent extracts of A. maximum rhizome were prepared using a Soxthlet extractor, and their total flavonoids, phenolics and diterpenoids contents were analyzed. In additional, radicals scavenging (DPPH and ABTS), α-glucosidase inhibitory, lipypolysaccharide-induced RAW264.7 cells assays were carried out to evaluate their antioxidant, anti-inflammatory, hypoglycemic activities. Results indicated that all four extracts possessed a scavenging capacity for both DPPH and ABTS radicals in different degree, and ME was in the highest degree. PE (IC50=12.87μg/mL) and ME (IC50=16.70μg/mL) showed the an equally α-glucosidase inhibitory activity as that of positive control, acarbose (P>0.05). PE and CH (at concentration 12.5~25μg/mL),as well as ME (at 100μg/mL),displayed a significant inhibitory effect on NO production in LPS-induced RAW(264.7) cells, but no obvious effect on cell proliferation. However, AQ exhibited no significant activity in any assay. In addition, CH, PE, and ME had respectively the highest total flavonoids, diterpenoidsand phenol contents, but AQ had the lowest contents. Conclusion Our findings show that the organic solvent extracts, but not water soluble fraction, should be the active fraction ofA.maximumrhizome. And more researches needed to carry out to further reveal its effective ingredients and underlying mechanism.
AmomummaximumRoxb; Anti-inflammatory;Radical Scavenging; α-glucosidase;Chemical Composition
国家自然科学基金项目(81602991)、中国科学院西部之光项目。
卢传礼(1983-),男,汉族,博士研究生,副研究员,研究方向为药用植物有效成分与作用机制。E-mail: luchuanli@xtbg.ac.cn
R29
A
1007-8517(2017)12-0031-06
2017-04-24 编辑:穆丽华)

