2017年中考化学模拟试题(四)
李建国
满分:50分 时间:60分钟
可能用到的相对原子质量 H:1 C:12
N:14 O:16 Na:23 S:32 Ba:137
一、识别与选择(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意)
1.下列物质的变化过程属于化学变化的是( )
A.干冰升华
B.铝放置于空气中,表面生成一层致密的薄膜
C.分离液态空气
D.蒸发蔗糖水溶液得到蔗糖晶体
2.2022年北京、张家口将联合举办冬奥会。为办成绿色奥运会,下列措施不可行的是 ( )
A.发展公共交通,提倡绿色出行
B.改进燃煤锅炉烟囱,将废气排到高空
C.增加使用太阳能、核能等新能源
D.城市生活垃圾定点存放,集中处理
3.家用燃气中的乙硫醇(化学式为C2H6S)易挥发,有蒜臭味,人们对该气味极其敏感。下列有关乙硫醇的说法不正确的是( )
A.乙硫醇的相对分子质量为62
B.乙硫醇中C、H、S三种元素的质量比是 2∶6∶1
C.一个乙硫醇分子中含有2个碳原子、6个氢原子和1个硫原子
D.在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
4.下列关于实验现象的描述,准确的是 ( )
A.碳在氧气中燃烧发出白光,生成二氧化碳
B.黄铜片和铜片互相刻画,铜片上留下的痕迹比黄铜片上的浅
C.硫在氧气中燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体
D.探究水的组成时,用燃着的木条检验与负极相连的玻璃管内气体,木条燃烧更旺
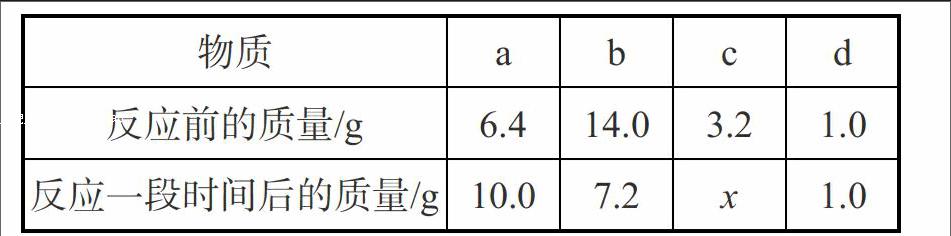
5.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表:
[物质\&a\&b\&c\&d\&反应前的质量/g\&6.4\&14.0\&3.2\&1.0\&反应一段时间后的质量/g\&10.0\&7.2\&x\&1.0\&]
下列有关说法正确的是( )
A.a和b是反应物
B.x=3.2
C.该反应属于分解反应
D.d一定是催化剂
6.下列说法或做法正确的是( )
A.人体缺少必需微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
B.房屋着火可以用水灭火,是因为降低了可燃物的着火点
C.打开汽水瓶盖时,汽水会自动喷出来,说明此时气体在水中的溶解度变大了
D.质量和质量分数均相等的氢氧化钠溶液与稀硫酸充分反应,所得溶液呈碱性
7.验证Zn、Fe、Cu金属的活动性强弱,使用下列各组试剂不能达到实验目的的是( )
A.FeSO4溶液、Zn、Cu
B.ZnSO4溶液、稀盐酸、Fe、Cu
C.ZnSO4溶液、FeSO4溶液、Cu
D.ZnCl2溶液、CuCl2溶液、Fe
8.a、b、c三种物质的溶解度曲线如图1所示。下列说法正确的是( )
A.b中含有少量a,可采用降温结晶的方法提纯b
B.t2 ℃时,把50 g a放入50 g水中,可得到100 g a的饱和溶液
C.将t2 ℃时等质量的a、b的饱和溶液降温到t1 ℃,析出晶体的质量a大于b
D.t1 ℃时,a、c的溶解度相等,则两物质的溶液中溶质质量分数也相等
9.逻辑推理是化学学习常用的思维方法。下列推理正确的是( )
A.CO2能灭火,将燃着的镁条伸入充满CO2的瓶中,镁条立即熄灭
B.铝与盐酸反应生成AlCl3和H2,则金属铁与盐酸反应生成FeCl3和H2
C.因为单质是由同种元素组成的,所以只含一种元素的纯净物一定是单质
D.农作物生长需要N、P、K等元素,为增加肥效,可把NH4H2PO4与草木灰混合施用
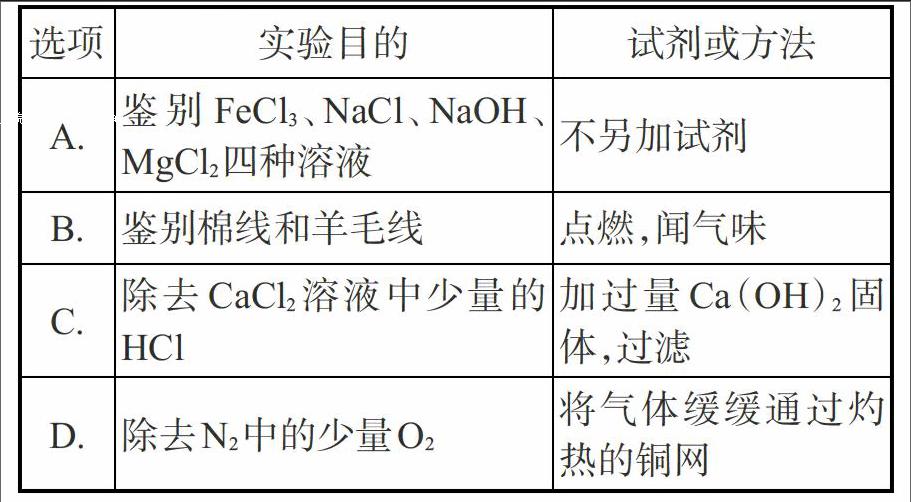
10.下列关于物质的鉴别、除杂所选用的试剂或方法错误的是( )
[选项\&实验目的\&试剂或方法\&A.\&鉴别FeCl3、NaCl、NaOH、MgCl2四种溶液\&不另加试剂\&B.\&鉴别棉线和羊毛线\&点燃,闻气味\&C.\&除去CaCl2溶液中少量的HCl\&加過量Ca(OH)2固体,过滤\&D.\&除去N2中的少量O2\&将气体缓缓通过灼热的铜网\&]
二、理解与应用(本题包括3小题,共15分)
11.(7分)化学用语是一种信息丰富、国际通用且比较简明的化学语言。请用化学用语填空。
(1)①2个铁离子: 。
②3个氨气分子: 。
③地壳中含量最多的金属元素: 。
(2)从C、H、O、S、Na五种元素中,选择适当元素组成符合下列要求的化学用语。
①发酵粉的主要成分之一是 。
②“西气东输”的气体主要成分是 。
③能形成酸雨的主要气体是 。
④一个中和反应的化学方程式:
。
12.(4分)波尔多液是农业上常用的一种杀菌剂。
(1)配制波尔多液的方法是先把生石灰和硫酸铜分别溶于水,该过程中发生化学反应的方程式是 ;再将所得的硫酸铜溶液缓慢倒入石灰乳中,即得到波尔多液。若把石灰乳倒入硫酸铜溶液中,易产生蓝色沉淀,该蓝色沉淀的化学式为 。
(2)波尔多液中硫酸铜比例过高易造成药害,有经验的果农常将磨光的铁制嫁接刀浸在药液里,若产生药害,很快就有明显现象出现,该现象是 。
(3)制作嫁接刀的金属是铁,写出高温下一氧化碳把铁从赤铁矿石中还原出来的化学方程式: 。
13.(4分)A、B、C、D、E是初中化学中常见的五种物质,其反应关系如图2所示,其中D是黑色固体,且与C在一定条件下反应有红色物质生成,E的固体俗称“干冰”。①②③④代表的反应类型分别是复分解反应、分解反应、化合反应和置换反应。图中“—”表示两端的物质之间能发生反应,“→”表示物质间的转化关系(部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)写出下列物质的化学式:D ,E 。
(2)A物质俗称 。
(3)写出反应④的化学方程式:
。
三、实验与探究(本题包括2小题,共10分)
14.(6分)化学是一门以实验为基础的科学。请结合图3所示实验装置回答问题。
图3
(1)写出图中b仪器的名称: 。
(2)若用高锰酸钾固体制取氧气,选用的发生装置是 (填装置编号),反应的化学方程式是 。
(3)某同学在实验室选用C装置(多孔隔板用来放块状固体)制取CO2, 则C装置与B装置相比较,其优点为 (答出一点即可)。
(4)在实验室用C装置制取H2时,若要得到干燥的气体,除了发生装置外,还应选用盛放 (填试剂名称)的D装置。若用E装置收集H2,则气体应从 (填“c”或“d”)端通入。
15.(4分)在工业上常用电解饱和食盐水的方法制取烧碱,即工业烧碱。某校化学兴趣小组的同学为了探究长时间放置的这种工业烧碱的成分,进行了如下实验:
(1)取少量烧碱样品于烧杯中,向其中加入过量的稀盐酸,观察到有气泡产生,说明样品中含有 ,该反应的化学方程式为 。
(2)接着又向上述烧杯中继续加入硝酸银溶液,出现了白色沉淀,小明同学立刻得出结论:样品中还含有氯化钠。小亮同学对小明的结论提出了质疑,认为不一定含有氯化钠,理由是 。
(3)小文同学则认为除了需要确认是否含有氯化钠外,还需要确认样品中是否含有氢氧化钠。于是,大家又进行了以下实验:
①另取少量样品溶解于水,向其中加入过量的硝酸钙溶液,产生白色沉淀,然后过滤,得滤渣和滤液。
②向滤液中加入足量稀硝酸,再滴入硝酸银溶液后产生白色沉淀。
③向滤渣中加少量水后滴入酚酞,溶液变红。
根据以上经验,得出的结论正确的是 (填字母)。
A.样品中无NaCl
B.样品中只有NaOH和Na2CO3
C.样品中无NaOH
D.样品中有Na2CO3、NaOH和NaCl
四、分析与计算(本题包括1小题,共5分)
16.实验中学的兴趣小组在参与“创建卫生城市”行动中,考察了某化工厂的废水处理工程,并提取该工厂未经处理的废水样品带回实验室进行测定分析。
(1)取废水样品少量,用紫色石蕊溶液测定废水的酸碱性,发现石蕊溶液变成 色,说明该废水显酸性。
(2)另取废水样品少量,滴加适量 Ba(NO3)2溶液,有白色沉淀产生,说明该废水中一定含有的酸根离子是 。
(3)同学们进一步了解到该废水样品中含有一种酸,为测定废水中所含酸的质量分数,取该废水样品200克于燒杯中,逐滴加入硝酸钡溶液至不再产生沉淀,过滤、干燥后称量,获得沉淀的质量为23.3克。请计算废水中酸的质量分数。(假设该废水中的其他物质均溶于水且不与硝酸钡溶液反应)
(参考答案见第67页)

