蛋白赖氨酸甲基转移酶SET7/9表达对肝癌细胞增殖、凋亡和迁移的影响
刘宏,顾页,蔡盈盈,余卫平
(东南大学医学院 病理学与病理生理学系,江苏 南京 210009)
·论 著·
蛋白赖氨酸甲基转移酶SET7/9表达对肝癌细胞增殖、凋亡和迁移的影响
刘宏,顾页,蔡盈盈,余卫平
(东南大学医学院 病理学与病理生理学系,江苏 南京 210009)

肝癌细胞; SET7/9; 细胞增殖; 凋亡; 迁移

1 材料与方法
1.1 材料
1.2 方法

1.2.2 细胞转染 参考SuperFectinTMⅡ转染试剂操作说明书。按照实验设计,将处于对数生长期的细胞分组接种于6孔培养板中,每组2孔,置培养箱中培养24 h。当细胞贴壁且融合度达80%时,将1 μg质粒与3 μl转染试剂在无血清培养基中混匀后室温静置15 min,再均匀地加入待转染培养细胞中孵育6 h,弃去培养液,加入新的完全培养液。转染后48 h当荧光显微镜下观察到转染效率达75%时,采用蛋白免疫印迹法检测转染效果。

1.2.4 细胞增殖检测 将经检测转染有效的细胞消化制备单细胞悬液并进行细胞计数,每孔加100 μl细胞悬液,保证细胞均匀分布,每组设6个复孔,同时将其种于96孔板,密度为每孔1 000~2 000个细胞,分别于24、48、72、96 h按凋亡试剂盒说明每孔加入10 μl CCK8凋亡试剂,放入37 ℃、5%CO2培养箱培养1 h,酶标仪测定450 nm波长处各测量孔的OD值以观察其增殖能力。
1.2.6 Transwell细胞迁移实验 用8.0 μm膜,上室加入300 μl不含血清及抗体的高糖DMEM培养基及用无血清培养基重悬的2.0×105个肿瘤细胞,下室加入含10%胎牛血清、100 U·ml-1青霉素、100 U·ml-1链霉素的高糖的DMEM培养基400 μl,肿瘤细胞会向含有细胞因子、趋化因子营养成分高的下室迁移,计数进入下室的细胞量可反映肿瘤细胞的迁移能力。
1.2.7 统计学处理 采用SPSS 18.0软件进行统计学分析。数据以均值±标准差表示,两组间比较用t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 肝癌细胞株中SET7/9表达状况
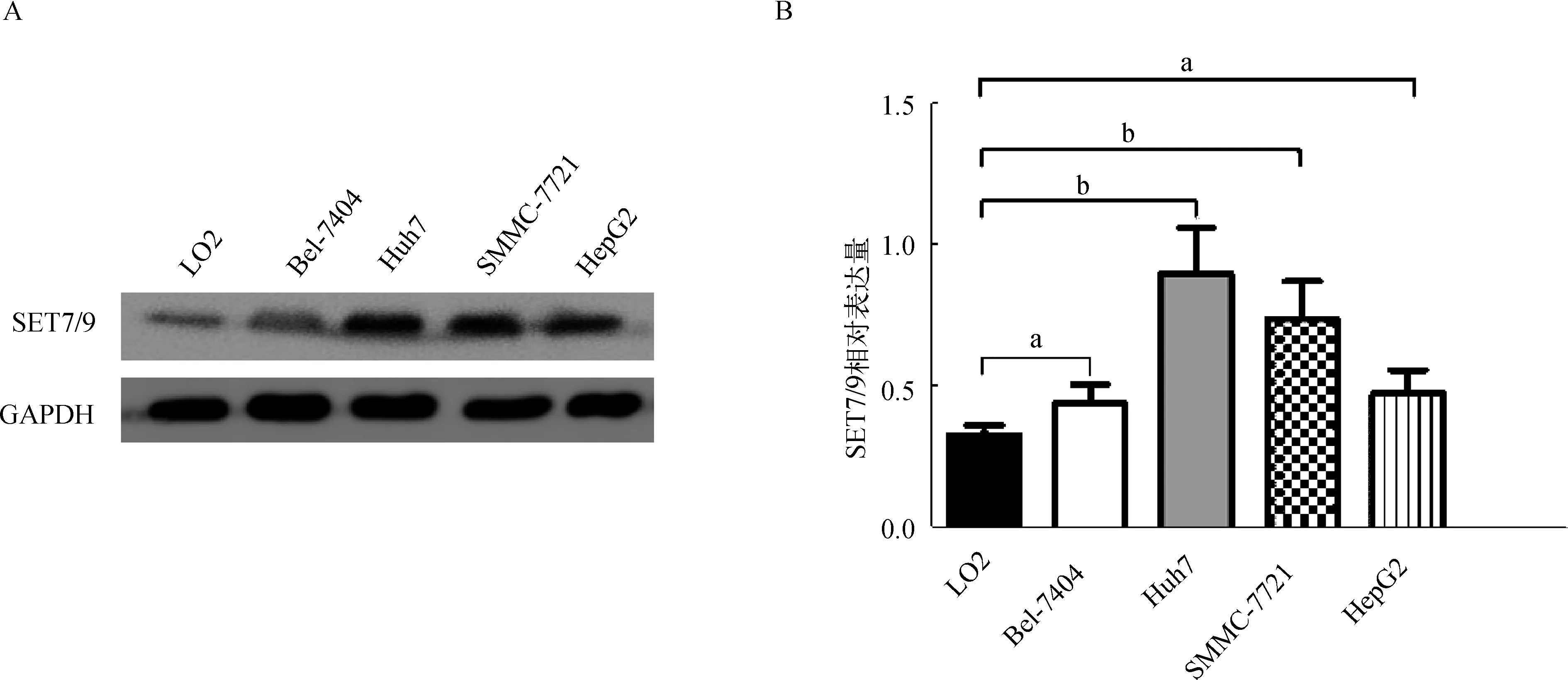
a 与正常肝细胞比较,P<0.05;b 与正常肝细胞比较,P<0.01
图1 正常肝细胞株与肝癌细胞株中SET7/9表达状况
Fig 1 Expression of SET7/9 in normal hepatic and four hepatoma cell lines

b 与对照组比较,P<0.01
图2 两株肝癌细胞转染不同质粒后SET7/9表达状况
Fig 2 Expression of SET7/9 in two liver cancer cell lines transfected with different plasmids
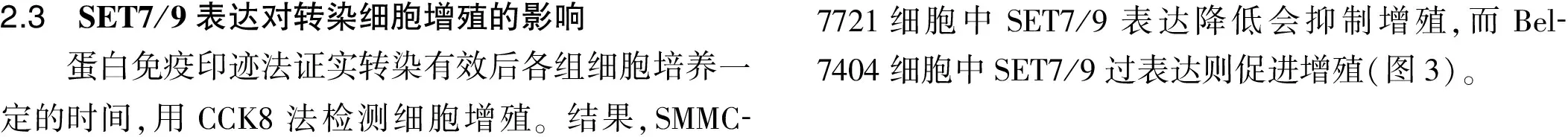
a 与对照组比较,P<0.05
图3 SET7/9表达变化对肝癌细胞增殖的影响
Fig 3 Effects of altered SET7/9 expression on proliferation of liver cancer cells

aP<0.05
2.5 SET7/9表达对转染细胞迁移力的影响
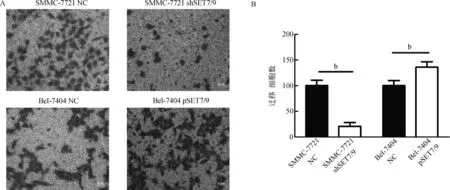
bP<0.01
图5 SET7/9表达变化对肝癌细胞迁移力的影响
Fig 5 Effects of altered SET7/9 expression on migration of liver cancer cells
3 讨 论
SET7/9也称为SET7或SET9,这种称呼上的差别源于最初报道者的不同命名,其表达基因位于染色体4q28,蛋白产物含保守的SET结构域,相对分子质量约为50[3- 4]。研究发现,SET7/9除了能甲基化组蛋白外,还能使转录因子、肿瘤抑制因子、膜相关受体等非组蛋白甲基化[7]。SET7/9所介导的不同非组蛋白赖氨酸甲基化能引发多种细胞效应包括蛋白稳定性改变和基因表达变化,与染色体结构维持、细胞增殖及凋亡调控等相关[3]。
本研究观察到的肝癌细胞中SET7/9表达状况及其表达改变对细胞生物学行为的影响,无疑有助于进一步阐明SET7/9的肿瘤细胞效应。最近,Song等[7]发现乳腺癌细胞中SET7/9表达降低会促进细胞增殖、迁移及侵袭力,SET7/9过表达可抑制细胞增殖、迁移及侵袭。Yoshimitsu等[10]发现原发性胃癌细胞中SET7/9明显降低,抑制胃癌细胞中SET7/9表达会促进细胞增殖、迁移和侵袭,证明SET7/9有抑制胃癌细胞的作用。显然,这些结果与我们及其他研究者在人肝癌细胞、人肺癌细胞和人卵巢癌细胞等观察到的情况并不一样,表明SET7/9对肿瘤细胞生物学调控具有双重性,在不同组织类型肿瘤细胞呈现不同效应。
至于肝癌细胞中SET7/9表达如何引起细胞增殖、凋亡及迁移力变化,我们认为涉及SET7/9对非组蛋白赖氨酸单甲基化修饰的胞内蛋白功能调控机制。由于不同组织类型肿瘤中SET7/9对一些重要因子的甲基化作用或增加(如p53、ER)或降低(如p65、DNMT1)蛋白稳定性,或促进其空间变构(如AR),继而改变它们的转录活性,影响靶基因表达[3],这会诱发不同类型细胞不同的细胞生长与行为学效应。通过深入研究SET7/9调控肝癌细胞的增殖、凋亡和迁移的具体机制,有望让SET7/9成为新的肝癌诊断生物标志物与治疗药物作用靶点。


[5] 汪渊.蛋白甲基化修饰酶SET7/9对p53缺失人肺癌细胞的凋亡效应及其机制[D].南京:东南大学,2014.


Effects of protein lysine methylation transferase SET7/9 expression on proliferation,apoptosis and migration of liver cancer cells
(DepartmentofPathologyandPathophysiology,SchoolofMedicine,SoutheastUniversity,Nanjing210009,China)

hepatic cancer cell; SET7/9; cell proliferation; apoptosis; migration


国家自然科学基金资助项目(81071654)
R735.7; R318
A



