大鼠反复轻度脑创伤后外周血中T细胞亚群的变化
白若靖,高华斌,韩召利,黄山,葛歆瞳,陈芳莲,雷平
[1.天津医科大学总医院 保健医疗部(老年病科),天津市老年病学研究所,天津 300052;2.天津医科大学总医院 神经外科,天津市神经病学研究所,天津 300052]
·论 著·
大鼠反复轻度脑创伤后外周血中T细胞亚群的变化
白若靖1,高华斌2,韩召利1,黄山2,葛歆瞳2,陈芳莲2,雷平1
[1.天津医科大学总医院 保健医疗部(老年病科),天津市老年病学研究所,天津 300052;2.天津医科大学总医院 神经外科,天津市神经病学研究所,天津 300052]
目的:探讨大鼠反复轻度脑创伤(rmTBI)后外周血中T细胞亚群的变化及其意义。方法:选择SD大鼠,采用控制性脑皮质撞击法(CCI)制作rmTBI大鼠模型,随机分为假手术对照组以及损伤后1、2、4、6周组共5组,每组8只,通过流式细胞仪检测各组大鼠1、2、4、6周时外周血中CD3+、CD4+、CD8+细胞百分率。结果:CD3+T细胞百分率在1、2周均有显著上升,在4、6周均有显著下降(P<0.05)。CD4+T细胞百分率在伤后持续下降(P<0.05);CD8+T细胞百分率在伤后1~4周逐渐上升(P<0.05)。结论:rmTBI模型大鼠在伤后存在免疫功能紊乱,这为rmTBI伤后存在外周免疫抑制提供了新的实验证据,其慢性期外周免疫抑制可能对疾病的预后产生重要影响。
反复轻度脑创伤; T细胞亚群; 免疫功能; 大鼠外周血; 免疫抑制
脑创伤(traumatic brain injury,TBI)是危险性较高的创伤类型,主要包括原发性损伤和继发性损伤,其因高发生率、高致残率、高死亡率而严重危害着人类健康。继发性损伤是指局部脑组织和外周微环境中相关炎症反应和免疫应答,其中免疫系统对TBI影响已成为近来研究的热点[1]。其中,慢性创伤性脑病(CTE)是与反复轻度脑创伤(repetitive mild traumatic brain injury,rmTBI)相关的一种神经退行性疾病,常见于拳击运动员、退伍士兵等[2]。以往的研究主要局限于严重TBI外周免疫变化,但CTE相关的rmTBI外周免疫如何变化尚未明确。本研究应用流式细胞仪检测rmTBI模型大鼠外周血中T细胞亚群CD3+、CD4+、CD8+的变化,以了解CTE相关rmTBI中急慢性期的外周免疫反应,为进一步探讨CTE相关rmTBI作用机制提供实验依据。
1 材料与方法
1.1 实验动物与试剂
1.2 颅脑损伤动物模型建立及分组
采用控制性脑皮质撞击法(CCI)制备大鼠rmTBI模型,以3.5 ml·kg-110%水合氯醛腹腔注射麻醉大鼠,固定后备皮消毒切开,分离颅骨与肌肉筋膜,于颅中线偏右3 mm、后颅线前4 mm开一直径为4 mm的骨窗,显微镊去除骨瓣后置于CCI损伤仪下,应用PinPointTMPCI3000精细颅脑撞击仪(Hatteras Instruments Inc.USA)设定轻型颅脑损伤打击参数,使用直径为2.5 mm的打击头精确撞击小鼠脑皮质(打击深度为3.6 mm、打击时间为100 ms、打击速度为1.2 m·s-1),消毒缝合后置于电热毯上维持体温。每隔24 h再进行上述打击,共重复4次。大鼠按照随机原则分为假手术对照组和损伤后1、2、4、6周组共5组,每组8只。假手术对照组除不作打击处理外,其余处理均与实验组相同。
1.3 标本采集
各组大鼠在相应时间点(损伤后1、2、4、6周)留取血样,均用EDTA抗凝管心脏采血约2 ml,立即轻微颠倒混匀后进行免疫学分析。
1.4 流式细胞技术检测外周血CD3+、CD4+、CD8+细胞表达
1.4.1 大鼠外周血单个核细胞(PBMC)分离 获取大鼠PBMC。(1)EDTA抗凝管常规采集大鼠外周血新鲜标本3 ml;(2)抗凝血与PBS缓冲液1∶1混匀,各3 ml;(3)15 ml离心管中加入大鼠淋巴细胞分离液9 ml,稀释后的血液缓慢加入到分离液表层,避免混合;(4)于离心机4 ℃下1 800 r·min-1离心30 min(升3降3);(5)离心后离心管中混合液分为4层(从下到上依次为红细胞、大鼠淋巴细胞分离液、单个核细胞层、血浆与PBS),吸取中间白膜层(单个核细胞层)置于新的15 ml离心管中,与PBS缓冲液混匀后4 ℃下2 000 r·min-1离心10 min(升10降10),进行第1次洗涤;(6)与PBS缓冲液混匀后2 000 r·min-1离心10 min;(7)离心弃上清,PBS重悬后进行细胞计数,调整细胞浓度为2×106个·ml-1,得到大鼠PBMC标本[3]。

1.5 统计学处理
应用SPSS 22.0统计软件分析,数据以均数±标准差表示,采用两独立样本的t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 rmTBI大鼠外周血中T细胞亚型CD3+、CD4+、CD8+的表达
各时间点大鼠外周血中T细胞亚型CD3+、CD4+、CD8+的检测结果见表1。伤后1、2周大鼠外周血中CD3+T细胞表达水平显著高于假手术对照组(P<0.05),而伤后4、6周显著低于假手术对照组(P<0.05)。CD4+T细胞占T细胞的百分率在伤后1~6周持续下降,与假手术对照组比较差异具有统计学意义(P<0.05);CD8+T细胞占T细胞的百分率在伤后1~4周逐渐上升,与假手术对照组比较差异具有统计学意义(P<0.05)。
3 讨 论
表1 rmTBI大鼠外周血中T细胞亚型CD3+、CD4+、CD8+的表达 %
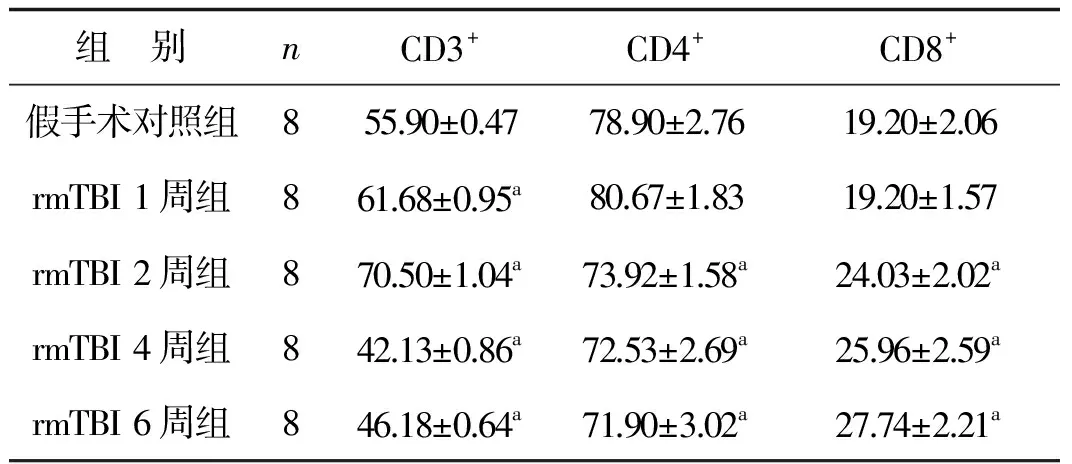
Tab 1 Changes of T lymphocyte subsets CD3+,CD4+,CD8+ in the peripheral blood of rats after rmTBI %
a 与假手术对照组比较,P<0.05
PBMC富含各种免疫活性细胞,主要为T细胞,其中CD3+代表总T淋巴细胞,分为调节免疫活性的辅助性T细胞亚群CD4+和抑制性T细胞亚群CD8+。其中CD4+T淋巴细胞促进淋巴细胞的增殖与分化,同时参与并协调各免疫细胞间的相互作用,而CD8+T淋巴细胞则作用相反。CD4+/CD8+值作为重要的免疫调节的标志,反映免疫系统内环境的稳定性[10]。
本研究结果表明,rmTBI慢性期存在显著的免疫抑制,这可能与伤后血脑屏障的破坏具有密切关系[11],这与之前报道的严重TBI后外周免疫抑制[5- 6,12- 13]相类似。另外,研究发现脊髓损伤(spinal cord injuries,SCI)慢性期的免疫抑制状态可长达3个月[14- 15]。本研究外周免疫抑制这一现象可能的原因如下:(1)伤后激活的交感神经系统(sympathetic nervous system,SNS)导致脾脏的收缩[16],进而造成相关免疫功能的紊乱[17],两者相互促进,并加重免疫抑制的程度[18]。(2)伤后激活的下丘脑-垂体-肾上腺轴[19- 20],导致外周糖皮质激素、儿茶酚胺水平增高和髓系抑制性细胞(myeloid derived suppressor cells,MDSCs)的增殖,进一步抑制T细胞的相关功能。(3)损伤的神经元经血脑屏障渗漏进入外周血,进一步促进MDSCs的增殖和淋巴细胞的减少[21]。故这一中枢神经损伤诱导的免疫缺陷,增加了感染的易感性并影响着神经功能的预后。
本研究首次发现大鼠rmTBI模型伤后外周血中T细胞亚群CD3+、CD4+、CD8+的变化,为rmTBI伤后存在外周免疫抑制提供了新的实验证据,但这一现象是否持续存在以及其他免疫细胞(如Treg、Th17、NK细胞等)表达的变化仍有待进一步研究。此外,本研究为rmTBI相关的CTE疾病研究提供了新的视角,并为改善神经退行性疾病的预后开辟了新的途径。
[3] 孔晓冬.自然杀伤细胞在创伤性脑损伤中的变化研究[D].天津:天津医科大学,2014.



[11]JIN X,ISHII H,BAI Z,et al.Temporal changes in cell marker expression and cellular infiltration in a controlled cortical impact model in adult male C57BL/6 mice[J].PLoS One,2012,7(7):e41892.


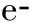


[21]HAZELDINE J,LORD J M,BELLI A.Traumatic brain injury and peripheral immune suppression:primer and prospectus[J].Front Neurol,2015,6:235.
Kinetics of T lymphocyte subsets in the peripheral blood of rats following repetitive mild traumatic brain injury
(1.DepartmentofGeriatrics,TianjinMedicalUniversityGeneralHospital,TianjinGeriatricsInstitute,Tianjin300052,China; 2.DepartmentofNeurosurgery,TianjinMedicalUniversityGeneralHospital,TianjinNeurologicalInstitute,Tianjin300052,China)

repeated mild traumatic brain injury;T lymphocyte subsets;immune function;peripheral blood of rats;immune suppression


国家自然科学基金资助项目(81471252);天津市科委自然基金面上项目(13JCYBJC23700);国家青年自然科学基金资助项目(81501055)
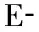
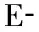

A



