奥贝胆酸的合成方法与药学性能的研究进展
冯 娜,胡祥正,2*
(1.天津科技大学 食品工程与生物技术学院,天津 300457; 2.天津科技大学 化工与材料学院,天津 300457)
奥贝胆酸的合成方法与药学性能的研究进展
冯 娜1,胡祥正1,2*
(1.天津科技大学 食品工程与生物技术学院,天津 300457; 2.天津科技大学 化工与材料学院,天津 300457)
奥贝胆酸是鹅去氧胆酸6位乙基衍生物,是一种有效的法尼酯衍生物X(FX)核受体激动剂,对非酒精性脂肪性肝炎和原发性胆汁性肝硬化有很好的治疗效果,临床应用前景广阔. 鉴于奥贝胆酸在临床应用方面的优越性能,奥贝胆酸的临床应用与合成是目前生物医药领域研究的热点. 尽管近些年,奥贝胆酸的合成方法和工艺研究方面取得长足进步,但要实现规模化生产,仍有一些问题需要解决. 本文就奥贝胆酸的合成方法和临床应用的研究进展做一综述.
奥贝胆酸;肝胆疾病;药学性能;合成方法
奥贝胆酸(6-乙基-3α,7α-二羟基-5β-胆烷-24-酸,简写为OCA;6-ECDCA,亦称为INT-747. 结构式如图1所示)是人体初级胆汁酸鹅去氧胆酸(CDCA)的半合成衍生物. 它是一种具有选择性的法尼酯衍生物X受体(FXR)激动剂,其活性要比CDCA高出100倍[1],具有抗胆汁淤积性和保护肝脏的特性[2]. 研究表明,FXR是主要的核胆汁酸受体,具有促进肝脏再生、保持肠屏障功能的完整性等生物功能. FXR通过调节肝脏中的糖质新生和肝糖循环来调控葡萄糖代谢,并且能够调节横纹肌对脂肪组织中的外周胰岛素敏感性[3-6]. FXR的抗炎作用可以增加肠和肝脏免疫系统的抗病毒功能[7-10]. 因此,作为FXR的激动剂,OCA拥有着巨大的应用价值和市场潜力. 前期的临床研究表明,OCA可以改善肝脂肪变性、纤维变性与门静脉血压过高等问题[11-13],还可以增加胰岛素敏感性,调节葡萄糖动态平衡,调整脂质代谢. 在肝脏、肾脏、肠等FXR表达器官中,OCA还表现出了抗炎性和抗纤维变性等活性[14]. 在动物模型试验中,OCA可以降低胰岛素抗性、肝脂肪变性和纤维变性[15]. 大量临床试验证明,它对于治疗胆汁淤积性肝病有着显著地效果.
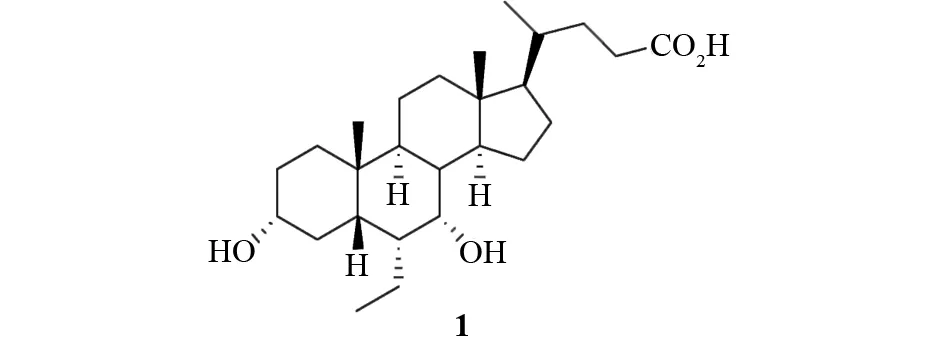
图1 OCA的分子结构式Fig.1 Molecule structure of OCA
1 OCA合成的相关研究
目前,用OCA治疗胆汁淤积性肝病的研究已经越来越多受到科学家们的重视,相关临床试验正在逐步开展,人们希望临床试验加深对OCA的长期治疗效果和治疗安全性的了解. 在这一背景下,如何用快速高效的方法合成OCA也逐渐成为了人们关注的热点.
ROBERTO等对OCA的合成方法进行了阐述[2],反应步骤如图2. 此方法以7-氧代-石胆酸(2)为原料,经过四步反应合成OCA:第一步是2在25 ℃、p-TsOH为催化剂的条件下,与3,4-二氢吡喃反应,生成3位保护的衍生物3. 第二步是在-78 ℃的THF溶液中,用LDA作催化剂,用R-Br作烷基化剂,在6位进行烷基化反应,同时脱去3位的保护基,生成6-烷基取代的衍生物(4a-4d). 第三步是用NaBH4作还原剂,将7位羰基还原为羟基,得到3α,7α-二羟基-6α-烷基-5β-胆烷酸甲酯(5). 第四步是在MeOH溶液中,用10%NaOH溶液作催化剂进行碱性水解,5脱去24位保护甲基,得到6(当R=CH2CH3时,产物为目标产物1).
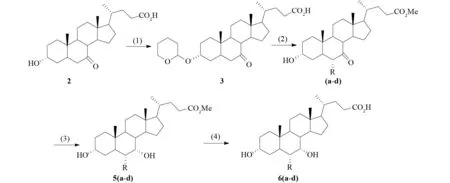
a. R=Me; b. R=Et; c. R=Pr; d. R=Bn.1. p-TsOH,C5H8O,C4H8O2,25 ℃; 2. (a)LDA,R-Br,THF,-78 ℃(b)10% HCL,MeOH; 3. NaBH4; 4. 10% NaOH,MeOH.图2 以7-氧-石胆酸为原料合成OCAFig.2 Synthesis route of OCA with 7-O-LiCA as raw material
此种OCA合成方法,最终得到的OCA总收率仅有2%~3%. 由于反应原料昂贵,在反应步骤中,各步反应产物都需要用色谱进行纯化,因此此种方法不适用于工业化规模生产. 另外,此合成方法中应用的六亚甲基磷酰胺有致癌作用,也限制了其应用价值.
YU等[16]对ROBERTO等提出的OCA的合成方做出了改进,他们以价格便宜、获取容易的CDCA(7)作为原料,经过四步反应合成OCA,具体步骤如图3所示. 第一步是用PCC作氧化剂,选择性氧化CDCA的7位羟基,得到2. 第二步以p-TsOH为催化剂,与3,4-二氢吡喃反应,生成3-四氢吡喃氧基衍生物8,通过形成醚氧键保护3位羟基. 第三步是用n-BuLi作还原剂,LDA/HMPA作催化剂,形成烯醇化物后,用Et-I进行烷基化反应,用PPTS脱出3位保护基,得到烷基取代的中间产物9. 第四步是用NaBH4作还原剂,最终得到OCA(1).
与ROBERTO提出的方法相比,该方法的改进之处在于,在氧化步骤使用了PCC和在立体选择性烷基化步骤中使用了HMPA或乙基碘化物. 这种改进后的合成方法经济有效,将产物收率提升到20%,并且原料便宜易得,相对来说是一种简单方便的方法.

1. PCC; 2. C5H8O, p-TsOH; 3. (a)LDA/HMPA, n-BuLi/Et-I (b)PPTS; 4. NaBH4.图3 以CDCA为原料合成OCAFig.3 Synthesis route of OCA with CDCA as raw material
2013年,STEINER等[17]提出了合成OCA的新方法,此方法以7-氧代-石胆酸(2)为原料,经过七步反应合成OCA,具体步骤如图4所示. 第一步是2与MeOH反应后得到10. 第二步是10在THF中,用LDA作催化剂,与Si(CH3)3Cl反应,制得硅烯醇醚11和12. 第三步是硅烯醇醚11和12与CH3CHO在CH2Cl2溶液中发生羟醛缩合反应,然后在BF3·CH3CN作用下,碱性水解,得到6-乙烯基取代的7-酮石胆酸甲酯13. 第四步,13在MeOH溶液中碱性水解,得到6-乙烯基取代的7-酮石胆酸14. 第五步是14在碱性条件下,用Pd/C与H2还原得6-烷基取代的7-氧代-石胆酸15. 第六步是6-烷基取代的7-酮石胆酸15用NaBH4作还原剂,得到C型OCA16. 第七步,C型OCA先与NaOH反应生成盐,后用HCl酸化,再结晶可得Ⅰ型OCA1,即最终产物OCA.
此方法在规模优化、安全性以及提升纯度方面有了比较好的改进,生产过程较之前更加安全,最终产物纯度提升至96%以上,但产物收率仍只有20%.

1. MeOH, H2SO4, (62 ℃); NaOH, AC; H2O(10~15 ℃); 2. THF/LDA, -25 ℃; Si(CH3)3Cl; C6H8O7(aq); 3. CH2Cl2, CH3CHO, -60 ℃; BF3·CH3CN, -60 ℃; NaOH/H2O; 4. MeOH, NaOH, H2O, 50 ℃; C6H8O7, AcOEt; AcOEt; EtOH; 5. 50% NaOH, H2O, Pd/C, H2, 25 ℃; HCl(conc.)/nBuOAc, 40 ℃; Act, Carbon, 40 ℃; nBuOAc; 6. H2O, NaOH, 90 ℃; NaBH4, 90 ℃; C6H8O7, nBuOAc, 40 ℃; nBuOAc; nBuOAc; nBuOAc; 7. H2O,NaOH,30 ℃; HCl,H2O.图4 以7-氧-石胆酸为原料OCA的新合成路线Fig.4 New synthesis route of OCA with 7-O-LiCA as raw material
近期,邱玥珩等[18]对合成路线在此基础上进行了优化,以2为原料,经五步反应合成OCA. 此方法中,中间体15无需纯化,可以直接投入下步反应,适合工业化生产;并且操作方便成本低廉,总收率为31.9%. 此方法与之前方法相比确有优化之处,但与真正的工业化大规模生产还有段距离.
2 奥贝胆酸的临床研究现状
2.1 OCA治疗PBC的研究进展
原发性胆汁性肝硬化(PBC)是一种慢性,进行性自身免疫性胆汁淤积性肝病,它的症状是炎症和肝内小导管的损伤,这些会导致肝硬化、纤维变性以及肝坏死,最终引起人的死亡[19]. 目前唯一被认可且被广泛应用,用于治疗PBC的药物是熊去氧胆酸(UDCA),它是一种双亲性、非细胞毒性胆汁酸[20-22]. 在UDCA治疗的患者中,40%以上的患者会产生不适反应[23-25]. 临床研究结果表明,PBC患者单独服用OCA或是UDCA与OCA一并服用,都会使胆汁淤积或炎症情况得到改善[26-27]. 因此,OCA可能是一种更加有效的治疗PBC的药物. HIRSCHFIELD 等[28]以那些对UDCA产生不适反应的PBC患者,用安慰剂做对照进行试验,采用OCA进行治疗. 最终显示,对于服用UDCA治疗PBC而产生不适反应的患者,用OCA对其治疗后效果较佳. OCA会明显的降低碱性磷酸酶(ALP)和胆红素的水平,并且伴随着C-反应蛋白和免疫球蛋白M (患有PBC时会明显增多的免疫球蛋白)的明显减少,也说明OCA可能会改善基础免疫和炎症反应. 对于PBC所引发的并发症也在一定程度上有所改善. 瘙痒症是慢性肝病发生时的一种较为棘手的并发症[29],瘙痒症是最常见的不良反应,并与OCA有明显的剂量关系. 尽管胆汁淤积性瘙痒的确切介质仍有待确定,但其中可能存在两种OCA作用机制:激活自体毒素途径[30]和激活TGR5[31-33]. 目前的研究数据并不能证明TGR5可以诱发瘙痒症;OCA是一种弱的TGR5激动剂,并且会降低人体内源性TGR5激动剂-DCA(去氧胆酸)的水平;OCA激活自体毒素途径也有待确定. 在治疗过程中随着OCA剂量的增加,瘙痒症的现象会随之加重,但与安慰剂组相比,症状较轻. 通过所有的剂量测试,OCA表现出了明显的生物化学效应;权衡其功效和耐受性,PBC患者每天服用10 mg的OCA效果最佳. 目前对于OCA治疗PBC的二期临床研究已经结束,美国、加拿大等国正在对其开展三期临床研究,以期对其长期治疗过程中的安全性与可靠性做出更加确切的结论[34].
2.2 OCA治疗NASH的研究进展
目前,非酒精性脂肪性肝炎(NASH)是全世界引发慢性肝病的一个越来越普遍的原因,它与肝病导致的死亡率的增加和肝细胞癌患者的增加有关[35-37]. NASH患者中会有15%~20%发展成为肝硬化,这也使得肝移植呈现上升趋势[38],但目前为止还没有正式获批的治疗方法. 在患有脂肪肝的动物模型试验中,OCA可以减少肝脂肪和纤维变性,因此BRENT等[39]对NASH患者用OCA加以治疗,来评估其治疗效果. 在美国的医疗中心,以非肝硬化、非酒精性脂肪性肝炎患者为对象,做了一个为期72 w,涉及多领域、双盲、安慰剂对照的平行随机临床试验,来评估OCA的治疗效果. 患者由电脑按1∶1随机分配,集中管理,按临床中心和糖尿病状态分层. 主要的观察指标是肝组织学集中性评分的改善,即从开始治疗到结束无恶化纤维化,在非酒精性脂肪性肝病中的活性分数至少下降百分之二.
这次的试验表明,FX核受体激动剂OCA,与安慰剂相比,改善了NASH的生化和组织学特性,更重要的是所有NASH 的活性分子都有所改善,包括脂肪变性、肝细胞气球样变性、小叶炎症以及纤维变性[40]. 对纤维变性的改善虽然不明显,但是仍可以表明其对于预防肝硬化的形成可能会起到一定的作用. FXR活化通过下调SREBP1c 和增加SIRT1[41-42]从而减少肝脂肪生成,这些作用在OCA治疗NASH时也起到了一定的效果. 然而,FXR活化的一个重要作用是抑制胆固醇转化为胆汁酸这一生物过程,这一过程,会导致血清胆固醇含量增加. 因此OCA治疗过程中血清胆固醇含量会增加. FXR激动剂对于胆固醇代谢的作用是比较复杂的,因为它们可能会促进胆固醇逆向转运出组织. 鉴于这些复杂性,在以后OCA治疗肝病中需要前瞻性的监测和分析[43-44].
对于NASH患者,OCA具有很好的耐受性,唯一的不良反应就是瘙痒症,与安慰剂组相比,出现的会更加频繁. 在用OCA治疗PBC时,瘙痒症也会在PBC患者中出现[45]. 用OCA进行治疗后,它会使血浆胆固醇池和胰岛素耐受性发生改变,这可能会增加机体患动脉粥样硬化的风险. 因此,OCA可改善NASH的组织学特性,对于NASH有一定治愈效果,但它长期治疗过程中的安全性还有待进一步考证.
2.3 OCA治疗二型糖尿病和NAFLD的研究进展
二型糖尿病和非酒精性脂肪肝(NAFLD)均属于代谢综合症的范围,具有很多相关的临床特征,包括胰岛素抗性、血脂异常、高血压和腹部肥胖等[46]. 二型糖尿病在全球范围内变得越来越普遍,预计到2030年,大概会有8%的人口患此疾病[47]. NAFLD是到目前为止最普遍的慢性肝病,全球大概有20%~40%的人口会患此疾病,其中,30%的NAFLD患者会发展成为NASH患者[48]. 二型糖尿病和NAFLD与肥胖症相关,这种疾病在全球范围内越来越广泛,是影响人们健康的一个重要问题[49]. 前期的临床研究显示,OCA表现出了调节葡萄糖和脂质代谢的功效. 研究人员依此,对OCA开展了二期临床研究,来评估OCA对于二型糖尿病和MAFLD的治疗效果[50].
在这个研究中,研究人员用OCA对糖尿病和NAFLD患者进行了为期6 w的治疗,最终改善了胰岛素敏感性,有轻微体重减轻现象的发生,提升了血浆中低密度脂蛋白胆固醇和纤维母细胞生长因子19(FGF19)浓度,从而使7-羟基-4-胆甾烯-3-酮(C4)和内生性胆汁酸水平降低,证明了OCA在治疗肝病和代谢疾病方面具备一定的潜力. OCA的治疗会使γ-谷氨酰转移酶的水平明显降低,它是脂肪肝疾病的一种标记物,与前驱糖尿病和糖尿病有关[51],并且是NAFLD患者患有糖尿病的一个已知危险因素[52]. OCA对肠内稳态的调节作用可能超过了对FGF19的诱导作用. 临床模型的测试结果表明,OCA激活FXR可以保护体内肠上皮屏障的完整性,可能是通过抗炎作用使连接紧密性得到加强. 其中,OCA还会增加抗菌肽在结肠中的表达,抗菌肽是一种具有杀菌作用的天然抗菌素,表明了OCA具有调节肠道菌群的作用[53]. 近来研究表明肠道菌群通过FXR依赖性机制影响整个肝肠系统胆汁酸池的大小和组成[54]. 无菌鼠试验中,OCA会增强回肠中FGF15的表达、抑制肝中CYP7A1的表达,表明它会增强FXR信号,并进一步支持OCA与肠道菌群的潜在交联作用. FXR的活化通过增加反向胆固醇运输和减少肠胆固醇吸收来降低血浆高密度脂蛋白胆固醇含量(HDL)[55]. 与此同时,FXR激动剂对于高脂血症低密度脂蛋白受体缺乏或是载脂蛋白E缺乏的小鼠会减少动脉粥样硬化病变[56-57].
其中,临床试验表明,FGF19在人类回肠中分泌较多,同时C4和FGF19是胆汁酸型腹泻的诊断标准[58],OCA可刺激FGF19的分泌,减少胆汁酸的合成,因此对胆汁酸型腹泻有很好的临床治疗效果[59-60]. 由此推测,OCA有可能对治疗慢性腹泻,特别是胆汁酸型慢性腹泻是有效的. 作为FXR激动剂,OCA对治疗NAFLD有较好的效果. 由于FXR能促使葡萄糖和脂质体内平衡的基因发生改变[61],但对于葡萄糖和脂质的体内平衡的影响效果还不是很显著,所以在这一方面的应用价值仍需要进一步研究[62].
3 结论
目前,胆汁淤积性肝病在全球范围内广泛存在,人们也一直在研究如何有效的改善患者的胆汁淤积状况,并寻找治疗此病的有效药物. 作为高效且具有选择性的FXR激动剂,OCA的临床研究仍在继续. 之前的临床应用研究结果显示,OCA能够改善胆汁淤积性肝病患者的胆汁淤积状况,减少并发症的发生. 有文献显示胆酸衍生物有一定的抗肿瘤活性[63],具有类似结构的OCA是否也具有相同的作用,仍需进一步验证. 基于OCA显著的临床应用价值,如何大量获得OCA也变得尤其重要. 由于化学合成是OCA的唯一来源,因此OCA合成方法的研究也成为近几年药物合成的热点. 尽管OCA的合成方法研究取得了较大进步,但到目前为止,所有的方法都存在步骤多、产率低、成本高、无法规模化实施等问题. 如何减少合成步骤、提高各步反应收率、降低生产成本、并适应于规模化生产应用依旧是OCA合成研究的重点.
[1] PELLICCIARI R, COSTANTINO G, CAMAIONI E, et al. Bile acid derivatives as ligands of the farnesoid X receptor. Synthesis, evaluation, and structure-activity relationship of a series of body and side chain modified analogues of chenodeoxycholic acid [J]. Journal of Medicinal Chemistry, 2004, 47(18): 4559-4569.
[2] PELLICCIARI R, FIORUCCI S, CAMAIONI E, et al.α-ethyl-chenodeoxycholic acid (6-ECDCA), a potent and selective FXR agonist endowed with anticholestatic activity [J]. Journal of Medicinal Chemistry, 2002, 45(17): 3569-3572.
[3] CARIOU B, VAN H K, DURANSANDOVAL D, et al. The farnesoid X receptor modulates adiposity and peripheral insulin sensitivity in mice [J]. Journal of Biological Chemistry, 2006, 281(16): 11039-11049.
[4] MA K, SAHA P K, CHAN L, et al. Farnesoid X receptor is essential for normal glucose homeostasis [J]. Journal of Clinical Investigation, 2006, 116(4): 1102-1109.
[5] ZHANG Y Q, LEE F Y, BARRERA G, et al. Activation of the nuclear receptor FXR improves hyperglycemia and hyperlipidemia in diabetic mice [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(4): 1006-1011.
[6] RIZZO G, DISANTE M, MENCARELLI A, et al. The farnesoid X receptor promotes adipocyte differentiation and regulates adipose cell function in vivo [J]. Molecular Pharmacology, 2006, 70(4): 1164-1173.
[7] CHEN W D, WANG Y D, MENG Z, et al. Nuclear bile acid receptor FXR in the hepatic regeneration [J]. Biochimica et Biophysica Acta, 2011, 1812(8): 888-892.
[8] INAGAKI T, MOSCHETTA A, LEE Y K, et al. Regulation of antibacterial defense in the small intestine by the nuclear bile acid receptor [J]. Proceedings of the National Academy of Sciences of the United States of America, 2006,103(10): 3920-3925.
[9] GADALETA R M, VAN ERPECUM K J, OLDENBURG B, et al. Farnesoid X receptor activation inhibits inflammation and preserves the intestinal barrier in inflammatory bowel disease [J]. Gut, 2011, 60(4): 463-472.
[10] MODICA S, GADALETA R M, MOSCHETTA A. Deciphering the nuclear bile acid receptor FXR paradigm [J]. Nuclear Receptor Signal, 2010(8): e005.
[11] VERBEKE L, FARRE R, TREBICKA J, et al. Obeticholic acid, a farnesoid X receptor agonist, improves portal hypertension by two distinct pathways in hotic rats [J]. Hepatology, 2014, 59(6): 2286-2298.
[12] CIPRIANI S, MENCARELLI A, PALLADINO G, et al. FXR activation reverses insulin resistance and lipid abnormalities and protects against liver steatosis in Zucker (fa/fa) obese rats [J]. Journal of Lipid Research, 2010, 51(4): 771-784.
[13] FICKERT P, FUCHSBICHLER A, MOUSTAFA T, et al. Farnesoid X receptor critically determines the fibrotic response in mice but is expressed to a low extent in uman hepatic stellate cells and periductal myofibroblasts [J]. American Journal of Pathology, 2009, 175(6): 2392-2405.
[14] ADORINI L, PRUZANSKI M, SHAPIRO D. Farnesoid X receptor targeting to treat nonalcoholic steatohepatitis [J]. Drug Discovery Today, 2012, 17(17/18): 988-997.
[15] VERBEKE L D, MANNAERTS I, SCHIERWAGEN R, et al. Obeticholic acid, an FXR agonist, reduces hepatic fibrosis in a rat model of toxic cirrhosis [J]. Journal of Hepatology, 2015, 62(51): S479.
[16] YU D, MATTERN D L, FORMAN B M . An improved synthesis of 6α-ethylchenodeoxycholic acid (6ECDCA), a potent and selective agonist for the Farnesoid X Receptor (FXR) [J]. Steroids, 2012, 77(13): 1335-1338.
[17] STEINER A, POULSEN H W, JOLIBIS E, et al. Preparation and uses of obeticholic acid: US, 20130345188 [P/OL]. 2013-12-26. Http://www.freepatentsonline.com/y2013/0345188.html.
[18] 邱玥珩, 曹忠诚, 强晓明, 等. 奥贝胆酸及其有关物质的合成[J]. 中国医药工业杂志, 2016, 47(4): 376-379.
QIU Y H, CAO Z C, QIANG X M, et al. Synthesis of obeticholic acid and its related substances [J]. Chinese Journal of Pharmaceuticals, 2016, 47(4): 376-379.
[19] CORRIGAN M, HIRSCHFIELD G M. Primary biliary cirrhosis [J]. Medicine, 2015, 43(11): 645-647.
[20] PARÉS A. Old and novel therapies for primary biliary cirrhosis [J]. Seminars in Liver Disease, 2014, 34(3): 341-351.
[21] HIRSCHFIELD G M, GERSHWIN M E. The immunobiology and pathophysiology of primary biliary cirrhosis [J]. Annual Review of Pathology, 2013, 8(8): 303-330.
[22] SHI J, WU C, LIN Y, et al. Long-term effects of mid-dose ursodeoxycholic acid in primary biliary cirrhosis: a metaanalysis of randomized controlled trais [J]. American Journal of Gastroenterology, 2006, 101(7): 1529-1538.
[23] CORPECHOT C, ABENAVOLI L, RABAHI N, et al. Biochemical response to ursodeoxycholic acid and long-term prognosis in primary biliary cirrhosis [J]. Hepatology, 2008, 48(3): 871-877.
[24] CORPECHOT C, CHAZOUILLERES O, POUPON R. Early primary biliary cirrhosis: biochemical response to treatment and prediction of long-term outcome [J]. Journal of Hepatology, 2011, 55(6): 1361-1367.
[25] CARBONE M, MELLS G F, PELLS G, et al. Sex and age are determinants of the clinical phenotype of primary biliary cirrhosis and reponse to ursodeoxycholic acid [J]. Gastroenterology, 2013, 144(3): 560-569.
[26] SILVEIRA M G, LINDOR K D. Obeticholic acid and budesonide for the treatment of primary biliary cirrhosis [J]. Expert Opinion on Pharmacotherapy, 2014, 15(3): 365-372.
[27] INVERNIZZI P, PENCEK R, MARMON T, et al. Integrated efficacy summary for obeticholic acid in subjects with primary biliary cirrhosis [J]. Journal of Hepatology, 2015, 62: S778.
[28] HIRSCHFIELD G M, MASON A, LUKETIC V, et al. Efficacy of obeticholic acid in patients with primary bbiliary cirrhosis and inadequate response to ursodeoxycholic acid [J]. Gastroenterology, 2014, 148(4): 751-761.
[29] BUNCHORNTAVAKUL C, REDDY K R. Pruritus in chronic cholestatic liver disease [J]. Clinics in Liver Disease, 2012, 16(2): 331-346.
[30] KREMER A E, DIJK R V, LECKIE P, et al. Serum autotaxin is increased in pruritus of cholestasis, but not of other origin, and responds to therapeutic interventions [J]. Hepatology, 2012, 56:1391-1400.
[31] ALEMI F, KWON E, POOLE D P, et al. The TGR5 receptor mediates bile acid-induced itch and analgesia [J]. Journal of Clinical Investigation, 2013, 123(4): 1513-1530.
[32] DAWSON P A, KARPEN S J. Bile acids reach out to the spinal cord:new insights to the pathogenesis of itch and analgesia in cholestatic liver disease [J]. Hepatology, 2014, 59(4): 1638-1641.
[33] RIZZO G, PASSERI D, De FRANCO F, et al. Functional characterization of the semisynthetic bile acid derivative INT-767, a dual farnesoid X receptor and TGR5 agonist [J]. Molecular Pharmacology, 2010, 78(4): 617-630.
[34] LINDOR K, HANSEN B, PENCEK R, et al. A phase 3B, double blind, placebo controlled study evaluating the effect of obeticholic acid on clinical outcomes in subjects with primary biliary cirrhosis at elevated risk of pro-gression to liver transplant or death [J]. Journal of Hepatology, 2015, 62(Supplement 2): S850-S851.
[35] MARRERO J A, FONTANA R J, SU G L, et al. NAFLD may be a common underlying liver disease in patients with hepatocellular carcinoma in the United States [J]. Hepatology, 2002, 36(6): 1349-1354.
[36] PAGE J M, HARRISON S A. NASH and HCC [J]. Clinics in Liver Disease, 2009, 13(4): 631-647.
[37] SANYAL A, POKLEPOVIC A, MOYNEUR E, et al. Population-based risk factors and resource utilization for HCC: US perspective [J]. Medical Research and Opinion, 2010, 26(9): 2183-2191.
[38] AGOPIAN V G, KALDAS F M, HONG J C, et al. Liver transplantation for nonalcoholic steatohepatitis: the new epidemic [J]. Annals of Surgery, 2012, 256(4): 624-633.
[39] NEUSCHWANDER-TETRI B A, LOOMBA R, SANYAL A J, et al. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial [J]. The Lancet, 2015, 385(9972): 956-965.
[40] NEUSCHWANDER-TETRI B, SANYAL A, LOOMBA R, et al. Obeticholic acid for NASH: benefits in a high risk subgroup and the effects of concomitant tatin use [J]. Journal of Hepatology, 2015, 62(1): S272.
[41] CALKIN A C, TONTONOZ P. Transcriptional integration of metabolism by the nuclear sterol-activated receptors LXR and FXR [J]. Nature Reviews Molecular Cell Biology, 2012, 13(4): 213-224.
[42] DEAGUIARVALLIM T, TARLING E, EDWARDS P. Pleiotropic roles of bile acids in metabolism [J]. Cell Metabolism, 2013, 17(5): 657-669.
[43] POREZ G, PRAWITT J, GROSS B, et al. Bile acid receptors as targets for the treatment of dyslipidemia and cardiovascular disease [J]. Journal of Lipid Research, 2012, 53(9): 1723-1737.
[44] HAGEMAN J, HERREMA H, GROEN A K, et al. A role of the bile salt receptor FXR in atherosclerosis [J]. Arteriosclerosis Thrombosis & Vascular Biology, 2010, 30(8): 1519-1528.
[45] KOWDLEY K V, JONES D, LUKETIC V, et al. An international study evaluating the farnesoid X receptor agonist obeticholic acid as monotherapy in PBC [J]. Journal of Hepatology, 2011, 54(9): S13.
[46] FARRELL G C. The liver and the waistline: fifty years of growth [J]. Journal of Gastroenterology & Hepatology, 2009, 24(Supplement 3): S105-S118.
[47] LAM D W, LEROITH D. The worldwide diabetes epidemic [J]. Current Opinion in Endocrinology Diabetes & Obesity, 2012, 19(2): 93-96.
[48] SANYAL A J. NASH: a global health problem [J]. Hepatology Research, 2011, 41(7): 670-674.
[49] FENEBERG A, MALFERTHEINER P. Epidemic trends of obesity with impact on metabolism and digestive diseases [J]. Digestive Diseases, 2012, 30(2): 143-147.
[50] MUDALIAR S. Efficacy and safety of the farnesoid X receptor agonist obeticholic acid in patients with type 2 diabetes and nonalcoholic fatty liver disease [J]. Gastroenterology, 2013, 145(3): 574-582.
[51] RUCKERT I M, HEIER M, RATHMANN W, et al. Association between markers of fatty liver disease and impaired glucose regulation in men and women from the general population:the KORA-F4-Study [J]. PLoS ONE, 2011, 6(8): e22932.
[52] ARASE Y, SUZUKI F, IKEDA K, et al. Multivariate analysis of risk factors for the development of type 2 diabetes in nonalcoholic fatty liver disease [J]. Journal of Gastroenterology, 2009, 44(10): 1064-1070.
[53] GADALETA R M, VAN ERPECUM K J, OLDENBURG B, et al. Farnesoid X receptor activation inhibits inflammation and preserves the intestinal barrier in inflammatory bowel disease [J]. Gut, 2011, 60(4): 463-472.
[54] SAYIN S L, WAHLSTROM A, FELIN J, et al. Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, a naturally occurring FXR antagonist [J]. Cell Metabolism, 2013, 17(2): 225-235.
[55] ZHANG Y Q, YIN L Y, ANDERSON J, et al. Identification of novel pathways that control farnesoid X receptor-mediated hypocholesterolemia [J]. Journal of Biological Chemistry, 2010, 285(5): 3035-3043.
[56] FLATT B, MARTIN R, WANG T L, et al. Discovery of XL 35(WAY-362450), a highly potent, selective and orally active agonist of the farnesoid X receptor(FXR) [J]. Journal of Medicinal Chemistry, 2009, 52(4): 904-907.
[57] HARTMAN H B, GARDELL S J, PETUCCI C J, et al. Activation of farnesoid X receptor prevents atherosclerotic lesion formation in LDLR-/- and apoE(-/-) mice [J]. Journal of Lipid Research, 2009, 50(6): 1090-1100.
[58] SERFATY L, POUPON R. Therapeutic approaches for hepatobiliary disorders with ursodeoxycholic acid and bile-acid derivatives [J]. Clinics and Research in Hepatology and Gastroenterology, 2012, 36(Supplement 1): S1.
[59] ZHANG J H, NOLAN J D, KENNIE S L, et al. Potent stimulation of fibroblast growth factor 19 expression in the human ileum by bile acids [J]. American Journal of Physiology Gastrointestinal & Liver Physiology, 2013,304(10): G940-G948.
[60] WALTERS J R F, JOHNSTON I M, NOLAN J D, et al. The response of patients with bile acid diarrhoea to the farnesoid X receptor agonist obeticholic acid [J]. Alimentary Pharmacology & Therapeutics, 2015, 41(1): 54-64.
[61] NEUSCHWANDER-TETRI B A. Farnesoid X receptor agonists: what they are and how they might be used in treating liver disease [J]. Current Gastroenterology Reports, 2012, 14(1): 55-62.
[62] CARR R M, REID A E. FXR Agonists as therapeutic agents for non-alcoholic fatty liver disease [J]. Current Atherosclerosis Reports, 2015, 17(4): 500.
[63] 郭深深, 代本才, 陈瑨, 等. 胆酸酰氧基膦酸酯衍生物的合成及抗肿瘤活性[J]. 化学研究, 2016, 27(2): 183-188.
GUO S S, DAI B C, CHEN J, et al. Synthesis and antitumor activity of cholic acid-phosphonate derivatives [J]. Chemical Research, 2016, 27(2): 183-188.
[责任编辑:张普玉]
Synthetic methods and pharmaceutical properties of obeticholic acid
FENG Na1, HU Xiangzheng1,2*
(1.CollegeofFoodEngineeringandBiotechnology,TianjinUniversityofScienceandTechnology,Tianjin300457,Tianjin,China;2.CollegeofChemicalEngineeringandMaterialsScience,TianjinUniversityofScienceandTechnology,Tianjin300457,Tianjin,China)
Obeticholic acid (OCA), a 6-ethyl derivative of chenodeoxycholic acid, is an effective farnesoid X(FX) nuclear receptor agonist. OCA has a good therapeutic effect on nonalcoholic fatty liver and primary biliary cirrhosis to result in broad application prospects in clinical practice. Due to it has superior performance in clinical practice, the clinical application and synthesis of OCA are the focus of biological medicine. In recent years, a great progress has been got in OCA’s synthetic methods and technology research, however, there is no method can be applied to large-scale production. This paper reviews the current status of clinical research and synthesis methods of OCA.
obeticholic acid; liver and gallbladder diseases; pharmaceutical properties; synthetic method
2017-01-17.
天津市科技计划项目 (14ZXCXSY00109,14RCHZSY 00159).
冯 娜 (1991-), 女, 硕士生, 研究方向为天然产物的提取与开发.*
, E-mail:huxzh@tust.edu.cn.
O629
A
1008-1011(2017)03-0395-08

