新型5-苯亚甲基-3,4-二卤-2(5H)-呋喃酮衍生物的合成与生物活性
王 芳,江 瑾,于艳玲,吕 健,王万春
(1.青岛市口腔医院,山东 青岛 266000; 2. 青岛市中心医院,山东 青岛 266042)
新型5-苯亚甲基-3,4-二卤-2(5H)-呋喃酮衍生物的合成与生物活性
王 芳1*,江 瑾2,于艳玲1,吕 健1,王万春1
(1.青岛市口腔医院,山东 青岛 266000; 2. 青岛市中心医院,山东 青岛 266042)
以粘卤酸为起始原料,经还原缩合、再缩合、成醚反应合成了15个5-苯亚甲基-3,4-二卤-2(5H)-呋喃酮衍生物4a-4o,其结构经1H-NMR、13C-NMR、MS谱确证. 研究所有化合物对细菌脂多糖LPS诱导RAW264.7细胞的抗炎作用. 初步活性结果显示,4a-4o对于LPS诱导RAW264.7细胞所产生的NO有抑制作用,其中化合物4h和4i的NO抑制率比较高. 生物活性的研究结果表明,卤代呋喃酮结构、吡啶环上连有给电子基团都可以提高化合物的体外抗炎生物活性,为临床上炎症等相关疾病的治疗提供新的药物设计和研究思路.
5-苯亚甲基-3,4-二卤-2(5H)-呋喃酮衍生物;合成;生物活性
一般来说,炎症反应是动物机体对各种致炎因子及局部损伤所产生的防御性反应. 临床上,炎症是最常见的病理过程,是许多疾病的病理基础,局部表现为红、肿、热、痛及功能障碍,并伴有不同程度的全身反应. 当致炎因子如细菌感染宿主时,会导致机体组织受损,进而可以激活和募集大量免疫细胞,如巨噬细胞,激活后的巨噬细胞可以产生大量的一氧化氮和超氧阴离子,还会产生很多促炎性细胞因子,如TNF-α、IL-12、IL-6等. 另外,也会异常激活巨噬细胞中炎症相关的信号通路,如NF-κB、MAPK等[1]. 这些变化都可使慢性感染的宿主组织引起炎症反应,并导致疾病的症状加重和永久性器官损伤[2].
过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma, PPARγ) 在体内广泛分布,它通过与配体结合被激活后,具有多种生物学功能[3]. 研究数据证明,在临床上,PPARγ通过与噻唑烷二酮类合成配体结合活化,参与调节体内多种与炎症反应相关疾病的病理生理过程[4]. 其中,已有的文献研究报道,PPARγ激动剂罗格列酮在心、肺、肾、胃肠道等诸多器官的急性、慢性炎症反应中都具有抗炎作用[5]. SASAKI等[6]研究发现,罗格列酮可以抑制TNF-α介导的大鼠溃疡性结肠炎中黏附因子的表达量. CUZZOCREA等[7]研究逐渐发现,大鼠足跖内注射角叉菜胶,构建大鼠足肿胀模型,给予罗格列酮治疗,会抑制COX-2、NO等炎症介质的作用,进而减轻大鼠足肿胀的严重程度和面积来发挥抗炎作用. 另外,研究也证实,由细菌引起的肺上皮细胞炎症反应能被罗格列酮所阻断[8-9]. 因此,以罗格列酮为模板化合物进行结构优化改造极有可能发现新型抗炎药物.
临床研究数据显示,PPARγ激动剂罗格列酮在改善糖尿病患者血脂等方面的疗效低于吡格列酮[10]. 同属噻唑烷二酮类化合物,二者的结构差异仅在于吡啶基连接的侧链部分,因此我们推测对于罗格列酮吡啶基侧链部分的改造有利于提高该类药物的活性. 据报道,海洋红藻Delisea pulchra能够产生一种卤代呋喃酮化合物,通过阻断细菌的群体感应系统,使细菌不能在Delisea pulchra表面产生群聚,进而抑制细菌的生长[11]. 众所周知,细菌长期慢性感染是引起炎症疾病的重要因素,因此我们设想引入卤代呋喃酮结构有利于提高该类化合物的抗炎活性.
总之,本研究通过改善吡啶基侧链部分,引入具有抑制细菌群体感应系统的活性药效团3,4-二卤-2(5H)-呋喃酮结构[12-13],设计合成新型5-苯亚甲基-3,4-二卤-2(5H)-呋喃酮衍生物4a-4o,见图1. 以粘卤酸为起始原料,在NaBH4和浓H2SO4作用下生成3,4-二卤-2(5H)-呋喃酮2[14]. 然后与苯甲醛类试剂进行Knoevenagel缩合反应,生成中间体3a-3f[15]. 将3a-3f与吡啶醇类试剂进行Mitsunobu成醚反应合成目标化合物4a-4o[16],化合物的合成见图2.
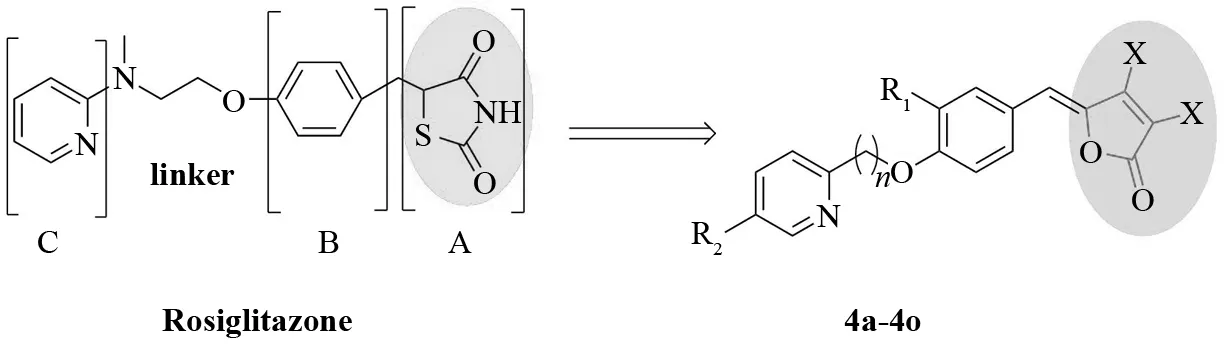
图1 4a-4o设计策略Fig.1 Design strategy for 4a-4o

图2 目标化合物4a-4o的合成路线Fig.2 Synthetic route of target compounds 4a-4o
1 实验部分
1.1 仪器与试剂
Bruker-AV300MHz型核磁共振仪(瑞士Bruker公司),内标物TMS,3a-3f溶剂为DMSO-d6,4a-4o溶剂为CDCl3;API2000型质谱仪(美国应用生物系统公司);旋转蒸发仪(日本Eyela公司);DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);CZCL-A数显智能控温磁力搅拌器(江苏金坛医疗仪器厂);循环水式真空泵(巩义市英裕予华仪器厂);分析天平(上海精密科学仪器有限公司);WRS-1B数字熔点测定仪(上海精密科学仪器有限公司);DLSB低温冷却液循环泵(郑州长城科工贸有限公司);低温反应仪(郑州长城科工贸有限公司). 所有试剂均为分析纯.
1.2 化合物的合成
1.2.1 3,4-二卤-2(5H)-呋喃酮(2)
称取粘溴酸或粘氯酸(1.0 mmol)加到35 mL CH3OH中,低温下缓慢加入NaBH4(1.7 mmol),反应15 min. 再缓慢滴加H2SO4(1.3 mmol),继续反应15 min,停止反应. 旋蒸,加入二氯甲烷和水萃取,合并有机相,饱和碳酸氢钠洗涤,无水硫酸钠干燥,旋蒸,粗品湿法上样,硅胶柱层析(石油醚和乙酸乙酯体积比为10∶1)过柱,得到白色固体(产率99.1%). 实验结果与文献报道相一致[17].
1.2.2 (Z)-3,4-二溴-5-(4-羟基-3-甲氧基苯亚甲基)-2(5H)-呋喃酮(3a)
称取3,4-二溴-2(5H)-呋喃酮(1.0 mmol)和香草醛(1.0 mmol)加到25 mL甲苯中,氮气保护下缓慢滴加2-甲基哌啶1.3 mL,再滴加冰醋酸1.3 mL,滴毕,温度调至125 ℃,TLC检测反应至3,4-二溴-2(5H)-呋喃酮反应完全,停止反应. 反应液用无水甲醇溶解,旋蒸,黑色粗品干法上样,硅胶柱层析(石油醚和乙酸乙酯的体积比为12∶1)过柱,得到黄色固体(产率32.1%).
分别以乙基香兰素、对羟基苯甲醛和3,4-二溴-2(5H)-呋喃酮投料,同法操作,制得3b和3c.
1.2.3 (Z)-3,4-二氯-5-(4-羟基-3-甲氧基苯亚甲基)-2(5H)-呋喃酮(3d)的合成
称取3,4-二氯-2(5H)-呋喃酮(1.0 mmol)和香草醛(1.0 mmol)加到30 mL甲苯中,氮气保护下缓慢滴加2-甲基哌啶1.3 mL,再滴加冰醋酸1.3 mL,滴毕,将温度调至125 ℃,TLC检测反应至3,4-二氯-2(5H)-呋喃酮反应完全,停止反应. 反应液用无水甲醇溶解,旋蒸,得到黑色粗产物,干法上样,硅胶柱层析(石油醚和乙酸乙酯的体积比为12∶1)过柱,得到黄色固体(产率36.1%).
分别以乙基香兰素、对羟基苯甲醛和3,4-二氯-2(5H)-呋喃酮投料,同法操作,制得3e和3f.
1.2.4 (Z)-3,4-二溴-5-(4-(2-吡啶基乙氧基)苯亚甲基)-2(5H)-呋喃酮(4a)
称取3c(1.0 mmol)和三苯基膦(1.5 mmol)加到圆底烧瓶中,抽真空、充氮气,氮气保护下加入3 mL四氢呋喃,再加入2-吡啶乙醇(2.0 mmol),5 min后缓慢滴加偶氮二甲酸二乙酯DEAD(1.5 mmol),滴毕继续反应30 min,转移至室温,搅拌反应,TLC检测反应至3c反应完全,停止反应. 加入少量乙醚,有黄色沉淀析出,直接抽滤干燥,得到黄色固体(产率35.1%).
以2-吡啶甲醇和3c投料,同法操作,制得4b.
以5-乙基-2-吡啶乙醇和3c投料,同法操作,制得4g.
分别以2-吡啶乙醇、2-吡啶甲醇、5-乙基-2-吡啶乙醇和3a投料,同法操作,制得4c、4f和4h.
分别以2-吡啶乙醇、2-吡啶甲醇、5-乙基-2-吡啶乙醇和3b投料,同法操作,制得4d、4e和4i.
1.2.5 (Z)-3,4-二氯-5-(4-(2-吡啶基甲氧基)苯亚甲基)-2(5H)-呋喃酮(4j)的合成
称取3f(1.0 mmol)和三苯基膦(1.5 mmol)加入到两口圆底烧瓶中,抽真空、充氮气,反复操作4次,在氮气保护下加入3 mL四氢呋喃,再加入2-吡啶甲醇(2.0 mmol),5 min后缓慢滴加偶氮二甲酸二乙酯DEAD(1.5 mmol),滴毕继续反应30 min,再转移至室温,搅拌反应,TLC检测反应至3f反应完全,停止反应. 加入少量乙醚,有黄色沉淀析出,直接抽滤干燥,得到黄色固体(产率71.0%).
分别将3d、3e和2-吡啶甲醇投料,同法操作,制得4k和4l.
分别将3f、3d、3e和2-吡啶乙醇投料,同法操作,制得4m、4n和4o.
1.3 目标化合物的药理活性测试
超净工作台(苏净集团安泰公司);微量移液器(德国Eppendorf公司);旋涡混合器XW-80型(上海第一医学仪器厂);恒温水浴锅(上海医用恒温设备厂);HHW21-600低温高速离心机(德国Beckman公司);多功能酶标仪(美国Bio-Rad公司);细菌浊度仪(郑州南北仪器设备有限公司);紫外可见分光光度计(上海谱元仪器有限公司);HPS-250生化恒温培养箱(哈尔滨市东明医疗仪器厂);ZHWY-2102C恒温培养振荡器(上海智城分析仪器制造有限公司).
小鼠腹腔巨噬细胞RAW264.7来自于中科院上海生命科学研究院细胞库. 阳性对照药罗格列酮和吲哚美辛来自于中国食品药品检定研究所.
将RAW264.7细胞悬液以每孔5×104个/100 μL接种于96孔板. 设置空白组(细胞培养液)、对照组(细胞培养液和LPS)和加药组(细胞培养液,药液和LPS). 培养24 h后,加入不同药物(浓度均为10 μmol/L)处理2 h,再加入LPS(浓度为100 ng/mL),培养48 h. 取上清液100 μL,加入等体积的Griess试剂,混匀后读取酶标仪540 nm处的吸光值,以罗格列酮和吲哚美辛为阳性对照[18],计算目标产物对NO释放的抑制率[NO抑制率/% = (OD对照组-OD加药组) / (OD对照组-OD空白组) ×100],实验平行3次,结果以平均值±标准差表示.
2 结果与讨论
2.1 化学合成部分
在目标化合物4a-4o的合成步骤中,成醚反应选择了Mitsunobu反应,它本身是双分子亲核取代反应,具有反应产率较高、立体选择性较高、产物可在少量乙醚溶剂中析出而无需过硅胶柱分离等优点[19]. 这些化合物的核磁共振氢谱、碳谱和质谱如下所示.
3a:黄色固体;1H NMR (300 MHz, DMSO-d6)δ9.88 (s, 1H), 7.44 (s, 1H), 7.39 (d,J= 1.8 Hz, 1H), 6.87 (d,J= 1.8 Hz, 1H), 6.58 (s, 1H), 3.81 (s, 3H);13C NMR (75 MHz, DMSO-d6)δ163.9, 149.8, 148.2, 144.0, 138.0, 125.8, 123.9, 116.6, 115.2, 114.9, 111.2, 56.1;ESI-MSm/z: 375.4 [M-H]-.
3b:红色固体;1H NMR (300 MHz, DMSO-d6)δ9.83 (s, 1H), 7.44 (s, 1H), 7.40 (d,J= 1.8 Hz, 1H), 6.90 (d,J= 1.8 Hz, 1H), 6.58 (s, 1H), 4.08 (q,J= 7.2 Hz, 2H), 1.36 (t,J= 7.2 Hz, 3H);13C NMR (75 MHz, DMSO-d6)δ163.9, 150.0, 147.4, 144.0, 138.0, 125.9, 124.0, 116.7, 116.4, 114.9, 111.2, 64.4, 15.1;ESI-MSm/z: 389.4 [M-H]-.
3c:黄色固体;1H NMR (300 MHz, DMSO-d6)Ztypeδ10.28 (s, 1H), 7.72 (d,J= 8.7 Hz, 2.07H), 6.86 (d,J= 8.7 Hz, 2.06H), 6.57 (s, 0.99H);Etypeδ10.28 (s, 1H), 7.35 (d,J= 8.8 Hz, 0.10H), 7.16 (s, 0.09H), 6.81 (d,J= 8.8 Hz, 0.12H);13C NMR (75 MHz, DMSO-d6)δ163.9, 160.1, 143.9, 138.0, 133.5, 123.6, 116.7, 114.6, 111.3;ESI-MSm/z: 345.2 [M-H]-.
3d:黄色固体;1H NMR (300 MHz, DMSO-d6)δ9.91 (s, 1H), 7.41 (d,J= 1.8 Hz, 1H), 7.37 (d,J= 1.8 Hz, 1H), 6.90 (d, 1H), 6.62 (s, 1H), 3.81 (s, 3H);13C NMR (75 MHz, DMSO-d6)δ162.5, 149.8, 148.3, 142.5, 141.4, 126.0, 123.7, 117.2, 116.6, 115.2, 113.7, 56.1;ESI-MSm/z: 285.3 [M-H]-.
3e:红色固体;1H NMR (300 MHz, DMSO-d6)δ9.83 (s, 1H), 7.40 (d,J= 1.8 Hz, 1H), 7.35 (d,J= 1.8 Hz, 1H), 6.90 (d, 1H), 6.62 (s, 1H), 4.07 (q,J= 7.2 Hz, 2H), 1.37 (t,J= 7.2 Hz, 3H);13C NMR (75 MHz, DMSO-d6)δ162.5, 150.1, 147.4, 142.5, 141.3, 126.0, 123.7, 117.2, 116.7, 116.5, 113.7, 64.4, 15.1;ESI-MSm/z: 299.4 [M-H]-.
3f:黄色固体;1H NMR (300 MHz, DMSO-d6)Ztypeδ10.27 (s, 1H), 7.71 (d,J= 8.7 Hz, 1.98H), 6.88 (d,J= 8.7 Hz, 1.96H), 6.62 (s, 0.97H);Etypeδ10.27 (s, 1H), 7.40 (d,J= 9.0 Hz, 0.10H), 7.31 (s, 0.08H), 6.82 (d,J= 9.0 Hz, 0.12H);13C NMR (75 MHz, DMSO-d6)δ162.6, 160.1, 142.5, 141.3, 133.6, 123.3, 117.2, 116.7, 113.4;ESI-MSm/z: 255.2 [M-H]-.
4a:黄色固体;1H NMR (300 MHz, CDCl3)δ8.56 (d,J= 5.6 Hz, 1H), 7.74 (d,J= 11.6 Hz, 2H), 7.62 (dd,J= 10.4, 2.4 Hz, 1H), 7.28 (d,J= 10.4 Hz, 1H), 7.16 (dd,J= 5.6, 2.4 Hz, 1H), 6.92 (d,J= 11.6 Hz, 2H), 6.37 (s, 1H), 4.43 (t,J= 8.8 Hz, 2H), 3.28 (t,J= 8.8 Hz, 2H);13C NMR (75 MHz, CDCl3)δ163.5, 160.5, 158.0, 149.4, 144.0, 137.2, 136.3, 132.8, 124.6, 123.7, 121.6, 115.1, 114.2, 111.3, 67.2, 37.8;ESI-MSm/z: 450.2 [M+H]+.
4b:黄色固体;1H NMR (300 MHz, CDCl3)δ8.61 (d,J= 4.8 Hz, 1H), 7.77 (d,J= 9.0 Hz, 2H), 7.73 (d,J= 7.8, 4.8 Hz, 1H), 7.50 (d,J= 7.8 Hz, 1H), 7.25~7.21 (m, 1H), 7.02 (d,J= 9.0 Hz, 2H), 6.39 (s, 1H), 5.25 (s, 2H);13C NMR (75 MHz, CDCl3)δ163.5, 159.9, 156.6, 149.4, 144.4, 137.2, 136.9, 133.0, 125.2, 122.8, 121.4, 115.5, 114.0, 111.8, 70.7;ESI-MSm/z: 436.2 [M+H]+.
4c:黄色固体;1H NMR (300 MHz, CDCl3)δ8.56 (d,J= 4.5 Hz, 1H), 7.68 (td,J= 7.5, 1.5 Hz, 1H), 7.41 (d,J= 1.8 Hz, 1H), 7.35 (d,J= 7.5 Hz, 1H), 7.29 (dd,J= 8.4, 1.8 Hz, 1H), 7.21 (dd,J= 4.5, 1.5 Hz, 1H), 6.93 (d,J= 8.4 Hz, 1H), 6.36 (s, 1H), 4.48 (t,J= 6.9 Hz, 2H), 3.9 (s, 3H), 3.38 (t,J= 6.9 Hz, 2H);13C NMR (75 MHz, CDCl3)δ163.5, 160.3, 157.5, 150.3, 149.5, 148.5, 144.3, 137.3, 125.8, 125.2, 124.3, 122.0, 114.5, 113.5, 112.9, 111.6, 68.1, 56.1, 37.4;ESI-MSm/z: 480.2 [M+H]+.
4d:黄色固体;1H NMR (300 MHz, CDCl3)δ8.55 (d,J= 4.8 Hz, 1H), 7.63 (td,J= 7.7, 1.8 Hz, 1H), 7.41 (d,J= 2.1 Hz, 1H), 7.34 (d,J= 7.7 Hz, 1H), 7.32~7.27 (m, 1H), 7.16 (dd,J= 4.8, 1.8 Hz, 1H), 6.93 (d,J= 8.7 Hz, 1H), 6.36 (s, 1H), 4.45 (t,J= 6.8 Hz, 2H), 4.07 (q,J= 7.0 Hz, 2H), 3.33 (t,J= 6.8 Hz, 2H), 1.44 (t,J= 7.0 Hz, 3H);13C NMR (75 MHz, CDCl3)δ163.5, 158.2, 150.9, 149.3, 148.9, 144.1, 137.2, 136.4, 125.8, 125.1, 124.0, 121.7, 115.4, 114.6, 113.1, 111.4, 68.1, 64.8, 37.8, 14.7;ESI-MSm/z: 494.2 [M+H]+.
4e:黄色固体;1H NMR (300 MHz, CDCl3)δ8.58 (d,J= 4.5 Hz, 1H), 7.71 (td,J= 7.8, 1.8 Hz, 1H), 7.56 (d,J= 7.8 Hz, 1H), 7.44 (d,J= 1.8 Hz, 1H), 7.26-7.17 (m, 2H), 6.90 (d,J= 8.4 Hz , 1H), 6.34 (s, 1H), 5.31 (s, 2H), 4.17 (q,J= 7.0 Hz, 2H), 1.50 (t,J= 7.0 Hz, 3H);13C NMR (75 MHz, CDCl3)δ163.4, 156.8,150.1, 149.0, 144.3, 137.2, 136.9, 125.5, 122.7, 121.1, 114.91, 114.4, 113.7, 111.6, 71.3, 64.7, 14.8;ESI-MSm/z: 480.3 [M+H]+.
4f:黄色固体;1H NMR (300 MHz, CDCl3)δ8.58 (d,J= 4.5 Hz, 1H), 7.70 (td,J= 7.7, 1.8 Hz, 1H), 7.52 (d,J= 7.7 Hz, 1H), 7.43 (d,J= 1.8 Hz, 1H), 7.25~7.16 (m, 2H), 6.90 (d,J= 8.4 Hz, 1H), 6.35 (s, 1H), 5.31 (s, 2H), 3.95 (s, 3H);13C NMR (75 MHz, CDCl3)δ163.4, 156.6, 149.8, 149.6, 149.2, 144.3, 137.2, 136.9, 125.5, 125.5, 122.8, 121.3, 114.3, 113.3, 113.3, 111.7, 71.3, 56.1; ESI-MSm/z: 468.3 [M+H]+.
4g:黄色固体;1H NMR (300 MHz, CDCl3)δ8.40 (s, 1H), 7.73 (d,J= 9.0 Hz, 2H), 7.47 (d,J= 7.8 Hz, 1H), 7.19 (d,J= 7.8 Hz, 1H), 6.93 (d,J= 9.0 Hz, 2H), 6.38 (s, 1H), 4.40 (t,J= 6.7 Hz, 2H), 3.25 (t,J= 6.7 Hz, 2H), 2.64 (q,J= 7.6 Hz, 2H), 1.25 (t,J= 7.6 Hz, 3H);13C NMR (75 MHz, CDCl3)δ163.5, 160.7, 155.3, 148.9, 144.1, 137.3, 136.0, 133.0, 132.1, 124.6, 123.4, 115.1, 114.4, 111.5, 67.4, 37.3, 25.8, 15.5;ESI-MSm/z: 478.3 [M+H]+.
4h:黄色固体;1H NMR (300 MHz, CDCl3)δ8.39 (s, 1H), 7.47 (d,J= 7.9 Hz, 1H), 7.42 (d,J= 2.1 Hz, 1H), 7.30 (dd,J= 8.4, 2.1 Hz, 1H), 7.22 (d,J= 7.9 Hz, 1H), 6.94 (d,J= 8.4 Hz, 1H), 6.38 (s, 1H), 4.46 (t,J= 7.1 Hz, 2H), 3.90 (s, 3H), 3.32 (t,J= 7.1 Hz, 2H), 2.64 (q,J= 7.6 Hz, 2H), 1.25 (t,J= 7.6 Hz, 3H);13C NMR (75 MHz, CDCl3)δ163.5, 155.1, 150.5, 149.5, 148.8, 144.2, 137.3, 137.2, 136.0, 125.7, 125.0, 123.5, 114.5, 113.5, 112.8, 111.5, 68.3, 56.1, 37.2, 25.7, 15.3;ESI-MSm/z: 508.3 [M+H]+.
4i:黄色固体;1H NMR (300 MHz, CDCl3)δ8.39 (s, 1H), 7.47 (d,J= 7.5 Hz, 1H), 7.41 (d,J= 1.5 Hz, 1H), 7.30~7.27 (m, 2H), 6.92 (d,J= 8.4 Hz, 1H), 6.36 (s, 1H), 4.43 (t,J= 6.8 Hz, 2H), 4.07 (q,J= 7.0 Hz, 2H), 3.31 (t,J= 6.8 Hz, 2H), 2.64 (q,J= 7.6 Hz, 2H), 1.44 (t,J= 7.0 Hz, 3H), 1.24 (t,J= 7.6 Hz, 3H);13C NMR (75 MHz, CDCl3)δ163.5, 155.3, 151.0, 148.9, 148.8, 144.1, 137.2, 136.9, 135.9, 125.8, 125.0, 123.7, 115.4, 114.6, 113.1, 111.4, 68.2, 64.8, 37.4, 25.7, 15.3, 14.7;ESI-MSm/z: 522.2 [M+H]+.
4j:黄色固体;1H NMR (300 MHz, CDCl3)δ8.60 (d,J= 4.8 Hz, 1H), 7.76 (d,J= 8.9 Hz, 2H), 7.70 (m, 1H), 7.50 (d,J= 7.8 Hz, 1H), 7.25~7.21 (m, 1H), 7.02 (d,J= 8.9 Hz, 1H), 6.34 (s, 1H), 5.24 (s, 1H);13C NMR (75 MHz, CDCl3)δ162.4, 159.9, 156.4, 149.3, 142.6, 141.9, 136.9, 133.0, 124.9, 122.8, 121.3, 118.2, 115.5, 112.5, 70.7;ESI-MSm/z: 348.1 [M+H]+.
4k:黄色固体;1H NMR (300 MHz, CDCl3)δ8.61 (d,J= 4.5 Hz, 1H), 7.73 (td,J= 7.8, 1.8 Hz, 1H), 7.55 (d,J= 7.8 Hz, 1H), 7.45 (d,J= 1.8 Hz, 1H), 7.27 (d,J= 8.4, 1.8 Hz, 1H), 7.24 (d,J= 1.8 Hz, 1H), 6.93 (d,J= 8.4 Hz, 1H), 6.34 (s, 1H), 5.34 (s, 2H), 3.98 (s, 3H);13C NMR (75 MHz, CDCl3)δ162.3, 156.5, 149.8, 149.6, 149.2, 142.6, 142.0, 136.9, 125.5, 125.2, 122.8, 121.3, 118.2, 113.4, 113.3, 112.8, 71.3, 56.1;ESI-MSm/z: 378.2 [M+H]+.
4l:黄色固体;1H NMR (300 MHz, CDCl3)δ8.61 (d,J= 4.5 Hz, 1H), 7.74 (td,J= 7.8, 1.8 Hz, 1H), 7.58 (d,J= 7.8 Hz, 1H), 7.47 (d,J= 1.8 Hz, 1H), 7.26~7.23 (m, 2H), 6.93 (d,J= 8.4 Hz, 1H), 6.34 (s, 1H), 5.34 (s, 2H), 4.20 (q,J= 7.0 Hz, 2H), 1.53 (t,J= 7.0 Hz, 3H);13C NMR (75 MHz, CDCl3)δ162.3, 156.8, 150.2, 149.1, 142.6, 141.9, 136.9, 125.5, 125.3, 122.7, 121.1, 118.2, 114.9, 113.7, 112.9, 112.4, 71.3, 64.7, 14.7;ESI-MSm/z: 392.4 [M+H]+.
4m:黄色固体;1H NMR (300 MHz, CDCl3)δ8.58 (dd,J= 4.9, 0.8 Hz, 1H), 7.74 (d,J= 8.8 Hz, 2H), 7.66 (dd,J= 7.5, 2.1 Hz, 1H), 7.36 (m, 1H), 7.19 (td,J= 7.5, 4.9, 0.8 Hz, 1H), 6.95 (d,J= 8.8 Hz, 2H), 6.36 (s, 1H), 4.46 (d,J= 6.6 Hz, 2H), 3.30 (t,J= 6.6 Hz, 2H);13C NMR (75 MHz, CDCl3)δ162.5, 160.5, 158.0, 149.4, 142.7, 141.7, 136.5, 132.9, 124.4, 123.8, 121.7, 117.9, 115.2, 112.8, 67.2, 37.8;ESI-MSm/z: 362.2 [M+H]+.
4n:黄色固体;1H NMR (300 MHz, CDCl3)δ8.57 (d,J= 4.8 Hz, 1H), 7.65 (td,J= 7.7, 2.0 Hz, 1H), 7.40 (d,J= 2.1 Hz, 1H), 7.33 (d,J= 7.7 Hz, 1H), 7.30 (d,J= 8.7, 2.1 Hz, 1H), 7.22~7.15 (m, 1H), 6.95 (d,J= 8.7 Hz, 1H), 6.34 (s, 1H), 4.49 (t,J= 7.0 Hz, 2H), 3.90 (s, 3H), 3.37 (t,J= 7.0 Hz, 2H);13C NMR (75 MHz, CDCl3)δ162.4, 157.9, 150.4, 149.5, 149.1, 142.6, 141.8, 136.7, 125.7, 124.8, 124.0, 121.8, 113.6, 113.0, 112.8, 112.6, 68.1, 56.1, 37.6;ESI-MSm/z: 392.3 [M+H]+.
4o:黄色固体;1H NMR (300 MHz, CDCl3)δ8.54 (d,J= 4.8 Hz, 1H), 7.62 (td,J= 7.5, 1.5 Hz, 1H), 7.39 (d,J= 1.8 Hz, 1H), 7.33 (d,J= 7.5 Hz, 1H), 7.29 (dd,J= 8.4, 1.8 Hz,1H), 7.15 (dd,J= 4.8, 1.5 Hz, 1H), 6.92 (d,J= 8.4 Hz, 1H), 6.31 (s, 1H), 4.45 (t,J= 6.8 Hz, 2H), 4.06 (q,J= 7.0 Hz, 2H), 3.33 (t,J= 6.8 Hz, 2H), 1.43 (t,J= 7.0 Hz, 3H);13C NMR (75 MHz, CDCl3)δ162.4, 158.2, 150.9, 149.3, 148.9, 142.6, 141.7, 136.3, 125.8, 124.8, 124.0, 121.6, 117.9, 115.4, 113.1, 113.1, 68.1, 64.8, 37.8, 14.7;ESI-MSm/z: 406.4 [M+H]+.
2.2 目标化合物对NO的抑制活性
以小鼠腹腔巨噬细胞RAW264.7为供试对象,采用Griess试剂法测定目标化合物对于LPS诱导RAW264.7细胞NO释放的抑制作用,结果见表3. 根据实验结果可以得出,与LPS组相比,阳性药和目标化合物对于LPS诱导RAW264.7细胞的NO抑制率大小不等,具有显著性差异(P< 0.05). 化合物4j和4m的NO抑制率与罗格列酮相当,其余目标化合物的NO抑制率均高于罗格列酮;化合物4j、4k和4m的NO抑制率低于吲哚美辛,4b和4f的NO抑制率与吲哚美辛相当,其余10个化合物的NO抑制率高于吲哚美辛. 在所有目标化合物中,4h和4i这两个化合物的NO抑制率比较高,分别是(75.8±4.3)%和(80.1±4.1)%,均超过70%,值得进一步的研究.
根据NO抑制率实验结果,分析构效关系如下:引入3,4-二卤-2(5H)-呋喃酮结构有利于提高化合物NO抑制活性;中间苯环上R1是给电子取代基时,目标化合物表现出较好的NO抑制活性;当R1取代基相同时,两个碳原子连接时的NO抑制率大于一个碳原子连接时的NO抑制率;当R1取代基相同、n相同时,吡啶环上是给电子取代基时,目标化合物表现出较好的NO抑制活性.

表1 化合物4a-4o 的NO抑制率Table 1 NO Inhibition of 4a-4o
*P< 0.05表示加药组与对照组相比,有显著性差异;**P< 0.01表示加药组与对照组相比,有非常显著性的差异.
3 结论
本文以粘溴酸或粘氯酸为原料,设计合成了15个未见文献报道的含3,4-二卤-2(5H)-呋喃酮结构片段的衍生物. 基于生物活性的研究结果可知,目标化合物4a-4o对LPS诱导RAW264.7细胞所产生的炎症因子NO有抑制作用,其中4h和4i的NO抑制率较高. 因此,从结构上来看,3,4-二卤-2(5H)-呋喃酮结构及吡啶环上连有给电子取代基可以显著提高化合物的体外抗炎生物活性,为临床上炎症等相关疾病的治疗提供新的药物设计的思路,但其具体的构效关系、作用机制与意义有待进一步研究.
[1] LI W, HUANG H, ZHANG Y, et al. Anti-inflammatory effect of tetrahydrocoptisine from Corydalis impatiens is a function of possible inhibition of TNF-alpha, IL-6 and NO production in lipopolysaccharide-stimulated peritoneal macrophages through inhibiting NF-kappaB activation and MAPK pathway [J]. European Journal of Pharmacology, 2013(1/3), 715: 62-71.
[2] SMITH R S, HARRIS S G, PHIPPS R, et al. The Pseudomonas aeruginosa quorum-sensing molecule N-(3-oxododecanoyl)homoserine lactone contributes to virulence and induces inflammation in vivo [J]. Journal of Bacteriology, 2002, 184(4): 1132-1139.
[3] LEHRKE M, LAZAR M A. The many faces of PPARgamma [J]. Cell, 2005, 123(6): 993-999.
[4] WADA K, KAMISAKI Y. Anti-inflammatory effect of PPARgamma agonists: basics and clinical applications [J]. Nihon Rinsho Japanese Journal of Clinical Medicine, 2010, 68(2): 278-283.
[5] ESPOSITO K, CIOTOLA M, MERANTE D, et al. Rosiglitazone cools down inflammation in the metabolic syndrome [J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2006, 26(6): 1413-1414.
[6] SASAKI M, JORDAN P, WELBOURNE T, et al. Troglitazone, a PPAR-gamma activator prevents endothelial cell adhesion molecule expression and lymphocyte adhesion mediated by TNF-alpha [J]. BMC Physiology, 2005, 5(1): 3-7.
[7] CUZZOCREA S, PISANO B, DUGO L, et al. Rosiglitazone, a ligand of the peroxisome proliferator-activated receptor-gamma, reduces acute inflammation [J]. Euro-pean Journal of Pharmacology, 2004, 483(1): 79-93.
[8] JAHOOR A, PATEL R, BRYAN A, et al. Peroxisome proliferator-activated receptors mediate host cell proinflammatory responses to Pseudomonas aeruginosa autoinducer [J]. Journal of Bacteriology, 2008, 190(13): 4408-4415.
[9] CUZZOCREA S, PISANO B, DUGO L, et al. Rosiglitazone, a ligand of the peroxisome proliferator-activated receptor-gamma, reduces acute inflammation [J]. European Journal of Pharmacology, 2004, 483(1): 79-93.[10] KRENTZ A. Thiazolidinediones: effects on the development and progression of type 2 diabetes and associated vascular complications [J]. Diabetes/Metabolism Research and Reviews, 2009, 25(2): 112-126.
[11] MANEFIELD M, DE NYS R, KUMAR N, et al. Evidence that halogenated furanones from Delisea pulchra inhibit acylated homoserine lactone (AHL)-mediated gene expression by displacing the AHL signal from its receptor protein [J]. Microbiology, 1999, 145(2): 283-291.
[12] GUO J L, LI B Z, CHEN W M, et al. Synthesis of substituted 1H-pyrrol-2(5H)-ones and 2(5H)-furanones as inhibitors of Pseudomonas aeruginosa biofilm [J]. Letters in Drug Design & Discovery, 2009, 6(2): 107-113.
[13] 陈卫民, 叶春强, 王玉真, 等. 基于稳定的膦叶立德合成2(5H)-呋喃酮和2(5H)-吡咯酮作为细菌群体感应抑制剂的研究 [J]. 化学通报, 2009, 72(5): 438-443.
CHEN W M, YE C Q, WANG Y Z, et al. Syntheses of 2(5H)-furanones and 2(5H)-pyrrolones as the bacterial quorum sensing inhibitor by using the stabilized phosphorus ylide [J]. Chemistry Bulletin, 2009, 72(5): 438-443.
[14] LIU G Y, GUO B Q, CHEN W N, et al. Synthesis, molecular docking, and biofilm formation inhibitory activity of 5-substituted 3,4-dihalo-5H-furan-2-one derivatives on Pseudomonas aeruginosa [J]. Chemical Biology & Drug Design, 2012, 79(5): 628-638.
[15] WU Y, KARNA S, CHOI C H, et al. Synthesis and biological evaluation of novel thiazolidinedione analogues as 15-hydroxyprostaglandin dehydrogenase inhibitors [J]. Journal of Medicinal Chemistry, 2011, 54(14): 5260-5264.
[16] SWAMY K C, KUMAR N N, BALARAMAN E, et al. Mitsunobu and related reactions: advances and applications [J]. Chemical Reviews, 2009, 109(6): 2551-2651.
[17] BELLINA F, ROSSI R. An efficient and inexpensive multigram synthesis of 3,4-dibromo- and 3,4-dichlorofuran-2(5H)-one [J]. Synthesis, 2007, 26(12): 1887-1889.
[18] KUMAR SA, LOHANI M, PARTHSARTHY R. Synthesis, characterization and anti-inflammatory activity of some 1, 3,4-oxadiazole derivatives [J]. Iranian Journal of Pharmaceutical Research, 2013, 12(2): 319-323.
[19] 张庆文, 周后元, 尤启冬. Mitsunobu反应及其在药物化学中的应用 [J]. 中国医药工业杂志, 2007, 38(10): 731-739.
ZHANG Q W, ZHOU H Y, YOU Q D. Mitsunobu reaction and its applications in medicinal chemistry [J]. Chinese Journal of Pharmaceuticals, 2007, 38(10): 731-739.
[责任编辑:张普玉]
Synthesis and biological evaluation of novel 5-benzylidene-3,4-dihalo-furan-2-one derivatives
WANG Fang1*, JIANG Jin2, YU Yanling1, LÜ Jian1, WANG Wanchun1
(1.QingdaoStomatologicalHospital,Qingdao266000,Shandong,China; 2.QingdaoCenterHospital,Qingdao266042,Shandong,China)
The 5-benzylidene-3,4-dihalo-furan-2-one derivatives 4a-4o were synthesized from mucobromic acid or mucochloric acidviaseveral steps: reduction condensation,condensation and aethrization, and their structures were characterized by1H-NMR,13C-NMR and MS. Their anti-inflammatory activities in vitro were evaluated by utilizing mice macrophage cells RAW264.7 which were induced by bacterial lipopolysaccharide LPS. Results of biological activity showed that 4a-4o had inhibitory effect on NO production in LPS-stimulated RAW264.7 cells, which 4h and 4i displayed excellent inhibitory activities on the production of NO. These research findings showed that compounds with halogenated furanone structure and electronic group on the pyridine ring had excellent anti-inflammatory activity, providing further new drug design and research strategy for the treatment of inflammation.
5-benzylidene-3,4-dihalo-furan-2-one derivatives; synthesis; biological activity
2017-01-17.
青岛市市南区科技发展资金项目(2016-3-042-YY);青岛市2015年度医药科研指导计划(2015-WJZD094).
王 芳(1988-),女,博士生,从事药物研究.*
,E-mail:dami525@126.com.
O626.1
A
1008-1011(2017)03-0335-08

