活性氧自由基在肾小管上皮细胞necroptosis中的作用
董 伟 张 舒 陈源汉 李志莲 李锐钊 史 伟 王蔚东 李春凌 梁馨苓,
活性氧自由基在肾小管上皮细胞necroptosis中的作用
董 伟1张 舒1陈源汉2李志莲2李锐钊2史 伟2王蔚东3李春凌3梁馨苓1,2
目的:探讨活性氧自由基(ROS)在肾小管上皮细胞necroptosis中的作用。 方法:构建肾小管上皮细胞HK-2细胞necroptosis模型,检测其ROS升高程度。并使用NADPH酶抑制剂Apocynin 抑制HK-2细胞necroptosis模型中ROS的生成,通过流式细胞计数及检测necroptosis的关键蛋白观察HK-2细胞necroptosis的变化。 结果:使用肿瘤坏死因子α、苄氧羰酰-缬氨酰-丙氨酰-天冬氨酰-氟甲基酮及抗霉素A成功建立了HK-2细胞necroptosis模型,并观察到HK-2细胞发生necroptosis时ROS显著升高(43.29±2.49vs25.90±1.27,P<0.001),而使用necrostatin-1抑制necroptosis后ROS生成受到抑制(35.58±1.08vs43.29±2.49,P=0.002)。当对necroptosis模型使用Apocynin干预时,HK-2细胞ROS明显下降(30.71±2.82vs43.29±2.49,P<0.001),并且流式细胞计数结果显示坏死细胞比例减少(2.00%±0.30%vs6.99%±2.79%,P<0.001),同时受体相关蛋白3和混合系列蛋白激酶样结构域的磷酸化水平降低。 结论:ROS参与了HK-2细胞的necroptosis,并且通过抑制ROS的生成可减少necroptosis发生,提高损伤状态下HK-2细胞存活率,减轻急性肾小管坏死。
活性氧自由基 necroptosis 肾小管上皮细胞 急性肾损伤
急性肾损伤(AKI)是可由多种病因导致的肾功能急剧下降或肾脏损伤的一种临床综合征,其发病率和死亡率居高不下[1],而急性肾小管坏死是AKI时严重的病理表现。既往认为细胞坏死是不可调控的,但近年来研究发现存在可调控性的细胞坏死。necroptosis是其中一种可调控性细胞坏死[2],与凋亡有着本质区别,一方面necroptosis在形态上仍表现为坏死,存在细胞破裂、内容物释放、诱发炎症反应等典型的细胞坏死的特征,碘化丙啶(propidium iodide,PI)染色阳性;另一方面,与细胞凋亡依赖于一系列caspase酶不同,necroptosis的调控过程并不依赖于caspase酶,而是被受体相关蛋白1(receptor-interacting protein kinase 1,RIP-1)、RIP-3、混合系列蛋白激酶样结构域(mixed lineage kinase domain-like,MLKL)所调控[2]。我们前期的研究表明在肾小管上皮细胞受到损伤时可发生necroptosis[3]。同时,在缺血再灌注、顺铂、造影剂等多种AKI模型中,均发现肾小管上皮细胞necroptosis参与了肾脏损伤[4-6],并且通过necroptosis抑制剂necrostatin-1(Nec-1)来抑制RIP-1磷酸化RIP-3,或者敲除necrotosis通路中重要蛋白RIP-3或MLKL,均可抑制necroptosis,从而减轻AKI。在心肌细胞、肝细胞、肺腺瘤细胞等细胞中[7-9],均发现活性氧自由基(reactive oxide species,ROS)参与了necroptosis,但是ROS在肾小管上皮细胞necroptosis中的作用尚未可知。本研究拟在前期成功建立的HK-2细胞的necroptosis模型中[3],证实ROS在肾小管上皮细胞necroptosis中的作用。
材料和方法
材料 HK-2细胞购自美国模式培养物集存库。肿瘤坏死因子α(tumor necrosis factor α,TNF-α) 、苄氧羰酰-缬氨酰-丙氨酰-天冬氨酰-氟甲基酮(benzyloxycarbonyl-Val-Ala-Asp-fluoromethylketone,zVAD-fmk)(V116)、Nec-1(N9037)购自Sigma;Apocynin(sc-203321)、抗霉素A(sc-202467)购自Santa Cruz Biotechnology。Anexin V/PI细胞凋亡/坏死检测试剂盒购自南京凯基生物科技发展有限公司;2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)活性氧检测试剂盒购自于碧云天。磷酸化RIP-3(p-RIP-3)(ab209384)及磷酸化MLKL(p-MLKL)(ab187091)抗体购自于ABCAM;β-actin(#12413)及山羊抗兔(#7077)二抗购自于Cell Signaling Technology。
方法
HK-2细胞necroptosis模型的构建 构建方法同本课题组前期所构建的HK-2细胞necroptosis模型[3]。无血清培养细胞24 h 使细胞生长同步化,用10 μg/L TNF-α和50 μmol/L zVAD-fmK 处理细胞6h后,加入10 μmol/L抗霉素A处理1h耗竭ATP。
Nec-1阻断HK-2细胞necroptosis 在HK-2细胞使用100 μmol/L Nec-1 预处理8h,再使用10 μg /L TNF-α和50 μmol/L zVAD-fmK 处理细胞6h后,加入10 μmol/L抗霉素A处理1 h耗竭ATP。
抑制HK-2细胞NADPH酶活性 在HK-2细胞同时加入10 μg/L TNF-α、50 μmol/L zVAD-fmK及 NADPH酶抑制剂Apocynin 500 μmol/L处理6h,再加入10 μmol/L抗霉素A处理1 h耗竭ATP。。
Anexin V/PI染色后流式细胞计数检测细胞凋亡/坏死 HK-2细胞培养时间结束,用不含EDTA的胰酶消化收集细胞,1 000 r/min离心3 min,弃培养液。用冷PBS洗涤细胞2次,用400 μl 1X Binding Buffer悬浮细胞,浓度大约为1×106cells/ml。在细胞悬液中加入1.25 μl Anexin V后室温孵育30 min,1 000 r/min离心3 min,弃上清。用400 μl 1X Binding Buffer悬浮细胞,加入5 μl PI后轻轻混匀于2~8℃避光条件下孵育5 min。在1h内用流式细胞仪上机检测。
ROS测定 按照1∶ 1 000 用无血清培养液稀释DCFH-DA ,使终浓度为10 μmol/L。各组干预细胞用不含EDTA的胰酶消化收集细胞,1 000 r/min离心3 min,弃培养液。用冷PBS洗涤细胞2次,后悬浮于稀释好的 DCFH-DA 中,细胞浓度为浓度大约为1×106cells/ml, 37 ℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清细培养液洗涤三次。在1h内用流式细胞仪上机检测。通过流式细胞仪测量DCFH-DA平均荧光强度来评估ROS的生成。
Western Blot 配置10%聚丙烯酰胺凝胶,点样后130V电泳90 min,PVDF膜400 mA转膜60 min。3% BSA封闭1h,TBST洗膜后一抗4℃孵育过夜。TBST洗膜5 min×4次,二抗室温孵育1h。TBST洗膜5 min×4次后,加入显影液曝光。曝光后图像采用Image J测量灰度。
统计学处理 用SPSS 22.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。
结 果
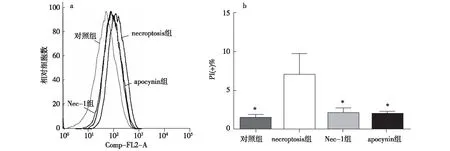
图1 PI染色流式细胞计数比较各组间细胞坏死比例*:与necroptosis组比较,P<0.001;PI:碘化丙啶;Nec-1:necrostatin-1
HK-2细胞necroptosis的构建及证实 流式细胞计数结果显示(图1),HK-2细胞经TNF-α、zVAD-fmK及抗霉素A处理后,较对照组细胞PI(+)细胞数明显增加(6.99%±2.79%vs1.53%±0.30%,P<0.001),Anexin V(+)细胞无明显变化(2.83%±0.65%vs2.85%±0.74%,P=0.876),提示该模型诱导了HK-2细胞坏死,而对凋亡无明显影响。Nec-1预处理可减轻HK-2细胞坏死(2.05%±0.61%vs6.99%±2.79%,P<0.001),而对凋亡无影响(3.23%±0.74%vs2.83%±0.65%,P=0.876)。这证实TNF-α、zVAD-fmK 及抗霉素A诱导的细胞死亡是Nec-1可抑制的可调性细胞坏死。同时为了进一步证实TNF-α、zVAD-fmK及抗霉素A所诱导的细胞死亡是necroptosis,采用Western Blot的方法检测necroptosis通路中RIP-3和MLKL的磷酸化水平。Western Blot结果显示(图2)HK-2细胞加入TNF-α、zVAD-fmK及抗霉素A后,磷酸化RIP-3和磷酸化MLKL水平明显升高,而加入Nec-1后则可降低RIP-3和MLKL磷酸化程度。因此证实TNF-α、zVAD-fmK及抗霉素A所诱导的细胞死亡是necroptosis。
Necroptosis组ROS水平增加 通过DCFH-DA活性氧探针检测各组细胞ROS发现,necroptosis模型组HK-2细胞ROS水平较对照组明显升高(平均荧光强度43.29±2.49vs25.90±1.27,P<0.001),而对模型组使用Nec-1预处理后ROS水平则可回落(35.58±1.08vs43.29±2.49,P=0.002)(图3)。
抑制ROS生成可减轻HK-2细胞necroptosis 在TNF-α、zVAD-fmK及抗霉素A诱导的neroptosis模型中加入NADPH酶的抑制剂Apocynin后,可见HK-2细胞ROS水平呈下降趋势(30.71±2.82vs43.29±2.49,P<0.001)(图3),说明Apocynin抑制了HK-2细胞ROS形成。流式细胞计数显示对necroptosis模型加入Apocynin后,PI (+)阳性的坏死细胞比例下降(2.00%±0.30%vs6.99%±2.79%,P<0.001),而细胞凋亡无明显变化(2.43±0.61vs2.83%±0.65%,P=0.876)(图1)。同时Wester Blot结果发现,Apocynin可抑制neroptosis模型组细胞RIP-3和MLKL磷酸化水平(图2)。
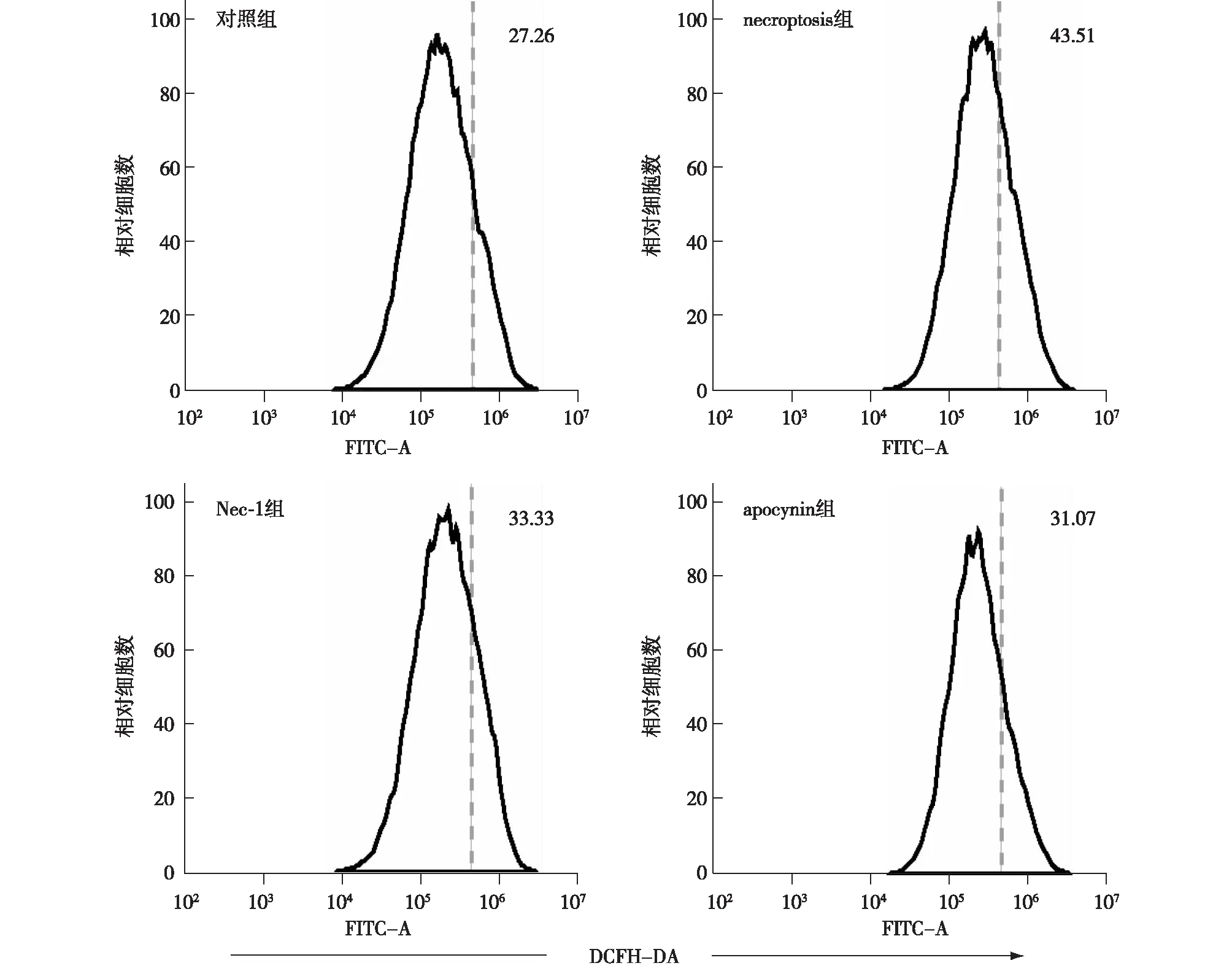
图2 流式细胞仪检测DCFH-DA染色荧光强度比较各组间ROS生成Nec-1:necrostatin-1;ROS:活性氧自由基;DCFH-DA:2′,7′-二氯荧光黄双乙酸盐
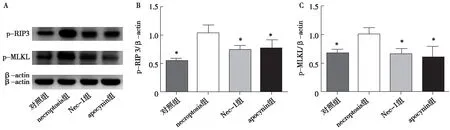
图3 Western Blot比较各组间necroptosis的关键蛋白*:与necroptosis组比较,P<0.05;P-RIP-3:磷酸化受体相关蛋白3;p-MLKL:磷酸化混合系列蛋白激酶样结构域;Nec-1:necrostatin-1
讨 论
急性肾小管坏死是AKI严重的病理表现。既往认为肾小管上皮细胞坏死是不可调控的,因此如何阻止AKI时肾小管上皮细胞坏死一直是未能攻克的难题。近年来,研究发现存在可调控性的细胞坏死,其中necroptosis是可调控性细胞坏死的一种重要形式,通过活化的RIP-1将RIP-3磷酸化,并进一步磷酸化pMLKL,最终使得细胞膜及线粒体膜破裂,导致细胞坏死[10-11]。而且越来越多研究证实肾小管上皮细胞中可出现necroptosis,并且在多种AKI动物模型中均证实necroptosis参与了AKI的发生、发展,通过necroptosis通路中相关蛋白抑制剂或敲除关键蛋白,均可减轻AKI[4-6]。
当氧原子上有未配对电子的自由基则被称为ROS,包括过氧化物、超氧化物、单线态氧等,生理状态下为氧代谢的副产物,起到信号传导及维持细胞稳态的作用。一些研究在发现ROS参与了心肌细胞、肝细胞、肺腺瘤细胞的necroptosis,并且抑制ROS生成可减少necroptosis发生[7-9]。既往研究中发现在缺血再灌注、脓毒血症、肾毒性药物、造影剂等多种原因所导致的AKI时,肾小管上皮细胞ROS的生成均明显增加,并且通过激活炎症体、损伤线粒体、引起细胞凋亡等导致肾小管上皮细胞损伤,清除ROS可在不同程度上减轻肾小管上皮细胞损伤[12-15]。但是并未有研究报道ROS是否参与了肾小管上皮细胞necroptosis并最终导致肾脏损伤,本研究首次探讨了肾小管上皮细胞ROS在necroptosis中的作用。
本研究通过流式细胞计数以及Western Blot在细胞和蛋白水平验证了前期所建立的HK-2细胞的necroptosis的模型,并且发现necroptosis时HK-2细胞存在ROS的增加,而抑制necroptosis则明显减少了ROS的生成。这提示肾小管上皮细胞发生necroptosis存在ROS的生成增加。当我们使用了NADPH酶的抑制剂Apocynin成功地减轻了necroptosis时细胞ROS,发现伴随着ROS的下降,PI (+)阳性的坏死细胞数也随之下降,同时蛋白水平上necroptosis标志性蛋白磷酸化RIP-3和磷酸化MLKL均呈下降趋势。这提示当肾小管上皮细胞ROS的生成减少时necroptosis也得到减轻。通过上述实验证实ROS参与了HK-2细胞凋亡样坏死,并且使用NADPH抑制剂Apocynin抑制ROS生成可减轻HK-2细胞necroptosis。
目前ROS如何参与necroptosis的机制尚不明确。在本研究中Nec-1可通过抑制RIP-1活化RIP-3可减少ROS生成,提示ROS作为RIP-1和RIP-3的下游机制参与了necroptosis;而抑制NADPH氧化酶产生ROS也可减少RIP-3的磷酸化水平及necroptosis,则提示ROS同时在RIP-3的上游机制来影响necroptosis。本研究虽然发现ROS参与了HK-2细胞的necroptosis,但是暂未阐明其具体机制,需要进一步研究来揭示ROS与necroptosis的关系。
综上所述,ROS参与了HK-2细胞的necroptosis,并且通过抑制ROS生成可减少necroptosis发生,提高损伤状态下HK-2细胞存活率,减轻急性肾小管坏死。该研究的结果有利于揭示肾小管上皮细胞necroptosis的具体机制,提供新的AKI的治疗靶点。
1 Susantitaphong P,Cruz D N,Cerda J,et al.World incidence of AKI:a meta-analysis.Clin J Am Soc Nephrol,2013,8(9):1482-1493.
2 Galluzzi L,Vitale I,Abrams JM,et al.Molecular definitions of cell death subroutines:recommendations of the Nomenclature Committee on Cell Death 2012.Cell Death Differ, 2012,19(1):107-120.
3 Liang X,Chen Y,Zhang L,et al.Necroptosis,a novel form of caspase-independent cell death,contributes to renal epithelial cell damage in an ATP-depleted renal ischemia model.Mol Med Rep,2014,10(2):719-724.
4 Linkermann A,Brasen J H,Himmerkus N,et al.Rip1 (receptor-interacting protein kinase 1) mediates necroptosis and contributes to renal ischemia/reperfusion injury.Kidney Int,2012,81(8):751-761.
5 Xu Y,Ma H,Shao J,et al.A Role for Tubular Necroptosis in Cisplatin-Induced AKI.J Am Soc Nephrol,2015,26(11):2647-2658.
6 Linkermann A,Heller J O,Prokai A,et al.The RIP1-kinase inhibitor necrostatin-1 prevents osmotic nephrosis and contrast-induced AKI in mice.J Am Soc Nephrol,2013,24(10):1545-1557.
7 Zhang T,Zhang Y,Cui M,et al.CaMKII is a RIP3 substrate mediating ischemia- and oxidative stress-induced myocardial necroptosis.Nature Medicine,2016,22(2):175-182.
8 Jiang Y,Shan S,Chi L,et al.Methyl methanesulfonate induces necroptosis in human lung adenoma A549 cells through the PIG-3-reactive oxygen species pathway.Tumor Biology,2016,37(3):3785-3795.
9 Takemoto K,Hatano E,Iwaisako K,et al.Necrostatin-1 protects against reactive oxygen species (ROS)-induced hepatotoxicity in acetaminophen-induced acute liver failure.FEBS Open Bio,2014,4:777-787.
10 Zhang DW,Shao J,Lin J,et al.RIP3,an Energy Metabolism Regulator That Switches TNF-Induced Cell Death from Apoptosis to Necrosis.Science,2009,325(5938):332-336.
11 Wang H,Sun L,Su L,et al.Mixed Lineage Kinase Domain-like Protein MLKL Causes Necrotic Membrane Disruption upon Phosphorylation by RIP3.Mol Cell,2014,54(1):133-146.
12 Quintavalle C,Brenca M,De Micco F,et al.In vivo and in vitro assessment of pathways involved in contrast media-induced renal cells apoptosis.Cell Death Dis,2011,2:e155.
13 Winterberg PD,Wang Y,Lin KM,et al.Reactive oxygen species and IRF1 stimulate IFN production by proximal tubules during ischemic AKI.Am J Physiol Renal Physiol,2013,305(2):F164-172.
14 Ahn JM,You SJ,Lee YM,et al.Hypoxia-inducible factor activation protects the kidney from gentamicin-induced acute injury.PLoS One,2012,7(11):e48952.
15 Zhao W,Zhang L,Sui M,et al.Protective effects of sirtuin 3 in a murine model of sepsis-induced acute kidney injury[J].Scientific Reports,2016,6:33201.
(本文编辑 青 松)
Effect of reactive oxygen species on necroptosis in renal tubular epithelial cell
DONGWei1,ZHANGShu1,CHENYuanhan2,LIZhilian2,LIRuizhao2,SHIWei2,WANGWeidong3,LIChunling3,LIANGXinling1,2
1SouthernMedicalUniversity,Guangzhou5105152DivisionofNephrology,GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China3InstituteofHypertension,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China
Correspondingauthor:LiangXinling(xinlingliang_ggh@163.com)
Objective:To investigate the role of reactive oxygen species on necroptosis in renal tubular epithelial cell. Methodology:The necroptosis model of HK-2 cell was constructed as our previous research.Apocynin,a specific inhibitor of NADPH oxidase was delivered in the necroptosis model.ROS production was detected by Dichlorodihydrofluorescein diacetate.The manner of cell death was identified by flow cytometry.Western Blot was used to determine phosphorylation of receptor-interacting protein kinase 3(RIP-3) and mixed lineage kinase domain-like (MLKL)which are essential to necroptosis. Results:Necroptosis model of HK-2 cell was established by TNF-α,benzyloxycarbonyl-Val-Ala-Asp-fluoromethylketone (zVAD-fmk) and antimycin A.In this model,PI(+) HK-2 cells was increased and phosphorylation of RIP-3 and MLKL was augmented.ROS increased in necroptosis group(43.29±2.49vs25.90±1.27,P<0.001) and could be inhibited by Nec-1(35.58±1.08vs43.29±2.49,P=0.002).Apocynin not only decreased ROS production(30.71±2.82vs43.29±2.49,P<0.001),but also reduced the proportions of necrosis in the necroptosis model(2.00%±0.30%vs6.99%±2.79%,P<0.001).Phosphorylated RIP-3 and MLKL was also decreased by Apocynin. Conclusion:ROS play an important role in necroptosis of HK-2 cell.Necroptosis could be ameliorated by inhibiting ROS production.
reactive oxygen species necroptosis renal tubular epithelial cell acute kidney injury
10.3969/cndt.j.issn.1006-298X.2017.03.009
国家临床重点专科建设项目,国家自然科学基金面上项目(81570609),广东省自然科学基金(2014A030313545)
1南方医科大学(广州,510515);2广东省人民医院 广东省医学科学院;3中山大学中山医学院高血压研究所
梁馨苓(E-mail:xinlingliang_ggh@163.com)
2016-11-30
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有

