含肉桂水提物的魔芋葡甘聚糖涂膜液对冷鲜猪肉的保鲜效果
, ,,, ,,
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068; 2.湖北轻工职业技术学院工商信息学院,湖北武汉 430070)
含肉桂水提物的魔芋葡甘聚糖涂膜液对冷鲜猪肉的保鲜效果
肖满1,吴考1,倪学文1,严文莉1,匡映1,姜发堂1,黄静2,*
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068; 2.湖北轻工职业技术学院工商信息学院,湖北武汉 430070)
以热水浸提和真空冷冻干燥法制备肉桂水提物,测定了其总酚及总黄酮含量,以及体外抗氧化性和抗菌性。研究了1%肉桂水提物+0.8%魔芋葡甘聚糖(KGM)涂膜液对猪肉进行浸渍涂膜的保鲜效果。在体外实验中,肉桂水提物可清除2,2-联氮-二(三-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基,清除能力为(0.36±0.04) mg VC/mg。可抑制金黄色葡萄球菌和大肠杆菌的生长,抑菌圈直径分别为(15.2±0.2) mm和(13.5±0.4) mm。经肉桂水提物+KGM涂膜液对冷鲜猪肉进行涂膜后,能延缓冷鲜猪肉中菌落总数、pH、硫代巴比妥酸(TBARS)值以及颜色的变化。以菌落总数为参考指标,利用肉桂水提物涂膜处理的冷鲜猪肉与未经涂膜处理的冷鲜猪肉对比,在4 ℃储藏条件下货架期延长3 d。肉桂水提物+KGM涂膜液对冷鲜猪肉具有保鲜作用。
肉桂,魔芋葡甘聚糖,涂膜,抗氧化,抗菌,冷鲜肉,保鲜
冷鲜猪肉是指生猪遵守严格检疫制度屠宰后,使其胴体温度在24 h之内降至0~4 ℃,并在后续加工、流通和销售过程中始终处于0~4 ℃冷链下的生鲜肉[1]。冷鲜猪肉由于水分和蛋白质含量高,易发生腐败变质,为了保持冷鲜猪肉的新鲜度,向冷鲜猪肉中添加天然防腐剂,如肉桂提取物,是一种有效的保鲜方法。如Shan等[2]利用肉桂、丁香和葡萄籽乙醇提取物作为保鲜液,对猪肉进行保鲜,发现3种保鲜液均可抑制冷鲜肉中油脂的氧化和大肠杆菌、李斯特菌等食品中常见腐败菌或病原菌的生长,可延长冷鲜肉的货架期。Zhang等[3]对肉桂、甘草、迷迭香和丁香等14种天然植物乙醇提取物对常见肉类腐败菌的抑制作用及对在4 ℃下贮藏的真空包装的新鲜猪肉的保鲜作用进行了研究,结果表明肉桂、甘草、迷迭香和丁香提取物表现出强的抗菌活性。
肉桂(Cinnamomumcassia)为樟科植物肉桂的干树皮,在中国为一种药食两用的植物原料。肉桂提取物具有强的抗菌和抗氧化的作用,其原因是肉桂的挥发油或乙醇提取物,如精油、二萜、倍半萜类、苯丙酯类、黄酮类、木脂素类,具有强的抗菌[4-5]和抗氧化[6-7]活性。因此,肉桂提取物可以作为一种有效的天然防腐剂,可应用于冷鲜肉中,对其进行抗菌防腐。但是,肉桂水提取物的抗菌性和抗氧化性以及其应用少有报道,考虑天然提取物结合涂膜保鲜技术是一种环境友好型的保鲜方法,并在食品保鲜中得到广泛应用[8]。因此,本文拟采用肉桂水提物作为天然防腐剂冷鲜猪肉进行保鲜研究。另外,魔芋葡甘聚糖(konjac glucomannan,KGM)作为一种天然植物多糖,具有可食性、水溶性、成膜性和可降解性等特点,其水溶液可制备成可食性膜[9-10],具有在农产品涂膜保鲜中的应用潜力。
本文选用肉桂水提物并将其添加至成膜性良好的魔芋葡甘聚糖[9-10]水溶液中制备保鲜涂膜液,对冷鲜猪肉进行涂膜保鲜研究。测定肉桂水提物的抗菌性和抗氧化性,以及肉桂水提物+魔芋葡甘聚糖涂膜液对冷鲜猪肉中菌落总数、硫代巴比妥酸(TBARS)值、pH以及颜色的影响。
1 材料与方法
1.1材料与仪器
肉桂 购于湖北中药材有限公司;生鲜猪肉 购于中粮武汉肉食品有限公司专营门面;大肠杆菌(分离号:NCTC 10538;分离源:人粪便)和金黄色葡萄球菌(分离号:CMCC 26085;来源于中国) 购于中国普通微生物菌种保藏管理中心;魔芋葡甘聚糖(KGM) 购于湖北强森魔芋科技有限公司;1,1-二苯基苦基苯肼(DPPH)和2,2-联氮-二(三-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) 购于东京化成工业株式会;没食子酸标准品和高硫酸钾 购于美国Sigma公司;芦丁标准品、维生素C和2-硫代巴比妥酸(TBA) 购于上海国药集团化学试剂有限公司。
2100型紫外可见分光光度计 龙尼柯(上海)仪器有限公司;HH-2型恒温水浴锅 国华电器有限公司;KQ5200超声波清洗器 江苏昆山市超声仪器有限公司;R-300旋转蒸发仪 瑞士步琦公司;BC-130A冰箱 山东青岛海尔股份有限公司;LGJ-10真空冷冻干燥机 河南兄弟仪器设备有限公司;JJ-1型电动搅拌器 江苏省金坛市医疗仪器厂;SW-CJ-1FD型超净工作台 苏州安泰空气技术有限公司;LHS-150HC恒温恒湿培养箱 天津市泰斯特仪器有限公司;80型手提式压力蒸汽灭菌锅 天津市泰斯特仪器有限公司。
1.2实验方法
1.2.1 肉桂水提物的制备 参考Shan等方法[2]进行肉桂水提物的提取。具体操作如下:将肉桂用粉碎机粉碎成60目及以上的粉末,称取10 g粉末分散于1000 mL水中,在70 ℃的水浴下以500 r/min搅拌3 h,然后在室温下以200 W功率进行超声处理20 min,用定性滤纸过滤三次。最后将所得的滤液用旋转蒸发仪浓缩至原体积的1/8,将浓缩液冷冻干燥成粉末,即得肉桂水提物。
1.2.2 肉桂水提物总酚含量的测定 采用福林酚比色法[11],以没食子酸为标准品做标准曲线,经过线性拟合得到的线性方程为:y=0.75477x+0.00491,相关系数R2=0.9995。肉桂水提物总酚含量的结果用没食子酸当量GAE(gallic acid equivalent)表示。
1.2.3 肉桂水提物总黄酮含量的测定 采用亚硝酸盐-硝酸铝-氢氧化钠比色法[12],以芦丁标准品做标准曲线,经过线性拟合得到的线性方程为:y=1.32851x+0.00903,相关系数R2=0.9999。肉桂水提物总黄酮含量的结果用芦丁当量(quercetin equivalent)表示。
1.2.4 肉桂水提物抗氧化性的测定 参照Re[13]的方法测定肉桂水提物对2,2-联氮-二(三-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除能力。将7 mmol/L ABTS储备液与2.45 mmol/L高硫酸钾溶液等体积混合,在室温避光的条件下静置12 h,制备ABTS自由基储备液。使用前用pH7.4的磷酸盐缓冲液稀释成工作液,使其在波长734 nm处的吸光值为0.70。分别配制浓度为0、0.005、0.02、0.04、0.08、0.12、0.16 mg/mL的肉桂水提物和VC溶液,取4.9 mL ABTS+·溶液与0.1 mL的样品溶液混合,反应10 min后,在波长734 nm下测定其吸光值。空白对照为4.9 mL ABTS+·溶液和0.1 mL水的混合液。
ABTS自由基清除率计算公式:清除率(%)=(A0-A)/A0×100,A0为空白对照的吸光值;A为样品与ABTS+·反应后的吸光值。
1.2.5 肉桂水提物体外抗菌性的测定 参照滤纸片扩散法[14]进行抗菌性测定。用打孔器将中性滤纸打成直径为6 mm的圆形滤纸片,滤纸片在121 ℃下灭菌15 min后备用。将已灭菌的滤纸片放入浓度为10 mg/mL肉桂水提物溶液中浸泡20 min。用移液枪分别吸取200 μL浓度为6.00 lg CFU/g的大肠杆菌和金黄色葡萄球菌菌悬液,滴加在对应的大肠杆菌和金黄色葡萄球菌的固体培养基表面,涂布均匀。然后将浸入了提取物溶液的滤纸片放在培养基表面。培养皿在37 ℃下培养24 h后,测量抑菌圈的大小。
1.2.6 涂膜液对冷鲜猪肉的保鲜测定
1.2.6.1 涂膜液及肉样的制备 浓度低于0.8%的KGM涂膜液,粘度太小,不利于涂膜;浓度大于0.8%的KGM涂膜液,粘度太大,不利于涂膜。使用0.8%的KGM涂膜液,通过浸渍的方法对猪肉进行涂膜,涂膜效果最好。作者通过预实验可知,肉桂水提物的最低抑菌浓度为1%。因此,本文选用1%的肉桂水提物和0.8%的KGM涂膜液用于猪肉涂膜的研究。
配制三种涂膜液:空白涂膜液,即100 mL水;KGM涂膜液,即0.8 g KGM溶于100 mL水中,60 ℃加热搅拌1.5 h,制得KGM涂膜液;KGM+肉桂涂膜液,即称取0.8 g KGM,加入100 mL蒸馏水中,60 ℃水浴搅拌1.5 h,将1.0 g肉桂水提物粉末加入到KGM水溶胶中,搅拌15 min,制得KGM+肉桂提取物的涂膜液。冷鲜肉去脂切成25 g的肉块,分别用上述三种涂膜液浸渍2 min,取出沥干,获得空白组、KGM处理组及KGM+肉桂处理组的肉样,然后分别将其装入无菌袋中,置于4 ℃冰箱中冷藏。在第0、3、6、9、12和15 d时,测定空白组、KGM处理组以及KGM+肉桂处理组肉样中菌落总数和理化指标。
1.2.6.2 菌落总数测定 参照GB 4789.2-2010[15]对肉样中菌落总数进行测定。根据肉样中菌落总数可将肉品的新鲜度分为三级,即菌落总数小于1×104cfu/g为新鲜肉;菌落总数在1×104~1×106cfu/g之间为次鲜肉;菌落总数大于1×106cfu/g为变质肉[16]。
1.2.6.3 pH的测定 参照GB/T 9695.5-2008[17]方法对肉样中pH进行测定。肉的新鲜程度可用pH进行评价,即变质肉的pH≥6.4;6.2≤二级鲜度的肉pH≤6.4;5.8≤一级鲜度的肉pH≤6.2。
1.2.6.4 硫代巴比妥酸(TBARS)值测定 参照白艳红[18]的方法,称取10 g肉样用剪刀剪碎后再研磨研细,置于100 mL的锥形瓶中,加入50 mL 7.5%的三氯乙酸-EDTA(含0.1%的EDTA)的溶液,振摇30 min,用双层滤纸抽滤2次,取上述滤液5 mL,加入5 mL浓度为0.02 mol/L TBA(2-硫代巴比妥酸)溶液,90 ℃水浴加热40 min,取出冷却后,1600 r/min离心5 min。在清液中加入5 mL三氯甲烷,摇匀,静置分层后取上清液,分别在波长为532 nm和600 nm处测定吸光度,每组平行测定三次。TBARS值计算公式[19]如下:
其中,TBARS值为1000 g肉样含有的丙二醛的毫克数;A532为样品在波长532 nm处的吸光度;A600为样品在波长600 nm处的吸光度。
1.2.6.5 色度值的测定 用色差计测定肉样在贮藏期间的L*值(明度),a*值(红度),b*值(黄色度)。重复测量三次,每次测量三个不同部位,取平均值。每组样品做三个平行,最后取平均值。
1.2.7 数据处理与统计分析 每组实验至少重复三次,采用SPSS for windows软件(SPSS公司)One-Way ANOVA方法对数据进行差异显著性分析,采用Origin 8.5软件(OriginLab公司)对数据进行绘图。
2 结果与讨论
2.1肉桂水提物总酚和总黄酮含量
测得肉桂提取物的总酚含量和总黄酮含量分别为(0.21±0.01) mg GAE/mg和(0.37±0.01) mg quercetin/mg。
2.2肉桂水提物抗氧化性
通过测定肉桂水提物对ABTS+·的清除能力,来分析其体外抗氧化性,并用VC抗氧化性作标准对照。由图1可知,样品对ABTS+·清除率随着其浓度的增大而增强,清除能力为VC>肉桂水提物,且具有显著性差异(p<0.05)。肉桂水提物的ABTS+·清除能力为(0.36±0.04) mg VC/mg。虽然肉桂水提物的体外抗氧化性小于强抗氧化剂VC,但表明肉桂水提物也具有抗氧化性。可能是肉桂水提物中含有黄酮类的抗氧化物质。据报道,肉桂的乙醇提取物具有体外抗氧化性[6],表明肉桂的水提取物和乙醇提取物都具有体外抗氧化性。
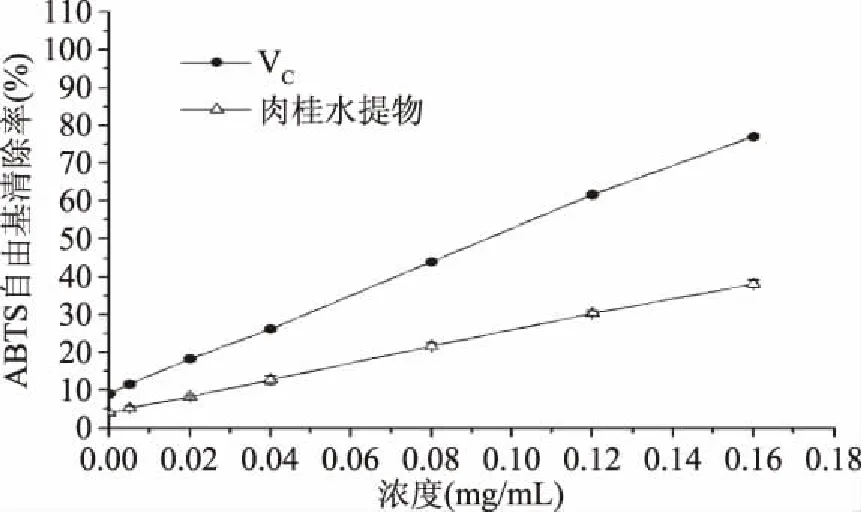
图1 VC及肉桂水提物对ABTS自由基清除率Fig.1 Effects of VC and Cinnamomum cassia water extracts on ABTS radical scavenging ability
2.3肉桂水提物抗菌性
肉桂水提物对金黄色葡萄球菌和大肠杆菌抑菌抑菌圈直径分别为(15.2±0.2) mm和(13.5±0.4) mm,表明肉桂水提物对金黄色葡萄球菌和大肠杆菌均有抑制作用,对金黄色葡萄球菌的抑菌能力大于对大肠杆菌的抑菌能力。本实验中肉桂水提物也具有体外抑菌性,原因可能是肉桂水提物中含有酚类物质,这类物质可抑制食品病原菌的生长,而且其浓度与抑菌活性呈正相关[18]。据报道,肉桂的乙醇提取物具有体外抑菌性[3],表明肉桂水提取物和乙醇提取物都具有体外抗菌性。
2.4涂膜液对冷鲜猪肉的保鲜效果
2.4.1 涂膜液对冷鲜猪肉中菌落总数的影响 在4 ℃贮藏条件下,肉样中菌落总数随贮藏时间的延长而增加(图2)。对比空白组和KGM组,添加肉桂水提物的涂膜液处理的肉样,菌落总数增加比空白组和KGM组慢,说明肉桂水提物可以抑制冷鲜肉中微生物的生长。空白组及KGM组肉样在贮藏第3 d时,细菌总数分别达到4.57 lg CFU/g和4.60 lg CFU/g,超出新鲜肉细菌总数的标准,成为次级肉。KGM+肉桂组处理的肉样在贮藏第3 d时细菌总数达到3.95 lg CFU/g,符合新鲜肉的标准。因此肉桂水提物对冷鲜肉具有保鲜作用。空白组及KGM组在第6 d时细菌总数达到5.95 lg CFU/g和5.84 lg CFU/g,KGM+肉桂组处理的肉样在贮藏第9 d时,细菌总数达到5.95 lgCFU/g,成为变质肉,而对比空白组,其可使肉样保持新鲜程度延长3 d。
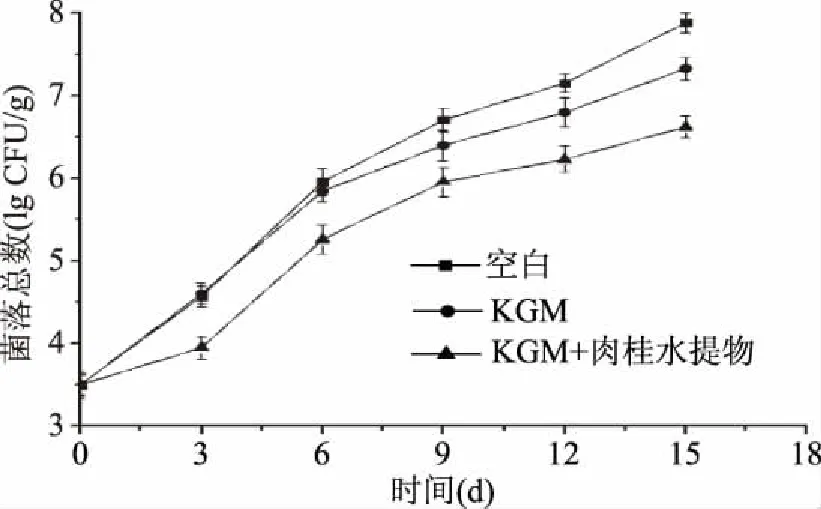
图2 冷鲜猪肉在4 ℃贮藏时菌落总数的变化Fig.2 Total numbers of bacterial colonies of chilled meat with different coating treatments stored at 4 ℃
2.4.2 涂膜液对冷鲜猪肉pH的影响 由图3可知,在15 d的冷藏时间内,空白组、KGM组和KGM+肉桂组的肉样pH逐渐升高,分别由5.68增加至6.67、6.55和6.17,其值显著大于初始值(p<0.05),可能是由于微生物和酶的作用,使肉样中的蛋白质分解成各种胺和氨类的碱性物质,使pH增加。空白组pH在第9 d时达到6.48,肉样变为变质肉。KGM处理组与空白组对比,在一定程度上减缓了肉样pH的增加,可能是KGM具有良好的成膜性,涂膜后在肉样表面形成薄膜,阻止了肉样与好氧菌与氧的接触,从而抑制了微生物对蛋白质的分解作用。KGM+肉桂组在15 d贮藏期间内,保持为一级鲜度肉的pH,表明KGM+肉桂涂膜冷鲜肉,具有显著延缓pH增加的作用。
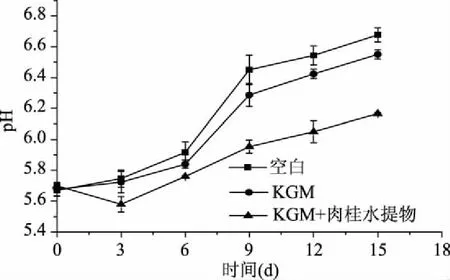
图3 冷鲜猪肉在4 ℃贮藏期间pH的变化Fig.3 pH changes of chilled meat with different coating treatments stored at 4 ℃
2.4.3 涂膜液对冷鲜猪肉中硫代巴比妥酸(TBARS)值的影响 由图4可知,随着贮藏时间的延长,TBARS值逐渐增加,表明肉样中脂质氧化逐渐增多。KGM组与空白组比较,其TBARS值显著小于空白组(p<0.05),可能是KGM在肉样表面形成了一层薄膜,减少了肉样与氧气的接触面积,在一定程度上抑制了脂质的氧化。KGM+肉桂水提物组的TBARS值显著小于空白组和KGM组(p<0.05),表明肉桂水提物可抑制肉样的脂质氧化,因为肉桂水提物含有酚类和黄酮类等活性物质,其具有极好的抗氧化性,可以有效抑制脂质氧化,使TBARS值增加缓慢,猪肉氧化减缓,从而可以延长冷鲜肉的货架期。

图4 冷鲜肉在4 ℃贮藏期间TBARS值的变化Fig.4 TBARS values of chilled meat with different coating treatments stored at 4 ℃

图5 冷鲜猪肉在4 ℃贮藏期间色度值Fig.5 Color parameters of chilled meat with different coating treatments stored at 4 ℃注:a,明度L*;b,红度a*;c,黄度b*。
2.4.4 涂膜液对冷鲜猪肉色度值的影响 各处理组肉样的明暗度L*在贮藏过程中逐渐减小(图5a),表明肉样颜色随时间增加而逐渐加深。空白组、KGM组和KGM+肉桂水提物组的肉样的L*值在0~15 d时,分别由初始的44.03、43.7和43.36减小到38.01、40.1和40.87,分别减小了6.02、3.06和2.49。对比空白组,KGM组和KGM+肉桂水提物组的明度值的减小程度小于空白组,且差异显著(p<0.05);KGM+肉桂组水提物的肉样L*值减小程度与KGM组无显著性差异(p>0.05),这是因为KGM具有良好的成膜性,减少了肉样与氧气的接触,抑制了肉样中脂质的氧化,从而抑制了肉样颜色的加深,但是肉桂水提物延缓冷鲜肉颜色变深的作用不明显。
在贮藏期间,肉样的红度值a*逐渐减小(图5b)。空白组和KGM组减小最快,KGM+肉桂水提物组减小最慢。肉样贮藏15 d后,空白组、KGM组及KGM+肉桂水提物组肉样的红度值a*分别减少了3.94、3.33和1.58,KGM+肉桂水提物组肉样减小程度最小,且差异显著(p<0.05)。说明肉桂水提物可维持猪肉红色度的稳定,减少肉样脂质氧化的发生。
肉样的黄度值在0~3 d时均减小,在3~15 d肉样的黄度值逐渐增大(图5c)。空白组b*变化最快,KGM+肉桂水提物组变化最慢。肉样贮藏15 d后,空白组、KGM组及KGM+肉桂水提物组的黄度值b*分别增大了8.65、6.54及5.19,KGM+肉桂水提物组黄度值b*增大程度最小,表明肉桂水提物可以维持猪肉黄度的稳定。
通过对肉样色度值分析可知,KGM具有良好的成膜性,阻碍了氧气与肉的接触;肉桂水提物中含有酚类和黄酮类抗氧化物质,延缓了肉的氧化,从而可减缓肉的颜色的变化。
3 结论
肉桂水提物可清除ABTS+·,且对金黄色葡萄球菌和大肠杆菌具有抑制作用。肉桂水提物+KGM涂膜液可以通过抑制油脂的氧化和微生物的生长,延缓冷鲜肉的腐败和颜色的变化。在4 ℃贮藏条件下,经肉桂水提物+KGM涂膜液涂膜的冷鲜猪肉,与未经涂膜处理的冷鲜猪肉相比,能延长货架期3 d。因此,肉桂水提物+KGM涂膜液具有保鲜肉类产品的应用前景。
[1]中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会.GB/T 19480-2009肉与肉制品术语[S]. 北京:中国标准出版社,2009.
[2]Shan B,Cai Y Z,Brooks J D,et al. Antibacterial and antioxidant effects of five spice and herb extracts as natural preservatives of raw pork[J]. Journal of the Science of Food & Agriculture,2009,89(11):1879-1885.
[3]Zhang H,Kong B,Xiong Y L,et al. Antimicrobial activities of spice extracts against pathogenic and spoilage bacteria in modified atmosphere packaged fresh pork and vacuum packaged ham slices stored at 4 ℃[J]. Meat Science,2009,81(4):686-692.
[4]Ooi L S M,Li Y,Kam S L,et al. Antimicrobial activities of cinnamon oil and cinnamaldehyde from the Chinese medicinal herbCinnamomumcassiaBlume[J]. The American Journal of Chinese Medicine,2006,34(3):511-522.
[5]Matan N,Rimkeeree H,Mawson A J,et al. Antimicrobial activity of cinnamon and clove oils under modified atmosphere conditions[J]. International Journal of Food Microbiology,2006,107(2):180-185.
[6]Lin C C,Wu S J,Chang C H,et al. Antioxidant activity ofCinnamomumcassia[J]. Phytotherapy Research,2003,17(7):726-730.
[7]Lee J S,Jeon S M,Park E M,et al. Cinnamate supplementation enhances hepatic lipid metabolism and antioxidant defense systems in high cholesterol-fed rats[J]. Journal of Medicinal Food,2003,6(3):183-191.
[8]Silva-Weiss A,Ihl M,Sobral P J A,et al. Natural additives in bioactive edible films and coatings:functionality and applications in foods[J]. Food Engineering Reviews,2013,5(4):200-216.
[9]Li X,Jiang F,Ni X,et al. Preparation and characterization of konjac glucomannan and ethyl cellulose blend films[J]. Food Hydrocolloids,2015,44:229-236.
[10]Xiao M,Wan L,Corke H,et al. Characterization of konjac glucomannan-ethyl cellulose film formation via microscopy[J]. International Journal of Biological Macromolecules,2016,85:434-441.
[11]Ozsoy N,Can A,Yanardag R,et al. Antioxidant activity ofSmilaxexcelsaL. leaf extracts[J]. Food Chemistry,2008,110(3):571-583.
[12]Krishnan K R,Babuskin S,Babu P A S,et al. Antimicrobial and antioxidant effects of spice extracts on the shelf life extension of raw chicken meat[J]. International Journal of Food Microbiology,2014,171:32-40.
[13]Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology & Medicine,1999,26:1231-1237.
[14]Oke F,Aslim B,Ozturk S,et al. Essential oil composition,antimicrobial and antioxidant activities ofSaturejacuneifoliaTen[J]. Food Chemistry,2009,112(4):874-879.
[15]中华人民共和国卫生部 中国国家标准化管理委员会.GB 4789.2-2010,食品微生物学检验菌落总数测定[S]. 北京:中国标准出版社,2010.
[16]段静芸,徐幸莲,周光宏.壳聚糖在冷却鲜猪肉保鲜中的应用研究[J].食品工业科技,2001,22(4):26-28.
[17]中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会.GB/T 9695.5-2008肉与肉制品pH测定[S]. 北京:中国标准出版社,2008.
[18]白艳红. 低温熏煮香肠腐败机理及生物抑菌研究[D]. 杨凌:西北农林科技大学,2005:2-29.
[19]Shan B,Cai Y Z,Brooks J D,et al. Theinvitroantibacterial activity of dietary spice and medicinal herb extracts[J]. International Journal of Food Microbiology,2007,117(1):112-119.
EffectsofCinnamomumcassiawaterextractsandkonjacglucomannancoatingonthefreshpreservationofchilledmeat
XIAOMan1,WUKao1,NIXue-wen1,YANWen-li1,KUANGYing1,JIANGFa-tang1,HUANGJing2,*
(1.College of Bioengineering and Food Science,Hubei University of Technology,Wuhan 430068,China; 2.School of Business and Information,Hubei Light Industry Technology Institute,Wuhan 430070,China)
Cinnamomumcassiawater extracts were prepared by the methods of hot water extraction and vacuum freeze drying,and the total phenolic and flavonoid contents in the preparedCinnamomumcassiawater extracts were measured. The antioxidant and antibacterial activities ofCinnamomumcassiawater extracts were performedinvitro. Effects of 1%Cinnamomumcassiawater extracts-0.8% konjac glucomannan coating on the fresh preservation of chilled meat stored at 4 ℃ were evaluated. The water extracts ofCinnamomumcassiaexhibited the 2,2′-Azinobis-(3-ethylbenzthiazoline-6-sul-phonate)(ABTS)free radical scavenging ability,and the value was(0.36±0.04) mg VC/mg. The growths ofStaphylococcusaureus andEscherichiacoliinvitrocould be inhibited by the water extracts ofCinnamomumcassia,and the inhibition zone were(15.2±0.2) mm and(13.5±0.4) mm,respectively. After chilled meat coated withCinnamomumcassiawater extracts-KGM water solution,the total
Cinnamomumcassia;konjac glucomannan;coating;antioxidant;antibacterial;chilled meat;preservation
2016-10-14
肖满(1979-),男,博士,讲师,研究方向:多糖分子生物材料,E-mail:15325378@qq.com。
*通讯作者:黄静(1969-),女,硕士,副教授,研究方向:食品添加剂数据库开发,E-mail:hjing222@sina.com。
国家自然科学基金青年科学基金项目(31301428);国家自然科学基金面上项目(31271832)。
number of bacteria,pH value,TBARS value,and color parameter of coated chilled meat were significant decreased compared to uncoated chilled meat. Based on the total number of bacteria,the shelf life of coated chilled meat stored at 4 ℃ was extended for 3 days compared to uncoated chilled meat. In conclusion,Cinnamomumcassiawater extracts-KGM had fresh preservation effects on the chilled meat.
TS251.5
:A
:1002-0306(2017)12-0305-05
10.13386/j.issn1002-0306.2017.12.056

