产角蛋白酶菌株的筛选及发酵条件优化
,, ,,
(湖北工业大学发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北武汉 430068)
产角蛋白酶菌株的筛选及发酵条件优化
蒋彪,王常高,杜馨,林建国,蔡俊*
(湖北工业大学发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北武汉 430068)
采用以羽毛为唯一碳氮源的无机盐培养基,通过考察HC值(水解圈直径与菌落直径的比值)、羽毛的降解程度,筛选得到10株产角蛋白酶的菌株,经测定10株菌株摇瓶发酵液的蛋白酶活力,确定了一株产酶能力较强的菌株CJPE209,并对菌株进行鉴定,菌株CJPE209被鉴定为芽孢杆菌(Bacillussp.),其发酵液酶活为267 U/mL。通过单因素实验,确定了菌株CJPE209产角蛋白酶的最适发酵条件:发酵周期48 h,培养基装液量25 mL/250 mL,发酵温度37 ℃,初始pH7,摇床转速220 r/min,发酵液酶活为337.6 U/mL,是优化前的1.26倍。
角蛋白酶,产角蛋白酶菌株,筛选,鉴定,产酶条件
近年来,现代农业技术的发展使养殖业扩大。据美国农业部的调查,2011年中国生产的鸡肉达到1.3千万吨,2012年全球鸡肉出口量达到9.1千万吨[1]。而羽毛占鸡肉的5%~7%,所以每年我国将产出近百万吨的羽毛。角蛋白是废弃羽毛的主要组成成分,粗蛋白含量可达到75%,且含有大量动物必需氨基酸和微量元素[2]。但是由于角蛋白是一种天然硬质蛋白,其结构中存在大量的二硫键,导致其比较稳定,无法被普通蛋白酶(胃蛋白酶、胰蛋白酶等)降解,大量羽毛被废弃,造成大量资源浪费和环境污染[3-5]。
在传统利用羽毛的过程中主要采取酸碱水解、热降解等方法,但是前者存在污染环境问题,后者能耗比较大,并且在处理过程中会造成部分氨基酸被破坏,大大降低产品价值[6]。而生物产酶降解羽毛却可以降低能耗同时不会造成环境污染。同时该酶还应用于制革行业、医疗行业和食品行业等诸多方面[7-10]。
由微生物产角蛋白酶具有制备方便,降低污染等优势。Tanmay Paul[11]等利用PaenibacilluswoosongensisTKB2固体发酵产角蛋白酶,产酶水平为162.2 U/g。冀勇良[12]等用短小芽孢杆菌(BacilluspumilusZW-36)液体发酵产酶,酶活为57.14 U/mL。Ana Maria Mazotto[13]等用黑曲霉固体发酵产酶,发酵周期7 d,酶活最高为172.7 U/mL。刘文涛[14]等采用一株工程菌(BaccillussubtilisWB600)进行补料分批发酵,27 h酶活达到864 U/mL。黄庞慧[15]等利用微生物产角质酶和角蛋白酶共浴处理羊毛,取得了较好的改性效果,适用于纺织行业。本研究旨在筛选出一株高产角蛋白酶的菌株,并通过单因素实验优化菌株产酶发酵条件。同时本研究对工业上处理废弃羽毛提供一定支持,降低大部分依靠化学处理废弃羽毛对环境造成的压力。
1 材料与方法
1.1材料与仪器
土壤样品 来自随州盈丰养鸡场,灭菌袋4 ℃保存备用;5%(W/V)水溶性角蛋白 东京化成工业株式会社;羽毛 随州盈丰养鸡场;羽毛粉 市售;福林酚试剂 国药集团化学试剂有限公司;富集培养基(g/L) 葡糖糖10.0、NaCl 5.0、牛肉膏5.0、蛋白胨10.0,pH自然;筛选培养基(g/L) 羽毛10.0、NaCl 5.0、K2HPO41.0、KH2PO40.5、MgSO41.0,pH自然;选择性分离培养基(g/L) 干酪素4.0、CaCl23.0、NaCl 5.0、牛肉膏5.0、琼脂粉16.0,pH自然;摇瓶种子培养基(g/L) NaCl 5.0、牛肉膏5.0、蛋白胨10.0,pH自然;斜面培养基(g/L) NaCl 5.0、牛肉膏5.0、蛋白胨10.0,pH自然;发酵培养基(g/L) 羽毛粉10.0、NaCl 5.0、K2HPO41.0、KH2PO40.5、MgSO41.0,pH自然;以上培养基均在1×105Pa条件下高压灭菌20 min。
酶标仪 Gene Company Limited;3K15冷冻离心机 德国Sigma公司;TGL-16C台式离心机 上海安亭科学仪器制品厂;PHS-2F pH计 上海雷磁。
1.2实验方法
1.2.1 富集培养 称取10 g土样加入到100 mL无菌生理盐水中,将土样摇匀打散,制备菌悬液。取4 mL菌悬液加入到富集培养基中,37 ℃、180 r/min振荡培养48 h。
1.2.2 初筛 取2 mL富集培养基中菌液加入到筛选培养基中,于37 ℃、180 r/min培养48 h,观察羽毛有无降解现象,取有降解现象的培养液2 mL于筛选培养基中,同样条件培养,重复3次,以筛选出能够降解羽毛的菌株。
将最终得到的筛选培养基菌液进行梯度稀释,取稀释到10-5~10-7倍的菌悬液200 μL涂布于选择性分离培养平板上(每个梯度3个平行),37 ℃培养箱倒置培养48 h,观察水解圈的大小,挑取水解圈较大的菌落,再进行平板点样,37 ℃培养48 h,比较水解圈直径(Dp)和菌落直径(Dc)比值(HC)的大小(HC=Dp/Dc)。挑选HC比值较大的菌株作为复筛出发菌株。
1.2.3 摇瓶复筛 将初筛得到的HC比值较大的菌株接种到种子培养基中37 ℃、180 r/min振荡培养24 h,之后按2%接种量转接到发酵培养基中,于37 ℃、180 r/min振荡培养48 h。发酵液离心取上清液(粗酶液)测酶活。
1.2.4 酶活测定 由于凡是具有结缔和保护功能的硬质纤维蛋白都可被称为角蛋白,且相同种类角蛋白氨基酸种类和含量也不相同,角蛋白酶酶活测定没有统一的定义。本研究参照Yamamura S[16]等的测定方法,采用1%(W/V)水溶性角蛋白(用0.01 mol/L的pH9的Tris-HCl缓冲液稀释)为底物,加入1 mL的粗酶液,55 ℃反应15 min后,加入2 mL、0.4 mol/L的三氯乙酸终止反应,离心取上清液1 mL加入4 mL、0.4 mol/L的碳酸钠溶液,和1 mL的福林酚试剂混合,于40 ℃反应20 min,在波长680 nm下检测吸光值;对照组使用经先加入三氯乙酸灭活的酶液。
酶活定义[16]:在上述反应体系中,吸光值增加0.01为一个酶活单位(U/mL)。
通过酶标仪导出测试样品吸光值,通过公式(1)计算得到样品酶活。
D=(A-B)×C×100
式(1)
其中,A表示实验组吸光值,B表示对照组吸光值,C表示粗酶液稀释倍数,D表示酶活(U/mL)。
1.2.5 菌株鉴定和保藏 菌株鉴定和保藏由中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)执行。
1.2.6 菌株CJPE209发酵条件的优化 初始培养条件为:接种量1%,装液量50 mL/250 mL,37 ℃,发酵周期48 h,摇床转速180 r/min,初始pH自然。
1.2.6.1 发酵时间的优选实验 发酵条件为初始发酵条件,调整发酵时间为12、24、36、48、60 h。研究发酵时间对CJPE209产酶的影响。
1.2.6.2 发酵温度的优选实验 发酵周期取上述实验确定的最优结果,其它发酵条件为初始发酵条件,分别在33、35、37、39、41 ℃摇床中进行发酵培养后测定角蛋白酶酶活,考察温度对菌种产角蛋白酶的影响。
1.2.6.3 摇床转速的优选实验 发酵时间和发酵温度取上述实验确定的最优结果,其它发酵条件为初始发酵条件,摇床转速分别为120、140、160、180、200、220、240 r/min,考察摇床转速对菌种产角蛋白酶的影响。
1.2.6.4 装液量的优选实验 发酵时间、温度、摇床转速取上述实验确定的最优结果,其它发酵条件为初始发酵条件,采用250 mL摇瓶装液,摇瓶装液量分别为25、50、75、100、125 mL,考察装液量对菌种产角蛋白酶的影响。
1.2.6.5 初始pH的优选实验 发酵时间、温度、摇床转速和装液量实验确定的最优结果,其它发酵条件为初始发酵条件,调整初始pH分别为5、6、7、8、9和10,考察pH对菌株产角蛋白酶的影响。
1.3数据处理
实验中每组三个平行,利用酶标仪得到吸光值,通过计算得到酶活,采用SPSS软件进行数据的显著性分析。并通过Origin 8软件作图。

表1 32株菌株HC值Table 1 The HC of 32 strains

表2 10株菌株所产的角蛋白酶活力Table 2 Keratinase activity of 10 strains produced
2 结果与分析
2.1菌株的筛选及鉴定
2.1.1 菌株的筛选 从土壤样品中分离得到32株初筛菌株,并通过平板点样,测得菌株的HC值,比较HC值,其结果见表1。挑选出HC值较大的10株菌进行摇瓶复筛,测酶活,其结果见表2。最终确定23号菌株酶活力最高,达到267 U/mL,将这株菌重新命名为CJPE209。
2.1.2 菌株鉴定 经16S rRNA基因序列分析比对,该菌株与芽孢杆菌属的蜡样芽孢杆菌(Bacilluscereus)、苏云金芽孢杆菌(Bacillusthuringiensis)等几株芽孢杆菌属的16S rRNA同源性都在99%以上,判定该菌属芽孢杆菌属(Bacillussp.)。并且该菌株已于2015年12月10日保藏于中国典型培养物保藏中心,保藏编号为:CCTCC M 2015734。
2.2菌株CJPE209发酵条件的优化
2.2.1 发酵时间的优选实验 由图1可知在48 h内,发酵时间越长,酶活越高,且在48 h时酶活最高达到297.4 U/mL,此后,随着发酵时间的延长,酶活开始降低,可能是由于发酵液中菌体需要的营养成分开始降低,代谢产物的积累,不利于该菌的生长,菌体自溶。并且随发酵时间的延长,代谢产物也开始累计,可能对酶的稳定性产生一定影响,从而使酶活降低。所以,选取48 h作为CJPE209的适宜发酵时间。
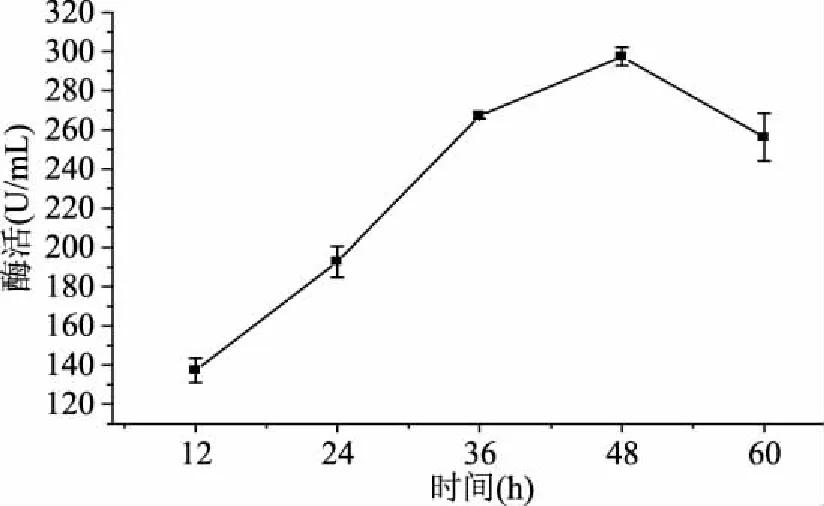
图1 发酵时间对菌株CJPE209产酶的影响Fig.1 Effect of fermentation time on keratinase production by strain CJPE209
2.2.2 发酵温度的优选实验 由图2可知,温度在37 ℃以下时,随温度上升酶活逐渐提高,37 ℃时酶活达到最高312.8 U/mL,但当温度继续升高时,菌株自身代谢相关的酶受到影响,活性降低,进而影响到菌株的正常代谢,酶的合成能力变弱,产酶减少。因此,最适发酵温度定为37 ℃。
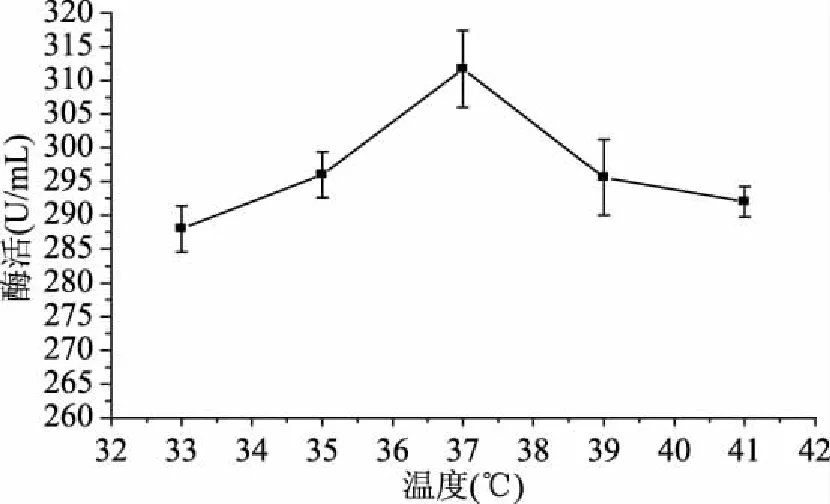
图2 发酵温度对菌株CJPE209产酶的影响Fig.2 Effect of fermentation temperature on keratinase production by strain CJPE209
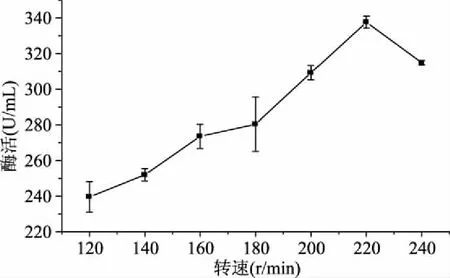
图3 摇床转速对菌株CJPE209产酶的影响Fig.3 Effect of rotating speedkeratinase production by strain CJPE209
2.2.3 摇床转速的优选实验 由图3知,随着摇床转速的提高,酶活逐渐增大,转速达到220 r/min时酶活最高达到337.6 U/mL,继续加快转速,酶活反而呈下降趋势。转速影响发酵过程中溶氧和物质交换,在转速达到220 r/min前,随转速增大溶氧和物质交换增加,菌株产酶增加,但是当转速超过220 r/min时,溶氧和物质交换不是菌株产酶的制约因素;可能随转速增加,剪切力也随之增加,制约了菌株生长和产酶[17]。因此,220 r/min为最佳摇床转速。
2.2.4 发酵摇瓶装液量的优选实验 由图4可知,在装液量为25 mL/250 mL时酶活达到最大值332 U/mL,装液量影响的是发酵过程中通气及溶氧条件,装液量越少,通气和溶氧加大。但是由于培养基中存在固形物成分-羽毛粉,在250 mL三角瓶中进行发酵时,当装液量过小时,羽毛粉极易粘附于三角瓶壁上,无法参与发酵。因此,当装液量为25 mL/250 mL时最适合菌体的生长和产酶。
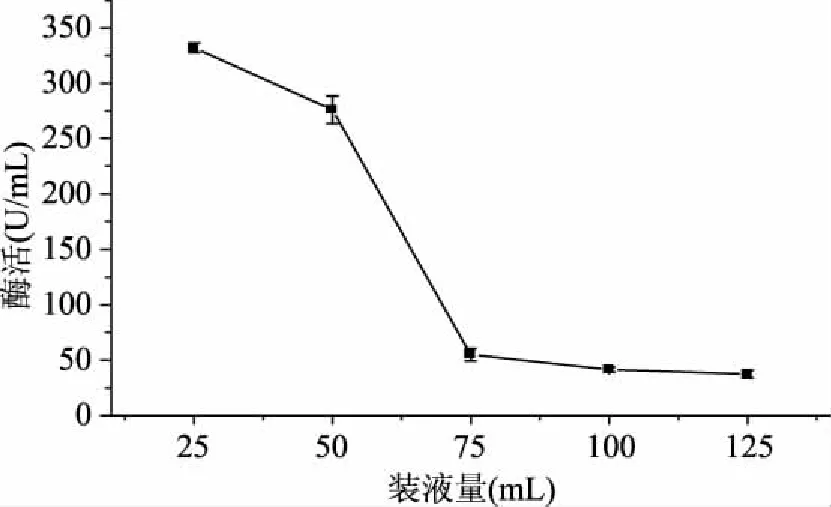
图4 装液量对菌株CJPE209产酶的影响Fig.4 Effect of loading volume on keratinase production by strain CJPE209
2.2.5 初始pH的优选实验 由图5知,pH从5~7的过程中,酶活随着pH的升高而增大,在pH为7时酶活最大达到335 U/mL。而初始pH升高,培养基呈碱性,菌体生长受到影响,同时影响菌体细胞对营养物质的吸收和代谢物的分泌,使菌株产酶能力下降。因此,pH 7为最适初始发酵pH。
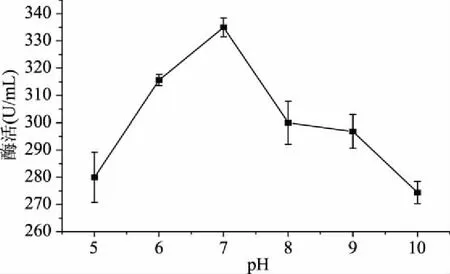
图5 初始pH对菌株CJPE209产酶的影响Fig.5 Effect of initial pH on keratinase production by strain CJPE209
3 结论
以羽毛为唯一碳氮源,从自然界中筛选到32株能够产角蛋白酶的菌株,经复筛后得到CJPE209这株产酶能力较强的菌株,其初始酶活为267 U/mL。经鉴定CJPE209为芽孢杆菌属(Bacillussp.)。该菌株发酵周期较短,产酶能力较强。通过单因素实验对该菌株的发酵条件进行优化,得到该菌的最佳培养条件:发酵周期48 h,发酵温度37 ℃,摇床转速220 r/min,培养基装液量25 mL/250 mL,初始pH7。通过优化发酵条件后,发酵液酶活为337.6 U/mL,是优化前的1.26倍。本研究得到CJPE209菌株产酶效果较好,为废弃羽毛的有效利用提供了一定支撑,在后续研究中,还需要对发酵培养基进行优化、酶的分离纯化、酶学性质及应用等方面的研究。
[1]Cedrola S M,de Melo A C,Mazotto A M,et al. Keratinases and sulfide fromBacillussubtilisSLC to recycle feather waste[J]. World Journal of Microbiology & Biotechnology,2012,28(3):1259-1269.
[2]Onifade A A,Al-Sane N A,Al-Musallam A A,et al. A review-Potentials for biotechnological applications of keratin-degrading microorganisms and their enzymes for nutritional improvement of feathers and other keratins as livestock feed resources[J]. Bioresource Technology,1998,66(1):1-11.
[3]Brandelli A. Bacterial Keratinases-Useful enzymes for bioprocessing agroindustrial wastes and beyond[J]. Food & Bioprocess Technology,2008,1(2):105-116.
[4]于晓朋,赵新强. 角蛋白酶研究进展[J]. 中国果菜,2015(2):77-81.
[5]汪国和,张日俊,丁丽敏. 家禽羽毛废弃物高值化利用研究进展[J]. 饲料工业,2005(1):46-48.
[6]Qi Z,Zhang T,Dong J,et al. Research on isolation and identification of keratin-degrading bacterias and its degradation mechanism[J]. Feed Industry,2012,33(17):19-24.
[7]Villa A L V,Aragäo M R S,Santos E P D,et al. Feather keratin hydrolysates obtained from microbial keratinases-effect on hair fiber[J]. Bmc Biotechnology,2012,13(1):1-11.
[8]周兴华,姜蕾,敖波,等. 羽毛蛋白开发应用进展[J]. 中国饲料,2003(20):28-29.
[9]Gupta R,Sharma R,Beg Q K. Revisiting microbial keratinases-next generation proteases for sustainable biotechnology[J]. Critical Reviews in Biotechnology,2013,33(2):216-228.
[10]蔡成岗. 角蛋白酶生产菌株选育、发酵与分离纯化研究[D]. 杭州:浙江大学,2007.
[11]Paul T,Das A,Mandal A,et al. Effective Dehairing Properties of Keratinase fromPaenibacilluswoosongensis,TKB2 Obtained Under Solid State Fermentation[J]. Waste & Biomass Valorization,2014,5(1):97-107.
[12]冀勇良,朱传合,刘丽英. 短小芽孢杆菌产角蛋白酶液体发酵条件的优化[J]. 食品与发酵科技,2014(1):19-24.
[13]Mazotto A M,Couri S,Damaso M C T,et al. Degradation of feather waste by Aspergillus niger,keratinases-Comparison of submerged and solid-state fermentation[J]. International Biodeterioration & Biodegradation,2013,85(2011):189-195.
[14]刘文涛,刘柏宏,张娟,等. 枯草芽孢杆菌产角蛋白酶的发酵过程优化[J]. 食品与生物技术学报,2014,33(5):466-471.
[15]黄庞慧,王强,董爱学,等. 角质酶/角蛋白酶一浴法处理对羊毛性能的影响[J]. 生物学杂志,2014(6):94-98.
[16]Yamamura S,Morita Y,Hasan Q,et al. Characterization of a new keratin-degrading bacterium isolated from deer fur[J]. Journal of Bioscience & Bioengineering,2002,93(6):595-600.
[17]刘婕. 羽毛降解菌的筛选、鉴定及产酶条件优化[D]. 南宁:广西大学,2013.
Screeningofproductionkeratinasestrainsandoptimizationoffermentationconditions
JIANGBiao,WANGChang-gao,DUXin,LINJian-guo,CAIJun*
(Key Laboratory of Fermentation Engineering(Ministry of Education),Hubei Provincial Cooperative Innovation Center of Industrial Fermentation,Hubei University of Technology,Wuhan 430068,China)
In this research,a medium in which feather was the sole nitrogen source was used for screening microorganisms which product keratinase. By examining HC value(the ratio of hydrolysis spot diameter to colony diameter)and degradation rate of feather,10 strains were got. By comparing the enzyme activity of the fermentation culture of the 10 strains,a strain named CJPE209 which highly product keratinase was selected for next research. CJPE209 was identified asBacillussp..Through the method of sigle-factor experiments,the optimal fermentation condition of CJPE209 was determined as follows-fermentation time 48 h,loading volume 25 mL/250 mL,fermentation temperature 37 ℃,initial pH7,rotation rate 220 r/min. After optimization,the enzyme activity of fermentation culture reached 337.6 U/mL which was 1.26 folds as high as that before optimization.
keratinase;production keratinase strains;screening;identification;keratinase production condition
2016-10-14
蒋彪(1989-),男,硕士,研究方向:发酵过程优化与放大,E-mail:445746520@qq.com。
*通讯作者:蔡俊(1968-),男,博士,教授,研究方向:微生物发酵工程,E-mail:hgcaijun@126.com。
国家自然科学基金项目(31401807)。
TS201.2+5
:A
:1002-0306(2017)12-0182-04
10.13386/j.issn1002-0306.2017.12.033

